Структура курса ФИЗИЧЕСКАЯ ХИМИЯ
Строение металлов и сплавов.
Геохимия и металлургия.
Химическая термодинамика и кинетика в металлургии.
Растворы, сплавы, фазовые диаграммы.
Электрохимия и металлургические производства.
ЛИТЕРАТУРА
Эткинс П. Физическая химия. М.: Мир, 1980. Т 1, 2.
Физическая химия: Учеб. пособие для хим.-тех. спец. вузов/ Под ред. К.С. Краснова М. :Высшая школа, 1982 и более поздние издания.
Стромберг А.Г., Семченко Д.П. Физическая химия: Учеб. пособие для вузов/ Под ред. А.Г. Стромберга. М.: Высшая школа, 1973 и более поздние издания.
Кутьин А.М. Курс физической химии. Электронная версия. 2006.
Исаев С.И. Курс химической термодинамики: Учебное пособие для машиностроительных спец. втузов. М.: Высшая школа, 1986 и более поздние издания.
Практикум по физической химии/ Под ред. В.В. Буданова, Н.К. Воробьева. М.: Химия 1986.
1. Неметаллы и металлы
Неметаллические элементы образуют неполярные ковалентные молекулы, начиная от двухатомных молекул типа Н2, О2, N2 или F2 и кончая гигантскими молекулами элементарного углерода и кремния. Многие неметаллические элементы способны существовать в одной из двух или даже нескольких аллотропных формах. В качестве примера можно привести углерод, существующий в виде алмаза и графита, а также кислород, элементарными формами которого являются О2 и О3 (озон). Как ионные, так и ковалентные вещества в твердом состоянии являются плохими проводниками тепла и электричества (свойства, типичные для изоляторов). Твердые вещества ионного типа обладают хрупкостью.
В отличие от всего этого металлы хорошо проводят тепло и электричество, обладают пластичностью и ковкостью и имеют характерный «металлический» блеск. Почти у всех металлов зеркально серебристая поверхность, и лишь несколько из них, в частности медь и золото, обладают яркой окраской. Приемлемая модель внутреннего строения твердых металлов должна быть способной удовлетворительно объяснить все эти наблюдаемые свойства.
Известно, что магнитная восприимчивость изолированного атома, например железа, или иона определяется наличием в его электронной оболочке неспаренных электронов. При наличии в кристаллической решетке железа достаточно большого числа атомов этот металл приобретает ферромагнитные свойства, которыми не обладают ни соединения железа, ни содержащие его ионы растворы.
1.1. Кристаллическое строение металлов
|
Чаще всего у металлов встречаются кристаллические структуры трех следующих типов (рис. 1.1):
Нижеследующая диаграмма отражает взаимосвязь между кристаллическим строением металлов и их положением в периодической системе. Щелочные металлы обладают ОЦК структурой (значок ◘); такую же структуру имеет большинство переходных металлов IV, V и VI групп. Металлы VIII и I Б групп обычно имеют КП структуру (значок ■). Ряд металлов могут существовать в нескольких модификациях, отличающихся типом структуры; например, железо, помимо КП, может обладать ОЦК структурой. На приведенной здесь диаграмме указаны наиболее распространенные типы структуры металлов, среди которых ГП структура отмечена значком ♦. В частности, Mn, кроме указанных на диаграмме, может обладать простой кубической элементарной ячейкой. |
|
|
I A |
II A |
III Б |
IV Б |
V Б |
VI Б |
VII Б |
VIII |
I Б | ||
|
Li◘ |
Be♦ |
|
|
|
|
|
|
|
|
|
|
Na◘ |
Mg♦ |
|
|
|
|
|
|
|
|
|
|
K◘ |
Ca♦■ |
Sc♦■ |
Ti♦◘ |
V◘ |
Cr◘ |
Mn■◘ |
Fe■◘ |
Co■♦ |
Ni■♦ |
Cu■ |
|
Rb◘ |
Sr■ |
Y♦ |
Zr♦◘ |
Nb◘ |
Mo♦◘ |
Tc♦ |
Ru♦ |
Rd■ |
Pd■ |
Ag■ |
|
Cs◘ |
Ba◘ |
La♦■ |
Hf♦◘ |
Ta◘ |
W◘ |
Re♦ |
Os♦ |
Ir■ |
Pt■ |
Au■ |
Наличием двух кристаллических форм железа, ОЦК α-Fe и КП γ-Fe, объясняется странная картина, которую можно наблюдать в сельской кузнице. Когда раскаленную железную подкову вынимают из горна и дают ей остыть на воздухе, ее ярко-красное свечение постепенно тускнеет, но внезапно снова сильно вспыхивает, после чего уже окончательно yгaсaет. При остывании раскаленное железо проходит через точку перехода (при 910ºС), в которой γ-Fe превращается в α-Fe. Этот переход является изотермическим, а выделяющееся тепло обусловливает возобновление темно-красного свечения остывающего железа.
В химическом кабинете при пропускании электрического тока через фортепианную струну в затемненном помещении хорошо видно, как проволока раскаляется докрасна; затем по мере остывания в точке фазового перехода наблюдается возобновление свечения проволоки. Одновременно с возобновлением свечения обнаруживается прогиб струны, который свидетельствует о том, что фазовый переход сопровождается уменьшением плотности, тaк как структура α-Fe не относится к плотноупакованным.. Удерживая часть проволоки в горизонтальном положении небольшим постоянным мaгнитом. можно также убедиться, что при нагревании железа при температуре около 700ºС происходит переход из магнитной α-фазы в немагнитную β-фазу — при этой температуре проволока отрывается от магнита.
|
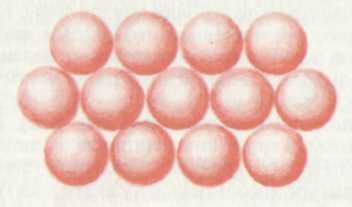
Рис. 1.2. Плотноупакованный слой шаров |
Плотноупакованные кубическая и гексагональная структуры характеризуются одинаковым расположением атомов в пределах одной кристаллической плоскости. Однако они отличаются способом чередования таких плоскостей (два варианта укладывания третьего слоя). Вследствие этого отличаются и элементарные ячейки этих структурных типов кристаллов, и другие кристаллические плоскости внутри них. В КП структуре имеются четыре набора эквивалентных параллельных плоскостей. Они образуются четырьмя диагональными плоскостями, одна из которых показана на рис. 1.1.а. |
В ГП структуре имеется всего один набор эквивалентных плоскостей — горизонтальные плоскости, изображенные на рис. 1.1.б. Это объясняет тот факт, что хотя длина связи и плотность у металлов, относящихся к обоим типам плотноупакованных кристаллических структур, мoгут быть довольно близкими, их пластичность и ковкость связаны с конкретным типом кристаллической структуры. Например. Сu, Ag, Аu и γ-Fe, обладающие кубической плотноупакованной структурой, характеризуются высокой пластичностью и хорошей ковкостью, а Сr, V и Мо, имеющие ГП либо ОЦК структуру, обладают значительно меньшей пластичностью и ковкостью. Вместе с тем щелочные металлы с ОЦК структурой имеют небольшую плотность и настолько мягки, что их можно легко резать ножом. Низкая плотность этих металлов по сравнению с большинством остальных указывает на то, что их кристаллическая структура характеризуется и слабыми межатомными связями и бо’льшими межатомными расстояниями вследствие относительно небольшого числа связывающих валентных электронов.
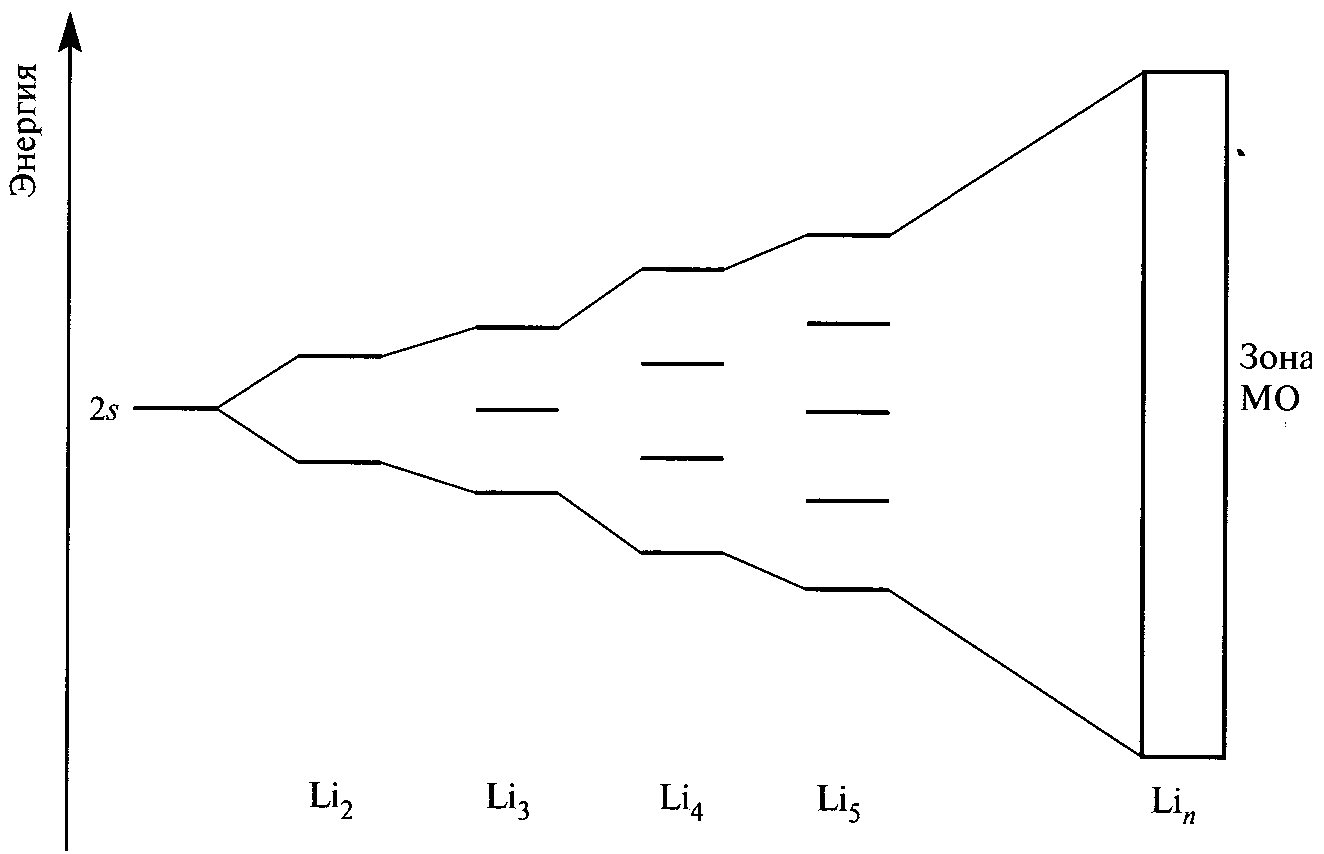
Основы электронного строения металлов можно понять, если рассмотреть схему изменения энергетических подуровней валентной электронной оболочки изолированных атомов, конденсирующихся в твердую фазу. (Рис. 1.3. соответствует металлическому литию).
|
Рис. 1.3. Перекрывание двух 2s атомных орбиталей (АО) в молекуле Li2 приводит к образованию двух молекулярных орбиталей (МО). В случае трёх атомов лития образуются три МО и т.д. В Lin образуется n очень близких по энергиям МО, которые можно рассматривать как зону. Каждый атом имеет один валентный электрон, и зона оказывается полузаполненной. |
Рис. 1.4. Характерной чертой металла является наличие частично заполненной зоны. Исходные выше- и нижележащие АО образуют соответственно незаполненные и полностью заполненные зоны. |
Между указанными на рис. 1.4 зонами могут располагаться достаточно большие запрещенные участки или зоны. В случае близких исходных АО зоны МО могут и перекрываться с образованием единой зоны смешанного типа.
Следует подчеркнуть, что энергетические зоны принадлежат кристаллу как единое целое и не относятся к его отдельным атомам, т.е. связывающие электроны в металле делокализованы и металлическая связь является ненаправленной.
Вся совокупность валентных электронов кристалла, располагающаяся на верхних заполненных подуровнях, образует его валентную зону. При 0 К электроны Li занимали бы только половину самых низких уровней зоны. Зона проводимости образуется из незанятых электронами вышележащих энергетических подуровней атомов. В металлах при обычных температурах за счет тепловой энергии валентные электроны распределяются не только по валентной зоне, но и по нижним уровням зоны проводимости. Под действием внешнего напряжения электроны перескакивают на более высокие уровни в пределах этой зоны, что соответствует практически свободному перемещению электрических зарядов через весь кристалл.
У ионных и ковалентных веществ валентные зоны полностью заполнены электронами, поскольку у исходных молекул или ионов все валентные орбитали заполнены электронами.
|
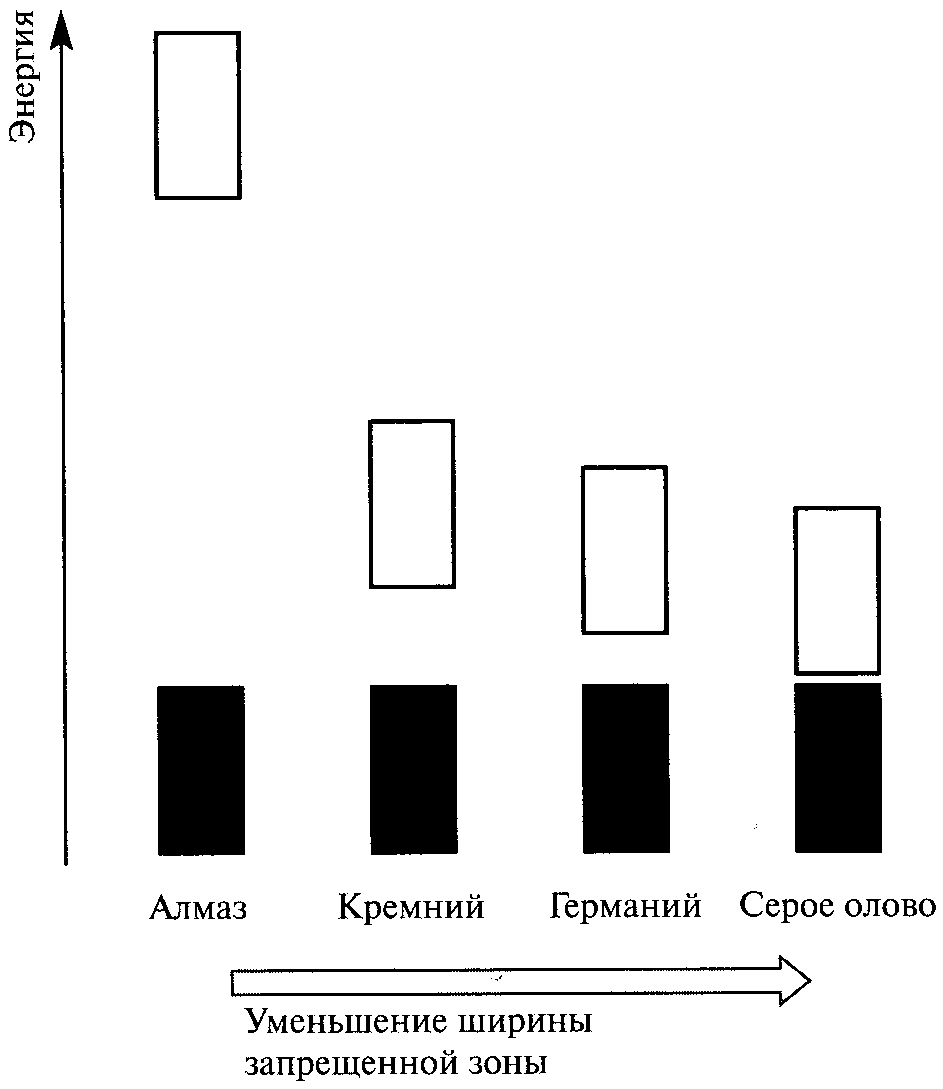
Высокоуровневая зона проводимости в ионных и ковалентных кристаллах оказывается пустой, даже при действии высокого напряжения, вследствие наличия большой запрещенной зоны, которая соответствует отсутствию коллективизированных уровней между зоной проводимости и полностью заполненной валентной зоной. Разумеется, при очень высоких температурах или чрезвычайно больших напряжениях может наступить пробой такого изолятора, подобно тому, как это бывает при проскакивании искр в воздухе. Зонная структура электронных энергетических уровней в полупроводниках имеет промежуточный характер между описанными выше для проводников (металлов) и изоляторов (ионных и ковалентных твердых веществ). При повышении температуры электроны получают возможность перескакивать через запрещенную зону и оказываются в зоне проводимости. При этом электропроводность быстро увеличивается в результате возрастания заселенности зоны проводимости и одновременного образования вакансий, или «дырок», в валентной зоне. Переход электронов в зону проводимости может осуществляться в результате поглощения света (явление фотопроводимости).
|
Рис. 1.4'. Зонная структура энергетических уровней электронов в изоляторах и полупроводниках. |
Электропроводность металлов, хотя и менее значительно, но уменьшается с ростом температуры вследствие возрастающих при повышении температуры колебаниях кристаллической решетки, которые препятствуют продвижению электронов.
Зонная модель объясняет присущий всем металлам специфический блеск, поскольку падающий на металлический кристалл свет практически полностью отражается вследствие последовательных актов поглощения – испускания световых квантов в широкой зоне большого числа чрезвычайно близких энергетических уровней. При облучении металла светом с достаточно большой энергией (частотой) электроны могут полностью отрываться от его поверхности. Это явление получило название внешнего фотоэлектрического эффекта.
Низкотемпературная сверхпроводимость возникает как результат образования куперовских пар при электрон-колебательных взаимодействиях в кристаллах (мощные электромагниты, передача энергии, транспортные проблемы…).

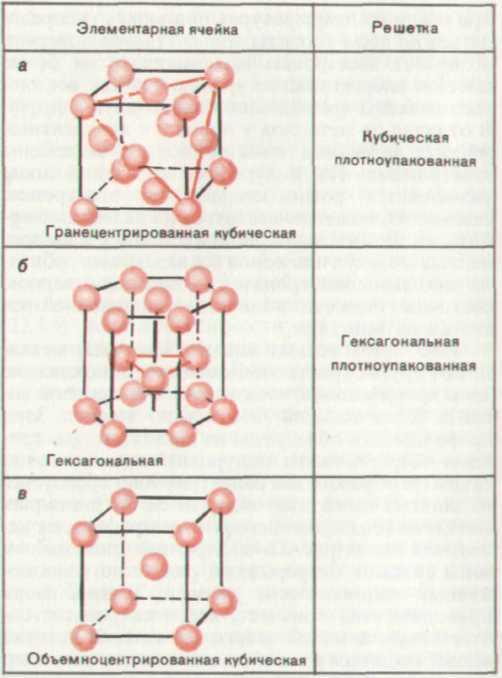 Рис. 1.1.
Кристаллическая
структура
металлов
Рис. 1.1.
Кристаллическая
структура
металлов