
- •Методические указания
- •Занятие 1 Тема: Белки. Цветные реакции на аминокислоты.
- •Методические указания
- •Занятие 2 Тема: Выделение белков, фракционирование и их гидролиз.
- •Методические указания
- •Занятие 3 Тема: Реакции осаждения белков.
- •Методические указания
- •Занятие 4 Тема: Ферменты.
- •Методические указания
- •Занятие 5 Тема: Липиды.
- •Методические указания
- •Занятие 6 Тема: Углеводы.
- •Методические указания
Занятие 4 Тема: Ферменты.
Цель: Получить опыт в выделении ферментов, определении их свойств и выявить факторы, влияющие на активность ферментов.
Материальное обеспечение:
Продукты: свежие пекарские дрожжи; 0,2% раствор крахмала.
Реактивы: 1%-ый раствор йода; 2%-ый раствор сахарозы; 5%-ый раствор гидроксида натрия; 5-ый раствор сульфата меди; 0,15 М однозамещенного фосфата калия КН2РО4 (рН=4); 0,15 М двузамещенного фосфата натрия Na2НРО4 (рН=9); 1%-ый раствор хлорида натрия; дистиллированная вода.
Посуда и оборудование: пробирки; складчатые бумажные фильтры; цилиндры на 10 см3; спиртовки; водяная баня; холодильник; термостат.
Методические указания
Ферменты - это специфические белки, входящие в состав всех клеток и тканей живых организмов, играющие роль биологических катализаторов.
Ферменты чрезвычайно эффективны и проявляют высокую каталитическую активность в условиях умеренной температуры (температура тела), нормального давления и в области, близких к нейтральным значениям pH среды. Активность изменяется от присутствия различных веществ- активаторов и ингибиторов.
Например, соляная кислота активирует фермент пипсиноген, но парализует действие амилазы слюны. Большинство тяжелых металлов (свинец, кадмий, ртуть) являются ферментными ядами.
Активаторами служат ионы магния, марганца, кальция, цинка. Фермент обнаруживается по его действию на субстрат. Например, отсутствие синей окраски при добавлении йода в крахмал показывает, что в растворе присутствует фермент амилаза, под действием которого крахмал осахаривается.
При длительном кипячении, действии химическими реагентами ферменты денатурируют, как все белки, теряя при этом каталитические свойства.
Как белки, они легко осаждаются из водных растворов при низких температуры методами высаливания или осторожным добавления ацетона, этанола. При этом ферменты не теряют своих каталитических свойств.
Опыт 1. Получение амилазы слюны.
В слюне ротовой полости выделяется фермент амилаза, сбраживающий крахмал.
Ход работы:
Предварительно прополоскав рот, набрать 10 мл дистиллированной воды и подержать 10-20 секунд. Затем вылить в пробирку. Раствор отфильтровывается через складчатый фильтр. Фильтрат представляет собой вытяжку амилазы.
Проверка: в две пробирки наливают по 1 см3 0,2%-ного раствора крахмала и в одну из них 0,5 см3 амилазы (вторая - контрольная), через 5 мин. в обе пробирки добавляют по 1-2 капли йода 1%-ного.
Результаты и выводы записать в тетрадь.
Опыт 2. Получение сахаразы из дрожжей.
В клетках дрожжей присутствует фермент сахараза, способный сбраживать сахарозу. При механическом разрушении клеточных оболочек и обработке их водой фермент переходит в раствор.
Ход работы:
5г свежих пекарских дрожжей растирают в ступке со щепоткой кварцевого песка, прибавляя понемногу 1,0 - 1,5 см3 дистиллированной воды, затем приливают еще порциями 10 см3 воды и ступки ставят в термостат на 10 мин. при температуре 25-30.
Проверка: в две пробирки набирают по 1 см3 2%-ного раствора сахарозы. В одну из них приливают 1 см3 раствора сахаразы (вторая контрольная - добавить 1 мл воды).
Через 15 мин. в этих пробирках проводят реакцию Троммера: добавляется 1 см3 5%-ного раствора NaOH и 2-3 капли 5%-ного раствора CuSO4.Содержимое пробирок перемешивается и нагревается на спиртовки до кипения. Положительная реакция Троммера (красный или оранжевый осадок) указывает на наличие моносахаридов.

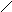
 О
О
О
О
R -C
+ Cu(OH)2
R
– C
+ Cu2O
+ H2O
-C
+ Cu(OH)2
R
– C
+ Cu2O
+ H2O
 H
OH
H
OH
Результаты и выводы записать в тетрадь.
Опыт 3. Влияние температуры на активность ферментов.
Каталитическая активность ферментов в большей степени зависит от температуры среды, в которой проходит реакция.
В термолабильности ферментов можно убедиться на примере действия амилазы слюны. Фермент амилаза осуществляет гидролиз крахмала через промежуточные продукты распада (декстрины) до мальтозы. Нерасщепленный крахмал с йодом дает синее окрашивание, а декстрины в зависимости от величины своих частиц дают с йодом фиолетовую, красно-бурую, оранжевую окраску или вообще не окрашиваются. Мальтоза, конечный продукт распада крахмала, не окрашивается раствором йода. Таким образом, по окраске раствора йода можно судить о степени гидролиза крахмала.
Ход работы:
В четыре пробирки наливают по 2 см3 0,2%-ного раствора крахмала и на 10 мин. Первую ставят в кипящую баню (100°С), вторую ставят в термостат (40С), третью оставляют при комнатной температуре (+20°С), четвертую помещают в снег или в холодильник (4°С).
Через 10 мин. в каждую пробирку добавляют по 1 см3 вытяжки амилазы и оставляют в тех же условиях еще на 15 мин.
Вынимают, горячие пробирки охлаждают водопроводной водой и добавляют в каждую пробирку по 2 капли йода. По интенсивности и цвету возникшего окрашивания судят о скорости и глубине протекания ферментативной реакции гидролиза крахмала амилазной слюны.
Сделать вывод о влиянии температуры на скорость ферментативной биохимической реакции. Указать какая температура оказывает оптимальное, инактивирующее или ингибирующее действие на активность ферментов.
Опыт 4. Установление специфичности ферментов.
Все ферменты обладают специфичностью действия: относительной (групповой), абсолютной или стереоспецифичностью.
Стереоспецифичность - фермент катализирует превращение только одного из возможных стереоизомеров субстрата.
О

 тносительная
(групповая) специфичность
наблюдается, когда фермент катализирует
реакции одного типа с более, чем одним
структуроподобным субстратом. Например,
пепсин расщепляет белки, хотя они могут
различаться друг от друга как по
химическому строению, так и по свойствам.
Однако он не расщепляет углеводы, так
как местом действия пепсина является
пептидная связь. Действие этих субстратов
распространяется на большое число
субстратов, что позволяет обойтись
небольшим числом пищеварительных
ферментов - иначе их потребовалось бы
намного больше.
тносительная
(групповая) специфичность
наблюдается, когда фермент катализирует
реакции одного типа с более, чем одним
структуроподобным субстратом. Например,
пепсин расщепляет белки, хотя они могут
различаться друг от друга как по
химическому строению, так и по свойствам.
Однако он не расщепляет углеводы, так
как местом действия пепсина является
пептидная связь. Действие этих субстратов
распространяется на большое число
субстратов, что позволяет обойтись
небольшим числом пищеварительных
ферментов - иначе их потребовалось бы
намного больше.
Абсолютная специфичность проявляется тогда, когда фермент действует лишь на одно-единственное вещество и катализирует лишь определенное превращение данного вещества. Например, амилаза слюны ускоряет гидролиз только полисахаридов, не оказывая действия на дисахариды. Мальтаза слюны катализирует гидролиз мальтозы, но не оказывает действия на сахарозу.
Сахароза не имеет свободной альдегидной группы, поэтому не дает реакции Троммера. Реакция Троммера может быть положительной только в том случае, если сахароза расщепится на свои составные части - глюкозу и фруктозу.
Ход работы:
Берут четыре пробирки. В первую и вторую заливают по 2 см3 0,2%-ного раствора крахмала, в третью и четвертую - по 2 см3 2% раствора сахарозы. Затем наливают вытяжки ферментов по 0,5 см3 (в первую и третью - амилазы, во вторую и четвертую- сахаразы, полученной при выполнении опыта 2 ).
Содержимое пробирок перемешивают и дают им постоять 15 мин. при комнатной температуре.
Затем, в пробирках, в которых в качестве субстрата взят крахмал, (первая и вторая пробирки) , проводят реакцию с йодом (3-4 капли раствора Люголя)
В третьей и четвертой пробирках проводят реакцию Троммера: добавляют 1 см3 5%-ного раствора NaOH и 2-3 капли 5%-ного раствора CuSO4. Содержимое пробирок перемешивают и нагревают на спиртовке до кипения.
Результаты записать в таблицу 5:
Таблица 5
Специфичность действия ферментов
|
№ про- |
Добавляемое вещество, мл |
Окраска |
Реакция | |||
|
Бирки |
крахмал |
сахароза |
амилаза |
сахараза |
с йодом |
Троммера |
|
1 |
2 |
- |
0,5 |
- |
|
- |
|
2 |
2 |
- |
- |
0,5 |
|
- |
|
3 |
- |
2 |
0,5 |
- |
- |
|
|
4 |
- |
2 |
- |
0,5 |
- |
|
Сделать вывод:
Опыт 5. Влияние рН среды на активность амилазы.
Ход работы:
В три пробирки наливают буферные растворы с различными значениями рН: в первую 1 см3 0,15 М однозамещенного фосфата калия КН2РО4 (рН=4), во вторую 1 см3 0,15 М двузамещенного фосфата натрия Na2НРО4 (рН=9), в третью - по 0,5 см3 того и другого раствора (рН=7).
Затем, в каждую пробирку добавляют по 1 см3 0,2%-ного раствора крахмала и по 0, 5 см3 вытяжки амилазы, перемешивают. Через 2-3 мин. в каждую пробирку добавляют по 1-2 капли йода и наблюдают окрашивание. Выводы записать в таблицу 6.
Таблица 6
Влияние рН среды на активность амилазы
|
|
Добавляемое вещество, см3 |
Выдержка, |
Реакция | |||
|
рН |
Крахмал |
КН2РО4 |
Na2НРО4 |
амилазы |
мин. |
|
|
4,0 |
1 |
1 |
- |
0,5 |
|
|
|
9,0 |
1 |
- |
1 |
0,5 |
|
|
|
7,0 |
1 |
0,5 |
0,5 |
0,5 |
|
|
|
4 |
- |
2 см3 |
- |
0,5 см3 |
|
|
Сделать вывод.
Опыт 6. Влияние активаторов и ингибиторов на активность амилазы слюны.
Ход работы:
В одну пробирку вносят 10 капель дистиллированной воды, во вторую - 8 капель воды и 2 капли 1%-го раствора хлорида натрия, в третью - 8 капель воды и 2 капли раствора сульфата меди (II).
В каждую пробирку добавляют по 20 капель разведенной (1:10) слюны, содержимое пробирки перемешивают, добавляют по 5 капель раствора крахмала и оставляют стоять при комнатной температуре 5 мин.
В это время готовят три пробирки с водой (по 1 см3 в каждой), подкрашенной каплей раствора йода, и добавляют в них по 2-3 капли содержимого опытных проб. Наблюдают окрашивание в зависимости от степени расщепления крахмала амилазой. В первой пробирке появляется фиолетовая или красно-бурая окраска, во второй пробирке, где ионы хлора играют роль активатора, появляется желтая окраска, а в третьей пробирке, где ионы меди тормозят действие амилазы, окраска остается синей. Если описанной картины не наблюдается, то опыт повторяют через 10 мин. Результаты вносят в таблицу 7.
Таблица 7
Влияние активаторов и ингибиторов на активность ферментов
|
№ пробирки |
Исследуемое вещество, капли |
Добавляемое вещество, капли |
Окраска | |||
|
|
крахмал |
амилаза |
Н2О |
NaCl |
CuSO4 |
|
|
1 |
5 |
20 |
10 |
- |
- |
|
|
2 |
5 |
20 |
8 |
2 |
- |
|
|
3 |
5 |
20 |
8 |
- |
2 |
|
Сделать выводы о характере влияния хлорида натрия и сульфата меди на активность амилазы.
Задание:
Изучить методические указания и ход предлагаемых работ.
Провести выше описанные опыты.
Письменно подготовить отчет по занятию: записать цель, название опытов, ход их проведения, результаты опытов и выводы.
Сделать вывод о свойствах ферментов.
Защитить работу и сдать теоретический материал по контрольным вопросам темы: «Ферменты»
Задание для СРС: подготовить теоретический материал по теме: «Химия и обмен липидов».
Контрольные вопросы:
Дайте понятие о ферментах, какова их химическая природа и функциональная организация?
Назовите механизм ферментативного действия (образование ферментосубстратного комплекса, теория Фишера и Кошланда).
Укажите факторы, влияющие на активность ферментов (ингибиторы, активаторы).
Назовите особенности биокатализа (влияние концентрации субстрата, ферментов, рН среды, температуры и т.д.).
Назовите классификацию ферментов.
Укажите функции отдельных классов ферментов в организме.
Каковы правила названия ферментов.
8. Каково применение ферментов в пищевой промышленности?
