
- •Методические указания
- •Занятие 1 Тема: Белки. Цветные реакции на аминокислоты.
- •Методические указания
- •Занятие 2 Тема: Выделение белков, фракционирование и их гидролиз.
- •Методические указания
- •Занятие 3 Тема: Реакции осаждения белков.
- •Методические указания
- •Занятие 4 Тема: Ферменты.
- •Методические указания
- •Занятие 5 Тема: Липиды.
- •Методические указания
- •Занятие 6 Тема: Углеводы.
- •Методические указания
Министерство образования Российской Федерации
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Методические указания
к выполнению лабораторных работ
по дисциплине «Биохимия»
для студентов 2-го курса специальности:
271200 «Технология продуктов общественного питания».
271203 «Технология хлеба, кондитерских и макаронных изделий»
НОВОСИБИРСК
2001
Составитель Т.В.Дерюшева, канд. техн. наук, доц.
Рецензент: И.В.Мацейчик, канд. техн. наук, доц.
Работа подготовлена на кафедре ТПП
Пояснительная записка
Методические указания для лабораторных работ по дисциплине «Биохимия» составлены в соответствии с программой курса для специальности 271200 «Технология продуктов общественного питания» и 271203 «Технология хлеба, кондитерских и макаронных изделий».
Занятия придерживаются определенной структуры, включающей цель занятия, материальное обеспечение, методические указания, ход выполнения опытов, задания, контрольные вопросы, оказывающие помощь студентам к теоретической подготовке по темам.
При выполнении лабораторных работ особое внимание уделяется основным веществам в жизнедеятельности организма: белкам, ферментам, углеводам и липидам.
Целью лабораторных работ является закрепление теоретического материала по дисциплине, а также опытного подтверждения некоторых биохимических свойств веществ, участвующих в обменных процессах организма.
В плане лабораторных работ предусмотрены коллоквиумы, контрольные работы и тестирование студентов, позволяющие контролировать и закреплять теоретические знания и практические навыки.
Занятие 1 Тема: Белки. Цветные реакции на аминокислоты.
Цель: Получить представление о возможности распознавания белковой природы веществ и аминокислот, входящих в их состав; получить опыт в качественном определении некоторых аминокислот в продуктах питания с помощью «цветных реакций».
Материальное обеспечение:
Продукты: яичный белок, 1%-ный раствор; желатин, 1%-ный раствор.
Реактивы: гидроксид натрия, 10%-ный раствор; медь сернокислая, 1%-ный раствор; нингидрин, 0,5%-ный раствор; азотная кислота, конц.; серная кислота конц.; уксуснокислый свинец - 0,5%-ный раствор; сахароза - 10%-ный раствор; гидроксид аммония конц.
Посуда и оборудование: штатив с пробирками; набор пипеток глазных; водяная баня; электроплитка; спиртовка; восковой карандаш; спички; держатель для пробирок.
Методические указания
При гидролизе белка образуются различные аминокислоты.
«Цветные реакции» характерны для определенных группировок или для боковых радикалов тех или иных аминокислот. «Цветные реакции» лежат в основе многих методов количественного колориметрического определения аминокислот в белках и полипептидах. «Цветные реакции» можно проводить с раствором яичного белка, желатина, а также с растворами белков продуктов растительного и животного происхождения.
Опыт 1. Биуретовая реакция (реакция Пиотровского)
Биуретовая реакция обусловлена наличием в соединениях пептидной группировки (-СО-NH-). Белки, пептоны, пептиды, амиды и имиды кислот дают с солями меди в щелочной среде окрашенный биуретовый комплекс. Схематично реакцию можно представить следующим образом:
NaOH
. ..-
NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-...
..-
NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-...




R1 R2 R3 R4
Полипептид (кетоформа)
OH OH OH OH



 Cu(OH)2
Cu(OH)2
 ...=
...= N-CH-C=NH-CH-C=NH-CH-C=NH-CH-C=...
N-CH-C=NH-CH-C=NH-CH-C=NH-CH-C=...




R1 R2 R3 R4
Полипептид (енольная форма)
 R2
R2





 N
CH C = N
N
CH C = N



 C
O CH - R3
C
O CH - R3



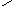




 R1
- CH O
Cu
C
R1
- CH O
Cu
C
N N OH


 ...
...
...
...
Окрашенный биуретовый комплекс
Для медных биуретовых комплексов различных соединений характерна окраска от красной через фиолетовую до синей с максимумом поглощения в интервале от 440 до 640 нм, что используется при количественном определении общего белка в исследуемом продукте.
Окраска биуретового комплекса зависит от качества медной соли в растворе и от структуры вещества, с которым координирован ион меди. Продукты распада белка - пептоны и полипептиды дают биуретовую реакцию с красным оттенком. Присутствие в исследуемом растворе белка аммонийных солей, например, сернокислого аммония, препятствует образованию окрашенного продукта. В этом случае для успешного проведения реакции требуется брать большой избыток щелочи. Избыток медного купороса маскирует образование окраски.
Ход работы:
В пробирку наливают 5 капель 1%-ного раствора яичного белка. Затем приливают 5 капель 10%-ного едкого натра и 1 каплю 1%-ного раствора сернокислой меди. Отмечают окраску. Результаты работы записывают в табл.1.
Опыт 2. Нингидриновая реакция.
Реакция основана на взаимодействии аминокислот и аминов с нингидрином. Большинство аминокислот дает красно-фиолетовое окрашивание, аспарагин - оранжево-коричневое, пролин и оксипролин -желтое.
Нингидрин (трикетогидринденгидрат) вызывает окислительное дезаминирование аминокислот с образованием конденсированного соединения розовато-фиолетового цвета («пурпура Руэманна»):
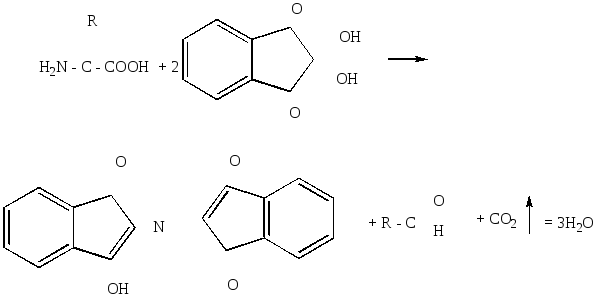






















Нингидриновая реакция широко используется как для открытия отдельных аминокислот, так и для определения их количества в биологических объектах.
Ход работы:
В одну пробирку вносят 5 капель 1%-ного раствора яичного белка, в другую - 5 капель 1%-ного раствора желатина. В каждую пробирку добавляют по 3 капли 0,5%-ного раствора нингидрина, закрывают пробирки плотно пробками и нагревают на кипящей водяной бане 18 минут. Через 2-3 минуты в обеих пробирках появляется окраска. Результаты работы записывают в табл. 1.
Опыт 3. Ксантопротеиновая реакция.
Эта реакция на белки с образованием нитропроизводных ароматических и некоторых гетероциклических радикалов. При взаимодействии белка с азотной кислотой происходит нитрование ядра ароматических аминокислот, содержащихся в белке, с образованием окрашенных соединений. С помощью ксантопротеиновой реакции в составе белка можно обнаружить такие циклические аминокислоты, как фенилаланин, тирозин, триптофан и др.
Реакция протекает по следующей схеме:










Ход работы:
В одну пробирку наливают 5 капель 1%-ного раствора яичного белка, в другую - 5 капель 1%-ного раствора желатина. В обе пробирки добавляют по 2-3 капли концентрированной азотной кислоты и осторожно нагревают на спиртовке до кипения, все время перемешивая. При нагревании раствор и осадок окрашивается в желтый цвет, если белок содержит ароматические аминокислоты. Охладив смесь, осторожно, по каплям добавляют избыток гидроксида аммония. При этом желтая окраска раствора переходит в оранжевую. Результаты работы записывают в табл.1.
Опыт 4. Реакция Фоля.
Белок, содержащий в своем составе серу, при нагревании с раствором щелочи гидролизуется, сера отщепляется в виде сероводорода, который тут же превращается в сульфид натрия. Таким образом, для обнаружения серы в белках требуется разрушение белковой молекулы. Отщепляющуюся серу можно определить, например, с помощью уксуснокислого свинца, который реагирует с сульфидом, образуя черный осадок сернистого свинца:
(
 CH3COO)2Pb
+ Na2S
2CH3COONa
+PbS
CH3COO)2Pb
+ Na2S
2CH3COONa
+PbS
Если количество серы в белке незначительно, вместо осадка образуется коричневый раствор.
Реакция обусловлена присутствием в белке серусодержащих аминокислот: цистеина, цистина и метионина.
Ход работы:
В две пробирки наливают по 5 капель яичного и желатинового растворов. В каждую пробирку добавляют двойной объем 10%-ного гидроксида натрия. Содержимое пробирок перемешивают и осторожно кипятят в течение 1-2 мин. Затем в каждую пробирку приливают по 5 капель уксуснокислого свинца и вновь нагревают. Наблюдают за изменением окраски в пробирках. Результаты работы записывают в табл.1.
Опыт 5. Реакция на триптофан
При последовательном добавлении к белку раствора сахарозы и концентрированной серной кислоты на границе двух жидкостей образуется красно-фиолетовое кольцо.
Реакция обусловлена наличием в белке триптофана, который реагирует с оксиметилфурфуролом, образующимся из фруктозы и дает окрашенные продукты конденсации. Концентрированная серная кислота участвует в реакции как водоотнимающее вещество.
Ход работы:
В одну пробирку наливают 5 капель раствора яичного белка, в другую - 5 капель раствора желатина. В каждую пробирку добавляют по одной капле 10%-ного раствора сахарозы, перемешивают, отмечают объем полученных растворов. Затем в первую и вторую пробирки добавляют такой же объем концентрированной серной кислоты. Пробирки ставят не менее, чем на 2-3 минуты на кипящую водяную баню. Наблюдают появление красно-фиолетового окрашивания в растворе, где присутствует в белке триптофан. Наблюдают за изменением окраски в пробирках. Результаты работы записывают в табл.1.
Таблица 1
Цветные реакции на белки и аминокислоты
|
Название реакции |
Употребляемые реактивы |
Сущность реакции |
Исследуемый материал |
Наблюдаемая окраска |
|
1. 2. 3. 4. 5. |
|
|
|
|
Задание:
Изучить методические указания и ход предлагаемых работ.
Провести выше описанные опыты.
Письменно подготовить отчет по занятию: записать цель, название опытов, ход их проведения, химические реакции, результаты опытов и выводы.
Сделать общий вывод об аминокислотном составе и полноценности яичного белка и желатина.
Защитить работу и сдать теоретический материал по контрольным вопросам темы: «Аминокислоты».
Задание для СРС: подготовить теоретический материал по теме: «Химия белков»
Контрольные вопросы:
Основные признаки живой материи
Структурная организация клетки
Что называется аминокислотами?
Какие классификации аминокислот известны?
Назовите представителей нециклических аминокислот из группы:
- моноаминомонокарбоновых кислот;
- гидроксиаминомонокарбоновые ;
- серусодержащие;
- моноаминодикарбоновые;
- диаминомонокарбоновые;
Перечислите основные циклические аминокислоты.
Какие из перечисленных аминокислот обладают:
- кислотными свойствами?
- основными?
- амфотерными?
Назовите незаменимые, полузаменимые и заменимые аминокислоты.
Дайте характеристику отдельных аминокислот.
Какие из них входят в знаменитую триаду по физиологической важности?
Назовите известные вам «цветные реакции», свойственные соответствующим аминокислотам.
