
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
Алгоритм розв’язання задач
1. Визначити умови задачі та записати рівняння дисоціації.
2. Вибрати потрібну формулу.
3. Підставити данні задачі і провести розрахунок.
4. Зробити висновок.
Приклад розв’язання задачі за алгоритмом
Визначити
![]() і рН 0,1 М розчинуNH4OH,
і рН 0,1 М розчинуNH4OH,
![]() .
Зробити висновки про силу електроліту
та реакцію
середовища.
.
Зробити висновки про силу електроліту
та реакцію
середовища.
З формули (2)
знаходимо
![]()
0,1 М розчин NH4OH
– слабкий електроліт
(![]() =1%,
КД=10-5)
=1%,
КД=10-5)
Запишемо
рівняння дисоціаціі
![]()
Концентрація
ОН—іонів
в розчині дорівнює
![]()
![]() моль/л.
моль/л.
З формули (7) рОН=-lg[OH-]=3.
З формули (8) pH+pOH=14→ pH=14-pOH=14-3=11;
pH>7, середовище в розчині NH4OH – лужне.
Висновок:0,1 М розчин
NH4OH
– слабкий електроліт
(![]() =1%,
КД=10-5)
=1%,
КД=10-5)
pH>7, середовище в розчині NH4OH – лужне.
Методика рішення задач з теми «Гальванічні елементи»
Щоб розв’язати задачі з цієї теми, треба знати будову гальванічних елементів (ГЕ), їх види, стадії роботи, мати уяви про стандартний електродний потенціал (Е0, В), рівняння Нернста для розрахунку електродного потенціалу (Е0, В), його залежність від різних факторів, розрахунок ЕРС (ΔЕ), правила запису електрохімічних формул ГЕ, напіврівняння анодного і катодного процесів, обчислювання можливості роботи ГЕ.
Головне, що треба знати при розв’язанні цих задач, що:
Анод (А) – це більш активний електрод з меншим значенням електродного потенціалу;
Катод (К) - це менш активний електрод з більшим значенням електродного потенціалу;
При роботі ГЕ анод окислюється, а на катоді йде відновлення електроліту, у який він занурен.
Рівняння
Ернста
![]() (1),
(1),
де Е, Е0 – відповідно електрдний та стандартний електродний потенціали металу,
n – кількість електронів, що приймають участь в електродному процессі,
СМ – молярна концентрація розчину солі металу.
Можливість
роботи ГЕ обчислюють за допомогою
значення вільної
енергії
Гіббса
![]() (2),
(2),
де n – кількість електронів, що приймаютьучасть в електродному процесі, F – стала Фарадея (96500 Кл/моль),
ЕРС (ΔЕ), ЕРС=ЕК-ЕА (3).
Алгоритм розв’язання задач
Виявити в ГЕ (А) і (К), за значеннями електродних потенціалів (Е0 – беремо в ряду напруг металів Н.Н.Бекетова).
Записати:
електрохімічну формулу ГЕ;
електронне напіврівняння анодного процесу;
електронне напіврівняння катодного процесу;
сумарне рівняння роботи ГЕ;
Привести розрахунок ЕРС (ΔЕ).
Обчислити можливість роботи ГЕ і зробити висновок.
Приклад розв’язання задачі за алгоритмом
Запишіть електрохімічну формулу ГЕ, складеного зі стандартного магнієвого електрода, зануреного у розчин своєї солі та залізного електрода, зануреного в 0,01 М розчин FeSO4. Запишіть електронні напіврівняння анодного та катодного процесів та сумарне рівняння реакції. Розрахуйте ЕРС та ΔG цього ГЕ. Зробіть висновки про можливість роботи цього ГЕ та залежність електродного потенціалу від концентрації електроліту, у який занурен електрод.
Задачу розв’язуємо згідно алгоритму.
Знаходимо в ряду напруг М.М. Бекетова
 .
.Розрахуємо
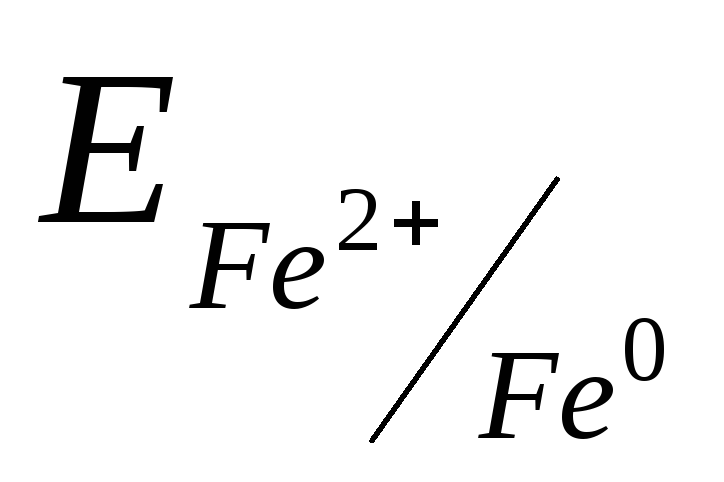 ,
користуючись рівнянням
Нернсту (1):
,
користуючись рівнянням
Нернсту (1):
![]()
![]()
![]() CM=10-2
M)
CM=10-2
M)
![]()
При розведенні розчину електроліту, у який занурен електрод, його електродний потенціал зменшується, а активність збільшується.
![]() ,
,
![]() ,
тому магнієвий
електрод буде анодом (А), а залізний
– катодом (К).
,
тому магнієвий
електрод буде анодом (А), а залізний
– катодом (К).
3. Запишемо електрохімічну формулу ГЕ:
(А) Mg | Mg2+||Fe2+SO4 | Fe (K)
 -2,38
1 M
0,01 M
-0,50
-2,38
1 M
0,01 M
-0,50
електронне напіврівнення анодного процесу: Mg0 - 2ē → Mg2+ 1
+
електронне напіврівняння катодного процесу: Fe2+ + 2ē → Fe0 1
Сумарне рівняння: Mg0+Fe2+→Mg2++Fe0
4. Розрахуємо ЕРС з рівняння (3):
ЕРС(ΔЕ)=ЕК-ЕА=-0,50-(-2,38)=1,88 (В).
5.Обчислимо
ΔG
з рівняння (2):
![]()
ΔG<0 – ГЕ буде робити.
