
n6
.docГИДРОКСИКИСЛОТЫ (Г/К)
Функц. группы Г/К : ОН и СООН (старшая)
Классификация
1) по у/в скелету:
алифат-кие; аромат-кие, циклические
2) по количеству СООН –групп:
моно-, ди- или трикарбоновые к-ты;
3) по количества ОН-групп: ди-, три- , тетра и т. д. гидроксикислоты.
По взаимному расположению функциональных групп различают α-, β-, γ-, δ-гидроксикислоты и т. д. 2. Систематические названия гидроксикислот строятся по общим принципам ИЮПАК. Часто предпочтительными являются тривиальные названия.
Некоторые представители гидроксикислот
|
Формула |
Трив. |
ИЮПАК |
|
|
Молочная эфиры:
ЛАКТАТЫ |
2-гидрокси-пропановая к-та |
|
|
Яблочная; эфиры малаты |
гидрокси-бутандиовая к-та |
|
|
Винная; ТАРТРАТЫ |
2,3-дигидрокси-бутандиовая к-та |
|
|
Лимонная;
Эфиры: ЦИТРАТЫ
|
3-гидрокси-3- карбоксипентан-диовая к-та |
|
|
Салици-ловая ; Эфиры: САЛИЦИЛА- ТЫ
|
2-гидрокси бензойная к-та (орто-) |
Способы получения алифатических гидроксикислот
1. Гидролиз
гидроксинитрилов (синтез α-гидроксикислот):
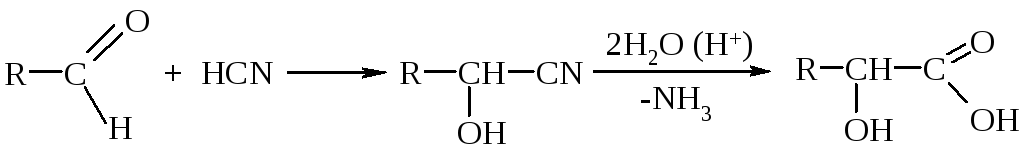
2. Щелочной гидролиз галогензамещенных кислот (кроме β-гидроксикислот):
 где n
= 0, 2, 3, 4 и т. д.
где n
= 0, 2, 3, 4 и т. д.
В (ОН-) среде будут получ-ся α,β-ненасыщенные к-ты( за счет отщепления НCl).
3.Окис-е гидроксиальд-дов в гидроксик-ты.
4.Восстан-е оксогруппы альд.- и кеток-т в гидроксигруппу Г/К.
5.Реакция
Реформатского(синтез β- Г/К):

сложн.эф. Г/К
7. Присоединение
Н2О
к непредельным кислотам:
 где n
= 0 ÷ 3.
где n
= 0 ÷ 3.
Способы получения аром-х г/ксикислот
-
Синтез салициловой к-ты по р-ции Кольбе–Шмитта:

ХИМИЧЕСКИЕ СВОЙСТВА ГИДРОКСИКИСЛОТ
Специфические свойства гидроксикислот обусловлены принадлежностью этих соединений одновременно к спиртам и карбоновым кислотам и во многом зависят от взаимного расположения функциональных групп.
-
Реакции по ОН- группе:

-
Реакции по СООН- группе:

3. Взаимное влияние функц-ных групп. Отношение к нагреванию α, β, γ- и δ-гидроксикислот
Отношение к нагреванию α-гидроксикислот
-
α-Гидроксикислоты при Т°C дегидратируются с образованием лактидов.
ЛАКТИДЫ - циклические эфиры, построенные из двух и более остатков гидроксикислот

-
α-гидроксикислоты при Т°C с разбавл.
р-ми H2SO4 или HCl расщепляются с образованием муравьиной кислоты (НСООН) и соответствующего альдегида:

Отношение к нагреванию β-гидроксикислот
-
β-Гидроксикислоты при Т°C или при действии кислот дегидратируются с образованием α-, β-ненасыщенных кислот:

Отношение к нагреванию γ- и δ- гидроксикислот
γ- и δ-гидроксикислоты при Т°C в кислой среде подвергаются внутримолекулярной этерификации с образованием пяти- и шестичленных лактонов.
ЛАКТОНЫ
- внутренние сложные эфиры гидроксикислот,
, в которых сложноэфирная группировка
— С(О)О — включена в циклическую
структуру.
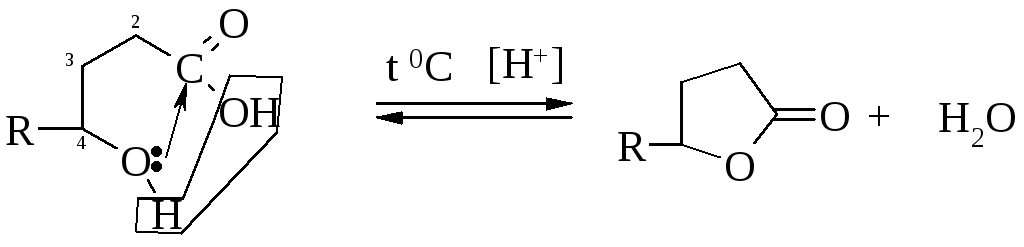
γ-гидроксикислота γ-лактон
4. Хим-е свойства салициловой кислоты:
а) р-ция этериф.:
получ. метилсалицилата
 б)
получение фенилсалицилата
б)
получение фенилсалицилата

в) синтез
ацетилсалициловой к-ты

г) другие реакции:
 пимелиновая кислота
пимелиновая кислота
Оптическая (зеркальная) изомерия
ОСНОВНЫЕ ПОНЯТИЯ
Оптическая активность – способность объектов взаимодействовать с плоскополяризованным светом
(вращать плоскополяризованный свет);
Различ.: право- (+) и левовращащие (-)
изомеры
Поляриметр–прибор для измерения
оптической активности:

Е
α ·100
с · l
 [α ]
=
[α ]
=![]()
α –наблюдаемое вращение
с – концентрация, l –длина трубки.
Причины оптической активности:
наличие асимметрического атома С (С*);
отсутст. плоскости и центра симметрии.
Асимметрический атом С — атом, у которого все четыре валентности затрачены на соедин. с различ. атомами или группами атомов.
Любое органическое соединение, содержащее С*, можно представить в виде двух несовместимых в пространстве пространственных изомеров, которые отличаются друг от друга как предмет от своего зеркального изображения, как правая рука отличается от левой.
Такая изомерия получила название «зеркальной». Молекулы, несовместимые в пространстве и относящиеся друг к другу как предмет к своему зеркальному отображению, называются хиральными (от греч. cheir — рука). Хиральные тела характеризуются отсутствием у них плоскости и центра симметрии.
При наличии в молекуле нескольких (n) асимметричных атомов углерода, общее количество стереоизомеров (Ν) определяют по формуле N = 2n.
Стереоизомеры подразделяют на:
энантиомеры (зеркальные изомеры) и диастереомеры – незеркальные изомеры.
Рацемическая смесь – смесь равных количеств энантиомеров, оптически недеятельна, обозначается (±).
При изображ. оптически актив. вещ-в обычно пользуются проекционными формулами, предлож. Э. Фишером.
По Фишеру: углерод. цепь располагают вертикально, вверху – наиболее окисленный атом С.
Проверка на совместимость в простр-ве:
а) наложением проекций одна на другую;
б) наложением проекций с разворотом чертежа на 180 град.
Для обозначения конфигураций часто применяют D,L -систему.
 По
системе D,L за эталон выбран глицериновый
альдегид:
По
системе D,L за эталон выбран глицериновый
альдегид:
Сравнивая с конфигур. глицер. альд-да, строение оптически активного соединения его относят к D- или L –ряду. Знак определ. на поляриметре (+)или (-).
Знак и конфигурация напрямую не связаны.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ МОЛОЧНОЙ КИСЛОТЫ

э н а н т и о м е р ы
D- и L- изомеры –энантиомеры (зеркальные изомеры).
Смесь равных количеств энантиомеров – рацемическая смесь(±).
L(+) — молоч. к-та образ. в мышеч. ткани как продукт расщепл. гликогена.
D(–) — молоч. к-та может быть получена под действием м/о.
Рацемич. смесь(±) – это молоч. к-та брожения.
Соли и сложные эфиры молочной кислоты - лактаты.
ОПТИЧ. ИЗОМЕРИЯ ВИННЫХ К-Т

ОПТИЧЕСКАЯ ИЗОМЕРИЯ ВИННЫХ КИСЛОТ
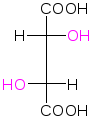


D(+)-винная L(-)-винная мезовинная кислота

tпл = 170°С tпл = 140°С
рацемат(±) — виноградная кислота tпл= 205°С
Соли и эфиры винной кислоты называются тартратами.
D-винная кислота содержится в виноградном соке и некоторых растениях. Двойная соль — тартрат калия-натрия, известная под названием сегнетова соль, используется для качественного и количественного определения альдегидов и моносахаридов под названием реактива Фелинга.
L-винную кислоту получают расщеплением виноградной кислоты на энантиомеры. В очень небольшом количестве она также содержится в виноградных винах.
Методы расщепления рацемических смесей.
ЛИМОННАЯ КИСЛОТА

Лимонная кислота — наиболее распространенная гидрокситрикарбо-новая кислота. Содержится в плодах цитрусовых, например, лимонах (до 8 %), некоторых ягодах и фруктах, махорке.
В промышленном масштабе лимонную кислоту получают лимоннокислым брожением сахаристых веществ. Нагревание лимонной кислоты до 175 °С приводит к дегидратации (как β-гидроксикислоты), с образованием аконитовой кислоты. Нагревание с серной кислотой приводит к расщеплению лимонной кислоты на ацетондикарбоно-вую и муравьиную, с последующим их разложением до диоксида и монооксида.
 Лимонная кислота
и ее соли (цитраты) широко используются
в различных областях пищевой промышленности.
Лимонная кислота
и ее соли (цитраты) широко используются
в различных областях пищевой промышленности.





