
S 3s 2s
и подставим их в выражение константы растворимости Ва3(РО4)2:
K°S(Ва3(РO4)2)=[Ва2+]3[РО43]2=(3S)3(2S)2=6,01039

[Ва2+]=3S=2,7108 M; [РО43]=2S=1,8108 M.
Вычислим значения массовых концентраций
w(Ва3(РO4)2)=9109М(Ва3(РO4)2)=9109602=5,4106 г/л
w(Ва2+)=2,7108М(Ва)=2,7106137=3,7106 г/л
w(PO43)=1,8108M(РО4)=1,810895=1,7106 г/л
Пример 12. При какой концентрации серной кислоты в промывной жидкости относительная ошибка, вызванная растворимостью осадка BaSO4, не превысит 0,1 %? Масса осадка составляет 230 мг, объем промывной жидкости 300 мл.
Решение. Допустимая растворимость осадка:
S(0,1/100)230/[М(BaSO4)300]=3,3106 M
BaSO4 Ba2+ + SO42
3,3106 3,3106 (3,3106+c(H2SO4))
K°S(BaSO4)=1,11010=3,3106[3.3106+с(H2SO4)];
с(H2SO4)>3,3105 M.
Пример 13. Вычислить растворимость CaSO4 в его насыщенном растворе с учетом влияния ионной силы раствора.
Решение. В справочнике находим K°S(CaSO4)=2,5105
CaSO4Са2++SO42
S S S
В первом приближении вычислим растворимость осадка без учета влияния ионной силы раствора:
K°S=S2; S=5,0103 M.
Рассчитаем ионную силу раствора
I=(510322+510322)/2=0,02
Для двухзарядного иона вычислим значение коэффициента активности по уравнению:
 ,
=0.56.
,
=0.56.
Определим значение концентрационной константы растворимости
KS=K°S/2=2,5105/0,562=S2
и уточненное значение растворимости
S=9103 M.
Пример 14. Вычислить растворимость SrSO4 в 0,050 М растворе Na2SO4 без учета и с учетом солевого эффекта.
Решение.
SrSO4 Sr2++ SO42
S S (0,050+S)
Примем 0,050+S0,050. Без учета солевого эффекта для
K°S=3,2107=S0,050, S=6,4106<0,050 M.
Принятое допущение справедливо. Ионная сила раствора в основном определяется концентрацией Na2SO4
I=(20,0512+0,0522)/2=0,15
Значение коэффициента активности двухзарядного иона находим по таблице интерполяцией двух значений для I=0,1 и I=0,2:
=(0,36+0,28)/2=0,32
Растворимость с учетом солевого эффекта:
KS=K°S/2=3,2107/0,322=S0,050; S=6,3105 M.
Пример 15. Вычислить значение концентрационной константы растворимости Ag2CrO4 при I=0,5 и рассчитать молярную концентрацию AgNO3, необходимую для обеспечения равновесной концентрации ионов СrО42: а) 1105 М; б) 1108 М.
Решение. По таблице находим для I=0,5 значение 1=0,69 однозарядного иона и 2=0,22 двухзарядного иона. Находим также из справочных данных для Ag2CrO4 KS=1,11012.
KS=K°S/(122)=1,11012/(0,6920,22)=1,11011
а) Для обеспечения [СrО42]=1105 M.
Ag2CrO4 2Ag+ + CrO42
(с(AgNO3)+2105) 105
Предположим, что c(AgNO3)>>2105 M. Тогда c(AgNO3)+2105=c(AgNO3).
KS=l,l1011=с(AgNO3)105;
c(AgNO3)=1103 M>2105 M.
Принятое допущение оправданно.
б) Аналогично для [CrO42]=1108 M:
1,11011=с(AgNO3)2108; c(AgNO3)=3,3102 M.
Пример 16. Рассчитать растворимость Ag2C2O4 в его насыщенном растворе при рН=3,0 и сравнить с растворимостью в чистой воде.
Решение. В справочных таблицах находим для Ag2C2O4 KS=3,51011, для щавелевой кислоты К1=5,6102 и K2=5,4105. Таким образом, в растворе имеются формы С2О42, НС2О4 и Н2С2О4. [Н+]=10рН=103 M. Ионную силу раствора не учитываем по условию задачи.

Ag2C2O4 2Ag++ C2O42
S 2S S0,050
K°S=3,51011=(2S)2S0,050; S==5,6104 M.
В чистой воде
3,51011=(2S')2S'; S'=3,3104 M
растворимость осадка несколько ниже.
Пример 17. Какую избыточную концентрацию осадителя нужно создать при рН=3,0, чтобы растворимость осадка СаС2О4 не превышала 106 моль/л?
Решение. Предположим, что в качестве осадителя используем (NH4)2C2O4. Т.к. KS(CaC2O4)=2,3109 и среда кислая, то c((NH4)2C2O4) явно больше 103 M. Примем c((NH4)2C2O4)+106=c((NH4)2C2O4).
Равновесная концентрация C2O42, необходимая для достижения растворимости 106 моль/л, будет равна [C2O42]=KS(CaC2O4)/106=2,3103 моль/л.
Равновесная концентрация C2O42 связана с общей концентрацией c((NH4)2C2O4) соотношением [C2O42]=(C2O42)c((NH4)2C2O4).
Значение (C2O42) для рН=3,0 будет равно
(C2O42)=Ka1Ka2/([H+]2+Ka1[H+]+Ka1Ka2)=0,050
Отсюда получаем c((NH4)2C2O4)=[C2O42]/(C2O42)=0,046 моль/л
Принятое допущение оправдано.
Пример 18. Вычислить растворимость сульфида ртути (I) в воде с учетом гидролиза сульфид-иона и определить, во сколько раз полученный результат больше растворимости, вычисленной без учета гидролиза?
Решение. K°S(Hg2S)=11047 очень мало. Примем, что в результате гидролиза сульфид-ионов рН воды практически не изменяется (рН=7, [Н+]=107 M). Для H2S К1=1,0107 и K°2=2,51013. [Hg2+]=2S; [S2]=S(S2).
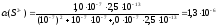
KS=11047=(2S)2S(S2)
 ,
,
что превышает значение растворимости
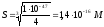 ,
,
вычисленное без учета гидролиза в 90 раз.
Пример 19. Рассчитать растворимость осадка Ва3(РО4)2 в его насыщенном растворе, учитывая гидролиз аниона.
Решение. Для Ва3(РО4)2 находим K°S=61039; для Н3РО4 Кa1=7,1103, Ka2=6,2108, K°a3=5,01013. В первом приближении учитываем гидролиз лишь по первой ступени с образованием НРО42, т. е. для значения K°a3:
Ва3(РО4)2+2Н2О3Ва2++2НРО42+2ОН
S 3S 2S 2S

Уточняем полученное значение с учетом следующих стадий гидролиза:
[ОН]=2S=1,0106 M;
[Н+]=1,0.1014/(1,0106)=1,0108 M

Ва3(РО4)23Ba2++2PO42
S 3S 2S(РО42)
KS=61039=(3S)3(2S4,3105)2; S=5,0107 M
Результат не изменился.
Задачи для подготовки к модульному контролю.
Произведения растворимости ряда иодидов равны:
|
Иодид |
ПР |
|
TlI |
6.5 10-8 |
|
AgI |
8.3 10-17 |
|
PbI2 |
7.1 10-9 |
|
BiI3 |
8.1 10-19 |
Расположите указанные соединения в порядке уменьшения растворимости в 1) воде, 2) 0,10 М растворе NaI, 3) 0,10 М растворе соответствующего катиона.
Произведения растворимости ряда иодатов равны:
|
Иодат |
ПР |
|
AgIO3 |
3.0 10-8 |
|
Sr(IO3)2 |
3.3 10-7 |
|
La(IO3)3 |
6.2 10-12 |
|
Се(IO3)4 |
4.7 10-17 |
Расположите перечисленные соединения в порядке уменьшения растворимости в 1) воде, 2) 0.10 М растворе NaIO3, 3) 0.10 М растворе соответствующего катиона.
Принимая, что для количественного удаления иона достаточно снизить его концентрацию до 1.010-6 моль/л, определите, осуществимы ли в принципе указанные ниже разделения, если исходная концентрация каждого иона 0,100 моль/л. Если разделение возможно, укажите условия, которые следует для этого создать. 1) Ag+ от Pb2+, используя Br- (ПР(PbBr2) =3.910-5); 2) Cl- от I-, используя Cu+; 3) Bi3+ от Ag+, используя I- (ПР(BiI3)=8.110-19, ПР(AgI)=9.98 10-17); 4) Ti3+ от TiO2+, используя ОН- (ПР(Tl(ОН)3)=110-40, ПР(Ti(ОН)2)=1 10-29) 5) Ва2+ от Ag+, используя SO42- (ПР(Ag2SO4)=1.610-5; 6) Fe3+ от Cu2+, используя ОН-.
Рассчитайте растворимость BaSO4 в 1) нейтральном растворе; 2) 0,100 М растворе HCl (HSO4- + Н2О Н3O+ + SO42-, K2=1.210-2).
Рассчитайте растворимость оксалата серебра Ag2C2O4 в растворе с концентрацией Н3О+, равной 1) 1.010-6 моль/л, 2) 1.010-4 моль/л, 3) 1.010-2 моль/л.
Рассчитайте растворимость приведенных ниже сульфидов в воде, сначала пренебрегая реакцией S2- как основания, а затем учитывая основные свойства S2 (допуская, что катионы не реагируют с Н2О): 1) CuS, 2) PbS, 3) MnS, 4) FeS.
Рассчитайте растворимость ВаСО3 в воде, сначала пренебрегая основными свойствами СО32-, а затем учитывая их.
Рассчитайте растворимость Ag2SO3 в воде (ПР=1.510-14), сначала пренебрегая основными свойствами SO32-, а затем учитывая их.
Произведение растворимости хлорида серебра равно 1.710-10, а хромата серебра 2.4510-12. Какое на соединений более растворимо в воде?
Какова максимальная концентрация иона кальция, которая может присутствовать в 1 л раствора, содержащего 3,00 моль фторид-иона?
Какая концентрация гидроксид-иона необходима для начала осаждения гидроксида магния из 0,01 М раствора сульфата магния?
Появится ли осадок гидроксида магния, если 25 мг хлорида магния растворить в растворе, полученном при разбавлении 10 мл 0,10 М раствора гидроксида натрия до 1 л?
К 150 мл раствора, содержащего 0.50 г Na2SO4, добавили 50 мл раствора, содержащего 1.00 г BaCl2. Рассчитайте массу (в мг) неосажденного сульфат-иона.
Концентрированный раствор иодида калия (KI) медленно добавляют к раствору, исходная концентрация которого 0,02 М по ионам свинца и 0.02 М по ионам серебра. Какой из катионов будет осаждаться первым? Какова будет концентрация, когда второй катион начнет осаждаться? Разбавлением раствора иодида калия пренебречь.
Чему равно произведение растворимости RbClO4, если концентрация иона рубидия Rb+ уменьшается в 111 раз, когда добавляют 3,00 моль перхлората лития (LiClO4) к 1 л насыщенного раствора перхлората рубидия?
Рассчитайте растворимость хромата бария в ацетатном буферном растворе, pH которого равен 4.26
BaCrO4(тв) Ba2+ + CrO42; Ksp = 2.6 10-10
HCrO4 H+ + CrO42; Ka2 = 3.2 10-7
2HCrO4 Cr2O72 +H2O; K' = 33
Уравнение равновесия при растворении и произведение растворимости оксалата бария следующие:
BaC2O4(тв) Ва2+ +C2O42; Ksp = 2.3 10-8
Щавелевая кислота является сравнительно слабой дипротонной кислотой, которая диссоциирует в соответствии со следующими уравнениями:
H2C2O4 H+ + HC2O4; Ka1 = 6.5 10-2
HC2O4 H+ + C2O42; Ka2 = 6.1 10-5
Рассчитайте растворимость оксалата бария в водном растворе, рН которого сохраняется постоянным (2.00) при помощи инертного буферного раствора.
Каковы будут равновесные концентрации Ва2+, Pb2+ и IO3 в 1 л насыщенного раствора (твердая фаза отсутствует) иодата бария, Ва(IO3)2, если последний находится в равновесии с 3.510-5 моль чистого твердого иодата свинца, Pb(IO3)2?
Ва(IO3)2(тв) Ва2+ + 2IO3; Ksp= 1.5 10-9
Pb(IO3)2(тв) Pb2+ + 2IO3; Ksp = 2.6 10-13
Вычислить произведение растворимости: 1) хромата серебра, если в 500 мл воды растворяется 0,011 г Ag2CrO4; 2) бромата серебра, если в 200 мл воды растворяется 0,36 г AgBrO3; 3) пирофосфата бария, если в 100 мл воды растворяется 8,78103 г Ва2Р2O7; 4) PbClF, если, в 250 мл воды растворяется 3,52104 моля этой соли; 5) селенита цинка, если в 200 мл воды растворяется 1,9510-2 г ZnSeO3; 6) фторида кальция, если растворимость CaF2 2,16104 моль/л; 7) роданида меди (I), если в 500 мл воды растворяется 4,21106 г CuSCN; 8) цианида никеля, если растворимость его 2,17106 г/л.
Какая соль из двух сравниваемых более растворима в воде и во сколько раз: 1) SrCO3 или ВаС)3; 2) Ba2Fe(CN)6 или Co2Fe(CN)6; 3) Са3(РO4)2 или BiPO4; 4) Hg2Br2 или PbBr2; 5) BaCrO4 или SrCrO4; 6) Zn(CN)2. или Cd(CN)2; 7) Са(IO3)2 или Pb(IO3)2; 8) CuC204 или FeC2O4; 9) BaSO4 или CaSO4; 10) Ni2Fe(CN)6 или Ni(IO3)2?
Вычислить растворимость (моль/л): 1) AgCl в воде; 2) AgCl в 0,01 М KCl; 3) СаС2O4 в воде; 4) СаС2O4 в0,01М (NH4)2C2O4; 5) SrSO4 в воде; 6) SrSO4 в 0,1 М K2SO4; 7) Hg2Cl2 в воде; 8) Hg2Cl2 в 0,1 М KCl; 9) AgIO3 в воде; 10) AgIO3 в 0,1 М AgNO3; 11) AgIO3 в 0,2М KIO3.
К 150 мл насыщенного раствора AgCl прибавлено 10 мл 3%-ного раствора NaCl. Сколько молей серебра останется в растворе?
Сколько миллилитров 0,1 М (NH4)2C2O4 следует добавить в 1 л насыщенного водного раствора СаС2O4 для понижения его растворимости до 0,1 мг/л?
К 50 мл 0,02 М CaCl2 прибавили 50 мл 0,03 М K2SO4. Сколько CaSO4 (г/л) останется в растворе?
Выпадет ли осадок Mg(OH)2 при действии на 0,2 М MgSO4 равным объемом: 1) 0,2 М NH3; 2) смеси 0,2 M NH3 и 2M NH4Cl?
К раствору, содержащему 50 г MgCl2, прилили 50 мл б М NH3. Сколько граммов NH4C1 необходимо добавить к смеси, чтобы после разбавления ее водой до 1 л осадок Mg(OH)2 не выпал?
При каком рН начнется выпадение осадка : Cо(ОН)2 из 0,1М СоСl2?
Будет ли осаждаться SrSO4 при добавлении 5 мл насыщенного раствора CaSO4 к 20 мл раствора, содержащего 0,5 мг иона стронция?
В 200 мл раствора содержится по 0,01 моля хлорида и оксалата натрия. К раствору добавляют AgNO3. Какова будет концентрация хлорид-иона, когда начнется осаждение Ag2C2O4?
Какое вещество начнет осаждаться первым при постепенном приливании AgNO3 к раствору, в 1 л которого содержится 0,01 моля KCl и 0,1 моля K2CrO4?
В 100 мл раствора содержится по 0,01 моля ионов Ba2+ и Sr2+. Сколько молей K2CrO4 следует ввести в раствор, чтобы осадить барий, но избежать осаждения стронция? Вычислить концентрацию бария, оставшегося в растворе.
В 100 мл раствора содержится 200 мг ионов Ва2+ и 1 мг ионов Pb2+. Какое вещество будет осаждаться первым при постеленном приливании K2CrO4. Можно ли количественно разделить указанные катионы в этом растворе с помощью хромата калия?
Раствор содержит 0,02 моль/л Br и 0,003 моль/л I. Можно ли разделить эти ионы при помощи осаждения солью свинца?
В 20 мл раствора содержится 20 мг K2CrO4 и 15 мг K2SO4. К раствору прибавляют малыми порциями Pb(NO3)2. Какая соль будет осаждаться первой?
Какую концентрацию ионов IO3 надо создать в 3 М K2CrO4, чтобы при добавлении Pb(NO3)2 осадок Pb(IO3)2 образовался прежде, чем PbCrO4?
Избыток BaSO4 обработали 3 M Na2CO3. Вычислите равновесную концентрацию сульфат-иона в равновесном растворе.
Вычислить концентрацию хромат- и карбонат-ионов в равновесном растворе, полученном при обработке хромата свинца 1,5 М Na2CO3.
Вычислить концентрацию фторид- и карбонат-ионов в равновесном растворе, полученном при обработке фторида кальция 1,5 М Na2CO3.
* При каком рН можно количественно осадить: 1) Zn2+ в виде ZnS; 2) Cd2+ в виде CdS; 3) Ni2+ в виде NiS, насыщая раствор сероводородом.
Вычислить растворимость PbC2O4 в растворе с рН: 1) 2,1,2) 3,2.
Сколько молей CH3COONa нужно прибавить к 1 л 1 М СН3СООН, чтобы обеспечить условия для открытия иона Ba2+ в присутствии Sr2+ посредством CrO42 ([Ba2+] = [Sr2+]=0,2 моль/л).
Вычислить рН насыщенного раствора: 1) Mg(OH)2; 2) Zn(OH)2; 3) Со(ОН)2; 4) Cu(OH)2; 5) Cd(OH)2; 6) Pb(OH)2; 7) Tl(OH)3; 8) Pu(OH)3; 9) Mo(OH)4; 10) Mn(OH)2; 11) Ni(OH)2; 12) Mn(OH)3.
При каком рН начнет выпадать осадок: 1) Al(OH)3 из 0,1 М AlCl3; 2) Fe(OH)3 из 0,2 М FeCl3.
1 Sal2- — анион салициловой кислоты.
** В подобных задачах концентрация H2S в насыщенном растворе составляет 0,1 моль/л.
