
2. Равновесие осадок раствор
Пример 1. Произведения растворимости AgCl и Ag2CrO4 соответственно равны 10-10 и 10-12. Рассчитать растворимости данных осадков.
Решение. Растворимость AgCl,
 .
.
Растворимость Ag2CrO4,
 .
.
Пример 2. Рассчитать растворимость CaC2O4 при pH=5, если ПР=2,6109 и для щавелевой кислоты: Ka1 = 5,610-2, Ka2=5,910-5.
Решение. Для pH=5 доля оксалат-иона будет равна
2=0,855
Отсюда растворимость оксалата кальция,
 .
.
Без
учета кислотно-основных свойств оксалата
 .
.
Пример 3. Рассчитать растворимость Hg2Cl2 при pH=6, если ПР=1,321018 и для кислотной диссоциации Hg22+, Ka=10-5.
Решение. Доля гидратированных ионов Hg22+ при pH=6 будет равна, 0=0,091. Растворимость Hg2Cl2,
 .
.
Без учета кислотных свойств Hg22+,
 .
.
Пример 4. Рассчитать растворимость CuS с учетом гидролиза аниона, если ПР=6,311036 и для сероводородной кислоты: Ka1=10-7, Ka2=1,310-13.
Решение. Произведение растворимости сульфида меди очень мало, поэтому принимаем pH=7. Отсюда 2=5,810-9. Растворимость,
 .
.
Пример 5. Рассчитать растворимость Ag3PO4 с учетом гидролиза аниона, если ПР=1,2910-20 и для фосфорной кислоты Ka1=7,0810-3, Ka2=6,1710-8, Ka3=4,6810-13.
Решение. Из значения ПР и состава осадка можно сделать вывод об относительно хорошей его растворимости. Константа ионизации Ka3 мала, поэтому можно предположить, что растворение протекает по следующей схеме
Ag3PO4+H2O3Ag++HPO42-+OH-

Растворимость
 .
.
Уточняем значение растворимости:
[H+]=3,9610–10, 3=1,1710-3,
 .
.
Без учета гидролиза аниона

Пример 6. Определить условие равновесия между осадками AgCl, Ag2CrO4 и раствором, если ПР(AgCl)=1,7810-10, ПР(Ag2CrO4)=1,4410-12.
Решение. В состоянии равновесия должно выполняться условие
 .
.
При

хромат серебра превращается в хлорид серебра. При

процесс протекает в обратном направлении.
Пример 7. Определить степень превращения BaSO4 в BaCO3 при обработке 0,01 г сульфата бария 1 мл 2 М раствора Na2CO3.
Решение. При обработке BaSO4 карбонатом натрия протекает реакция
BaSO4+CO32-BaCO3+SO42-
В состоянии равновесия должно выполняться условие

Обозначим через x число молей BaCO3, полученных в результате превращения. Отсюда
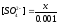 ,
,
 .
.
Подставим значения концентраций ионов в условия равновесия,
 ,
,
 .
.
Степень превращения
 .
.
Пример 8. Определить последовательность образования осадков BaCO3 и CaCO3, если концентрации ионов Ba2+ и Ca2+ равны 0,0001 М и 0.01 М соответственно.
Решение. Для образования карбоната бария необходимо, чтобы
 M.
M.
Образование карбоната кальция будет происходить при
 M.
M.
Отсюда можно сделать вывод, что первым из раствора при действии карбоната натрия будет выделяться карбонат кальция. После достижения концентрации карбонат-иона 410-6 М оба осадка будут выделяться одновременно.
Пример 9. Определите pH раствора, при котором возможно разделение бария и стронция в виде хроматов, если концентрации ионов бария и стронция равны 0.01 М. Осадителем является бихромат калия с концентрацией 0.05 М.
Решение. При осаждения бария и стронция бихроматом устанавливаются следующие равновесия:
Cr2O72-+H2O2CrO42-+H+, K=138,
CrO42-+H+HCrO4-, Ka2=310-7,
HCrO4-+H+H2CrO4, Ka1=310-1,
Ba2++CrO42-BaCrO4, ПР1=210-10,
Sr2++CrO42-SrCrO4, ПР2=410-5.
Из произведений растворимости хроматов следует, что заданных концентрациях ионов первым из раствора будет выделяться бихромат бария. Концентрация CrO42-, необходимая для его полного выделения из раствора
 .
.
Хромат стронция начнет осаждаться при концентрации
 .
.
Таким образом, существует интервал концентраций хромат-иона, внутри которого наблюдается полное выделение хромата бария, а хромат стронция полностью остается в растворе. Общая концентрация хромат-иона в растворе будет равна 0,1 М. Концентрацию ионов водорода, необходимую для полного выделения хромата бария, находим решением квадратного уравнения
 .
.
Это значение равно [H+]=310-5 (pH=4,5).
Пример 10. Для насыщенного при 20 °С раствора Ag2CO3 найдено, что концентрация соли составляет 2,7102 г/л. Вычислить приближенное значение константы растворимости Аg2СО3.
Решение. Выражения констант равновесий справедливы для молярных концентраций. Рассчитаем молярную растворимость соли в воде:
S(Ag2CO3)=2,7102/М(Ag2CO3)=1,0104 M.
Напишем равновесие растворимости, указав под каждым компонентом значение его молярной концентрации с учетом стехиометрических коэффициентов:
Ag2CO3 2Ag+ + CO32
1,0104 21,0104 1,0104
В выражение константы равновесия подставим численные значения соответствующих величин:
K°S(Ag2CO3)=[Ag+]2[СО32]=(21,0104)21,0104=41012
Пример 11. Константа растворимости Ва3(РО4)2 составляет 6,01039. Вычислить массовую концентрацию соли и каждого из ионов в насыщенном растворе.
Решение. Исходя из равновесия растворимости и его стехиометрии, выразим равновесные концентрации ионов через молярную растворимость S соли
Ва3(РО4)23Ba2++2PO43
