
Сиволоб. Молекулярна біологія
.pdf
Розділ 8. Синтез білків
а можуть бути продуктами одного гена, розрізняючись модифікаціями основ. Оскільки типів тРНК менше, ніж кодонів, одна тРНК здатна впізнавати кілька синонімічних кодонів, що забезпечується неоднозначністю спарювання між першою позицією антикодона і третьою (за якою, головним чином, розрізняються синонімічні кодони, див. розділ 4) – кодона. А саме, U і G здатні впізнавати по два нуклеотиди у третій позиції кодона, I (який досить часто зустрічається в першій позиції антикодона) упізнає три нуклеотиди (табл. 8.1).
Таблиця 8.1. Відповідність між нуклеотидами
в першій позиції антикодона і третій позиції кодона
Антикодон |
Кодон |
|
|
C |
G |
|
|
A |
U |
|
|
U |
A, G |
|
|
G |
U, C |
|
|
I |
U, C, A |
|
|
Аміноацилювання тРНК
Порядок залучення амінокислот до поліпептидного ланцюга, що утворюється при білковому синтезі, залежить лише від взаємодій між нуклеїновими кислотами – кодоном і антикодоном; амінокислота, яку несе тРНК, жодним чином не розпізнається рибосомою. Отже, акцептування певної амінокислоти молекулою тРНК відповідного типу (і тільки відповідного) є одним із найважливіших моментів білкового синтезу: від точності процесу акцептування буде залежати й точність синтезу білка в цілому.
Процес приєднання амінокислот до тРНК каталізується аміноацил-
тРНК-синтетазами (АРСаза, aaRS – aminoacyl-tRNA-Synthetase). Кожна з 20 типів (за кількістю амінокислот) цих ферментів каталізує дві хімічні реакції (рис. 8.3):
•На першій стадії відбувається так зване активування амінокислоти – її приєднання до АМР з утворенням аміноациладенілату, коли пірофосфат (рр) у складі АТР замінюється на амінокислоту (аа). Активування амінокислоти супроводжується зниженням вільної енергії, але при цьому значна частина вільної енергії, що “звільняється” при відщеплені пірофосфату
225
Сиволоб А.В. Молекулярна біологія
від АТР, заощаджується у формі аміноациладенілату – молекули, гідроліз якої також супроводжується великим енергетичним ефектом. Молекула АТР, що використовується на етапі активування амінокислоти, – єдине джерело енергії для майбутнього синтезу пептидного зв'язку на рибосомі.
•Аміноациладенілат утворює проміжний комплекс з активним центром ферменту й ефективно атакує ОН-групу рибози 3'-кінцевого аденозину тРНК (3'- або 2'-ОН групу залежно від класу АРСази): відбувається перенесення амінокислоти на тРНК. Після дисоціації від АРСази у складі аа-тРНК має місце спонтанний обмін амінокислоти між двома ОН-групами рибози; при зв'язуванні з рибосомою амінокислота фіксується на 3'-ОН групі. Аа-тРНК – також “макроергічна” сполука: руйнування зв'язку між амінокислотою та тРНК є енергетично вигідним, що й забезпечує утворення пептидного зв'язку на рибосомі.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
NH2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
R O |
|
|
|
|
O |
O |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|||||||||||||||||||||||||||||||
H3+N CH C O- |
|
|
-O P O P O P O |
|
|
|
|
|
O |
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
-O |
-O |
-O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1. aa + ATP |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
OH |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
O |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
aa-AMP + pp |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
||||||||||||||
-O P O P O- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
N |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
-O |
-O |
|
|
|
|
|
|
|
R O |
O |
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
H3+N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
CH C O |
P O |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. aa-AMP + tRNA |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
N |
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
aa-tRNA + AMP |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
O |
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|||||||||||
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
-O P O |
|
|
|
|
|
|
|
CC |
|
|
O |
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
-O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
OH |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
O |
||||||||||||||||
C O
O
R CH
H3+N
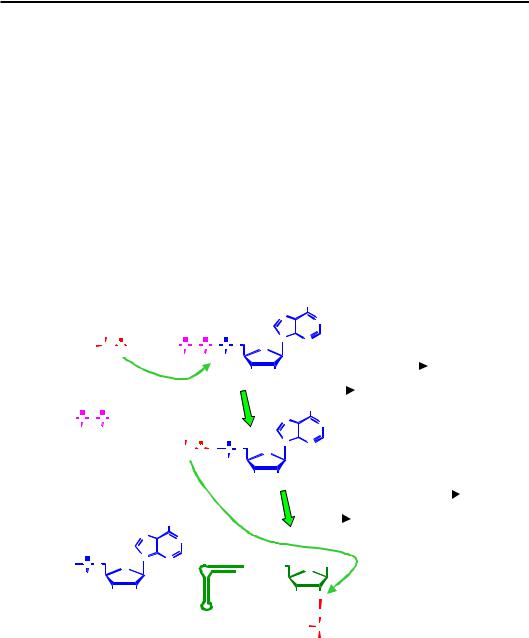
Рис. 8.3. Приєднання амінокислоти до тРНК, яке каталізується АРСазою
226

Розділ 8. Синтез білків
Отже, АРСази не тільки залучають амінокислоти до білкового синтезу, приєднуючи їх до тРНК, а й забезпечують заощадження вільної енергії, необхідної для приєднання амінокислоти до поліпептидного ланцюга.
Двадцять типів АРСаз, між якими немає майже нічого спільного на рівні первинної структури, можна поділити на два класи, по десять у кожному (табл. 8.2). Це завжди мультидоменні білки зі складною структурою (рис. 8.4), що зумовлено розмаїттям функцій – необхідністю специфічно зв'язати три субстрати й каталізувати дві хімічні реакції. Крім того, еукаріотичні АРСази різних типів взаємодіють між собою та з мембраною ендоплазматичного ретикулуму, утворюючи так звану кодосому, що розташована поблизу від рибосом. Мультисубодиничні АРСази (гомодимери, гомотетрамери або гетеротетрамери) містять два ідентичні набори активних центрів та сайтів зв'язування.
Таблиця 8.2. Порівняльна характеристика двох класів АРСаз
|
Клас 1 |
Клас 2 |
|
|
|
|
|
Кількість субодиниць |
1 (іноді 2) |
2 або 4 |
|
|
|
|
|
Спільний структурний мо- |
|
Паралельний β-шар |
|
тив, що оточує |
Укладка Россмана |
||
із 7 β-ділянок |
|||
активний центр |
|
||
|
|
||
|
|
|
|
Амінокислоти, |
Leu, Ile, Val Cys, Met, Glu, |
His, Pro, Ser, Thr, Phe, |
|
що акцептуються |
Gln, Arg, Tyr, Trp |
Asp, Asn, Lys, Gly, Ala |
|
|
|
|
|
Група рибози, |
2'-ОН |
3'-ОН |
|
що аміноацилюється |
|||
|
|
||
|
|
|
Центральна частина поліпептидного ланцюга АРСази формує активний центр (сайт зв'язування амінокислоти), в оточенні якого реалізується спільний для ферментів одного класу структурний мотив: для першого класу – укладка Россмана (див. розділ 2), для другого – приблизно плоский паралельний β-шар із семи β-ділянок (рис. 8.4). Як видно з табл. 8.2, амінокислоти з подібними властивостями часто є субстратами АРСаз різних класів залежно від розміру амінокислот: великі потрапляють до першого класу, маленькі – до другого (наприклад, Tyr і Phe, Glu і Asp, Arg і Lys). Відповідно, активний центр АРСаз першого класу розташований у порівняно неглибокій порожнині на поверхні ферменту, другого класу – у глибшому кармані.
227
Сиволоб А.В. Молекулярна біологія
1 |
2 |
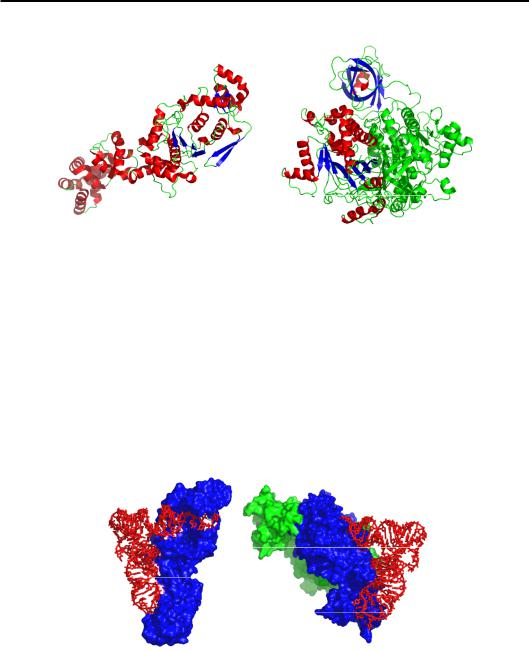
Рис. 8.4. Структури АРСаз першого (мономерна Glu-тРНК-синтетаза, 1G59) та другого (Asp-тРНК-синтетаза, гомодимер, 1ASY) класів
Із частини молекули, яка утворює спільний структурний мотив, випетльовуються інші структурні домени, які, разом із N або С-кін- цевими доменами беруть участь у взаємодії з тРНК. АРСази двох класів упізнають різні елементи структури тРНК: маленький жолобок акцепторного стебла, D-петля та антикодонова петля для першого класу; великий жолобок акцепторного стебла, варіабельна та антикодонова петлі для другого (рис. 8.5). Причому специфічність упізнання тРНК залежить у першу чергу від взаємодій з акцепторним стеблом: штучна акцепторна частина (міні-тРНК) здатна специфічно зв'язатися з АРСазою та акцептувати амінокислоту.
1 |
2 |
|
|
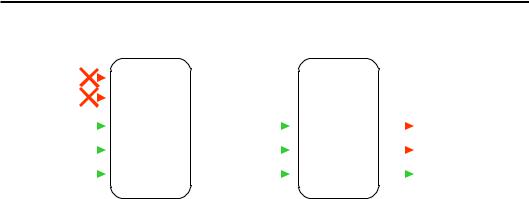
Рис. 8.5. Комплекси тРНКGlu (1 клас, 1G59) і тРНКAsp (2 клас, 1ASY)
з відповідними АРСазами. З димерною АРСазою зв'язано дві молекули тРНК. На даній проекції видно лише одну з них
228
Розділ 8. Синтез білків
Phe |
|
|
|
|
|
|
|
|
|
|
|
|
|
Tyr |
|
|
|
|
|
|
|
|
|
|
|
|
|
Val |
|
Val-AMP |
|
|
|
Val |
|
|
|
||||
Ala |
|
Ala-AMP |
|
|
|
Ala |
|
|
|
||||
Ile |
|
Ile-AMP |
|
|
|
Ile-тРНКIle |
|
|
|
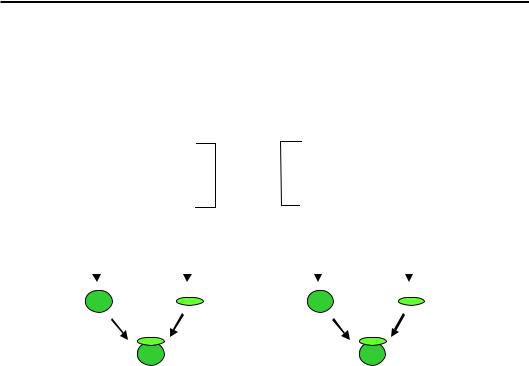
Рис. 8.6. Подвійне сито на прикладі Ile-тРНК-синтетази
Специфічність зв'язування АРСазою такого великого ліганду, як тРНК, не становить значної проблеми: велика кількість контактів дозволяє досить легко дискримінувати різні типи тРНК за рахунок різниці у вільній енергії зв'язування. Амінокислоти, навпаки, є маленькими лігандами (до того ж іноді з дуже схожою структурою), з яким неможливо реалізувати велику кількість взаємодій. Тим не менш, середня частота помилок при аміноацилюванні тРНК становить приблизно 10–6 – такий рівень точності неможливо досягти просто за рахунок різниці у вільній енергії зв'язування, яка не може сильно відрізнятися для різних амінокислот. Відповідно, АРСази використовують певну систему корекції помилок за механізмом так званого подвійного сита. Наприклад, активний центр Ile-тРНК-синтетази (рис. 8.6) здійснює первинне вибракування частини амінокислот досить великого розміру на етапі зв'язування / активування, інші амінокислоти (включаючи Ile) піддаються активуванню. На другому етапі всі аміноациладенілати, що містять більш маленькі порівняно з Ile амінокислоти, гідролізуються в іншому активному центрі (центр редагування), а Ile переноситься на тРНК, оскільки його розмір не дозволяє йому зв'язатися з центром редагування. У результаті дуже близький до Ile за структурою Val акцептується тРНКIle в одному випадку з 180 тис. Інші АРСази можуть здійснювати редагування помилок уже після акцептування амінокислоти, коли аа-тРНК упізнається як ціле, і неспоріднена амінокислота відщеплюється.
229

Сиволоб А.В. Молекулярна біологія
Рибосома
Склад рибосоми
Рибосома – рибонуклеопротеїдний комплекс, який складається із двох субодиниць (рис. 8.7). Компоненти рибосоми прийнято позначати коефіцієнтами седиментації – коефіцієнтами пропорційності, що показують, наскільки зростає швидкість руху частинки при центрифугуванні зі зростанням відцентрової сили (швидкості обертання ротора центрифуги). Коефіцієнт седиментації використовується як міра рухливості частинки, залежить від її маси, об'єму та форми, вимірюється у сведбергах (S) – позастистемних одиницях, які мають розмірність часу (1S = 10–13 с).
Маленька субодиниця прокаріотичної рибосоми з коефіцієнтом седиментації 30S, містить одну молекулу рРНК (16S) і 21 молекулу рибосомних білків, що позначаються як S1–S21 (від Small subunit). Велика субодиниця містить дві молекули рРНК (23S і 5S) і білки L1–L36 (від Large subunit) – цей комплекс седиментує з коефіцієнтом 50S. Об'єднання субодиниць дає рибосому з коефіцієнтом седиментації 70S – оскільки коефіцієнт седиментації залежить від форми частинки, він не є адитивною величиною. Еукаріотична рибосома містить трохи більшу 18S рРНК замість 16S, дві рРНК, що міцно взаємодіють між собою (28S і 5,8S), замість 23S і більшу кількість білків. Структура обох рибосом і принципи їхньої роботи подібні.
Синтез еукаріотичних рРНК 18S, 5,8S і 28S здійснюється в ядерці, яке формується на тандемних повторах кластера відповідних генів рРНК (див. рис. 4.6). Первинний транскрипт, що синтезується РНК-полі- меразою І, має константу седиментації 45S і містить три фрагменти майбутніх рРНК, розділені спейсерами. Процесинг рРНК – деградація спейсерів, а також модифікація певних основ і метилування 2'-ОН груп специфічних рибоз – здійснюється за участю близько 150 типів малень-
ких ядерцевих РНК (snoRNA – small nucleolar RNA), які, аналогічно до маленьких ядерних РНК, визначають специфічні сайти деградації та модифікацій. Частина маленьких ядерцевих РНК синтезується на певних генах РНК-полімеразами ІІ та ІІІ. Але велика кількість цих РНК є інтронами, що визволяються в результаті сплайсингу мРНК білкових генів. 5S рРНК синтезується РНК-полімеразою ІІІ на окремих кластерах відповідних генів поза ядерцем. В ядерці, практично одночасно з процесин-
230
Розділ 8. Синтез білків
гом рРНК відбувається її поступова взаємодія з рибосомними білками, до ядерця ж дифундує комплекс 5S рРНК з білками: утворюються субодиниці рибосоми, які далі транспортуються до цитоплазми.
|
Прокаріоти |
|
|
Еукаріоти |
|
|
|||||
23S |
|
|
|
|
|
|
28S • 5.8S |
|
|
||
2900 н |
|
|
|
|
|
|
4800 н • 160 н |
|
|
||
|
|
|
рРНК |
|
|
||||||
+ |
|
|
|
|
+ |
|
|
|
|||
5S |
16S |
|
|
5S |
18S |
||||||
120 н |
1540 н |
|
|
|
120 н |
1900 н |
|||||
+ |
|
+ |
|
|
|
|
+ |
|
+ |
|
|
L1…L36 |
S1…S21 |
білки |
|
L1…L50 |
S1…S33 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
50S |
|
30S |
|
|
|
60S |
|
40S |
||
|
|
|
|
|
|
||||||
|
|
70S |
|
|
|
|
80S |
||||
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 8.7. Склад прота еукаріотичної рибосом. рРНК позначено їхніми коефіцієнтами седиментації та довжиною в нуклеотидах (н)
Первинний транскрипт, що синтезується на бактеріальному рибосомному опероні, містить ділянки, які відповідають усім трьом прокаріотичним рРНК, а також кілька майбутніх тРНК. Часткова деградація транскрипту приводить до утворення зрілих молекул, які взаємодіють з рибосомними білками, формуючи дві субодиниці рибосоми. In vivo остаточне збирання рибосоми із двох субодиниць, як у про-, так і в еукаріотів, здійснюється при ініціації трансляції.
Структура рибосоми
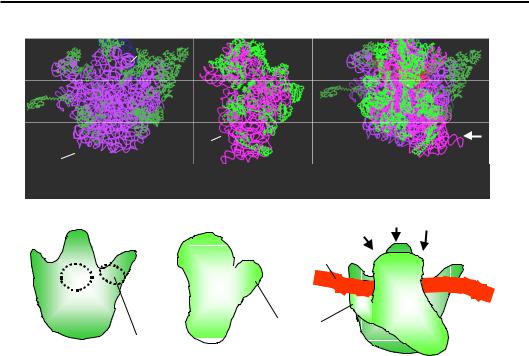
Структуру рибосоми за результатами рентгеноструктурного аналізу її кристалів показано в різних проекціях на рис. 8.8–8.10, де також схематично зображено зовнішню анатомію субодиниць та їхнє розташування у складі рибосоми відносно одна одної та деяких інших елементів системи трансляції.
231
Сиволоб А.В. Молекулярна біологія
5S
|
|
16S |
|
|
|
23S |
|
|
|
|
|
|
50S |
|
30S |
|
70S |
|
Центральний |
|
Сайти зв'язування тРНК |
||
L1 |
протуберанець |
Головка |
E |
P |
A |
L7/12 |
|
мРНК |
|
|
|
|
|
|
|
|
|
|
PT |
|
|
|
|
|
|
|
5' |
|
3' |
|
|
|
Платформа |
|
|
Сайт  зв'язування G-білків
зв'язування G-білків
Рис. 8.8. Структура рибосоми Thermus thermophilus та її субодиниць (1GIX, 1GIY), показано лише основні ланцюги РНК і білків (білки пофарбовано зеленим).
Окремі субодиниці орієнтовані інтерфейсами взаємодії між ними до глядача, у складі рибосоми орієнтація великої субодиниці збережена. Білою стрілкою позначено напрям зору, в якому структуру зображено на рис. 8.9.
Унизу: схематичне зображення структур субодиниць та їхнього комплексу в тих самих проекціях, РТ – пептидилтрансферазний центр
Від основного досить монолітного тіла великої субодиниці відходять три характерні відростки: виріст L1, палець (стебло) L7/12, сформовані відповідними рибосомними білками, і центральний протуберанець, утворений комплексом певних білків з рРНК 5S. Два окремі структурні домени – головка та платформа – відходять від тіла маленької субодиниці.
У складі рибосоми можна виділити три основні зони контактів між субодиницями: головка – центральний протуберанець; платформа – виріст L1; центральні частини основного тіла обох субодиниць. Усі структурні елементи рухливі: можливим є переміщення головки й пальця L7/12, обертання малої субодиниці навкруг нормалі до поверхні великої субодиниці на ~6° проти годинникової стрілки тощо. Рухи струк-
232
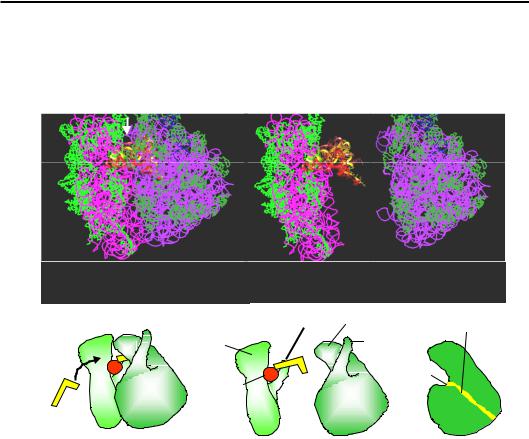
Розділ 8. Синтез білків
турних елементів рибосоми в зонах контактів мають важливе значення для її функціонування, оскільки саме на інтерфейсі між субодиницями знаходяться всі активні центри та сайти взаємодії з елементами системи трансляції:
`
тРНК
Платформа |
Головка |
мРНК |
аа-тРНК |
Центральний протуберанець Тунель
L7/12 |
РТ |
Рис. 8.9. Структура рибосоми та її субодиниць у комплексі з трьома молекулами тРНК з рис. 8.8 у іншій проекції – з боку входу аа-тРНК
до А-сайта. Білою стрілкою позначено напрям зору, у якому структуру зображено на рис. 8.10. Унизу: схематичне зображення у тій самій проекції, крайня права схема – велика субодиниця в розрізі
•В основі центрального протуберанця розташований пептидилтрансферазний центр (рис. 8.8, 8.9), який відповідає за каталіз реакції синтезу пептидного зв'язку. Від пептидилтрансферазного центру через тіло великої субодиниці відходить тунель – канал виходу поліпептидного ланцюга, що синтезується (рис. 8.9).
•В основі пальця L7/12 міститься сайт зв'язування G-білків (рис. 8.8) – факторів трансляції, детальне описання яких наведено нижче.
233
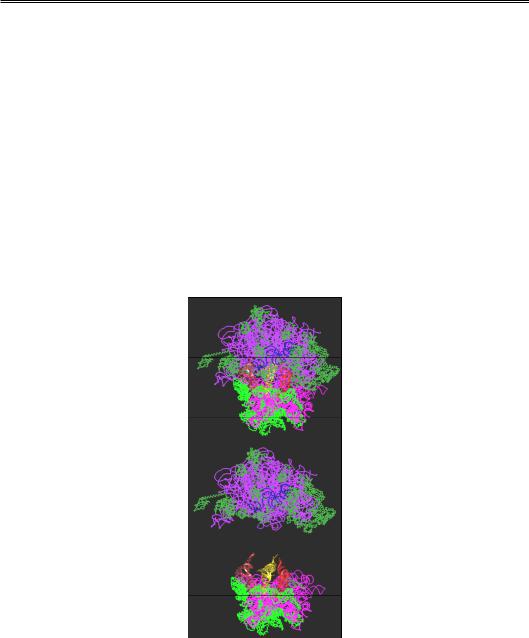
Сиволоб А.В. Молекулярна біологія
•У щілині між платформою та головкою маленької субодиниці відбувається взаємодія з мРНК (рис. 8.8, 8.9).
•Сайти зв'язування тРНК розташовані між двома субодиницями: антикодонові частини тРНК взаємодіють з мРНК і маленькою субодиницею, акцепторні частини – з великою субодиницею (рис. 8.9, 8.10). Рибосома містить три такі сайти: А-сайт, де відбувається зв'язування аа-тРНК; Р-сайт, де з рибосомою взаємодіє пептидил-тРНК (тРНК, до якої приєднаний пептидил – ланцюг, що синтезується); Е-сайт (від exit), де міститься деамі-
ноацильована тРНК перед її звільненням з рибосоми. Акцепторні частини тРНК, розташовані в А- і Р-сайтах, наближе-
ні одна до одної (рис. 8.10, 8.11) і взаємодіють з великою субодиницею в зоні пептидилтрансферазного центру. Кількість контактів з тРНК у Р-сайті є більшою, ніж кількість контактів, що утримують молекулу тРНК в А-сайті.
EP A
Рис. 8.10. Вид зверху (по стрілці на рис. 8.9) на структуру рибосоми та її субодиниць у комплексі з трьома молекулами тРНК
234
