
- •Предисловие
- •Адсорбция природа поверхностной энергии
- •Сорбция и её виды
- •Теория мономолекулярной адсорбции ленгмюра
- •Заключение
- •Вопросы и задачи для самоконтроля
- •Адсорбция на границе жидкость – газ
- •Поверхностно - активные вещества
- •4 3 2 1 С, мольдм–3 , нм–1
- •Поверхностно - инактивные вещества
- •Индифферентные вещества
- •Значение адсорбции на границе жидкость – газ
- •Заключение
- •Вопросы и задачи для самоконтроля
- •Адсорбция на границе твердое тело – раствор
- •Молекулярная адсорбция из растворов
- •Факторы, влияющие на молекулярную адсорбцию
- •Ионная адсорбция из растворов
- •Избирательная адсорбция ионов
- •Ионообменная адсорбция
- •Заключение
- •Вопросы и задачи для самоконтроля
- •Адсорбция на границе жидкость—жидкость
- •Заключение
- •Вопросы для самоконтроля
- •Адсорбционная хроматография
- •Смачивание
- •Когезия и адгезия
- •Заключение
- •Вопросы для самоконтроля
4 3 2 1 С, мольдм–3 , нм–1

Рис. 6 Изотермы поверхностного натяжения некоторых кислот:
СН3СООН – уксусная кислота,
СН3СН2СООН – пропионовая кислота,
СН3(СН2)2СООН – масляная кислота,
СН3(СН2)3СООН – изовалериановая кислота.
Правило справедливо для водных растворов и обращается для углеводородных сред. Действительно, чем длиннее углеводородная цепь, тем неполярней вещество, тем в большей степени его молекулы выталкиваются водой на поверхность, т.к Е н2о-н2о > Е н2о-пав. Правило Дюкло-Траубе явилось теоретической основой синтеза современных моющих средств.
В соответствии с правилом Дюкло-Траубе, адсорбция возрастает с удлинением цепи в гомологическом ряду, но для всех членов ряда величина адсорбции стремится к одной и той же предельной величине Г∞, называемой предельной адсорбцией (Рис. 7).
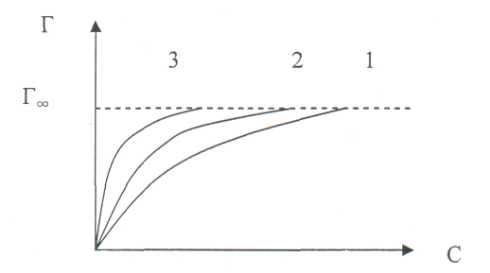
Рис. 7 Серия изотерм адсорбции на границе раствор-газ для гомологического ряда ПАВ. 1 – для низшего члена ряда, 3 – для высшего члена ряда
Наличие Г∞ является доказательством существования мономолекулярного слоя ПАВ на поверхности жидкости. При малых концентрациях в области, далекой от насыщения, углеводородные цепи, вытолкнутые в воздух, «плавают» на поверхности воды, тогда как полярная группа погружена в воду. Взаимодействие между молекулами ПАВ незначительно, монослои называют газообразными (Рис. 8а). С ростом концентрации число молекул в поверхностном слое увеличивается, цепи поднимаются и в пределе приобретают вертикальное положение (Рис. 8б).
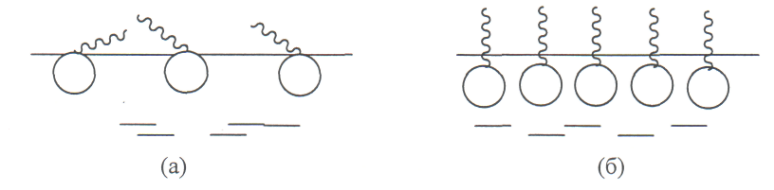
Рис. 8 Схема образования мономолекулярного слоя
При такой ориентации изменение длины цепи не изменяет площади, занятой молекулой в поверхностной слое, а, следовательно, не изменяет количества молекул, приходящихся на единицу поверхности, пропорционального Г∞. Такие монослои называются конденсированными.
По способности молекул диссоциировать на ионы ПАВ подразделяются на два больших класса: ионогенные (диссоциирующие) и неионогенные (недиссоциирующие).
Ионогенные ПАВ, в свою очередь, классифицируют на
анионактивные, дающие при диссоциации поверхностно-активный анион: мыла RСООМе (Ме - К+, Nа+, NН4+), сульфокислоты, их соли и другие соединения;
катионактивные, образующие при диссоциации поверхностно-активный катион: соли аминов, четвертичных аммониевых оснований, алкил-пиридиновых соединений;
амфотерные, способные в зависимости от рН проявлять анионактивные свойства (в щелочной среде) или катионактивные свойства (в кислой среде): алкиламинокислоты и др.
В качестве примера анионактивных ПАВ, применяемых в медицине, можно привести натрия лаурилсульфат [H3C-(CH2)11-SO3]- Na+, катионактивных ПАВ – цетилтриметиламмония бромид [H3C-(CH2)15-N(CH3)3]+Br-. К амфотерным относится хлоргидрат алкилдиаминоэтилглицина [H3C - (CH2)11 – NH (CH2)2 – NH - CH2 – COOH] HCl. Катионактивные и анионактивные ПАВ применяют в хирургии в качестве антисептиков. Например, четвертичные аммониевые соединения приблизительно в 300 раз эффективнее фенола по губительному действию в отношении микроорганизмов. При длине алкильного радикала от С8 до С14 ПАВ обладают ярко выраженной антифаговой активностью. Антимикробное действие ПАВ связывают с их влиянием при адсорбции на проницаемость клеточных мембран, а также ингибирующим действием на ферментные системы микроорганизмов.
Неионогенные ПАВ получают при взаимодействии высших спиртов, кислот или фенолов с молекулами оксида этилена. Получаются соединения типа R(ОСH2СН2)mОН. Чем длиннее оксиэтиленовая цепочка, тем более выражены гидрофильные свойства. Широкое применение нашли в фармации в роли стабилизаторов спаны и твины (сложные эфиры жирных кислот, сорбита или оксиэтилированного сорбита)
