
- •2.1. Связи, определяющие и стабилизирующие структуру биополимеров.
- •2.1.1. Ковалентная (химическая) связь
- •2.1.2. Ионные или электростатические взаимодействия.
- •2.1.3. Водородная связь.
- •2.1. Механизм образования водородной связи между молекулами воды
- •2.1.4. Гидрофобные взаимодействия
- •2.1.5. Ван-дер-ваальсовы взаимодействия.
- •2.2. Белки
- •2.2.1. Уровни структурной организации белковых молекул
- •2.2.1.1. Первичная структура белков
- •2.2.1.2. Вторичная структура белков
- •2.2.1.2.1. Α-спираль
- •2.2.1.2.2. Β-структура
- •2.2.1.2.3. Β-изгиб
- •2.2.1.4. Третичная структура белков
- •2.2.1.5. Четвертичная структура белков
2.2. Белки
В предыдущей лекции мы с вами говорили о том, что аминокислоты, соединяясь друг с другом посредством пептидных связей, образуют полипетиды.
!!! Белками являются полипетиды, способные образовывать и самостоятельно стабилизировать свою пространственную структуру.
Эта способность приобретается благодаря наличию большого числа слабых нековалентных взаимодействий и связана с числом аминокислотных остатков, образующих полипептидную цепочку.
Как правило, белками называют полипетиды, содержащие более 50 аминокислотных остатков.
Вместе с тем длина полипептидной цепи может достигать до нескольких тысяч остатков аминокислот; молекулярная масса белков колеблется от 6000 до 1 миллиона и более килодальтон.
2.2.1. Уровни структурной организации белковых молекул
При всем разнообразии функций, реализация функции белков всегда базируется на высоко специфическом — как у ключа с замком — взаимодействии белка с обрабатываемой им молекулой.
Для специфического взаимодействия необходима достаточно "твердая" пространственная структура. Поэтому биологическая функция белков тесно связана с наличием определенной трехмерной структуры молекулы.
Знание молекулярной трехмерной структуры белка необходимо для понимания механизма функционирования белковой молекулы.
Поэтому мы с вами сейчас будем говорить структуре, о природе ее стабильности и способности к самоорганизации
Обычно при рассмотрении пространственной организации биополимеров (белков и нуклеиновых кислот) выделяют четыре уровня: первичную, вторичную, третичную и четвертичную структуры (Рис. 2.5):
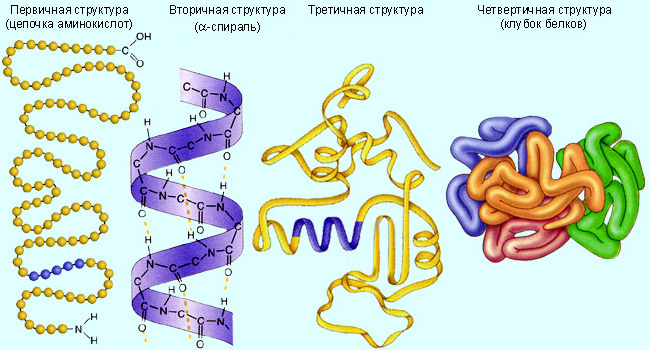
Рис. 2.5. Уровни организации белковой структуры: первичная структура (аминокислотная последовательность), вторичная структура (a-спираль), третичная структура глобулы, сложенной одной цепью, и четвертичная структура олигомерного (в данном случае - тетрамерного) белка
2.2.1.1. Первичная структура белков
Первичная структура белков – последовательность аминокислот в полипептидной цепи (или цепях) и положение дисульфидных связей (если они есть (Рис. 2.6):
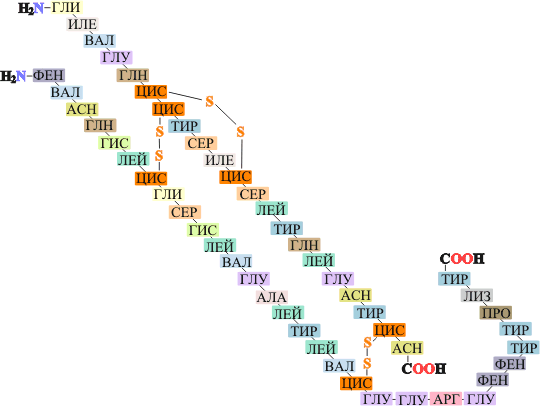
Рис. 2.6. Первичная структура белковой молекулы
Свойства первичной структуры:
1) Последовательность аминокислот в первичной структуре белка является специфической видовой характеристикой данного белка.
2) Первичная структура белка является основой для формирования последующих структур белка за счёт взаимодействия радикалов аминокислотных остатков полипептидной цепи.
2.2.1.2. Вторичная структура белков
Часто в полипептидных цепях содержатся участки, последовательность аминокислотных остатков которых, образует локально упорядоченные трёхмерные структуры.
Совокупность таких упорядоченных структур называют вторичной структурой белков.
В результате совокупности действия таких факторов, как:
- плоское строение пептидной связи;
- возможность свободного вращения связей у α-углеродного атома
- постоянство углов и межатомных расстояний
формируются следующие типы вторичной структуры белков: α-спираль, β-структура и β-складка.
2.2.1.2.1. Α-спираль
Одним из основных элементов вторичной структуры белков является α‑спираль (Рис. 2.7):
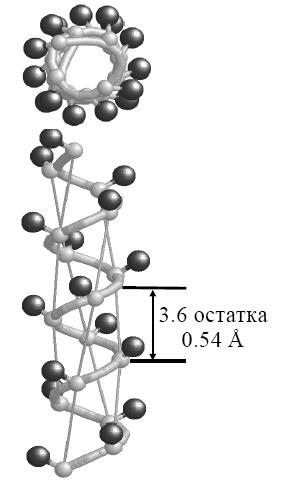
Рис. 2.7. Вторичная структура белковой молекулы: α-спираль (*)
Это — правая спираль, которую можно себе представить в виде пептидной цепи, закрученной вокруг гипотетического цилиндра. При графическом изображении спиральные участки изображаются цилиндром.
Характеристики α-спирали:
- содержит 3,6 аминокислотного остатка на виток с периодом повторяемости 5,4 нм *[0,54 Å (Å – ангстремы; 1 Å = 10 нм)];
- полипептидный остов образует плотные витки вокруг длинной оси молекулы;
- боковые радикалы выступают наружу;
- спираль удерживается водородными связями между атомом водорода N-H группы одной пептидной связи и кислородом группы С=О, принадлежащей другой пептидной связи, расположенной через четыре аминокислотных остатка над первой в следующем витке спирали;
- в α-спирали полностью использована возможность образования водородных связей (внутримолекулярные), поэтому она не способна образовывать водородные связи с другими элементами вторичной структуры.
Степень спирализации в белках колеблется от 5 до 80%. Для некоторых белков, например для цитохрома С, α-спираль лежит в основе пространственной структуры, другие, например химотрипсин, не имеют α‑спирализованных участков.
