
- •Федеральное агентство по образованию
- •Диссоциацию кислой соли можно выразить уравнением
- •Лабораторная работа Получение и свойства оксидов, гидроксидов и солей Цель работы
- •Контрольные вопросы и упражнения
- •2. Скорость химической реакции. Катализ
- •Катализ
- •Лабораторная работа Химическая кинетика. Катализ
- •Опыт 2. Зависимость скорости гомогенной реакции от температуры
- •Контрольные вопросы и упражнения
- •3. Химическое равновесие
- •Лабораторная работа Химическое равновесие
- •Контрольные вопросы и упражнения
- •4. Растворы электролитов. Электролитическая диссоциация
- •Лабораторная работа Электролитическая диссоциация
- •Контрольные вопросы и упражнения
- •5. Растворы
- •5.1 Растворимость веществ в воде. Свойства растворов
- •Лабораторная работа Растворимость веществ в воде. Свойства растворов
- •5.2 Концентрация растворов. Приготовление водных растворов
- •Приготовление раствора заданной концентрации по правилу смешения из более концентрированного раствора и воды или из двух растворов с известным процентным содержанием
- •Лабораторная работа Приготовление растворов
- •Плотности растворов NaCl и kCl, соответствующие различным концентрациям в %
- •Контрольные вопросы и упражнения
- •6. Ионообменные реакции
- •Контрольные вопросы и упражнения
- •7. Ионное произведение воды. Водородный показатель. Гидролиз солей
- •Лабораторная работа Гидролиз солей
- •Контрольные вопросы
- •8. Электродные потенциалы металлов. Гальванические элементы. Электролиз
- •Разность потенциалов в цепи
- •Эдс, определяемая вольтметром, равна
- •Лабораторная работа
- •Ряд напряжений металлов. Гальванические элементы.
- •Электролиз
- •Цель работы
- •Контрольные вопросы и упражнения
- •9. Дисперсные системы
- •Лабораторная работа
- •Опыт 4. Коагуляция коллоидных растворов
- •Контрольные вопросы
- •Список литературы
- •Коэффициенты активности ионов при ионных силах раствора
- •Термодинамическая константа растворимости (произведение растворимости) труднорастворимых в воде электролитов при 25 0с
- •Стандартные электродные потенциалы металлов (ряд напряжений металлов)
- •Приложение 4 Константы диссоциации некоторых слабых электролитов (при 25 0с)
- •Учебное издание
- •Практикум по химии
- •Часть 1
Опыт 2. Зависимость скорости гомогенной реакции от температуры
Эту зависимость можно наблюдать на той же системе
Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2↑ + H2O.
Приготовить три чистые сухие пробирки, пронумеровать их. В каждую из них внести по 10 капель раствора тиосульфата натрия. Пробирку № 1 поместить в стаканчик с водой при комнатной температуре и через 1…2 минуты отметить температуру. Затем в пробирку добавить одну каплю серной кислоты, одновременно включить секундомер и остановить его при появлении слабой, едва заметной мути. Отметить время в секундах от момента добавления кислоты в пробирку до появления мути. Записать результат в таблицу.
Затем повысить температуру воды в стакане точно на 100 либо нагреванием на плитке, либо смешиванием с горячей водой. Поместить в эту воду пробирку № 2, выдержать несколько минут и добавить одну каплю серной кислоты, включив одновременно секундомер, встряхивать пробирку с содержимым в стаканчике с водой до появления мути. При появлении едва заметной мути выключить секундомер и внести показания секундомера в таблицу.
|
№ пп |
Температура опыта t, 0C |
Время помутнения раствора τ, с |
Относительная скорость реакции 1/τ,с-1 |
Температурный коэффициент γ |
|
1 2 3 |
20 30 40 |
|
|
|
Аналогичный опыт провести с третьей пробиркой. Температуру в стакане предварительно повысить ещё на 100, поместить в неё пробирку № 3, выдержать несколько минут и добавить одну каплю серной кислоты, одновременно включив секундомер и встряхивая пробирку.
Результаты опытов выразить графиком, откладывая по оси ординат скорость, а по оси абсцисс – температуру.
Определить температурный коэффициент реакции γ:
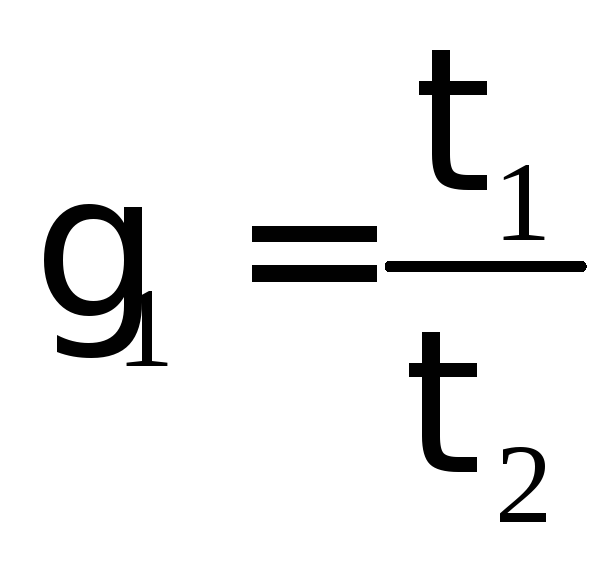 ,
,
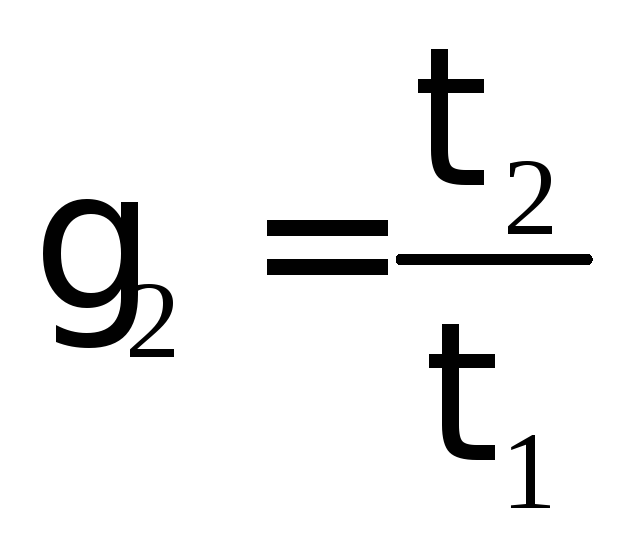 и
и 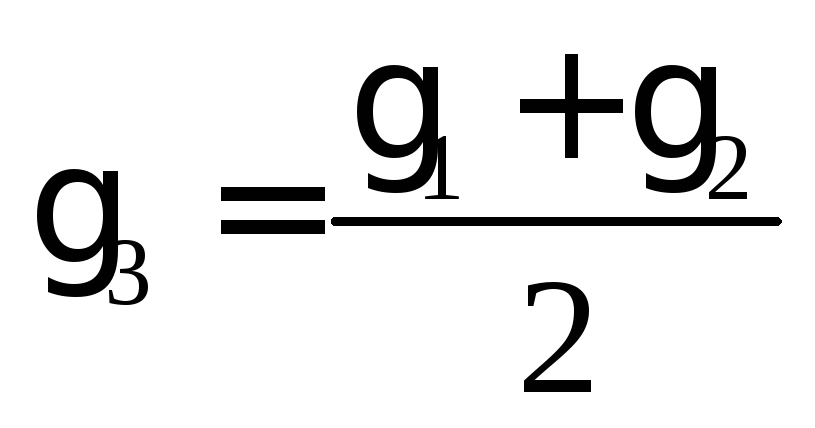 .
.
Сделать вывод о влиянии температуры на скорость реакции. Энергию активации рассчитать по формуле

для температур Т1 и Т2, Т2 и Т3, а также среднюю Еа.
Опыт 3. Влияние поверхности реагирующих веществ на скорость реакции в гетерогенной системе
Уравновесить на технических весах кусочек мела и такую же массу порошка мела – приблизительно 0,5 г. В две пробирки налить по 5 мл разбавленной соляной кислоты и внести в них одновременно навески мела: кусочек – в одну пробирку, порошок – в другую. Отметить время, которое потребуется для полного растворения мела. В какой пробирке реакция протекает быстрее и почему?
Написать уравнение реакции и математическое выражение закона действующих масс. Сделать вывод о влиянии поверхности реагирующих веществ на скорость реакции, протекающей в гетерогенной системе.
Опыт 4. Качественное определение активности различных катализаторов на примере разложения пероксида водорода
Пероксид водорода разлагается при комнатной температуре в присутствии различных катализаторов по уравнению
2 H2O2 → 2 H2O + O2.
Изучить действие двух катализаторов на скорость разложения пероксида водорода: оксида свинца (IV) и оксида марганца (IV).
В две пробирки внести по 10 капель 30 %-ного раствора пероксида водорода. В одну пробирку добавить немного (на кончике шпателя) оксида свинца (IV), а в другую – столько же оксида марганца (IV). О скорости разложения пероксида водорода судят по интенсивности выделения пузырьков газа. Как доказать, что в обеих пробирках выделяется кислород? Какой из использованных катализаторов эффективней?
Опыт 5. Гетерогенный катализ. Изучение влияния количества катализатора на скорость разложения пероксида водорода
В две пробирки с помощью мерного цилиндра налить по 5 мл 3 %-го раствора пероксида водорода. В первую пробирку добавить на кончике шпателя порошка оксида марганца (IV), во вторую в два раза больше. Записать время начала и окончания выделения пузырьков кислорода в обеих пробирках. Сделать вывод о влиянии количества катализатора оксида марганца (IV) на скорость разложения пероксида водорода.
Опыт 6. Автокатализ
Изучить явление автокатализа на примере взаимодействия перманганата калия с щавелевой кислотой, протекающей по уравнению
5 H2C2O4 + 2 KMnO4 + 3 H2SO4 = 10 CO2 + 2 MnSO4 + K2SO4 + 8 H2O.
В пробирку внести одну каплю раствора перманганата калия. Добавить к раствору дистиллированной воды в таком количестве, чтобы получился прозрачный розовый раствор. В сухую пробирку налить 10 капель полученного розового раствора и добавить 2 капли щавелевой кислоты и 4 капли раствора серной кислоты. Смесь перемешать, встряхнув пробирку. Тут же включить секундомер. Отметить время обесцвечивания раствора.
Повторить опыт в другой пробирке, предварительно добавив к смеси растворов один кристаллик сульфата марганца (II).
Объяснить, почему во втором случае реакция протекает быстро, а в первом она постепенно ускоряется.
