
6 курс / Эндокринология / Эндокринология_подростков,_Строев_Ю_И_,_Чурилов_Л_П_
.pdf
106

онным и посттрансляционным механизмам в течение нескольких минут после воздействия АКТГ на рецеп тор.
По Р. Фариси с соавт. (1981), важным моментом служит активация фосфатидил-инозитоловых посредников и протеинкиназы С, ответственных за митогенное действие на клетки-мишени.
Наконец, А. Дазо с соавт. (1983) показали, что АКТГ опосредует свои отсроченные эффекты (проявляющиеся 2-4 ч спустя послерецепции) через ключевые белки стероидогенеза, дерепрессирующие транскрипцию определенных ферментов в адренокортикоцитах.
АКТГ очень сильно стимулирует выработку глю-
кокортикоидов и андрогенов, а также умеренно сти-
мулирует продукцию минералокортикоидов, уступая в этом первые роли ренин-ангиотензиновой системе.
Ангиотензин II — пептидный гормон ренин-ангио-
тензиновой системы — служит главным митогенным и секреторным стимулятором для клубочковой зоны коры надпочечников и выработки минералокортикоидов, Он может также стимулировать и продукцию глю-кокортикоидов, но гораздо слабее (Нассдорфер Г. Дж. с соавт. 1982).
Центральным звеном этой системы служит юкста-
гломерулярный аппарат почек (ЮГА) (рис. 43).
Ренин — гликопротеид, вырабатывается юкстагломерулярными клетками, лежащими вблизи плотного пятна (macula densa) в стенкеафферентных и, в меньшей степени, эфферентныхартериол клубочков почек (Бэкстер Дж., 1987; Рейд Я.А., 1998).
Эти клетки тесно связаны с АПУД-системой. Непосредственно они вырабатывают препроренин, который переходит в проренин, подвергающийся протеолизу, вследствиечегов этих клетках и ихпаракринном окружении, а также в плазме крови формируется
ренин.
Переход проренина в ренин заторможен при инсулинозависимом сахарном диабете, что является результатом гликирования прогормона и приводит к нарушению почечного кровотока, способствующему диабетической нефропатии. Проренин продуцируется также в печени и мозге. Переход в вертикальное положение усиливает продукцию ренина. На этом основана ортостатическая проба, которая используется в дифференциальной диагностике артериальных гипертензий. Многие простагландины (в частности, Е2) усиливают секрецию ренина и ведут к гиперплазииренинпродуцирующихклеток(синдромБартте-
Ангиотензиноген — продуцируемый печенью гликопротеидный препрогормон. Его синтез стимулируют
глюкокортикоиды, эстрогены, тироидные гормоны
и ангиотензин II. Беременность, некоторые заболевания печени, тиротоксикоз и гиперкортицизм протекают с выраженной гиперангиотензиногенемией.
Под влиянием ренина формируется ангиотензин I
— прогормон, лишенный собственной биологической активности (рис. 43).
Ангиотензин I служит субстратом для фермента ди- пептидил-карбоксипептидазы, известного под условным названием «ангиотензин-конвертаза». Этот фермент эндотелиоцитов и плазмы имеется повсеместно, но наиболее активен на сосудистом ложе лёгких — важный участник протеолиза пептидных прогормонов и гормонов. Он превращает ангиотензин I воктапептидный гормон плазмы крови — ангиотензин II, первый из известных гормонов, не имеющий клетки-источника, а возникающий прямо в плазме.
Ингибиторы ангиотензинконвертазы (каптоприл и его многочисленные аналоги) вошли в широкую клиническую практику как средства против артериальной гипертензии.
Ангиотензин II— ключевой эффектор в рениновой системе.
Ангиотензин II— мощный вазоконстриктор (в десятки раз активнее нор адреналина. В почках анги-
отензин II не только подавляет продукцию ренина, за-
мыкая обратную связь, но и усиливает реабсорбцию натрия в проксимальных канальцах. Он вызывает сужение почечных сосудов. Ангиотензин II в мозге стимулирует центр жажды и является прямым дипсогеном — провокатором питьевого поведения. Через ангиотензинергические нейроны он усиливает продукцию вазопрессина в гипоталамусе, что способствует выработке АКТГ.
Ангиотензин II— служит тропным гормоном минералокортикоидной зоны коры надпочечиков, что, как уже упоминалось, впервые доказано Г. Дж. Нассдор-
фером с соавт. (1982).
Собственно ангиотензин //усиливает продукцию алъдостерона, действуя на несколько этапов: как ранних — конверсия холестерина в прегненолон, так и по-
здних — превращение кортикостерона в 18-гидро- ксикортикостерон (рис. 3). Кроме того, ангиотензин
II способствует секреции минералокортикоидов, а для клеток клубочковой зоны он служит митогеном. В больших концентрациях он стимулирует и синтез глюкокортикоидов. Интересно, что и на гладкие миоциты сосудов этот гормон оказывает митогенное действие, а в кардиомиоцитах—способствует внутриклеточной гипертрофии.
107

Рис. 43. Ренин-апгиотензин- альдостероновая система
Время жизни этого гормона в кровотоке достаточно короткое — до 2 минут. При последовательном протеолизе он дает ряд дериватов.
Среди них — продукт отщепления аспарагинового остатка аминопептидазой — гептапептид ангиотен-
зин III. Он обладает слабой, сходной с предшественником, биологической активностью, также стимулируя и минералокортикоидный биосинтез, и чувство жажды. Его уровень у человека составляет до 20% от концен-
трации ангиотензина II.
Работа ренин-ангиотензиновой системы in vivo неотделима от регуляторных эффектов других вазоак-
тивных пептидов — кининов и атриопептинов. Ки-
ниновая система влияет на функции надпочечников незначительно, и ее эффект сводится к активации освобождения катехоламинов из мозгового вещества.
Атриопептины — важные тормозные регуляторы клубочковой зоны коры надпочечников. Они существенно влияют на минералокортикоидные реакции и поэтому нуждаются в кратком описании.
Так называемые секреторные кардиомиоциты предсердий, которые относят к нейроэндокринным клеткам, концентрируются в ушках предсердий, но присутствуюти в желудочкахсердца. Эти клетки синтезируют препрогормон из 151 аминокислоты, из которого образуют-
ся атриопептии А (28 аминокислот) и атриопептин В(32аминокислоты). Оба пептида имеют сходнуюциклическую часть (17 аминокислот), а также отходящие от нее короткую и длинную ветви (рис. 44). Атриопептииы убиквитарны и продуцируются также клетками АПУД-системы лёгких и нейроэндокриноцитами центральной нервной системы и вегетативных ганглиев.
108

Внастоящеевремясчитается(КумарП.,КларкМ., 2002), чтов предсердияхвыделяетсяглавнымобразом мозговой натрийуретический фактор (атриопеп-
тин В). Секреторные кардиомиоциты предсердий и желудочков способны также выделять предсердный натрийуретический фактор (атриопептин А) и не-
большиеколичества атриопептинаС, высокой продукциейкоторогоотличаетсяголовноймозг.
В мозге преобладает атриопептин С (22 аминокислоты, цикл и одна нециклическая ветвь), но выделяется и атриопептин В. Тем не менее во многих источниках атриопептины рассматриваются как гормоны сердца—воплощение его давно предполагавшихся и, наконец,описанныхэндокринныхфункций.
Атриопептины блокируют действие ренин-ан- гиотензиновой системы, увеличивают диурез, прессорную натрийуретическую реакцию почек и вызывают вазодилатацию, всем этим способствуя снижению нагрузки на сердце. Установлено повыше-
ние секреции атриопептинов, особенно мозгового натрийуретического фактора, при перегрузке сер-
щца, главным образом, дополнительным объемом крови. Перерастяжение предсердий наиболее сильно стимулирует секреторныекардиомиоциты.
Секреция атриопептинов возрастает при гиперволемии, при переходев горизонтальноеположение, при физических усилиях и при солевой нагрузке. Интересно, что механизм стимуляции атриопептиногенеза растяжением миокарда не требует участия рефлексов
(Нидлмен Ф., 1987).
Глюкокортикоиды, алъдостерон и вазопрессин
усиливают секрецию атриопептинов. Их уровень растет также при сердечной и почечной недостаточности. Атриопептины сильно подавляют функцию ренин-ангиотензин-альдостероновой системы, уменьшая секрецию ренина и альдостерона, а также снижают продукцию АДГ. Атриопептины действуют на особые рецепторы трех типов — ANPA-С, представляющие собой трансмембранную гуанилатциклазу (см. выше). Стимуляция этого энзима повышает уровень ц-ГМФ и снижает количество кальция в цитозоле клеток-мишеней. Затем гормоны подвергаются эндоцитозу. В минералокортикоидной зоне коры надпочечников представлены атриопептиновые рецепторы, непосредственно угнетающие продукцию альдо-
стерона.
Атриопептины оказывают сосудорасширяющий и гипотензивный эффекты, снижают реабсорбцию и увеличивают фильтрацию натрия в почках. Поэтому они являютсяосновными эффекторамипри реализа-
Рис. 44. Структура атриопептинов учеловека (ноЯ. А. Рейду. 1998)
ции важнейшего физиологического механизма —
прессорного натрийуреза, предохраняющего от пе-
рехода острых гипертензий в хронические. При повышении кровяного давления, как установлено А. Гайтоном (1989), почки усиливают экскрецию натрия и воды, что обеспечивает мощную долговременную стабилизирующую реакцию в отношении артериального кровяного давления.
Данная реакция требует одновременно усиления действия атриопептиновогои ослабления влияния ренин-ан- гиотензинового звена пептидной регуляции объёма внеклеточной жидкости. На фоне высокого уровня активного ренина она осуществиться не может. Таким образом, данныегормоны предохраняют организм от перегрузки жидкостью и солью, препятствуют артериальной гипертензий и развитию застойной сердечной недостаточности.
109

Эффект атриопептинов — не только периферический. Обнаружены нейроны, чувствительные к ат риопептину, в гипоталамусе — в прилегающей ко дну III желудочка передневентральной части перивентрикулярного ядра. Эта область гипоталамуса связана с регуляцией кровяного давления и водно-солевого гомеостаза (см. выше).
Есть указания на продукцию в наружной субкапсулярной части минералокортикоидной зоны коры надпочечников неидентифицированных натрийуретических стероидов антиальдостеронового действия, связанных с атриопептинами (ДеВарденер Х.Э., Кларк-сон Э.М., 1985). Ставится вопрос о существовании естественных лигандов уабаиновых и дигоксиновых рецепторов, которые обладали бы натрийуретическим действием за счет блокирования калий-натриевого насоса, либо антинаперстяночным действием (Шрайбер В., 1987). Этим гипотетическим соединениям отводят важную роль даже в сенсибилизации сосудов к прессорным воздействиям при недостаточном прессорном натрийурезе, что свойственно эссенциальной гипертензии (Нидлмен Ф., 1987). Но их строение и источник неизвестны, хотя они отождествляются некоторыми авторами с предполагаемыми антиальдостероновыми кортикостероидами, а другими — с уже известными минералокортикоидами. Если такие натрийуретические вазоконстрикторные агенты будут найдены, то речь пойдет еще об одном модуляторе эффектов ренин-ангиотензин-атриопептиновых взаимодействий.
Повышение активности ренин-ангиотензин-альдо- стероновой системы и снижение эффективности атриопептиновых контррегуляторных механизмов считаются ключевыми в патогенезе всех видов системных отёков. Оно приводит к вторичному гипералъдостеронизму. Нарушениям регуляции ренин- ангиотензин-альдостероновых механизмов и связанной с ними атриопептиновой и кининовой регуляции придают большое значение в патогенезе артериальных гипертензий и сердечной недостаточности.
В дополнение к схеме стероидогенеза в надпочечниках, представленной выше, приводим краткую цитофизиологическую схему их продукции (рис. 45), отражающую локализацию и ферментативное обеспечение основных этапов биосинтеза кортикоидов.
Гормоны коры надпочечников выполняют разные, но частично перекрывающиеся биологические функции. Удаление надпочечников смертельно, однако при введении минералокортикоидов адреналэктомированнымживотным последниеизбегают острой гибели
и живут в условиях глубоких метаболических рас стройств и пониженной стрессоустойчивости.
Минералокортикоиды — в основном альдостерон и дезоксикортикостерон — важнейшие регуля-
торы калий-натриевого гомеостаза и объема внеклеточной жидкости. Их действие адресовано главным образом почкам и тесно увязано с функцией ренин-ан гиотензиновой и атриопептиновой систем.
Минералокортикоиды выраженно действуют так жена желудочно-кишечный тракт, на потовыеи слюн ные железы.
Во всех клетках-мишенях они адресуют свое отсроченное действие цитозольному минералокрортикоидному рецептору (он же — глюкокортикоидный рецептор I типа), который обеспечивает их проникновениев ядро и дерепрессию определённых генетических программ. Этот рецептор связывает альдостерон в 100 раз активнее, чем кортизол.
Под действием этих эффекторов клетки собирательных трубок и соединительного сегмента нефрона начинают активно захватывать натрий и обменивать его на калий и водород. Следовательно, при наличии натрия в фильтрате почек пропорционально его доступности альдостерон и его аналоги будут осуществлять задержку натрия и воды, способствовать экскреции калия и подкислению мочи. Если натрия в первичной моче мало, эффективность этих процессов минимальна.
Ренин и ангиотензин, делая натрий доступным для обменного транспорта, создают условия для эффективной альдостероновой регуляции, а не просто по-
вышают концентрации алъдостерона. Атриопептин
служит неконкурентным антагонистом алъдостерона. Потеря калия и водорода и задержка натрия происходят под влиянием гормонов также в потовых и слюнных железах, в тонком и толстом кишечнике.
Большое значение имеют эффекты минералокортикоидов за пределами почек. Установлено, что у этих гормонов имеются быстрые эффекты, не связанные ни с цитозольным рецептором, ни с модуляцией транскрипции. Как и предсказывает принцип Г. Расмуссена (см. выше), ранние эффекты минералокортикоидов связаны с их прямым действием на плазматические мембраны клеток, их водород-натриевый противопереносчик и фосфатидил-инозитоловые посредники.
Даже минимальные концентрации алъдостерона на протяжении 1 -2 минут активируют данную транспортную систему, что ведет к задержке ионов натрия и потере протонов и ионов калия всеми исследованными клетками, даже теми, где ядерные механизмы
110
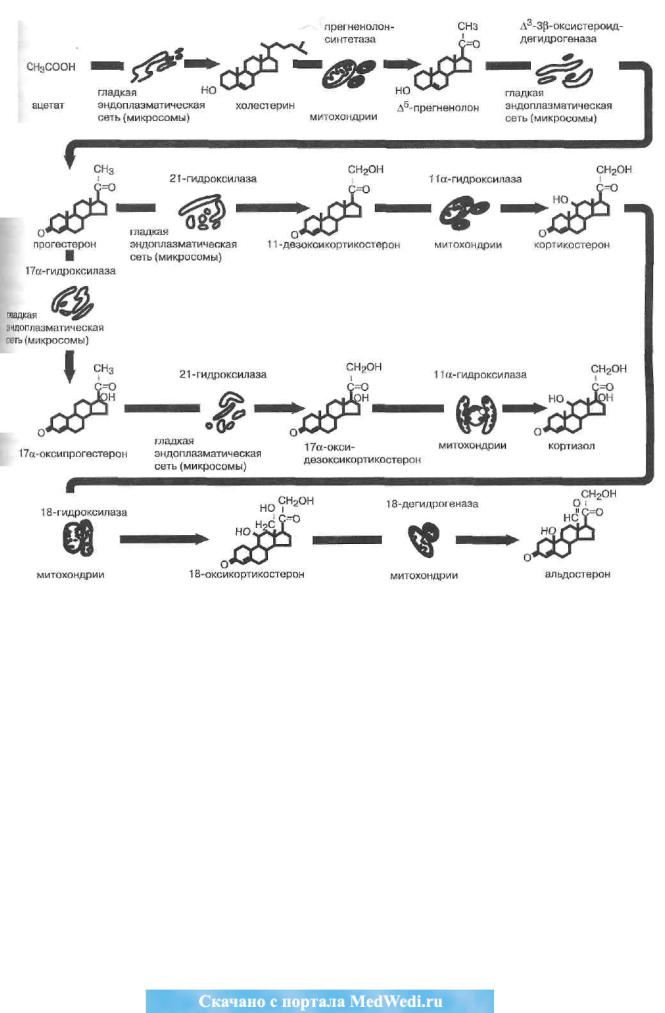
Рис.45.Цитофизиологическисперемещенияибиохимическиепревращенияприбиосинтезекортикостероидов(поВ.И.Кандрору,1991)
действия минералокортикоидов неактуальны (например, лейкоцитами и миоцитами, мозгом и плацентой). Эти эффекты влияютна объём клеток, на их чувствительность к другим гормонам, на системный водно-солевой и кислотно-основной обмены, на выделение и всасывание ионов в желудочно-кишечном тракте, потовых железах, на акклиматизацию к жаре и т.д.
Расстройства секреции минералокортикоидов из-
вестны в форме гипоальдостеронизма и в форме ги-
перальдостеронизма. И тот, и другой синдромы могут быть результатом надпочечниковых поражений (первичные формы) и нарушений экстранадпочечниковой регуляции (вторичные формы).
Глюкокортикоиды (у человека прежде всего кор-
тизол, и в меньшей степени — кортикостерон и кор-
тизон) — гормоны универсального метаболического действия, основные эффекторы стресса и контринсулярные регуляторы, биорегуляторы, сдерживающие воспаление и иммунный ответ в рамках ортофлогоза и предупреждающие шок. В малых и средних количествах они действую на глюкокортикоидный рецептор II типа, а в больших концентрациях — через рецептор I типа — оказывают и некоторый минералокортикоидный эффект.
Подчеркнем, что в большинстве тканей (кроме печени) глюкокортикоиды способствуют катаболизму белков и липидов, понижают использованиеглюкозы в
111

тех клетках, которые имеют лишь инсулинзависимые глюкозные транспортёры. Этим определяется их диссимиляторное действие. Одновременно в печени они стимулируют синтезглюкозыи гликогена, захватаминокислот,синтезрядабелковииспользованиежирныхкислот.
В органах с инсулиннезависимыми транспортёрами глюкозы (например, в центральной нервной системе, сердце и диафрагмальной мышце) глюкокортикоиды увеличивают потребление глюкозы (рис. 46).
Глюкокортикоиды — пермиссивные регуляторы экспрессии рецепторов многих других гормонов. Они влияют на скорость апоптоза в лимфоидных и других клетках.
При повышении продукции глюкокортикоидов развивается гиперкортицизм. Он может быть как первичным, надпочечниковым, так и вторичным — при аномалии регуляции глюкокортикостероидогенеза. Так как АКТГ и другие регуляторы совместно активируют продукцию глюко-иминералокортикоидов, при гипер-
кортицизме нередко имеются и черты гипералъдостеронизма. Первичная недостаточность функций коры надпочечниковили отсутствиедолжнойстимуляции со
Рис. 46. Биологические эффекты глюкокортикоидов (по Н. А. Юдаеву, 1976)
стороны еерегуляторов могут соответственнообусловить первичный или вторичный гипокортицизм.
После попадания в кровь и глюко- и минералокортикоиды связываются белком транскортином, а-гло- булиновым белком печёночого происхождения. Его продукцияусиливается пригиперэстрогенизме, беременности, гипертирозе, при сахарном диабете. Существует наследственная аномалия, проявляющаяся в аутосомно-рецессивномусилениипродукциитранскор- тина.
Все эти состояния характеризуются повышенным связыванием кортикостероидов. При подобных ситуациях происходит уменьшение фракции активного свободного кортизола, что влечёт за собой активацию продукции АКТГ. Нормокортицизм устанавливается при повышенном уровне неактивного связанного кортизола.
Гипотироз, печёночная недостаточность и нефротический синдром ведут к понижению уровня транскор-
тина. Он понижен при миеломной болезни Рустицко-
го-Калера и при семейном наследственном дефиците этого глобулина. За счет действия центрального cepвомеханизма во всех этих случаях устанавливается нормокортицизм с пониженным резервом неактивно-
го кортизола в крови.
Кортизолсвязывается транскортином активнее других глюкокортикоидов и имеет большее время полувыведенияизплазмы крови—1-1,51часа, против 45 минут — у кортикостерона. Только 10%плазменныхглюкокортикоидовсво-бодны и метаболически активны.
Минералокортикоиды связываются не толь-ко транскортином, но и альбумином менее актив-но, чем глюкокортикоиды. Поэтому более 30°/о общего их содержания в плазме представлено свободными гормонами. Понижение продукции альбумина и транскортина при печёночной недостаточности и голодании, их потеря при нефротическом синдроме косвенно способствуют вто-
ричному гиперальдостеронизму с системным отёчным синдромом.
Время полувыведения алъдостерона — 20-30
минут. Как глюкокортикоиды, так и минерал локортикоидыинактивируются в печени путём образованияводорастворимыхпарныхсоедине-ний
— глюкуронидов и сульфатов,а затем экскретируются с мочой и желчью. Свободныекортикостероиды составляютнеболее1% суточной экскреции.Печеночнаянедостаточность,голодание,кахексияразличнойэтиологииигипотироззамедляютихинактивацию,чтоимеетзначениепри этих состояниях для поддержаниягиперальдос-
теронизма и относительного гиперкортициз-ма.
112

Андрогены сетчатой зоны (андростендион, дегидроэпиандростендион и его сульфат, а также са-
мый активный из них, хотя и секретируемый в наименьших количествах андроген — тестостерон) участвуют в регуляции половых функций, стрессе и контроле анаболических процессов. У мужчин их образование при стрессе существенно для наиболее эффективной психологической и метаболической адаптации, а также для уменьшения негативных последствий дистресса. У лиц обоего пола они влияютна формированиелибидо. К томуже уженщин надпочечники — это единственный источник андрогенов, необходимых для оптимального развития клитора, что связано с возможностью испытывать оргазм. Выше уже шла речь омеханизмах стимуляции ихпродукции. Они секретируются в свободном виде и лишь незначительно связываются с альбумином. Конверсия этих гормонов идет не только путем образования парных соединений в печени, нои в тканях-мишенях, где они метаболизируются в более активные тестостерон и дегидротестостерон. Плацента и жировая ткань, особенно локализованная в гиноидных зонах, способ-
ны превращать андрогены в эстрогены.
Нарушения секреции андрогенов могут сопровождать расстройства продукции других кортикостероидов (например, при тотальном гиперкортицизме, при синдроме Иценко-Кушинга). Однако возможны и изолированные нарушения их секреции, в частности, надпочечниковый гиперандрогенизм при некоторых опухолях и врождённой гиперплазии коры надпочечников. Эти нарушения известны под собирательным назва-
нием «адреногенитальные синдромы». Катехоламины мозгового вещества — адреналин,
норадреналин и дофамин — весьма существенные компоненты обеспечения острого ответа организма на повреждение. Они — участники регуляции гемодинамики. Кроме того, путем процессирования проопиомеланокортина в корковом и мозговом веществе надпочечника образуются опиатные пептиды, прежде всего энкефалины, что необходимо в фазу физиологического выхода из стресса (Зайчик А.Ш., Чурилов Л.П., 1999, 2001). Известны гормонообразующие опухоли мозгового вещества надпочечников, нарушающие баланс адреномедуллярных гормонов.
Таким образом, всё разнообразие патологии надпочечников можно условно подразделить на состояния,
характеризующиеся гиперадренизмом и гипоадре-
низмом. Оба синдрома могут быть тотальными, то есть предусматривающими уменьшение выработки гормоноввсехфункциональныхчастейнадпочечников,
и парциальными — сводящимися к избирательной недостаточности функции какой-либо части. Термин
«тотальный гиперадренизм» неупотребителен в ев-
ропейских источниках, поскольку фактически этот синдром представляет собой скорее гиперкортицизм и относится к гиперфункции только коры надпочечников. Тотальный гипоадренизм, напротив, известен и в виде гипокортицизма, и в форме, затрагивающей секрецию как коркового, так и мозгового веществ (например, при апоплексии надпочечников — синдро-
ме Уотерхауза-Фридериксена). Отметим, что из-за универсальной роли АКТГ как стимулятора адренокортикоцитов всех трёх зон гиперкортицизм не является только гиперглюкокортицизмом. Тотальный гиперкор-
тицизм включает, как правило, более или менее выраженные симптомы как гипералъдостеронизма, так и гиперандрогенизма.
Парциальные формы гиперфункции коркового ве-
щества надпочечников предусматривают резкое преобладание гиперсекреции и эффектов какой-либо из групп кортикостероидов. Фактически чистопарциальных форм посуществунет, таккак и эффекты гормонов, и действие стимуляторов их продукции перекрываются. Выше уже шла речь о глюкостеромах, вырабатывающих избыток глюкокортикоидов. Хотя формально это вызывает, казалось бы, парциальный гиперкортицизм, у больных на практике отмечаются, как правило, и минералокортикоидные, и андрогенные эффекты.
Тем не менее можно выделить состояния с преобладанием гиперактивности тех или иных зон коры надпочечников или гиперсекреции какой-либо группы кортикоидов. Интерес среди них в первую очередь представляет гипералъдостеронизм.
Выделяют первичный альдостеронизм, вызванный избыточной, нерегулируемой секрецией минералокортикоидов в коренадпочечников, а такжевторичный, тоесть вызванный чрезмерной ренин-ангиотензиновой стимуляцией.
Кроме истинного гипералъдостеронизма существует и ложный — псевдогипералъдостеронизм. Он развивается при употреблении в пищу избытка солодки (лакрицы), которая содержит ингибитор 11-в-гидрокси- лазы—глицирризиниевую кислоту. У лиц, жующих табак и употребляющих леденцы с лакрицей, а также у энтузиастов траволечения превращение кортизола в кортизон при передозировке солодки тормозится, и избыток первого оказывает альдостероноподобное действие. Воспроизводятся клинические признаки альдостеронизма.
Аналогичный ферментативный дефект бывает при гипертензивнойформеврожденнойнаследственной ги-
113

перплазии коры надпочечников, вызванной дефектом 11-в-гидроксилазы.
Псевдогипералъдостеронизм также воспроизво-
дится при синдроме Лиддля — первичной гиперчувствительности к альдостерону, когда при нормальном уровне минералокортикоидов наступают гипокалиемия, артериальная гипертензия и гипоренинемия.
Экзогенный альдостеронизм может быть также ятрогенным результатом введения минералокортикоидов, которые иногда входят в состав некоторых назальных капель и аэрозолей.
При всех формах первичного альдостеронизма и при псевдоалъдостеронизме имеет место низкая активность ренина. Продукция ренина тормозится за счет активации рецепторов растяжения избыточным объёмом внеклеточной жидкости и повышенным давлением, создающимися при превышении (адекватного уровня альдостерона.
Вторичный гиперальдостеронизм, распространен-
ный во много раз больше, чем первичный, протекает с высоким уровнм ренина (это иногда обозначают звучным термином —ренинизм) и активной ренин-ангио- тензиновой стимуляцией минералокортикоидного стероидогенеза. Данная форма гиперальдостеронизма создается в нескольких ситуациях:
•При ишемии почек, вызванной атеросклерозом и артериосклерозом бассейна почечных артерий, что обычно связано с хроническими гипертензиями, диабетическим гломерулосклерозом (синд-
ром Киммельстиля-Уилсона) и т.д.
•При снижении объёма внутрисосудистой жидкости (застойная сердечная недостаточность, нефротический синдром, хроническая печёночная недостаточность, голодание, другие гипопротеинемические состояния,передозировкамочегонных и слабительных).
•При гипонатриемии и усиленных потерях натрия (хроническая почечная недостаточность, почечный канальцевый ацидоз).
•При первичной гиперплазии юкста-гломеруляр- ного аппарата (синдром Барттера, избыток простагландина Е2).
•При рениномах — опухолях, секретирующих ре- нин автономно (юкстагломерулярной и редко — овариальной локализации). Эта форма иногда обо-
значается как синдром первичного ренинизма
(ШрайберВ., 1987).
•При беременности, так как эстрогены стиму лируют продукцию ангиотензиногена и ренина,
а прогестины снижают эффективность действия альдостерона («физиологический вторичный гиперальдостеронизм»).
При вторичном гипералъдостеронизме в адре-
ногломерулокортикоцитах наблюдаются признаки гиперсекреции и гипертрофии-гиперплазии, однако опухоль или проявления нодулярной гиперплазии отсутствуют. Уровень альдостерона при вторичном гипералъдостеронизме выше, чем при первичном Типичны выраженная задержка натрия и воды, системные отёки.
В подростковом периоде актуален первичный альдостеронизм, который проявляется достаточно ранее Ниже приводится его подробное обсуждение.
Вопросы вторичного гиперальдостеронизма как синдрома, широко распространенного в основном у взрослых и пожилых пациентов, в данной книге затронуты тольков дифференциально-диагностическим целях.
Основные заболевания надпочечников в подростковом периоде
Нижевначалерассматриваютсязаболевания,характеризующиесянарушениямифункцийкорынадпочечни ков, а затем — важнейшие заболевания мозговом веществанадпочечников уподростков.Приэтомзаболевания,протекающиеспарциальной, мозаичнойи тотальнойгиперпродукцией соответствующихгормонов. описанывпервую,апротекающиесихгипопродукцией — во вторую очередь.
ПЕРВИЧНЫЙ ГИПЕРАЛЬДОСТЕРОНИЗМ
Определение. Первичный гиперальдостеронизмзаболеваниевследствиегиперсекреции альдостеронапри аденомеили гиперплазии коры надпочечника, реже — при раке надпочечника.
Синонимы: первичный альдостеронизм, альдосте-
рома, синдром Конна (Конн Дж., 1955).
Распространенность.Первичный гиперальдосте- ронизмвыявляетсяу8-12%лиц сартериальнойгипертензией, ноистинный синдром Конна — лишь в 1 °/о случаев.Средиподростковпервичныйгиперальдостеронизмнаблюдаетсяв основномудевушек(соотношение девушек и юношей, как 3:1).
Этиология и патогенез. Причины первичного ги-
перальдостеронизма неизвестны, но очевидна роль общих причинных факторов неоплазии. Для возникновения гормонообразующего опухолевого клона клеток в надпочечнике необходимы соматические мутации, а их этиология связана с действием химических, физических и\ или вирусных мутагенов на соответствующий орган (Зайчик А.Ш., Чурилов Л.П., 2002).
114

В 70-90 % случаев первичногогиперальдостеронизма находят (чаще слева) солитарную аденому —аль- достерому (до 4 см в диаметре, до 86 г весом), исходящуюихклубочковой зоны. В6%случаев изменений надпочечников ненаходят. Обычноаденомы на разре- зе—оранжевые или золотисто-желтые. Они имеют автономную секрецию алъдостерона.
Альдостеромы могут иметь эктопическую локализацию (яичник, кишечник, щитовидная железа). Так как минералокортикоиды не ингибируют продукцию АКТГ, альдостеромы не сопровождаются, в отличие от глюкостером, атрофией остальной коры надпочечников.
Разновидностью альдостером являются глюко-
кортикоидподавляемые минералокортикоидпро-
дуцирующие аденомы, в которых сервомеханизм ограничения минералокортикоидной секреции не полностью отсутствует и может быть индуцирован большими дозами глюкокортикоидов. Такие доброкачественные опухоли характерны для наследственного первичного гипералъдостеронизма I типа, который встречается редко. Это — глюкокортикоидзависимая форма первичного гиперальдостеронизма. Во время мейоза в гаметах, из которых развиваются носители данной аномалии, происходит неравномерный кроссинговер, и формируется результат слияния участков двух разных генов — гена альдостерон-синтетазы и гена 11-в-гидроксилазы. Гибридный химерический онкобелок CYPIIB1-CYPIIB2 сохраняет активность ключевого фермента биосинтеза алъдостерона, но приобретает сильную зависимость от стимуляции АКТГ.
АКТГ как митоген оказывается для клубочковой зоны таких больных сверхэффективным. Глюкокортикоиды, снижаяпродукцию АКТГ, тормозят экспрессию данной аномалии.
У взрослых изредка (у подростков — гораздо чаще!)
бывает симметричная узелковая гиперплазия коры надпочечников с первичным гипералъдостеронизмом. Природа неопухолевой билатеральной гиперп-
лазии клубочковой зоны коры надпочечников неизвестна, но, поаналогии с микронодулярной гиперплазией пучковой зоны коры надпочечников или щитовидной железы, предполагают важную роль аутоиммунной стимуляции роста и функций адреногломерулокортикоцитов и при данной форме первичного гиперальдостеронизма. Такая гиперплазия порождает либо неподавляемую продукцию минералокортикоидных гормонов
(идиопатический первичный гипералъдостеро-
низм), либочастичноподавляемую их продукцию(нео-
пределённый гипералъдостеронизм).
Патогенез и проявления гиперальдостеронизма всех видов до известной степени типичны, но варьируют в зависимости от этиологии. Манифестация первичного гиперальдостеронизма обусловлена огромным перепроизводством альдостерона (в 70-100 раз) с подавлением ренин-ангиотензиновой системы и функциональной атрофией противоположногонадпочечника.
При любом гиперальдостеронизме минералокортикоиды вызывают задержку натрия и воды, а также потерю калия и катионов водорода почками. Поначалу стимулируется реабсорбция натрия в собирательных трубках почек и обмен натрия на калий и протоны — в дистальных извитых канальцах. Повышается обьём внеклеточной жидкости, и растёт артериальное кровяное давление.
Артериальная гипертензия — главный симптом первичного алъдостеронизма. Особенно повышается диастолическое давление. На развитии артериальной гипертензии сказывается и то, что задержка Na+ в тканях повышает чувствительность к катехол-
аминам.
Формируются гипертрофия и дилатация сердца. Артериальная гипертензия осложняется колебаниями давления ортостатического характера, поскольку при потере калия барорецепторы малочувствительны и не обеспечивают адекватной постуральной стабилизации артериального давления.
По достижении и длительном удержании определенного уровня давления крови, если этому не мешает избыток ренин-ангиотензиновых регуляторов, включается и «наращивает обороты» механизм прессорного натрийуреза, предохраняющий от хронической артериальной гипертензии.
Это означает усиление секреции атриопептинов, что ведет к ускользанию собирательных трубок почек из-под эффекта альдостерона. Выделение натрия и воды увеличивается, что позволяет пациентам с первичным гиперальдостеронизмом не иметь отёков (эффект утечки). Но в дистальных извитых канальцах атриопептиновые рецепторы не имеют столь выраженного представительства, поэтому там действие альдостерона продолжается в полной мере. Это ведет к продолжению потери калиевых и водородных катионов. Гипернатриемия носит умеренный характер из-за разведения натрия, но гипокалиемия и выделительный метаболический алкалоз продолжают прогрессировать. Полиурия может сопровождаться жаждой и гипостенурией.
Клиника. Картина болезни слагается из мышечных, почечных и гипертензивных симптомов.
Больные жалуются на головную боль, головокружения в ортостазе, повышениеартериального давления,
115
