
6 курс / Эндокринология / Особенности_метаболического_синдрома_у_женщин_в_различные_периоды
.pdf
Повышение уровня лептина у лиц с ожирением может противодействовать созреванию доминантного фолликула и овуляции. Уровень лептина различен в зависимости от фазы менструального цикла. Пик его отмечен в лютеиновую фазу и коррелирует с максимальным уровнем прогестерона [6;10].
Онкологическая настороженность по отношению к пациенткам с СПКЯ и ожирением обусловлена данными о высокой частоте гиперплазии эндометрия (2547%) и повышенном риске развития рака эндометрия в перименопаузальном периоде [28]. Патология эндометрия обусловлена пролонгированной секрецией эстрогенов и повышением чувствительности к гормону в эстроген-рецепторных комплексах клеточных мембран. Механизмы развития гиперплазии эндометрия подробно отражены в трудах А.Н.Стрижакова, А.И.Давыдова, Л.Д.Белоцерковцевой [9; 29].
20
3.3. Метаболический синдром и беременность
При ожирении у беременных в большинстве случаев выявляются основные компоненты МС: избыточный вес, АГ, дис-липидемия, ИР. Нормально протекающая беременность сопровождается глубокими метаболическими изменениями организма матери, которые нередко переходят в патологические состояния.
При физиологически протекающей беременности происходит постепенное увеличение резистентности к инсулину, что выражается в снижении действия инсулина на 50% в конце III триместра. Чтобы компенсировать это состояние, увеличивается функция β-клеток в три раза по сравнению с реакцией β-клеток на то же количество глюкозы до беременности. Наличие физиологической ИР и сохранность компенсаторных механизмов обеспечивает нормальное развитие беременности. У женщин с наследственной неполноценностью инсулярного аппарата или при существовании каких-либо сбоев механизмов компенсации увеличение степени ИР будет способствовать переходу физиологической ИР в патологическую, и приводить как к развитию осложнений беременности, так и к различным метаболическим нарушениям [12].
Физиологически протекающей беременности свойственна выраженная гиперлипидемия, при этом имеется прямая корреляционная зависимость между содержанием липидов в крови и сроком беременности [14]. Максимальный рост липидных фракций отмечен во второй половине беременности, особенно в III триместре [25]. Второму триместру беременности соответствует анаболическая фаза с повышением уровня ХС ЛПНП до 685 мг%, что совсем нетипично для небеременных женщин этого же возраста и свидетельствует об изменении метаболизма в целом с «переключением» белкового обмена на липидный как один из признаков адаптивного стрессорного состояния. У беременных женщин и родильниц меняется соотношение α- и β-липопротеидов в пользу последних с двукратным повышением в крови ТГ и свободных жирных кислот, а также ХС. Повышение уровня ХС ЛПНП может быть связан как с нарушением поступления β-липопротеидов в клетки на уровне мембран при ГИ, так и с созданием энергетического фонда жиров на фоне гипопротеи-немии и дефицита глюкозы за счет активного поглощения плодом [25]. Холестерин идет на построение мембран и синтез гормонов, а ХС ЛПНП служат не только как транспортный механизм для холестерина, но и являются энергетическим субстратом. Высокий уровень ХС ЛПНП при низком холестерине может быть следствием функциональной ГИ, а также фазности изменения липид-ного обмена. Известно также, что в пупочной вене новорожденных по сравнению с материнской кровью повышено содержание фосфолипидов, эфиров холестерина, триглицеридов и свободных жирных кислот
[25].
Частота распространенности ожирения среди беременных составляет 15-38%[23]. Среди тучных беременных преобладают женщины в возрасте 21-25 лет (30-32% случаев) и 26-30 лет (26-28% случаев). Однако число беременных с ожирением в старших возрастных группах также достаточно велико и может достигать 37-40%. Первородящие женщины составляют 34,1-36% случаев, повторнородящие - 5264% случаев. Большее число тучных перво-беременных (83-90%) страдает
21
алиментарно-конституциональной формой ожирением с детского возраста [11;
24].
Оказывая негативное влияние на состояние основных систем и органов, ожирение значительно повышает риск патологического течения беременности, родов, послеродового периода у женщин и перинатальной заболеваемости и смертности у новорожденных [7; 13; 18; 16]. Показано, что осложненное течение беременности при I степени ожирения имели 80%, при II степени - 76%, а при III степени - 100% родивших женщин. Частота раннего токсикоза составляет 10-17%, угрожающего аборта - 8%, гестоза 2563% [34]. Перинатальная летальность при ожирении составляет 10-200/00 [35].
В исследовании, проведенном на кафедре акушерства и гинекологии МИ СурГУ, показано, что у женщин с ожирением и избыточной массой тела беременность осложняется классическим гестозом в три раза чаще, чем в группе пациенток с нормальным весом. У каждой второй пациентки с морбидным ожирением диагностированы нарушения маточно-плацентарного кровотока, многоводие отмечалось в три раза чаще при ожирении, чем при нормальной массе тела. У 5056% женщин с избыточной массой тела и ожирением вес детей при рождении превышал средние величины для гестационного срока. Показатели содержания ХС ЛПОНП во II триместре составили в среднем у беременных с ожирением I степени 0,99±0,10 ммоль/л, у пациенток с ожирением III степени - 1,08±0,22 ммоль/л, в контрольной группе - 0,66±0,07 ммоль/л. При прогрессировании беременности дислипидемические изменения усиливались: в III триместре уровень ТГ у беременных с ожирением I степени составил в среднем 2,30±0,20 ммоль/л, при ожирении II степени - 2,51±0,31 ммоль/л, при морбидном ожирении -
3,12±0,50 ммоль/л, в группе контроля - 2,34±0,15 ммоль/л [5; 12].
Избыточная масса тела, ожирение являются фактором риска развития гестационного сахарного диабета (ГСД) от 1 до 14% всех беременностей. В России распространенность ГСД составляет 4,5% [8]. За последние 10 лет идет неуклонный рост нарушений углеводного обмена, в частности СД у беременных. Изменилась и структура нарушений углеводного обмена, увеличилось количество скрытых форм СД, таких как ГСД и НТГ, с 25% до 67%. Наибольшее количество беременных с нарушением углеводного обмена проживают в городах, что отражает ухудшение экологической обстановки.
Гестационный диабет - это любая степень нарушения углеводного обмена с началом и первым выявлением во время беременности. Он может проявляться незначительной гипергликемией натощак, постпрандиальной гипергликемией, либо развивается классическая клиническая картина СД с высокими цифрами гликемии. По своим последствиям для матери и плода (развитие акушерской патологии, пороков развития, макросомии плода и т. д.) ГСД аналогичен СД, существовавшему у женщины до беременности [20]. Одна из особенностей ГСД заключается в том, что он часто остается нераспознанным. Клинические проявления в большинстве случаев отсутствуют или неспецифичны. Как правило, имеется ожирение различной степени, нередко - быстрая прибавка веса во время беременности. При высоких цифрах гликемии появляются жалобы на полиурию, жажду, повышение аппетита и т. д. Наибольшие трудности для диагностики представляют случаи ГСД с умеренной гипергликемией, когда часто не выявляется глюкозурия и отсутствует гипергликемия натощак [11].
22
У тучных молодых женщин в период беременности нарушение толерантности к углеводам клинически протекают очень легко. Они не предъявляют характерных для СД жалоб, или эти симптомы проявляются слабо и не вызывают тревоги у беременной. Часто срок беременности не влияет на прогрессирование диабета, однако нарушения углеводного обмена возникают чаще на 24-28 неделях беременности, т. к. в этот период активно функционирует плацента, продуцирующая ряд контринсулярных гормонов и, прежде всего плацентарный лактоген.
ГСД развивается после 16-й недели беременности и не является причиной врожденных пороков развития. Однако не-диагностированная или нелеченная гипергликемия во II или III триместрах беременности может привести к осложнениям в развитии плода [30]. Наиболее часто встречается макросомия (крупный плод). Через плаценту от матери к плоду глюкоза проникает в неограниченном количестве, т. к. она требуется для развития и роста ребенка. Инсулин матери через плаценту не проникает, он разрушается в ней ферментом инсулиназой. Поэтому поджелудочная железа плода для снижения уровня сахара в его крови начинает вырабатывать избыточное количество собственного инсулина. Избыток углеводов под воздействием инсулина плода преобразуется в жир. Сочетание гипергликемии матери и избыточной продукции инсулина у плода приводит к ускорению его роста. Увеличиваются такие органы, как печень, сердце, поджелудочная железа, происходит избыточное отложение подкожного жира и возникает диспропорция частей тела - большой живот, широкий плечевой пояс и маленькие конечности (диабетическая фетопатия). Отсюда большой вес плода при рождении, что представляет проблему для матери и ребенка [31].
Таким образом, беременные с ожирением и избыточной массой тела изначально формируют группу риска по невынашиванию, гестозу, развитию ГСД, макросомии плода, аномалиям родовой деятельности и репродуктивным потерям [30].
3.4.Метаболический синдром у женщин в пери- и постменопаузе
Вперименопаузе снижается продукция эстрогенов фолликулярным аппаратом яичников, но в строме продолжается секреция их андрогенных предшественников. Циркулирующие в периферическом кровотоке эстрогены у женщин перименопаузального периода имеют и яичниковое, и надпочечниковое происхождение. Образующийся в этих структурах андростендион подвергается превращениям в периферических тканях (преимущественно в жировой ткани) в эстрон и тестостерон. Андростендион, тестостерон, дигидротестостерон имеют смешанное надпочечниково-яичниковое происхождение. В период постменопаузы яичники секретируют в периферический кровоток около 50% тестостерона и 30% андро-стендиона.
Второй особенностью периода угасания репродуктивной системы является изменение уровня продукции гонадотропинов гипофизом, развивается дискоординации взаимодействия центрального и периферического звена гипоталамо-гипофизарно-адре-наловой системы. В периоде климактерия происходит снижение андрогенной функции надпочечников, снижение или неизменность глюкокортикоидной функции надпочечников при возрастающей или стабильной адренокортикотропной функции гипофиза. Формируется так называемый «постменопаузальный» гипофиз.
23
Все эти изменения, происходящие в пери- и постменопау-зальном периодах, оказывают влияние на метаболические процессы в организме женщины [4; 9]. В результате потери защитного влияния эстрогенов повышается уровень общего ХС, ХС ЛПНП, общих ТГ и снижается содержание ХС ЛПВП. У женщин более важным фактором риска является низкое содержание ХС ЛПВП при высоком уровне ТГ. Снижение содержания ХС ЛПВП ведет к уменьшению возможности удаления ХС из стенок артерий. Показано, что женщины с уровнем общего ХС до 240 мг/дл при содержании ЛПВП выше 50 мг/дл не имеют повышенного риска сердечно-сосудистых заболеваний. Наоборот, риск возрастает у женщин с уровнем общего ХС менее 200 мг/дл при содержании ХС ЛПВП менее 50 мг/дл [6;
47].
Дефицит эстрогенов может играть роль и в изменении обмена глюкозы и инсулина. Обмен инсулина в постменопаузе характеризуется ГИ, ИР, центральным (андроидным) ожирением. Одновременно наблюдается снижение секреции инсулина, элиминации инсулина, инсулин-чувствительности в периферических тканях. Инсулин стимулирует накопление липидов, пролиферацию гладкомышечных волокон стенки артерий, повышает антифибринолитическую активность крови. По мнению R. Krauss, инсулинорезистентность в постменопаузе нередко может быть центром «запутанной паутины» факторов риска развития сердечно-сосудистых заболеваний. Поскольку в постменопаузе увеличивается частота диабета II типа, ИР может вызвать атерогенные изменения в эндотелии сосудов, что, в свою очередь, может вести к гипертензии и изменению эластичности сосудов.
Повышенный уровень андрогенов, центральное (андроид-ное) ожирение, АГ и повышенное содержание катехоламинов, обусловленное инсулинрезистентностью, являются факторами риска сердечно-сосудистых заболеваний в менопаузе [4; 9; 27; 47].
Система гемостаза в постменопаузе характеризуется повышением уровня фибриногена, факторов VII-а, VII-c, PAI-1, которые связаны с инсулинорезистентностью и дислипопротеинеми-ей. Это приводит к преобладанию процессов тромбообразования, коагуляции над процессами фибринолиза [6].
В последние годы отмечается рост как гинекологических, так и экстрагенитальных заболеваний, приводящих к раннему выключению функции яичников. Резко наступающий дефицит половых гормонов приводит к дезадаптации в нейроэндокринной системе женщины. На базе БУ ХМАО-Югры «Сургутского клинического перинатального центра» за период с 2003 по 2009 гг. было обследовано 180 женщин с ранней менопаузой различного генеза. Проявления МС наблюдались у 87(48,3%) обследованных пациенток. Через 3,6±0,90 лет развилась у 22,5% пациенток АГ, через 2 года у 65% - ожирение, развившееся на фоне ИР и ГИ у 48,3% женщин с менопаузой. По сравнению с контрольной группой у пациенток с ранней менопаузой в 2 раза преобладали тяжелые степени ожирения, с изменением структуры тела по показателям ОТ. Особый, с нашей точки зрения, интерес представлял анализ у больных с ранней менопаузой секреции андрогенов как яичникового, так и надпочечникового генеза. С наступлением естественной менопаузы могут возрастать свободные фракции тестостерона, что приводит к относительной гиперандрогении и часто к формированию абдоминального ожирения. Согласно нашим данным, у 31,7%
24
больных с ранней менопаузой на фоне закономерных для данной патологии соотношений ФСГ, ЛГ и эстрадиола было отмечено андрогендефицитное состояние. Обращает на себя внимание высокие показатели ДГЕА-С и кортизо-ла у пациенток с нарушенной толерантностью к глюкозе [4].
ГЛАВА 4. ДИАГНОСТИКА МЕТАБОЛИЧЕСКОГО СИНДРОМА
4.1. Критерии диагностики метаболического синдрома
Согласно Рекомендациям экспертов Всероссийского научного общества кардиологов по диагностике и лечению метаболического синдрома (Второй пересмотр, 2009 г.) основным признаком МС является:центральный (абдоминальный) тип ожирения - окружность талии (ОТ) более 80 см у женщин и
более 94 см у мужчин. Дополнительные критерии:
артериальная гипертония (АД ≥ 130/85 мм рт. ст.)
повышение уровня триглицеридов (≥ 1,7 ммоль/л)
снижение уровня ХС ЛПВП (<1,0 ммоль/л у мужчин; <1,2 ммоль/л у женщин)
повышение уровня ХС ЛПНП > 3,0 ммоль/л
гипергликемия натощак (глюкоза в плазме крови натощак ≥ 6,1 ммоль/л)
нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 часа после нагрузки глюкозой в пределах ≥7,8 и ≤11,1 ммоль/л)
Наличие у пациента центрального ожирения и двух дополнительных критериев является основанием для диагностирования у него метаболического синдрома.
Рекомендуемые исследования:
Взвешивание пациента и измерение роста для вычисления индекса массы тела (ИМТ);
Наиболее простой метод косвенного определения абдоминального типа ожирения состоит в антропометрическом измерении ОТ;
Для выявления нарушений углеводного обмена применяется определение глюкозы в крови натощак и через 2 часа после перорального приема 75 г глюкозы - пероральный тест толерантности к глюкозе (ПТТГ);
Определение в крови показателей липидного обмена (общего холестерина и триглицеридов);
Определение уровня мочевой кислоты;
Измерение уровня артериального давления методом Ко-роткова.
Длительное бессимптомное течение МС определяет необходимость более тщательного обследования пациентов, имеющих факторы риска развития МС:
1.семейный анамнез (наличие АГ, ИБС, СД, подагра предрасположенность к ожирению у родственников);
25
2.социальный анамнез (особенности образа жизни, патологические пищевые привычки, нарушенный режим питания, стрессовые ситуации, малоподвижный образ жизни, курение);
3.акушерско-гинекологический анамнез (низкий вес при рождении и/или медленный набор веса в первый год жизни, нарушение менструального цикла, позднее менархе, преждевременное адренархе, невынашивание беременности, ГСД, гестационная АГ);
4.наличие признаков избытка андрогенов у женщин (гирсу-тизм, вульгарные угри, андрогенное облысение, себорея);
5.с жалобами на нарушение дыхания во время сна, с нигро-идным акантозом, булимическими проявлениями, тромботическими осложнениями,
6.ожирение;
7.возраст старше 50 лет для женщин.
Программа обследования женщин с метаболическим синдромом
1.антропометрические измерения (рост, вес, ИМТ, ОТ, ОБ, ОТ/ОБ)
2.мониторинг артериального давления, ЭКГ-исследование
3.определение биохимических показателей уровня три-глицеридов, общего холестерина ХС ЛПВП, ХС ЛПНП, апо-В плазмы
4.определение глюкозы в крови натощак
5.определение содержания инсулина в крови натощак
6.проведение теста на толерантность глюкозе с одновременным определением уровня инсулина
7.определение уровня мочевой кислоты
8.определение уровня глобулина, связывающего половые гормоны
9.определение уровня лептина
10.определение уровня гормонов репродуктивной системы у женщин (общий тестостерон с вычислением индекса свободных андрогенов, ЛГ, ФСГ, соотношение ЛГ/ФСГ)
11.ультразвуковое исследование органов малого таза
12.ультразвуковое исследование молочных желез и маммография для женщин старше 40 лет 1 раз в 2 года.
Таблица 4. Основные компоненты МС и методы их оценки. (Т.И.Ушакова, 2007г.)
Компоненты |
Методы оценки в |
Методы оценки МС при |
МС |
клинической практики |
проведении дополнительного |
|
|
обследования |
|
|
|
Ожирение |
ОТ ОБ |
Биоимпедансный метод |
|
|
(электронные весы с анализом |
|
ОТ/ОБ ИМТ |
содержания в организме воды и |
|
|
жира) Денситометрия |
|
|
Компьютерная томография (КТ) |
|
|
Магнитно-резонансная |
|
|
томография (МРТ) |
|
|
|
ИР |
Глюкоза крови натощак |
Лептин Адипонектин Резистин |
|
Пероральный |
Инсулин |
|
глюкозотолерантный тест |
|
|
|
|
26
|
(ПГТТ) |
Индексы инсулинорези-стентности |
|
|
Внутривенный глюкозотолерант- |
|
|
ный тест (ВГТТ) Эугликемический |
|
|
клэмп-тест |
|
|
|
АГ |
Систолическое АД (САД) |
Суточное мониториро-вание АД |
|
Диастолическое АД (ДАД) |
Микроальбуминурия Ангиотензин |
|
|
II Эндотелин |
|
Прием гипотензивный |
|
|
препаратов |
|
|
|
|
Гиперлипиде- |
ТГ |
Апо-А1 Апо-В |
мия |
|
|
|
ХС ЛПВП ХС ЛПНП |
Постпрандиальные уровни |
|
|
липидов |
|
|
|
4.2. Клиническая значимость и диагностика отдельных компонентов метаболического синдрома
Оценка состояния углеводного обмена и степени выраженности инсулинорезистентности.
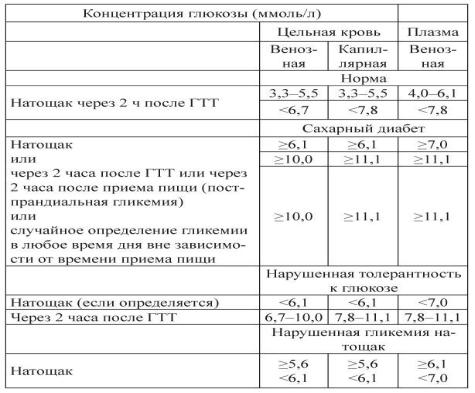
Для оценки состояния углеводного обмена пациенту необходимо определить уровень сахара в цельной крови (плазме). При выявлении нормальных или пограничных результатов назначается диета с повышенным содержанием углеводов (не менее 150 г в сутки) при нормальной физической активности на период не менее 3 дней. После этого проводится пероральный нагрузочный тест на толерантность к глюкозе. Тест проводится после 8-14 часового ночного голодания. После забора крови натощак пациенту предлагается выпить 75 г сухой глюкозы, растворенной в 250 мл воды. В процессе теста не разрешается курение, прием пищи. Через 2 часа производится повторный забор крови. Результаты оцениваются по схеме, приведенной в таблице 5.
Возможно также проведение внутривенного нагрузочного теста на толерантность к глюкозе. В этом случае помимо глюкозы оценивается и уровень инсулина, что позволяет косвенно судить о степени резистентности к инсулину и/или о дефиците либо от-сроченности его выброса в ответ на повышение глюкозы в крови.
«Золотым стандартом» диагностики инсулинорезистент-ности признан метод эугликемического гиперинсулинемического клампирования (DeFronzo, 1979). Он основан на внутривенном введении константных доз инсулина. Уровень гликемии регулируется при помощи экзогенного введения 20% глюкозы с контролем сахара в крови через каждые 5-7 минут. В течение 1-2 часов достигается равновесие поступления и потребления экзогенной глюкозы. При этом считается, что собственная печеночная продукция глюкозы полностью подавляется, однако для получения достоверных данных с целью проведения теста принято использовать меченую глюкозу. Данный метод позволяет оценить величину и скорость
27
утилизации глюкозы мышцами по формуле: M=Ginf. + HGO - Ugl, где Ginf - количество вводимой глюкозы HGO - печеночный выход глюкозы Ugl - потеря глюкозы с мочой
Гиперинсулинемия - состояние, когда концентрация им-мунореактивного инсулина в плазме крови натощак составляет более 5,3-25,0 мкЕД/мл, а также его уровень через 2 часа после нагрузки глюкозой превышает 25,0-28,0 мкЕД/мл. Критериями инсулинорезистентности стали следующие оценки: индекс Caro - менее 0,33; HOMA-IR - более 2,86 баллов; гиперинсулинемия - более 12,8 мкЕд/мл.
Для оценки секреторной способности поджелудочной железы у пациентов с подозрением на метаболический синдром проводится исследование на С-пептид и инсулин. На ранних этапах заболевания (при развитии гиперинсулинемии) эти показатели повышены, на начальном этапе нарушения толерантности к глюкозе умеренно повышены или в норме и снижаются при развитии клинического сахарного диабета.
Метод исследования гликированного (гликолизирован-ного) гемоглобина основан на способности гемоглобина присоединять молекулу глюкозы с образованием стойкого соединения. Неферментативный процесс протекает в течение всей жизни эритроцита (около 120 дней), при этом относительное количество гликированного гемоглобина у здорового человека составляет 3-6%. Данный метод позволяет оценить состояние углеводного обмена за период 3-4 месяцев, однако не способен выявить ранние стадии нарушения в условиях изолированной гиперинсули-немии и нарушенной толерантности к глюкозе.
Таблица 5. Критерии диагностики СД и других видов гипергликемии (ВОЗ,
1999)
28

Табл. 5.1
Расчетные показатели инсулинорезистентности
Индекс Caro (F.Caro, 1991) = G0/I0 (норма>3,4); HOMА-IR - Homeostasis Model Assessment= I0хG0/22,5 (нор-ма<2,77);
НОМА-βcell - показатель активности β-клеток = 20хI0/(G0-3,5) - норма<180%;
Quantative Insulin sensitivity ChecK Index - QUICKI = 1/ [logI0+log(G0)/18)] -
норма>3,4;
где I0 - базальный уровень инсулина, мкМЕ/мл и G0 - базальный уровень глюкозы плазмы, ммоль/л.
Дополнительный маркер ИР, предложенный АТРIII, отношение ТГ/ХС ЛПВП
(норма<1,32) [1].
Оценка нарушений липидного обмена и степени ожирения
Ожирение - нарушение обмена веществ, характеризующееся избыточным объемом жировой ткани. Объективным исследованием является определение типа телосложения и степени ожирения, определяя индекс массы тела (ИМТ) по
G. Brey (1978):
ИМТ = масса тела, кг/длина тела, в м 2 .
29
