
4 курс / Общая токсикология (доп.) / Toxikologicheskaya_khimia_Ekzamen
.docx
65.ХТА каннабиоидов.объекты исследования, метаболизм. Каннабиноиды — группа терпентиновых соединений, производных 2-замещённого 5-амилрезорцина. В природе встречаются в растениях семейства коноплёвых (Cannabaceae), являются действующими веществами гашиша и марихуаны. Растительные каннабиноиды также называют фитоканнабиноидами .В настоящее время каннабиноидами принято называть также синтетические вещества, имеющие родственную растительным каннабиноидам структуру и обладающие аналогичным фармакологическим действием — такие вещества называются классическими каннабиноидами. Данные соединения необходимы для нормального функционирования головного мозга и отвечают за ряд жизнено важных функций. Каннабихроменовая, каннабидиоловая и дельта-9-тетрагидроканнабиноловая кислоты являются основными каннабиноидами, поскольку их синтез в растении обусловлен генетически. Все каннабиноиды — жирорастворимые вещества. При попадании в организм они накапливаются в тканях, богатых липидами (мозге, лёгких, внутренних половых органах) и постепенно высвобождаются в систему кровообращения. Опьяняющий эффект препаратов конопли (марихуаны, гашиша и т. д.) есть результат комплексного действия всех каннабиноидов, хотя лишь немногие из них обладают психотропным действием в чистом виде; к ним относятся в первую очередь дельта-9- и дельта-8-тетрагидроканнабинолы, обладающие основным психотропным действием. Такие каннабиноиды, как каннабидиол, каннабихромен и каннабинол сами психотропным действием не обладают, но способны вносить некоторые дополнения в эффект психотропых каннабиноидов. Также обладают психотропым эффектом дельта-9-тетрагидроканнабиварин и бутиловый аналог дельта-9-тетрагидроканнабинола, которые найдены в некоторых образцах марихуаны. Объект исследования:моча,,кровь. Определение каннабиноидов в слюне курильщика. Отбор проб:У подозреваемого отбирают 10мл. слюны в склянку с пробкой на 100мл., промывают полость рта 50мл. 70% этанола, насыщенного хлоридом натрия. Слюну опечатывают и направляют на химическое исследование: пробу смешивают с 50мл. насыщенного раствора хлорида натрия и экстрагируют этилацетатом трижды по 10мл. Экстракт высушивают путем добавления безводного сульфата натрия, через 30 мин. фильтруют, фильтрат упаривают до нескольких капель и наносят на пластинку «Силуфол». Дифференцирование каннабиноидов производят по положению и окраске пятен на хроматограмме. Смывы с поверхности пальцев рук. Исследование: тампон + метиловый эфир или этилацетат (этиловый эфир уксусной к-ты) 2 порциями. Упаривают и наносят на фильтровальную бумагу, затем высушивают и опрыскивают 0,5% р-ром прочного синего Б в К2СО3. Если нет окрашивания – отрицательное заключение. Оранжевое окрашивание – часть экстракта наносят на пластинку «Силуфол». Дифференцирование каннабиноидов проводят по положению и окраске пятен на хроматограмме. Хромогенные реакции проводят с аликвотой спиртового смыва, к которой добавляют смесь соли прочного синего Б с сульфитом натрия, несколько капель хлороформа и 0,1М р-ра NaOH. В присутствии каннабиноидов образуется пурпурно-красное окрашивание. Определение каннабиноидов в плазме крови.При подготовки пробы к анализу ГЖХ и ГХ-МС конъюгатов Δ9-ТГК-кислоты, ее экстрагируют и после упаривания растворителя переводят в метиловый эфир. Характерные масс-фрагменты Δ9-ТГК 314, 299, а для метилового эфира Δ9-ТГК – 328,313.
|
66. ХТА фенилалкиламинов: амфетамина и метамфетамина. Метаболизм. Фенилалкиламины, являются стимуляторами ЦНС, симпатомиметиками. Обладают основными свойствами. Длительность действия примерно 4-6 часов, быстро всасываются в ЖКТ, максимальная концентрация в крови достигается через 2-3 часа при приеме через рот. Химические исследования небиологического происхождения:
Подтверждающие методы анализа фенилалкиламинов применяют: ГЖХ, ВЭЖХ. В медицине применяется препарат эфедрин – α, β-адреностимулятор – сужает сосуды, повышает АД. В спорте в виде запрещенных допинговых средств и психомоторных стимуляторов – амфетамин, метамфетамин. Как наркотическое средство – эфедрин.
Основные пути метаболизма амфетамина и метамфетамина.
→
→
метамфетамин амфетамин норэфедрин
ОН ОН
фенолацетон глюкурониды и коньюгаты с глицином
|
67. . Производные пиризола: антипирин в хим-токс отношении.
2.Р-р антипирина, подкисленный разведенной серной к-той, при добавлении неск капель р-ра натрита натрия принимает зеленое окрашивание, а при больших колич выпадает зеленый осадок нитрозоантипирина.
3.Р-ция образования азокрасителя. Если прибавить р-р нитрита натрия и уксусную к-ту,то образуется нитрозоантипирин,кот.пр взаимодействии с альфа-нафтиламином образует пиразолоновый азокраситель, имеющий красную окраску. 4.Обнаружение антипирина по уф- и ик- спектрам. Антипирин быстро всасывается из пищ канала. Максимальный уровень его в плазме достигается через 1-2 часа после поступления в ор-м. Медленно метаболизируется в органах и тканях. Около 5% дозы антипирина выделяется в несвязанном виде ,больше 50% этого препарата подвергается метаболизму. Около 30-40% введенной дозы антипирина связывается с глюкуроновой к-той и выделяется в виде глюкуронида. Некоторое кол-во подвергается гидроксилированию с образованием 4-гидроксиантипирина.Определенная часть дозы антипирина метаболизируется путем разрыва пиразолонового цикла. Отравления антипирином наблюдаются в связи с широким его применением в качестве лекарства.
|
68. Новокаин (прокаин, аллокаин, синкаин и др.) — гидрохлорид β -диэтиламиноэтилового эфира п -аминобензойной кислоты. Он представляет собой белый кристаллический порошок без запаха. Растворяется в воде, этиловом спирте , слабо растворяется в диэтиловом эфире и хлороформе. Новокаин экстрагируется органическими растворителями из щелочных водных растворов. Применение. Действие на организм. Новокаин широко используется в медицине как анестетик. Он менее активен, чем кокаин. После всасывания в кровь новокаин понижает возбудимость периферических холинореактивных систем, уменьшает спазмы гладкой мускулатуры, понижает возбудимость мышцы сердца и некоторых отделов головного мозга. В токсических дозах новокаин вызывает возбуждение, а затем паралич центральной нервной системы. Метаболизм. Новокаин является нестойким препаратом. В организме он распадается на п -аминобензойную кислоту и диэтиламиноэтанол. В течение 24 ч после введения новокаина около 2 % этого препарата выделяется с мочой в неизмененном виде. Указанные выше метаболиты новокаина тоже выделяются с мочой. Часть п -аминобензойной кислоты выделяется с мочой в неизмененном виде и в виде глюкуронида. Обнаружение новокаина. Для обнаружения новокаина применяют реакцию диазотиро-вания, реакцию с реактивом Драгендорфа и физико-химические методы. Реакция диазотирования. К исследуемому раствору прибавляют 1 %-й раствор соляной кислоты, а затем по каплям прибавляют 1 %-й раствор нитрита натрия до тех пор, пока не начнет окрашиваться в синий цвет иодкрахмальная бумажка. Через 5 мин жидкость подщелачивают 2%-м раствором гидроксида натрия до щелочной реакции и прибавляют щелочной раствор β-нафтола. При наличии новокаина раствор приобретает красно-оранжевую окраску. Приготовление иод крахмальной бумажки . Реакция с реактивом Драгендорфа. От прибавления к сухому остатку исследуемого вещества капли реактива Драгендорфа образуется осадок, состоящий из прямоугольных пластинок красно-бурого цвета. Обнаружение новокаина методом хроматографии. Раствор исследуемого вещества в этиловом спирте или спиртовой раствор остатка вещества, выделенного из биологического материала, наносят на хроматографическую пластинку, покрытую тонким слоем силикагеля. Пятна нанесенных растворов подсушивают на воздухе, а затем пластинку вносят в камеру, насыщенную парами системы растворителей (циклогексан — бензол — диэтиламин (75 : 15 : 10). Пластинку выдерживают в камере для хроматографирования до тех пор, пока жидкость поднимается на 10 см выше линии старта. После этого пластинку вынимают из камеры, высушивают на воздухе и опрыскивают реактивом Дра-гендорфа, модифицированным по Мунье. При наличии новокаина на пластинке появляются оранжево-коричневого цвета пятна (Rf = 0,16...0,18). Дикаин в этих условиях имеет Rf = 0,33...0,35, а кокаин —Rf = 0,60...0,63. Приготовление хроматографических пластинок . Обнаружение новокаина по УФ- и ИК-спектрам. |
69. ЭФЕДРИН
Реакция с 2,4-Динитрохлорбензолом. Эфедрин и другие соединения, у которых ОН-группа находится в α-положении, а аминогруппа в β-положении по отношению к ароматическому кольцу, при нагревании претерпевают гидраминное разложение. При этом образуется фенилэтилкетон и амин: Образовавшийся при этой реакции метиламин с 2,4-динитро-хлорбензолом дает соединение желтого цвета, которое экстрагируется хлороформом. При наличии эфедрина в растворе появляется желто-коричневая окраска. Если к охлажденному раствору прибавить 1—2 капли хлороформа и несколько капель разбавленной уксусной кислоты, а затем взболтать, то хлороформный слой приобретает желтую окраску. Реакция с реактивом Драгендорфа. При взаимодействии эфедрина с реактивом Драгендорфа образуются кристаллы, напоминающие тонкие иглы, собранные в пучки. Обнаружение эфедрина по УФ- и ИК-спектрам. |
70. Методы изолирования мет. ядов из биоматериала. Подготовка объекта, техника. Для исследования биологического материала на наличие «металлических ядов» необходимо разрушить органические вещества, с которыми связаны металлы, и перевести их в ионное состояние. Гуппы:1. СУХОЕ ОЗОЛЕНИЕ И СПЛАВЛЕНИЕ ОРГАНИЧЕСКИХ ВЕЩЕСТВ.А) Метод сухого озоления основан на нагревании органических веществ до высокой температуры при доступе воздуха. Сухое озоление производят в фарфоровых, кварцевых или платиновых тиглях. При разрушении органических веществ с помощью этого метода на исследование берут относительно небольшие навески и нагревают их в тигле до 300—400 °С.. Недостатки:улетучивание некоторых металлов или их соединений в процессе нагревания, а также взаимодействие отдельных металлов с материалом тиглей;трудно контролировать температуру исследуемого материала в тигле. Б) Метод сплавления органических веществ с нитратами.Пользуясь методом сплавления, биологический материал или др. органические в-ва нагревают с расплавленными нитратами щелочных металлов. С повышением температуры окислительные свойства нитратов усиливаются. При этом может происходить быстрое окисление органических веществ, сопровождающееся выбрасыванием из тигля мелких частиц сожженной пробы. 2. МОКРОЕ ОЗОЛЕНИЕ.Применяют кислоты-окислители (азотную, серную и хлорную кислоты). При их помощи происходит разрушение биологического материала с образованием более простых химических соединений. Роль азотной кислоты. Разрушение биологического материала нагреванием с концентрированной азотной кислотой требует большой затраты времени. Конц-ая азотная кислота слабо окисляет жиры, находящиеся в биологическом материале. Поэтому иногда требуется проводить экстракцию жиров петролейным эфиром или другими органическими растворителями и только после этого приступать к разрушению органических веществ нагреванием с концентрированной азотной кислотой. Роль серной кислоты. Концентрированная серная кислота применялась для разрушения различных органических соединений. Разбавленная серная кислота не проявляет окислительных свойств и не разрушает органических соединений.Процесс окисления длительный., могут образовываться неразлагающиеся этой кислотой обуглившиеся остатки. Этот метод мало пригоден для минерализации объектов биологического происхождения. Роль хлорной кислоты.характеризуется высокой скоростью минерализации, а также способностью этой кислоты разрушать вещества, стойкие или медленноразлагающиеся другими окислителями. Роль воды. Способствует гидролизу. Препятствует прохождению процессов, сульфирования и нитрования. Подготовка объекта к минерализации. Каждую пробу материала подвергают минерализации раздельно. При большом количестве материала, объект разрушают, затем соединяют минерализаты. Стадии минерализации.1.Стадия деструкции. На этой стадии образуется гидроперекиси, являющиеся первыми продуктами окисления. Распад форменных элементов протекает очень бурно с выделением большого количества газообразных продуктов. белки расщепляются до аминокислот, гликоген до ди- и моносахаридов и начинается процесс гидролиза жиров.2.Стадия глубокого жидкофазного окисления. Процесс протекает в реакционной смеси, идет окисление жиров, трудно поддающихся окислению и др. соединений. Определение конца минерализации: смесью H2SO4+HNO3+H2O – не темнеет; смесью H2SO4+HNO3+HClO4 – слабо-желтая окраска.
|
71. Денитрация минерализата. Чем вызвана необходимость денитрации, в чем сущность денитрации? Денитрация с помощью формальдегида (уравнение реакции).Денитрация — процесс освобождения минерализатов от азотной, азотистой, нитрозил-серной кислот и оксидов азота. На первых этапах применения метода разрушения органических веществ азотной и серной кислотами для денитрации минерализатов применялся так называемый гидролизный метод. метод основан на разбавлении минерализатов водой и на последующем нагревании полученных жидкостей. При нагревании минерализатов, разбавленных водой, улетучиваются азотная, азотистая кислоты и оксиды азота, а нитрозил-серная кислота при указанных условиях практически не улетучивается. Она постепенно разлагается водой (гидролизуется). Реакции гидролиза нитрозилсерной кислоты является обратимой. Чтобы она протекла до конца, следует удалить образующуюся азотистую кислоту, что достигантся путем добавления специальных веществ – денитраторов. Эти вещества образуются с азотистой, а так же с азотной кислотами, летучие продукты, которые легко удаляются из минерализата при нагревании. В качестве денитратора используют формальдегид. При взаимодействии формальдегида с азотной кислотой, выделяется азот: 4HNO 3 + 5НСНО ---> 2N 2 + 5СО 2 + 7Н 2 О. В результате взаимодействия азотистой кислоты с формальдегидом выделяются азот, оксид азота (II), оксид углерода (IV) и вода: 4HNO 2 + 2НСНО ---> Ν 2 + 2ΝΟ + 2СО 2 + 4Н 2 О. Оксид азота (II) окисляется кислородом воздуха до оксида азота (IV), который при взаимодействии с водой дает азотную и азотистую кислоты: ΝΟ + Ο — ΝΟ 2 2ΝΟ 2 + Н2О ---> ΗΝΟ 2 + ΗΝΟ 3 Образовавшиеся при этом азотная и азотистая кислоты реагируют с формальдегидом, как указано выше. Нитрозилсерная кислота при нагревании с водой разлагается. Условия денитрации формальдегидом: 1)Требуется разбавление минерализата в 2 раза, чтобы концентрация H2SO4, равнялась 57%. 2)Формальдегид добавляется каплями при постоянном перемешивании, чтобы денитрация проходила более полно и чтобы не добавлять избыточное количество данного денитратора. 3)Температура минерализата должна быть равной 110-130С (поэтому более, чем в 2 раза разбавлять минерализат водой нельзя).Денитрацию следует проводить по следующим причинам: 1)В присутствии азотной к-ты возможна частичная потеря катионов Ва и Pb за счет образования растворимых в воде Pb(NO3)2 и Ва(NO3)2. Это недоступно, т.к. их обнаружение основано на выделении в виде нерастворимых в воде сульфатов. 2)Невозможность доказать присутствие тех ионов металлов, обнаружение которых основанных на реакциях восстановления.Например: H3AsO4 + 8H → AsO3↑ + 4H2O 3)Окислению будут подвергаться некоторые реактивы, применяемые в дробном методе анализа.Для проверки полноты денитрации минерализатов проводят реакцию с раствором дифениламина (0,5 г дифениламина растворяют в 100 г концентрированной серной кислоты и прибавляют 20 мл дистиллированной воды). При наличии азотной, азотистой кислот или оксидов азота в минерализате появляется синяя окраска. Эта реакция основана на окислении дифениламина азотной кислотой и продуктами ее разложения. Вначале при окислении дифениламина образуется бесцветный дифенилбензидин, при окислении которого образуется соединение, имеющее синюю окраску. Денитрация считается оконченной тогда, когда реакция минерализата с раствором дифениламина будет отрицательной. Если от прибавления раствора дифениламина к минерализату он окрашивается в синий цвет, то денитрацию проводят повторно. |
72.Дробный метод анализа. Требования,преимущества. Основоположником дробного метода анализа, применяемого в современной аналитической химии, является советский учёный Н. А. Тананаев. Большая заслуга в разработке методик дробного анализа «металлических ядов» и внедрении этих методик в практику химико-токсикологического анализа принадлежит А. Н. Крыловой и сотр. Дробный метод основан на применении реакций, с помощью которых в любой последовательности можно обнаружить искомые ионы в отдельных небольших порциях исследуемого раствора. Пользуясь дробным методом, отпадает необходимость выделения исследуемых ионов из растворов. Для обнаружения соответствующих ионов дробным методом необходимо применять специфические реактивы, позволяющие обнаружить искомый ион в присутствии посторонних ионов. Однако не всегда можно подобрать специфические реакции для обнаружения искомых ионов. В этих случаях в дробном анализе пользуются специальным приемом (маскировкой), с помощью которого устраняется влияние мешающих ионов. Обнаружение искомых ионов дробным методом производится в два этапа. Вначале устраняют влияние мешающих ионов с помощью соответствующих реактивов или их смесей, а затем прибавляют реактив, дающий окраску или осадок с искомым ионом. Преимущества дробного анализа: - быстрота выполнения, так как сокращается время на длительные операции последовательного отделения одних ионов от других; - дробные реакции легко воспроизводимы, т.е. их можно повторять несколько раз. Однако в случае трудности подбора селективных (специфических) реакций обнаружения ионов, маскирующих реагентов, расчета полноты удаления ионов и других причин (сложность смеси) прибегают к выполнению систематического анализа.
|
73. Обнаружение и определение соединений бария при химико-токсикологических исследованиях, их токсикологическое значение. Применение и токсичность соединений бария. Растворимые соединения бария, поступившие в организм через пищевой канал, всасываются в желудке и вызывают отравление. Проникновению в кровь растворимых в воде соединений бария препятствуют находящиеся в желудке сульфаты некоторых металлов. При этом образуется нерастворимый сульфат бария, не проникающий в кровь из желудка. Соединения бария раздражают слизистые оболочки пищевого канала. При отравлениях соединениями бария может наступить перерождение печени. Смерть от соединений бария наступает в результате сердечно-сосудистой недостаточности. Исследование минерализатов на наличие бария. В ХТА для обнаружения соединений бария используется осадок BaSO 4, который может быть в минерализатах, полученных после разрушения биологического материала смесью серной и азотной кислот или смесью серной, азотной и хлорной кислот. Кроме осадка сульфата бария в минерализате может быть и осадок сульфата свинца. Исследование осадка сульфата бария производят после отделения его от осадка сульфата свинца. Для разделения этих осадков их обрабатывают горячим раствором ацетата аммония, подкисленным уксусной кислотой. Получившийся в реакции осадок используют для исследования его на наличие бария. 1)Перекристаллизация осадка сульфата бария. Часть исследуемого осадка наносят на предметное стекло и слегка подсушивают. прибавляют концентрированной серной кислоты и нагревают до появления белых паров SОз. При нагревании серная кислота не должна растекаться на предметном стекле. Если в осадке находится сульфат бария, то через 10—20 мин после охлаждения смеси на предметном стекле появляются бесцветные кристаллы, собранных в виде крестов. 2)Реакция восстановления сульфата бария. Обнаружение ионов бария в его соединениях. Объектами исследования на наличие бария могут быть не только органы трупов и биологические жидкости. 1)Реакция
с хроматом
калия.
При взаимодействии ионов
бария
с хроматами
образуется, светло-желтый осадок
хромата
бария,
растворимый в минеральных кислотах
и нерастворимый в уксусной
кислоте
В
связи с растворимостью
осадка хромата
бария
в минеральных кислотах
прибавляют ацетат
натрия:
Образовавшаяся при этой реакции уксусная кислота не растворяет осадка хромата бария. 2)Реакция с серной кислотой. От прибавления к ионам бария серной кислоты или растворимых в воде сульфатов выпадает белый осадок сульфата бария. Этой реакции мешают ионы стронция,которые в указанных условиях тоже дают белый осадок сульфата стронция, который не растворяется в кислотах. 3)Реакция с родизонатом натрия. Родизонат натрия с ионами бария образует красновато-коричневый осадок (реакцию выполняют на фильтровальной бумаге):Этой реакции мешают ионы стронция, которые с родизонатом натрия тоже образуют красновато-коричневый осадок. Однако осадок родизоната стронция растворяется в соляной кислоте, а осадок родизоната бария под влиянием указанной кислоты переходит в нерастворимую кислую соль, имеющую ярко-красную окраску. Количественное определение бария сульфата. 1)Весовой метод. 2)Объемный трилонометрический метод. Основан на обратном титровании
|

 эфедрин
эфедрин
 4-гидроксиметамфетами
4-гидроксиамфетамин
4-гидроксиметамфетами
4-гидроксиамфетамин
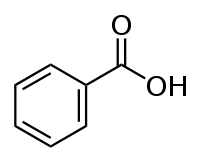 бензойная
кислота
бензойная
кислота
 Изолирование
производится слабоподкисленным
спиртом или подкисл водой. часть
антипирина экстрагируется из кислого
р-ра,но главная часть экстрагир
хлороформом из щелочной жидкости.
Антипирин прим-ся при невралгиях,
ревматизме, хорее, простудных и др.
Обладает болеутоляющим, жаропонижающим
и противовоспалительным действием.Уменьшает
проницаемость капилляров и препятствует
развитию воспалит процессов. Антипирин
при местном применении оказывает
кровоостанавливающее действие.
Обнаружение.
1.
Хлорид окисного железа
дает с остатаком из щелочного
хлороформного извлечения кроваво-красное
окрашивание, обусловленное образованием
комплекса феррипина:
Изолирование
производится слабоподкисленным
спиртом или подкисл водой. часть
антипирина экстрагируется из кислого
р-ра,но главная часть экстрагир
хлороформом из щелочной жидкости.
Антипирин прим-ся при невралгиях,
ревматизме, хорее, простудных и др.
Обладает болеутоляющим, жаропонижающим
и противовоспалительным действием.Уменьшает
проницаемость капилляров и препятствует
развитию воспалит процессов. Антипирин
при местном применении оказывает
кровоостанавливающее действие.
Обнаружение.
1.
Хлорид окисного железа
дает с остатаком из щелочного
хлороформного извлечения кроваво-красное
окрашивание, обусловленное образованием
комплекса феррипина:
