
5 курс / Пульмонология и фтизиатрия / Чучалин_А_Г_Респираторная_медицина_т_1_2017
.pdf
Раздел 2
вого пространства). Гиповентиляция всегда приводит к артериальной гипоксемии (за исключением случаев, когда пациент дышит обогащенной кислородной смесью) и повышению артериального PCO2.
Среди причин гиповентиляции могут быть угнетение дыхательного центра различными препаратами (производные морфина, барбитураты); аномалии проводящих путей спинного мозга; поражения клеток передних рогов спинного мозга (полиомиелит); поражение иннервации респираторных мышц (синдром Гийена–Барре); болезни нейромышечного узла (миастения); поражения собственно респираторных мышц (прогрессирующая мышечная дистрофия); аномалии и травмы грудной клетки; обструкция верхних дыхательных путей; ожирение и другие причины.
Можно заметить, что при всех этих состояниях сами легкие в норме. Эти причины необходимо отделить от тех ситуаций, когда накопление углекислоты связано с хроническим легочным заболеванием. В этом случае основным фактором, приводящим к повышению PCO2, является ВПН, служащая причиной неэффективности легочного газообмена.
Повышение альвеолярного PCO2 как результат гиповентиляции может быть рассчитан с применением уравнения альвеолярной вентиляции:
· |
· |
|
|
VCO2 |
|
|
|
VA = |
|
×K, |
(1) |
PACO |
|||
|
2 |
|
|
где К — константа. Уравнение можно преобразовать следующим образом:
|
|
· |
|
|
|
P |
= |
VCO2 |
×K. |
(2) |
|
· |
|||||
ACO2 |
|
|
|
||
|
|
VA |
|
|
Поскольку в нормальных легких альвеолярная (PACO2) и артериальная (PaCO2) идентичны, то можно написать:
|
|
· |
|
|
|
P |
= |
VCO2 |
× K. |
(3) |
|
· |
|||||
aCO2 |
|
|
|
||
|
|
VA |
|
|
Это очень важное уравнение, обозначающее, что уровень PCO2 в альвеолярном газе и артериальной крови находится в обратной зависимости от альвеолярной вентиляции. Например, если альвеолярная вентиляция снижается вдвое, то PCO2, напротив, удваивается.
Те же принципы, использованные в уравнении (1), могут быть использованы по отношению к кислороду для понимания влияния гиповентиляции на альвеолярное (а следовательно, и артериальное) PO2:
· |
· |
· |
(4) |
VO2 |
= VI ×FIO2 |
− VA × FAO2, |
где · — инспираторная альвеолярная вентиля- VI
ция. Уравнение (4) выражает потребление кислорода, как разницу между количеством кислорода,
вдыхаемом в течение минуты (объем вдыхаемого газа × фракционную концентрацию кислорода) и выдыхаемом в течение минуты (объем альвеолярной концентрации и фракционная концентрация кислорода в альвеолярном газе).
Если посмотреть с практической точки зрения, то значение гипоксемии не столь велико по сравнению с задержкой углекислоты и последующим респираторным ацидозом. Это показано на рис. 2.7, где представлены изменения газообмена, наступающие в результате гиповентиляции. Видно, что при тяжелой гиповентиляции альвеолярное PCO2 удваивается от 40 до 80 мм рт.ст., в то время как альвеолярное PO2 снижается от 10 до 60 мм рт.ст. Хотя артериальное PO2, вероятно, будет незначительно ниже альвеолярного, тем не менее насыщение артериальной крови кислородом будет составлять около 80%. Вместе с тем развивается выраженный респираторный ацидоз — уровень артериального рН около 7,2. Это показывает еще раз, что гипоксемия играет меньшую роль, чем накопление углекислоты и респираторный ацидоз при чистой гиповентиляции.
2 |
|
CO сатурация |
ый |
 CO2
CO2 

Норма
Рис. 2.7. Газообмен при гиповентиляции. Отмечается относительно большой подъем PCO2 и соответствующее падение рН по сравнению со средней степенью падения насыщения кислорода артериальной крови (West J.B. Pulmonary Pathophysiology — The Essentials. 8th ed. Baltimore, Lippincott Williams & Wilkins, 2013)
Диффузионное ограничение
Поскольку кислород, углекислота и другие газы пересекают альвеолярно-капиллярный барьер путем простой диффузии, то происходит это в соответствии с законом Фика, согласно которому скорость переноса газа через слой ткани прямо пропорционален площади ткани (А) и разнице парциальных давлений по обе стороны
60

|
|
|
|
Респираторная физиология |
||||
от нее (Р1–Р2) и обратно пропорционален ее |
|
PO2 |
|
|
|
|||
толщине (Т): |
|
|
|
|
|
|
||
A |
|
|
|
|
|
|
||
|
(5) |
|
|
|
|
|
||
Vgas = |
T ×D(P1−P2). |
|
|
|
|
|
||
Как было отмечено ранее, площадь альвео- |
|
|
|
|
|
|||
лярно-капиллярного барьера легких огромна |
|
|
|
|
|
|||
(50–100 м2), а толщина некоторых составляет ме- |
|
|
|
|
|
|||
нее 0,3 микрон. Таким образом, характеристики |
|
|
|
|
|
|||
альвеолярно-капиллярной мембраны идеальны |
|
|
|
|
|
|||
для осуществления диффузии. |
|
|
|
|
|
|
||
Скорость диффузии также пропорциональна |
|
|
|
|
|
|||
константе D, которая зависит от свойств ткани и |
2 |
|
|
|
|
|||
газа. Константа пропорциональна растворимости |
PO |
|
|
|
|
|||
газа (Sol) и обратно пропорциональна корню ква- |
|
|
|
|
|
|||
дратному из молекулярного веса (MW): |
|
PO2 |
|
|
|
|
||
|
Sol . |
(6) |
|
|
|
|
|
|
D = MW |
|
|
|
|
|
|
||
Это означает, что углекислота диффундирует |
|
|
|
|
|
|||
примерно в 20 раз быстрее кислорода через тка- |
|
|
|
|
|
|||
невые слои, так как CO2 обладает значительно |
|
|
|
|
|
|||
большей растворимостью (24:1 при 37 °С), а корни |
|
|
|
|
|
|||
квадратные из молекулярного веса для обоих газов |
|
|
|
|
|
|||
отличаются незначительно (1,17:1). Необходимо |
|
|
|
|
|
|||
отметить, что эти расчеты справедливы только для |
|
|
|
|
|
|||
тканевых мембран, а не для процессов потребле- |
|
|
|
|
|
|||
ния кислорода или выработки углекислоты легки- |
Рис. 2.8. Временные характеристики изменения PO2 в ле- |
|||||||
ми, в которых большую роль играют и скорости |
||||||||
химических реакций. |
|
|
гочных капиллярах при нормальной диффузии, сокращен- |
|||||
|
|
ном времени контакта и утолщенной альвеолярно-капил- |
||||||
На рис. 2.8 демонстрируются изменения PO2 |
||||||||
лярной мембране. Временные характеристики окиси угле- |
||||||||
крови в легочных капиллярах в норме. Расчеты |
рода представлены нижней кривой (West J.B. Pulmonary |
|||||||
основаны на законе Фика (уравнение (5)) и допу- |
Pathophysiology — The Essentials. 8th ed. Baltimore: Lippin- |
|||||||
щении, что диффузионные характеристики альве- |
cott Williams & Wilkins, 2013) |
|
|
|
||||
олярно-капиллярного барьера однородны по всей |
Скорость связывания кислорода с кровью до- |
|||||||
длине капилляра. Показано, что время, в течение |
||||||||
которого кровь находится в легочных капиллярах в |
вольно высока (около 0,2 с) и проходит 2 стадии: |
|||||||
норме в состоянии покоя, составляет около 0,75 с. |
1-я — диффузия кислорода через альвеолярно-ка- |
|||||||
Если альвеолярно-капиллярный барьер утол- |
пиллярный барьер, плазму и внутрь эритроцита; |
|||||||
щается, то скорость переноса кислорода снижа- |
2-я — реакция кислорода с гемоглобином. Хотя |
|||||||
ется в соответствии с законом Фика, и скорость |
на первый взгляд эти процессы существенно раз- |
|||||||
повышения PO2 замедляется. В этих условиях |
личаются, тем не менее их можно описать мате- |
|||||||
может развиться разница PO2 альвеолярного и |
матически одним уравнением Roughton–Forster: |
|||||||
конечно-капиллярного барьера. Это означает, что |
1 |
1 |
1 |
, |
(7) |
|||
существует некоторое диффузионное ограничение |
= |
+ |
θ ×Vc |
|||||
переноса кислорода. Важно отметить, что в боль- |
DL |
DM |
|
|
||||
где DL — диффузионная способность легких; |
||||||||
шинстве случаев перенос кислорода ограничива- |
||||||||
ется перфузией и только в редких случаях может |
DM — диффузионная способность мембраны |
|||||||
быть некоторое диффузионное ограничение. |
|
(включающая в себя плазму и внутреннюю часть |
||||||
Для такого газа, как кислород, форма кривой |
эритроцита), θ — скорость реакции кислорода |
|||||||
диссоциации непостоянна и зависит от PO2 и |
(или CO2) с гемоглобином (на 1 мл крови) и Vc — |
|||||||
в меньшей степени от таких факторов, как рН, |
объем крови в легочных капиллярах. |
|
||||||
PCO2, температура и концентрации в эритроцитах |
В здоровом легком диффузионное сопротив- |
|||||||
2,3-дифосфоглицерата. |
|
ление мембранного компонента и компонентов, |
||||||
Физиологически инертные газы, такие как азот, |
участвующих в химической реакции, приблизи- |
|||||||
полностью перфузионно ограничены в переносе, в |
тельно одинаково. Окись углерода используется в |
|||||||
то время как перенос окиси углерода через мембрану |
качестве газа для измерения диффузионной спо- |
|||||||
является преимущественно лимитированным диф- |
собности легочной ткани, потому что его перенос |
|||||||
фузией. Количество окиси углерода, захватываемого |
через альвеолярно-капиллярный барьер — процесс |
|||||||
кровью, полностью зависит от диффузионной спо- |
практически полностью диффузионно-ограничен- |
|||||||
собности альвеолярно-капиллярного барьера. |
|
ный. И хотя нас в большей степени интересует |
||||||
|
|
|
|
|
|
|
61 |
|

Раздел 2
диффузия кислорода, диффузионное ограничение этого газа в большей степени обусловлено перфузией при нормоксии и частично диффузией при гипоксии. По этой причине измерения с использованием кислорода трудно интерпретировать, хотя предлагаются методики с использованием изотопов кислорода.
Как было сказано выше, в соответствии с законом Фика количество газа, переносимого через тканевую мембрану, пропорционально площади, диффузионной константе и разнице парциальных давлений и обратно пропорционально толщине мембраны:
· |
A |
|
|
Vgas = |
|
×D×(P1−P2), |
(8) |
|
|||
|
T |
|
|
где А — площадь мембраны; Т — толщина мембраны; D — диффузионная константа.
В реальности легкое является столь сложным органом, что определить площадь и толщину альвеолярно-капиллярного барьера при жизни не представляется возможным. Поэтому вместо этих трех переменных, определяющих объем переносимого газа, можно ввести константу DL:
· |
(9) |
Vgas = DL×(P1−P2), |
где DL — это диффузионная способность легких, показатель, включающий в себя площадь, толщину и диффузионные свойства тканевой мембраны, а также диффузионные свойства газа. Тогда DL для углекислоты может быть рассчитана:
·
DL = VCO , (10) (P1−P2)
где Р1и Р2 — парциальные давления CO в альвеолярном газе и капиллярной крови соответственно.
Поскольку парциальное давление CO в капиллярной крови очень низкое (см. рис. 2.8), то им можно пренебречь. В этом случае уравнение принимает следующий вид:
·
DL = VCO . (11)
PACO
Таким образом, DL для CO — это переносимый объем CO, выраженный в миллилитрах в 1 мин на 1 мм рт.ст. альвеолярного парциального напряжения CO.
Существует несколько способов измерения диффузионной способности легких (ДСЛ) для CO. При выполнении методики одиночного вдоха выполняется вдох смеси, содержащей 0,3% CO, и рассчитывается скорость исчезновения монооксида углерода из альвеолярного газа при 10-секундной задержке дыхания. Расчет производится на основании измерения вдыхаемой и выдыхаемой концентраций CO с помощью инфракрасного датчика. По окончании
периода задержки дыхания проба альвеолярного газа анализируется (первые 750 мл, представляющие собой объем газа мертвого пространства исключаются из анализа). Газовая смесь помимо CO также содержит гелий для измерения легочного объема дилюционным методом. При использовании данного метода уравнение принимает следующий вид:
|
|
|
× K |
|
|
F |
|
× |
F |
|
|
|
|
|
|
DL = |
V |
A |
|
|
I |
A |
He |
|
, |
(12) |
|||||
|
|
log |
e |
|
|
CO |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
t |
FI |
× FA |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
He |
|
|
CO |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
где VA — альвеолярный объем в литрах, t — время задержки дыхания в секундах, К — константа, также в уравнении представлены соответствующе обозначенные фракционные концентрации CO и гелия во вдыхаемом и выдыхаемом воздухе.
DL может быть также измерена методом устойчивого состояния. При этом исследуемый дышит низкими концентрациями CO (около 0,1%) примерно около полминуты, до тех пор пока не будет достигнуто устойчивое состояние газообмена. Затем измеряется константа скорости исчезновения CO из альвеолярного газа. Эта методика лучше подходит для измерения во время нагрузки, когда тест с задержкой дыхания применить невозможно. Должные величины диффузионной способности для CO (как и для большинства легочных функциональных тестов) зависят от пола, возраста, роста.
Шунт
Понятием «шунт» обозначается попадание крови в системный артериальный кровоток без прохождения через вентилируемые отделы легких. Даже в норме может отмечаться некоторое снижение артериального PO2 как результат влияния этого фактора. Например, часть кровотока из бронхиальных артерий попадает в легочные вены. Поскольку концентрация кислорода в этой крови снижена, то ее смешивание с кровотоком из легочных капилляров приводит к снижению артериального PO2.
При легочных заболеваниях возможно отсутствие вентиляции в газообменных участках вследствие бронхиальной обструкции, ателектаза или заполнения альвеол жидкостью или клетками. Кровь, протекающая через эти участки, формирует шунт.
Когда причиной шунта является добавление смешанной венозной крови (легочной артериальной) к крови из капилляров (легочной венозной), то можно измерить объем шунтирования. Общее количество кислорода, покидающего систему, равняется общему кровотоку (QT), умноженному на концентрацию кислорода в системном артериальном кровотоке (CaO2), или QT × CaO2. Это должно равняться сумме количества кислорода в шунтовой крови (QS × CVO2) и конечно-капил- лярной крови (QT – QS) × CcO2. Таким образом:
· |
|
|
|
· |
|
|
|
|
· |
|
· |
|
|
. (13) |
|
×Ca |
|
|
× Cv |
|
|
|
|
||||||
Q |
T |
O2 |
= (Q |
O2 |
)+(Q |
T |
−Q )×Ccœ |
|||||||
|
|
|
S |
|
|
|
|
S |
O2 |
|
||||
62

Респираторная физиология
Преобразование этого уравнения дает:
· |
(Ccœ |
|
− Ca |
O |
|
) |
|
|
|
Q |
O |
2 |
|
2 |
|
|
|
||
S |
= |
|
|
|
|
. |
(14) |
||
· |
|
|
|
|
|
|
|||
QT |
(CcœO2 |
− Cv |
O2 ) |
|
|||||
Концентрация кислорода конечно-капилляр- ной крови обычно рассчитывается из альвеолярной PO2 и концентрации гемоглобина, допуская, что насыщение оксигемоглобина составляет 100%.
Когда причиной шунта становится поступление крови, которая имеет иную концентрацию кислорода, чем смешанная венозная кровь, то в этом случае рассчитать его величину невозможно.
Важная диагностическая характеристика шунта — артериальное PO2 не повышается до нормального уровня при назначении пациенту 100% кислорода. Причиной этого является то, что шунтируемая кровь минует вентилируемые альвеолы и не вступает в контакт с высоким альвеолярным PO2. Его смешивание с конеч- но-капиллярной кровью способствует снижению артериальной PO2.
Назначение 100% кислорода пациенту с шунтом — очень чувствительный метод определения незначительного шунта.
У пациента с шунтом обычно не отмечается повышенного PCO2 в артериальной крови, несмотря на то что шунтируемая кровь богата двуокисью углерода. Это происходит вследствие того, что хеморецепторы регистрируют любое повышение CO2 и реагируют на это повышением вентиляции.
Вентиляционно-перфузионные отношения
Хорошо известно, что несоответствие вентиляции и кровотока является одной из основных причин гипоксемии. Взаимоотношения вентиляции, кровотока и газообмена зависят от кривых диссоциации кислорода и углекислоты, которые не только имеют нелинейный характер, но и взаимозависимы.
Новые возможности цифровых технологий позволили усовершенствовать анализ кривых диссоциации кислорода и углекислого газа. Были проанализированы поведение и распределение ВПО
ипредставлена множественная элиминационная техника инертных газов, которая впервые позволила получить информацию о дисперсии, режимах
иформе распределения.
Газообмен отдельной легочной единицы
PO2, PCO2 и PN2 любой газообменной единицы легкого в разной степени определяется тремя основными факторами:
•вентиляционно-перфузионным отношением;
•смешиванием вдыхаемого газа и композицией смешанной венозной крови;
•наклоном и позицией релевантных кривых диссоциаций кровь–газ.
Формально ключевая роль ВПО может быть выражена следующим образом. Количество углекислоты, поступающей в окружающий воздух из
альвеолярного газа в 1 мин, может быть получено путем преобразования уравнения (3):
|
|
× K, |
(15) |
VCO2 |
= VA ×PA |
||
|
|
CO2 |
|
где VCO2 — продукция углекислоты, Va — альвеолярная вентиляция, К — константа при условии, что CO2 отсутствует во вдыхаемом воздухе.
Количество углекислоты, поступающей в альвеолярный газ из капилляров в 1 мин, рассчитывается следующим образом:
|
|
|
|
|
− Ccœ ), |
(16) |
|
|
|
||||
V |
= Q(Cv |
CO2 |
||||
|
CO2 |
|
|
O2 |
|
|
где Q — кровоток, а Cvo2 и Ccco2 — концентрации CO2 в смешанной венозной и конечно-капилляр- ной крови соответственно. Далее в устойчивом состоянии количество углекислоты, утилизируемой из альвеол и из капилляров, должно быть одинаковым:
|
|
× P |
|
|
|
|
|
− Ccœ ) или |
||
|
|
|
|
|
||||||
V |
A |
× K= Q(Cv |
||||||||
|
ACO |
|
|
|
|
|
CO2 |
O2 |
||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
(Cv |
CO2 |
− Ccœ ) |
(17) |
||
|
|
|
VA |
= |
|
|
|
O2 |
×K. |
|
|
|
|
|
|
PACO2 |
|||||
|
|
|
Q |
|
|
|
||||
Таким образом, альвеолярное Рсо2 (и соответствующая конечно-капиллярная концентрация, допуская, что конечно-капиллярное и альвеолярное Рсо2 идентичны) определяется следующими факторами: ВПО, концентрацией CO2 в смешанной венозной крови и кривой диссоциации углекислоты, описывающей отношение PCO2 к концентрации углекислоты.
В контексте альвеолярного вентиляционного соотношения и углекислота, и кислород могут быть описаны похожими уравнениями:
|
|
(Ccœ |
|
− Cv |
O2 |
) |
|
|
|
VA |
=K× |
O2 |
|
|
|
. |
(18) |
||
|
(PI |
− PA |
|
|
) |
||||
Q |
|
O2 |
|
|
|||||
|
|
O2 |
|
|
|
|
|
||
Так же как и для CO2, допускается, что для кислорода альвеолярное и конечно-капиллярное PO2 идентичны, учитывая диффузионное равновесие по обе стороны альвеолярно-капиллярной мембраны. Альвеолярное PO2 также определяется тремя основными факторами: ВПО, уровнем кислорода во вдыхаемом воздухе и смешанной венозной крови и соотношением PO2 и концентрации кислорода (кривая диссоциации кислорода).
Графический анализ этих взаимоотношений осуществляется с использованием диаграммы O2– CO2, на которой показатели PO2 представлены на горизонтальной оси, а PCO2 — на вертикальной. Диаграмма использовалась для решения многих проблем, связанных с вентиляционно-перфузион- ными отношениями.
Очень важно иметь в виду топографическую неравномерность газообмена, которая отмечается
63

Раздел 2
вздоровом легком в вертикальном положении как результат вентиляционно-перфузионной неравномерности. Вентиляция и кровоток на единицу объема снижаются в верхних отделах по сравнению с нижними. Изменение кровотока более выражены, чем изменения вентиляции. И как следствие, вентиляционно-перфузионное отношение повышается от более низкого уровня в базальных отделах до более высокого — в апикальных.
Поскольку ВПО определяют газообмен, то PO2 повышается примерно на 40 мм рт.ст. от осно-
вания к верхушке легкого, в то время как PCO2 падает примерно на 14 мм рт.ст. Показатель рН
вобласти верхушек более высокий из-за низко-
го уровня PCO2. Очень малая часть потребления кислорода происходит в апикальных отделах из-за низкого кровотока.
Данные, представленные на рис. 2.9, демонстрируют показатели вентиляции, кровотока и ВПО на всех 9 уровнях от верхушек до апикальных отделов, которые могут рассматриваться как частотное распределение вентиляционно-пер- фузионных отношений. Показано, что большая часть кровотока поступает в базальные отделы, но напряжение (PO2) и концентрация кислорода
вконечно-капиллярной крови в этих отделах наиболее низкая. В результате к легочной венозной крови (системной артериальной) примешивается менее оксигенированная кровь из базальных отделов и снижается артериальное PO2.
Рис. 2.9. Региональные различия газообмена в легких в вертикальном положении. Легкое делится на 9 воображаемых зон (Q — кровоток, Vol — объем, VA — поток газа). (West J.B. Respiratory Physiology — The Essentials. 9th ed. Baltimore: Lippincott Williams & Wilkins, 2012)
Традиционное измерение вентиляционноперфузионной неравномерности
Традиционными критериями ВПО являются показатели PO2 и PCO2 в артериальной крови и выдыхаемом воздухе. Артериальное PO2 конечно же дает некоторую информацию о степени ВПН. В целом чем ниже PO2, тем более выражено несоответствие вентиляции и кровотока. Основное достоинство этого измерения — простота. Недостаток же этого метода — высокая чувствительность к общей вентиляции и легочному кровотоку.
Вследствие этих ограничений часто приходится оценивать альвеолярно-артериальную разницу по PO2 (напряжению кислорода). Эта величина является более информативной, чем артериальное PO2, так как менее чувствительна к уровню общей вентиляции. Для понимания важности этого измерения необходимо более детально рассмотреть то, как газообмен изменяется при появлении ВПН.
На рис. 2.10 показана диаграмма взаимозависимости напряжений кислорода и углекислоты. Что происходит при появлении вентиляци- онно-перфузионного несоответствия? Обе точки, и альвеолярная, и артериальная, отдаляются от идеальной точки (i). Чем больше ВПН, тем дальше расходятся эти точки. Кроме того, тип ВПН определяет то, как далеко будет каждая точка двигаться. Например, поддержание высокого уровня вентиляции в отделах с высоким ВПО приведет к смещению точки А вниз и вправо от идеальной точки i. При поддержании высокого кровотока в легочных отделах с низким вентиляционно-пер- фузионным отношением точка а смещается влево в сторону от идеальной точки по R-линии.
Понятно, что горизонтальная дистанция между альвеолярной и артериальной точками (т.е. смешанная альвеолярно-артериальная разница по PO2) является важным критерием степени ВПН. К сожалению, этот показатель практически невозможно получить у большинства пациентов, так как точка А обозначает композицию смешанного
2 |
|
CO |
А |
|
R-линия газа |
 O2
O2


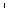
Рис. 2.10. Диаграмма взаимозависимости кислорода и углекислоты, где представлены точки для идеального газа (i), артериальной крови (a) и альвеолярного газа (A). R-линии — отношение респираторного обмена
64

Респираторная физиология
выдыхаемого газа за исключением газа анатомического мертвого пространства. При большинстве легочных заболеваний пораженные альвеолы опустошаются последовательно. Наименее плохо вентилируемая альвеола опустошается последней. Таким образом, проба газа, полученная сразу после порции мертвого пространства, не будет репрезентативной в отношении всего смешанного выдыхаемого альвеолярного газа. Только у единичных пациентов, имеющих очень однородную вентиляцию, но неоднородный кровоток, этот индекс может быть использован. В этом случае PO2 конечно-экспираторного газа используется для оценки смешанного выдыхаемого альвеолярного газа.
Поскольку пробу смешанного выдыхаемого альвеолярного газа в большинстве случаев невозможно получить, то более важным индексом может считаться разница по PO2 между идеальным альвеолярным газом и артериальной кровью. Этот показатель рассчитывается как горизонтальная дистанция между точками i и a. Идеальное альвеолярное PO2 рассчитывается из следующего уравнения альвеолярного газа:
|
|
|
|
PaCO2 |
|
|
|
(1−R) |
|
|
PA |
|
= PI |
− |
|
+ Pa |
|
× FI × |
|
|
(19) |
O2 |
R |
CO2 |
|
|||||||
|
O2 |
|
|
O2 |
R |
|
||||
Использование этого уравнения предполагает, что PCO2 идеального альвеолярного газа такое же, как и PCO2 артериальной крови.
Физиологический шунт является другим важным индексом ВПН. Он показывает, что отклонение артериальной точки от идеальной по R-линии крови. Для расчета физиологического шунта представим, что все движение влево от артериальной точки обусловлено добавлением смешанной венозной крови — v к идеальной крови i. Такое допущение не является настолько неприемлемым, как это может показаться, так как из легочных отделов с очень низким ВПО поступает кровь, которая имеет в сущности такой же газовый состав, как и смешанная венозная кровь. Уравнение шунта, используемое в этом случае, будет выглядеть следующим образом:
|
(Ci |
O |
|
− Ca |
O |
|
) |
|
|
|
Q |
|
2 |
|
2 |
|
|
|
|||
PS |
= |
|
|
|
|
|
, |
(20) |
||
|
|
|
|
|
|
|
|
|||
QT |
(CiO2 |
− Cv |
O2 ) |
|
||||||
где Qps — физиологический шунт, QT — общий легочный кровоток, CiO2, CaO2 и CvO2 — соответственно концентрации кислорода идеальной, артериальной и смешанной венозной крови. Концентрация кислорода идеальной крови рассчитывается из идеальной PO2 и кривой диссоциации кислорода. Показатель физиологического шунта в норме должен составлять менее 0,05.
Еще одним традиционно используемым индексом служит физиологическое мертвое пространство [также известный как непроизводительная вентиляция (wasted ventilation)]. В то время как
физиологический шунт отражает количество кровотока, поступающего в участки легких с аномально низким ВПО, физиологическое мертвое пространство — напротив, показатель количества вентиляции, поступающей в участки с аномально высоким ВПО. Таким образом, оба эти индекса позволяют провести измерение обеих конечных точек спектра характеристик вентиляционно-пер- фузионных отношений.
Для расчета физиологического мертвого пространства представим, что все отклонение альвеолярной точки А от идеальной точки i обусловлено добавлением вдыхаемого газа I идеальному газу. Опять же, это не настолько некорректно, как это может показаться на первый взгляд, так как участки с очень высокими ВПО ведут себя очень похоже на точку I. Смешанный выдыхаемый газ содержит порцию из анатомического мертвого пространства, которая еще больше приближает состав этого газа к инспираторному (т.е. точке I). Уравнение Bohr поэтому используется в следующем виде:
|
|
V |
|
P |
− P |
|
|
|
|
|
|
Dphys |
|
aCO |
ECO |
|
|
||
|
|
|
= |
|
2 |
2 |
, |
(21) |
|
|
|
VT |
PaCO |
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
2 |
|
|
|
|
где V |
— физиологическое мертвое простран- |
||||||||
Dphys |
— дыхательный объем, P |
|
— сме- |
||||||
ство, V |
ECO |
||||||||
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
шанное PCO2 в выдыхаемом воздухе. Мы сно- |
|||||||||
ва используем факт, |
что |
PCO2 |
идеального газа |
||||||
иартериальной крови практически одинаковы. Показатель физиологического мертвого пространства очень чувствителен к дыхательному объему из-за большого вклада в последний анатомического мертвого пространства. В норме показатель физиологического мертвого пространства составляет менее 0,3.
Краткое описание и анализ концепции ВПН, приведенный выше, еще иногда обозначается термином «трехкомпонентная модель», так как легкое, согласно этой концепции, делится на невентилируемый отдел (шунт), неперфузируемый отдел (мертвое пространство) и отдел, который нормально вентилируется и перфузируется (идеальный). Такая точка зрения на легкое пораженное патологическим процессом впервые была представлена Riley
иCournand и доказала свою ценность при рассмотрении эффектов несоответствия вентиляции и кровотока в клинических ситуациях. Однако трехкомпонентная модель не в полной мере отражает те процессы распределения вентиляции и перфузии, которые происходят в реальном легком.
Таким образом, газообмен в легком:
•осуществляется анатомическими образованиями и физиологическими механизмами, объединяющими вентиляцию с кровотоком;
•часто нарушается у пациентов с легочными заболеваниями вследствие гиповентиляции, диффузионных нарушений, шунтирования и несоответствия вентиляции и перфузии;
65

Раздел 2
•осуществляется для доставки кислорода в количестве, достаточном для поддержания метаболических потребностей организма и удаления углекислоты, образующейся в результате метаболических процессов.
Список литературы
См. 
2.2. Механика дыхания
А.В. Черняк, С.Н. Авдеев, З.Р. Айсанов
Перемещение воздуха в альвеолы и обратно (легочную вентиляцию) можно описать физическими законами, которые рассматривают изменение давления, объема и воздушного потока в дыхательной системе. Изучением этих взаимоотношений занимается область физиологии, которую называют «механикой дыхания». При этом активной силой, обеспечивающей легочную вентиляцию, является сокращение дыхательных мышц, тогда как движение легких совершается пассивно. Силы, развиваемые дыхательными мышцами, приводят к изменению объема легких. Однако легочная
вентиляция определяется не только силой мышечного сокращения, но и эластичностью легких и стенок грудной клетки, сопротивлением дыхательных путей и инерционным сопротивлением, которое при нормальной ЧД составляет примерно 5% общего сопротивления, поэтому в механике дыхания его обычно не учитывают.
Дыхательные мышцы
Анатомия и физиология дыхательных мышц
Дыхательные мышцы относятся к скелетной поперечнополосатой мускулатуре и по своему гистологическому строению практически не отличаются от других скелетных мышц, например мышц конечностей [1–3]. В зависимости от функции, дыхательные мышцы делят на инспираторные (основные и вспомогательные) и экспираторные (рис. 2.11). Основную инспираторную группу мышц составляют диафрагма, наружные межреберные и межхрящевые мышцы, к вспомогательным относятся лестничные, грудино-клю- чично-сосцевидные, трапециевидные, большие и малые грудные мышцы. Экспираторную группу составляют абдоминальные (внутренняя и наруж-
а |
б |
в |
Рис. 2.11. Дыхательные мышцы: а — глубокий вдох. При движении диафрагмы вниз грудная клетка увеличивает свой объем. Одновременно это движение вниз вызывает поднятие нижних краев ребер, что существенно расширяет пространство грудной клетки. Активизируются наружные межреберные мышцы и мышцы шеи (лестничные и грудино-ключично-сосце- видные); б — сокращение наружных межреберных мышц влияет с равной силой на соседние ребра, однако поворотный момент в большей степени приходится на нижние ребра (более длинное плечо рычага), чем на верхние. Поэтому ребра поднимаются и смещаются вперед, диаметр грудной клетки увеличивается как в переднезаднем, так и в боковом направлениях. Внутренние межреберные мышцы действуют антагонистически по отношению к наружным межреберным мышцам; в — глубокий выдох. При сокращении абдоминальных мышц диафрагма поднимается вверх, объем грудной клетки уменьшается. В активном выдохе также участвуют внутренние межреберные мышцы (рисунок взят из книги «Атлас по физиологии. Учебное пособие в 2 томах». Камкин А.Г., Киселева И.С. М. ГЭОТАР-Медиа. 2013) [5]
66

Респираторная физиология
ная косые, прямая и поперечная мышцы живота) и внутренние межреберные мышцы.
Диафрагма — куполообразная скелетная мышца, разделяющая грудную и брюшную полости. При сокращении диафрагмы органы брюшной полости смещаются вниз и вперед и вертикальные размеры грудной полости возрастают. Кроме того, при этом поднимаются и расходятся ребра, приводя к увеличению поперечного размера грудной полости (рис. 2.11, а). При спокойном дыхании диафрагма является единственной активной инспираторной мышцей и ее купол опускается примерно на 1–1,5 см. Повышенный тонус наружных межреберных мышц служит исключительно для стабилизации стенки грудной клетки. При глубоком форсированном дыхании, например при физической нагрузке, увеличивается амплитуда движений диафрагмы (экскурсия может достигать 10 см) и активизируются наружные межреберные
ивспомогательные мышцы [4]. Из вспомогательных мышц у человека наиболее значимыми являются лестничные и грудино-ключично-сосцевид- ные мышцы.
Наружные межреберные мышцы (см. рис. 2.11, а) соединяют соседние ребра. Их волокна ориентированы наклонно вниз и вперед от верхнего к нижнему ребру. При сокращении этих мышц ребра поднимаются и смещаются вперед, что приводит к увеличению объема грудной клетки в переднезаднем и боковом направлениях (рис. 2.11, б). Так же действуют
имежхрящевые мышцы.
Лестничные и грудино-ключично-сосцевидные мышцы при спокойном дыхании практически не задействованы, однако включаются при увеличении легочной вентиляции. При их сокращении (лестничные мышцы поднимают два верхних ребра, а вместе с ними грудину и реберную клетку; грудино-ключично-сосцевидные — поднимают I ребро и грудину) увеличивается объем грудной клетки.
В отличие от вдоха, выдох при спокойном дыхании происходит пассивно с помощью эластичных возвратных сил точно так же, как растянутая пружина сама возвращается в исходное положение. К началу выдоха инспираторные мышцы еще активны и обусловливают крайне «мягкое» возвращение объема грудной клетки и легких к исходному (так, тяжелый предмет осторожно ставят на пол, вместо того чтобы бросить). При физической нагрузке или при патологически осложненном дыхании выдох становится активным. Наиболее важными и сильными экспираторными мышцами являются абдоминальные мышцы, образующие переднебоковую стенку брюшной полости (рис. 2.11, в). При их сокращении повышается внутрибрюшное давление, диафрагма поднимается вверх, объем легких снижается, т.е. создается «запас» эластической энергии для облегчения последующего инспираторного усилия [6]. Диафрагма и мышцы живота действуют вместе, если должно быть создано
высокое внутрибрюшное давление, например, во время родов при потугах.
В активном выдохе также участвуют внутренние межреберные мышцы. При их сокращении ребра опускаются и объем грудной клетки уменьшается (см. рис. 2.16, в). Вместе с тем сокращение этих мышц способствует укреплению межреберных промежутков; в противном случае при напряжении мягкие ткани выпячивались бы через них.
Кроме того, экспираторные дыхательные мышцы играют важнейшую роль в таких физиологических процессах, как чиханье, кашель, рвота, дефекация.
Измерение силы дыхательных мышц
Сила, развиваемая дыхательными мышцами во время их сокращения, зависит от числа активированных волокон, частоты стимуляции, длины мышц во время стимуляции и степени свободы движения мышц. Все эти закономерности описываются соотношениями, общими для всех скелетных мышц: сила/частота, сила/длина
исила/скорость, при этом соотношение сила/ длина является наиболее важным. Максимальная сила достигается при оптимальной длине мышцы. Для дыхательных мышц изменение длины тесно связано с изменением объема легких.
Силу дыхательных мышц можно оценить опосредованно, измеряя создаваемое ими давление в результате волевой активации испытуемым или электрической/магнитной стимуляции диафрагмального нерва [7]. Наибольшее клиническое применение получил неинвазивный метод измерения максимального инспираторного (MIP, или PImax)
иэкспираторного (MEP, или PEmax) давления в ротовой полости [7]. Измерять давление в ротовой полости следует в течение квазистатических коротких (несколько секунд) максимальных инспираторных (проба Мюллера) и экспираторных (проба Вальсальвы) маневров.
Пробой Вальсальвы называют экспираторное усилие (т.е. попытка сильного выдоха) при закрытых дыхательных путях (при закрытом рте и зажатом носе). После спокойного выдоха величина давления, развиваемого дыхательными мышцами, может превышать 15 кПа. Генерируемое давление тем выше, чем больше объем легких.
При пробе Мюллера оценивают максимальное инспираторное усилие (т.е. попытка осуществить вдох) при закрытых дыхательных путях, на уровне ФОЕ альвеолярное давление может быть снижено до –10 кПа. В отличие от экспираторного давления, величина инспираторного давления обратно пропорциональна объему легких.
Дисфункция дыхательных мышц
Нарушение функции дыхательной мускулатуры (дисфункции дыхательных мышц) условно подразделяют на утомление и слабость дыхательных мышц. Утомление дыхательных мышц — это
67

Раздел 2
состояние, при котором сила и скорость сокращения дыхательных мышц снижаются в результате их чрезмерной работы. Утомление — процесс обратимый, после отдыха функции дыхательных мышц могут восстановиться [8]. Причиной утомления дыхательных мышц является внезапное увеличение нагрузки на аппарат дыхания: повышение бронхиального сопротивления (резистивная нагрузка), снижение растяжимости легких или грудной клетки (эластичная нагрузка) [9, 10]. Утомление дыхательной мускулатуры в клинической практике (не в условиях эксперимента) практически всегда сопровождает критические состояния и при отсутствии своевременного отдыха дыхательных мышц (респираторной поддержки) может привести к остановке дыхания и гибели больного [11]. В клинических условиях утомление дыхательных мышц встречается у больных в отделениях интенсивной терапии, либо нуждающихся в проведении искусственной вентиляции легких (ИВЛ) [12], либо при неудачном «отлучении» от респиратора [11, 13].
Под слабостью дыхательной мускулатуры понимают состояние, при котором сила дыхательных мышц снижена даже в состоянии «покоя» [14]. Спектр заболеваний и состояний, при которых возникает слабость дыхательных мышц, чрезвычайно широк. В большинстве случаев причиной слабости дыхательной мускулатуры являются метаболические, воспалительные и дегенеративные изменения, приводящие к нарушению функции либо мышечных волокон, либо нервов, либо нейромышечных соединений. Многие причины слабости дыхательных мышц, за исключением очевидных (невропатии, мышечные дистрофии), часто упускаются из вида; например, слабость дыхательных мышц развивается при приеме ГК [15], кахексии [16], застойной сердечной недостаточности (ЗСН) [17]. Особой проблемой в настоящее время являются невропатии/миопатии критических состояний, которые сопровождаются генерализованной мышечной слабостью (в том числе и дыхательных мышц) более чем у 25% больных, получавших ИВЛ [18].
При ХОБЛ снижение силы дыхательных мышц связано с гиперинфляцией легких, которая ставит диафрагму в невыгодные условия. Во-первых, при гиперинфляции длина волокон диафрагмы укорачивается, и они смещаются на кривой «сила– длина» в менее выгодную позицию. Во-вторых, гиперинфляция меняет геометрию диафрагмы, которая уплощается, а следовательно, увеличивается радиус ее кривизны. В-третьих, при гиперинфляции уменьшается или даже практически исчезает зона аппозиции — область, где диафрагма прилегает к внутренней поверхности грудной клетки. Эта зона играет важную роль в растяжении диафрагмой нижних отделов грудной клетки во время вдоха [19].
Эластичность и растяжимость дыхательной системы
Легкие и грудная клетка обладают эластическими свойствами, которые можно исследовать с помощью кривых зависимости давления от объема (кривых «давление–объем») или кривых статического растяжения (изменения регистрируют при отсутствии воздушного потока в дыхательных путях).
Упрощенная модель легких представлена на рис. 2.12. Дыхательные мышцы изменяют объем грудной клетки и создают градиент давления (разница между давлением в альвеолах — альвеолярным или интрапульмональным давлением и давлением в ротовой полости), в результате чего происходит движение воздуха в дыхательных путях. Во время вдоха сокращение инспираторных мышц приводит к расширению грудной клетки. Легкие пассивно следуют за объемным приращением грудной клетки, в результате давление в альвеолах становится ниже атмосферного (отрицательным) и воздух заходит в легкие. На выдохе, напротив, объем легких уменьшается, давление в альвеолах становится выше атмосферного (положительным) и альвеолярный воздух выходит в окружающую среду. В конце вдоха и выдоха объем грудной полости прекращает изменяться и при открытой голосовой щели альвеолярное давление (PA) становится равным атмосферному (Pатм, т.е. PA = Pатм = 0), поток воздуха отсутствует. PA представляет собой сумму плеврального давления (Ppl) и давления, создаваемого эластической паренхимой легких, — давления эластической легочной тяги (Pel):
|
PA = Ppl + Pel. |
(1) |
|
Легкие |
Грудная |
Плевральная |
Мышцы |
|
стенка |
полость |
|
Рис. 2.12. Упрощенная модель легких. Легкие находятся в грудной клетке, объем которой изменяется вследствие движения поршня (дыхательные мышцы). При сокращении диафрагмы грудная клетка увеличивает свой объем, воздух заходит в легкие. Во время выдоха объем грудной клетки уменьшается и воздух через трахею выходит из легких. Легкие обладают эластичностью, которая определяет скорость выдоха и поддерживает бронхи открытыми
68

Респираторная физиология
Плевральное давление — давление в герметично замкнутой плевральной полости между висцеральными и париетальными листками плевры. Давление внутри плевральной полости зависит от эластичности легких и грудной клетки, усилий дыхательных мышц и процессов фильтрации и всасывания плевральной жидкости висцеральной и париетальной плеврами. Кроме того, под действием силы тяжести у здорового человека в положении стоя существует вертикальный градиент плеврального давления: наиболее отрицательное давление у верхушки легких и наименее отрицательное у основания. Это приводит к разнице давлений между апикальными и прилегающими к диафрагме базальными отделами легких и, соответственно, к разной воздухонаполненности легких. В положении лежа на спине или на боку градиент меньше и совсем отсутствует в вертикальном положении вниз головой. Плевральное давление может быть измерено манометром, соединенным с плевральной полостью полой иглой. В клинической практике часто применяют косвенный метод оценки величины плеврального давления — измеряют давление в пищеводе. Пищеводное давление регистрируют с помощью катетера с маленьким баллончиком на конце. Обычно измеряют давление в нижней трети пищевода для того, чтобы определить давление, необходимое для растяжения большей части легких. Изменения внутрипищеводного давления во время дыхания отражают изменения внутриплеврального давления.
В норме плевральное давление всегда ниже атмосферного во время вдоха, а во время выдоха может быть ниже, выше или равным атмосферному в зависимости от мышечного усилия. При ране-
нии стенки легкого или грудной клетки возникает пневмоторакс (нарушение герметичности грудной клетки и сообщение плевральной полости с окружающей средой): плевральное и атмосферное давление выравнивается, что приводит к спадению легкого и делает невозможной легочную вентиляцию.
Разница между альвеолярным и плевральным давлением называется транспульмональным давлением:
Ptp = PA – Ppl, |
(2) |
величина которого в соотношении с атмосферным давлением и является основным фактором, вызывающим движение воздуха в дыхательных путях.
В области контакта легких с диафрагмой давление называется трансдиафрагмальным (Ptd), оно рассчитывается как разница между внутрибрюшным (Pab) и плевральным давлением: Ptd = Pab – Ppl. Измерение трансдиафрагмального давления представляет собой наиболее точный способ оценки сократительной способности диафрагмы.
Эластичность и растяжимость легких
Механические свойства дыхательной системы можно описать с помощью понятий «эластичность» и «растяжимость». Легочная ткань обладает эластичностью, которая является основной силой, заставляющей воздух при выдохе выходить из легких. Эластичность также играет большую роль в поддержании просвета бронхов (рис. 2.13). В качестве модели легких рассмотрим эластичный баллон, например воздушный шарик. Чтобы наполнить шарик воздухом, необходимо, чтобы давление внутри
шарика (Pвнутр.) было выше, чем внешнее давление (Pвнеш.), т.е. создать градиент давления на его стен-
Рис. 2.13. Изменение давления и объема эластичного баллона. Слева наверху внутреннее давление
(Pвнутр.) повышается, в то время как внешнее давление (Pвнеш.) остается
атмосферным (Pатм). Справа навер-
ху Pвнеш. понижается, а Pвнутр. остается атмосферным. В обоих случаях
баллон расширяется, потому что трансмуральная разность давления увеличивается (рисунок из: Камкин А.Г., Киселева И.С. Атлас по физиологии: учебное пособие в 2 томах. М.: ГЭОТАР-Медиа, 2013 [5])
69
