
5 курс / Пульмонология и фтизиатрия / Респираторная_медицина_Руководство_в_3_томах_Том_1
.pdf
Раздел 2
ках. Этот градиент можно создать, или повышая давление внутри шарика (рис. 2.13, слева), или с помощью отрицательного давления вокруг шарика, поместив его в камеру, из которой воздух удален насосом (рис. 2.13, справа).
В обоих случаях наполнение шарика зависит только от разности давления на его стенках, т.е. от трансмуральной разности давления Pтрансмур.:
Pтрансмур. = Pвнутр. – Pвнеш. |
(3) |
Если по мере постепенного наполнения шари-
ка воздухом регистрировать Pтрансмур. и объем (V), то можно построить кривую зависимости давления
от объема (кривую «давление–объем») или кривую растяжения (рис. 2.14). Наклон этой кривой показывает, что при большом объеме шарика необходимо прогрессирующее увеличение прироста
трансмуральной разности давления (ΔPтрансмур.), чтобы получить заданное изменение объема (ΔV).
Изменение объема на единицу давления называется растяжимостью (С):
С = ΔV / ΔPтрансмур. |
(4) |
Обратная величина 1/C называется эластичностью (Е). Она представляет собой меру упругости и определяет способность ткани возвращаться после растяжения в исходное состояние (т.е. к первоначальному объему). Из рис. 2.14 следует, что с увеличением объема растяжимость уменьшается, а эластичность увеличивается.
Таким образом, объем заполнения воздушного шарика определяют эластичность его стенок и трансмуральная разность давления.
Более физиологичной моделью является изолированное легкое. Если изолированное легкое поместить в камеру и снизить давление в камере ниже атмосферного, то легкие расширятся, их объем можно будет измерить с помощью спирометра. Объем легких измеряют при разных уровнях давления в статических условиях при отсутствии потока и строят кривую «давление–объем» (рис. 2.15). Из этой кривой видно, что кривые для вдоха и для выдоха разные. Это различие между ними обозначается как гистерезис — свойство всех эластических структур, которое заключается в том, что для поддержания данного объема легкого во время его наполнения требуется большее транспульмональное давление, чем при спадении легкого. Кроме того, из рис. 2.15 видно, что кривые не исходят из начала координат. Это указывает на то, что даже при отсутствии растягивающего давления в легких содержится небольшое количество воздуха (подтверждением этому служит наличие воздуха в легких человека, извлеченных из грудной клетки при аутопсии).
Статическая растяжимость зависит от размеров легких. Легкое крупных размеров подвержено большим изменениям своего объема на единицу изменения давления, чем маленькое легкое.
Всвязи с этим применяют такой показатель, как удельная растяжимость — статическая растяжимость, отнесенная к единице объема легких.
Вклинической практике статическую растяжимость измеряют от уровня спокойного выдоха (ФОЕ) при увеличении объема на 500 мл. У здоровых взрослых людей она составляет величину около 0,2 л/см вод.ст. У детей аналогичный пока-
|
|
V |
|
P |
|
Объем, V |
C = |
V |
|
|
P |
|
Трансмуральная разность давления, P |
|
Рис. 2.14. Кривая «давление–объем» (кривая растяжения) эластичного баллона показывает, что отношение ΔV/ ΔPтрансмур., т.е. растяжимость, уменьшается с увеличением объема (рисунок из: Камкин А.Г., Киселева И.С. Атлас по физиологии: учебное пособие в 2 томах. М.: ГЭОТАР-Медиа, 2013 [5])
Рис. 2.15. Кривая зависимости объема от давления для изолированного легкого. Нижняя кривая образована во время ступенчатого наполнения, верхняя — ступенчатого спадения
70

Респираторная физиология
затель значительно ниже. При патологии статическая растяжимость может как повышаться, так и понижаться. При эмфиземе легких растяжимость повышается вследствие утраты эластической тяги [20]. При фиброзе легких, ЗСН, геморрагии легких происходит ее снижение [21].
Эластичность, а значит, и растяжимость легких определяют несколько факторов. Одним из них является содержание эластических структур в тканях (эластина и коллагена). Однако не только растяжимость отдельных эластичных волокон, но также их геометрическое расположение определяют эластичность легочной ткани. Это служит таким же принципом, который справедлив для стенок артерий.
Дополнительным фактором является ПН пленки жидкости, выстилающей альвеолы изнутри [22]. ПН жидкости — сила, возникающая на изогнутых пограничных поверхностях между жидкой и газообразной фазами и стремящаяся сократить поверхность альвеол до минимума, создавая положительное давление и обеспечивая спадение альвеол. Для расчета давления можно использовать закон Лапласа:
Pтрансмур.= |
2γ |
, |
(5) |
|
|||
|
r |
|
|
где Pтрансмур. — трансмуральная разность давления, r — радиус пузыря и γ — поверхностное натяжение
жидкости на пограничной поверхности.
Для воды γ имеет величину 0,072 Н×м–1. Следовательно, для одной альвеолы с радиусом в 48 мкм (48×10–6 м) трансмуральная разность давления оказалась бы равной 2×0,072 /(48×10–6) = 3000 Па = 3 кПа. Однако в состоянии равновесия дыхательной системы трансмуральная разность давления достигает только 0,5 кПа. Фактически существующее в легком ПН уменьшается благодаря сурфактанту — поверхностно-активному веществу, которое секретируется альвеолярными эпителиальными клетками II типа и выстилает альвеолярную поверхность.
Сурфактант состоит из ФЛ (85–90%) и белков (10%, половину из которых составляют четыре специфических для сурфактанта протеина: SP-A, SP-B, SP-C и SP-D), а также из небольшой части угольного гидрата. В жидкости, выстилающей альвеолярное пространство изнутри, сурфактант с помощью белка SP-A превращается в трубчатый миелин, а липидные и протеиновые части разделяются. Под действием белков SP-B и SP-C липиды располагаются в виде мономолекулярного слоя, обращенного в полость альвеолы липофильными участками. Активное поверхностное действие сурфактанта приписывается отталкивающим межмолекулярным силам этих липофильных частей. Иначе говоря, поскольку молекулы сурфактанта с одного конца гидрофобны, а с другого конца гидрофильны, действующие между ними силы молекулярного отталкивания противодействуют си-
лам притяжения между молекулами воды, которые обусловливают ПН. Кроме того, эта жидкостная пленка, выстилающая альвеолы, сглаживает неровности альвеолярной стенки.
В легких сурфактант выполняет важные физиологические функции [22]:
1)понижая ПН, увеличивает растяжимость легких и тем самым снижает совершаемую при вдохе работу;
2)обеспечивает стабильность альвеол, препятствуя их спадению и появлению ателектазов, и предотвращает перемещение воздуха из меньших альвеол внутрь больших в результате более выраженного снижения ПН при малых объемах;
3)препятствует транссудации жидкости на поверхность альвеол из плазмы капилляров легких.
Дефицит сурфактанта приводит к расстройствам дыхания, при отсутствии интенсивной терапии нередко вызывающим смерть (например, респираторный дистресс-синдром (РДС) новорожденных или острый РДС у взрослых).
Крепление каждой альвеолы друг с другом является еще одним фактором, определяющим эластичность легких. Альвеолы, стремясь к спадению, растягивают соседние альвеолы. Таким образом, коллапс имеющей меньший объем альвеолы предотвращается посредством эластической тяги (ретракции) окружающих альвеол, имеющих больший объем. Это эластичное взаимодействие в легочной ткани имеет большое значение для поддержания диаметра мелких бронхов (и сосудов). Уменьшение эластической ретракции альвеол может привести к сужению или коллапсу мелких дыхательных путей, что приводит к увеличению сопротивления дыхательных путей. Подобные изменения эластической ретракции легких происходят при эмфиземе легких.
Эластические свойства грудной клетки и дыхательной системы
Грудная стенка
Эластичными свойствами обладают не только легкие, но и грудная стенка, которая состоит из костей грудной клетки, межреберных мышц, подлежащих мягких тканей и париетальной плевры. Однако, в отличие от растяжимости легких, которая определяется пассивными структурными элементами и не зависит от напряжения дыхательных мышц, растяжимость мышц грудной клетки, как и любой другой скелетной мышцы, изменяется при напряжении. Следовательно, для измерения пассивной растяжимости грудной клетки необходимо, чтобы дыхательные мышцы не находились в состоянии напряжения. Способ измерения представлен на рис. 2.16. Кривые регистрируются при ненапряженной дыхательной мускулатуре и обозначаются как кривые растяжения покоя. После максимально глубокого выдоха [на уровне ОО легких (ООЛ)] эластическая
71
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 2
Рис. 2.16. Кривые «давление–объем» для легких, грудной клетки и дыхательной системы дыхания в целом. ОЕЛ — общая емкость легких; ФОЕ — функциональная остаточная емкость легких; ООЛ — остаточный объем легких. Кривая для системы дыхания равна графической сумме кривых для легких и грудной клетки
72
Респираторная физиология
тяга изолированной грудной стенки направлена наружу. По мере того как грудной объем увеличивается, направленная наружу эластическая тяга стенки снижается и падает до нуля при объеме грудной полости около 60% ЖЕЛ (см. рис. 2.16). При дальнейшем расширении грудной клетки до уровня ОЕЛ эластическая тяга ее стенки направляется внутрь. Растяжимость грудной клетки у здорового человека примерно соответствует растяжимости легких и равна 0,2 л/см вод.ст. Выраженное ожирение, обширный плевральный фиброз, кифосколиоз могут приводить к изменению растяжимости грудной клетки.
Дыхательная система
Легкие и грудная стенка функционально связаны посредством плевральной полости, в которой находится жидкость. Ее количество как раз достаточно, чтобы сделать возможным скольжение листков плевры относительно друг друга без трения. Поскольку жидкость нерастяжима, париетальный и висцеральный листки плевры (а в сущности, легкие и грудная клетка) сцепляются так же прочно, как два влажных стекла, которые легко передвигаются относительно друг друга, но с большим трудом могут быть разделены.
Из рис. 2.16 видно, что кривая растяжения покоя дыхательной системы в целом имеет S-образную форму (красная кривая), становится более плоской как в верхней, так и в нижней части. На уровне ОЕЛ эластическая тяга легких и грудной стенки суммируется, создавая большое давление всей дыхательной системы. На уровне ООЛ направленная наружу эластическая тяга грудной стенки значительно превосходит эластическую тягу легких, направленную внутрь. В результате в дыхательной системе возникает суммарное давление эластической тяги, направленное наружу. В конце спокойного выдоха (объем легких равен ФОЕ) эластическая тяга легких, направленная внутрь, уравновешена силой грудной клетки, направленной наружу. Таким образом, на уровне ФОЕ дыхательная система находится в равновесии. При этом плевральное давление (Ppl) отрицательно (около –0,5 кПа), а транспульмональное давление (Ptp), наоборот, положительное (+0,5 кПа). На уровне ФОЕ дыхательная система проявляет свою самую большую растяжимость.
Статическая растяжимость всей дыхательной системы наполовину меньше, чем растяжимость легких или растяжимость грудной клетки, и равна 0,1 л/см вод.ст.
Все изложенные выше рассуждения справедливы для статических условий, т.е. при отсутствии воздушного потока в дыхательных путях. При дыхании эти условия нарушаются. Поэтому при изучении механики дыхания необходимо учитывать свойства дыхательной системы, от которых зависит сопротивление воздушному потоку.
Сопротивление дыхательных путей
Перед тем как перейти к сопротивлению воздушному потоку, рассмотрим, каким может быть движение воздуха в трубке. Воздух проходит через трубку, если между ее концами существует перепад давлений (движущее давление). По аналогии с законом Ома для электричества объемная скорость потока (объем воздуха, проходящего за единицу времени, — Vœ) определяется давлением и сопротивлением:
R = |
P |
, |
(6) |
|
|||
|
Vœ |
|
|
где R — сопротивление, Vœ — объемная скорость потока, ΔР — движущее давление.
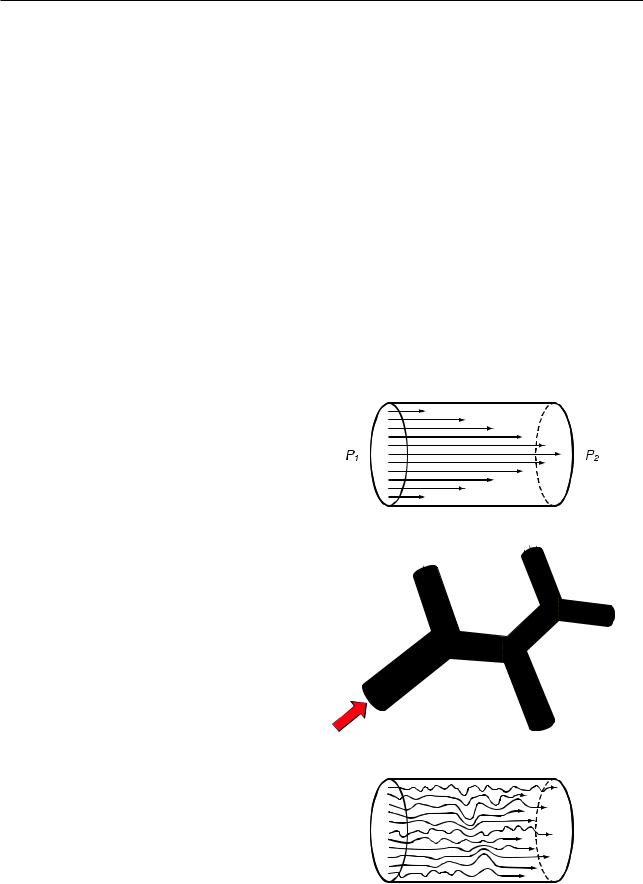
При прохождении воздуха через трубку характеристики потока могут быть различными: ламинарный режим (при низких скоростях линии течения параллельны стенкам трубки), переходный (по мере возрастания скорости поток становится менее однородным с образованием завихрений в месте бифуркации трубки) и турбулентный режим (при очень высоких скоростях линии течения полностью теряют упорядоченность) (рис. 2.17).
а
б
в
Рис. 2.17. Типы потоков воздуха в трубке: а — ламинарный; б — переходный; в — турбулентный
73
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 2
В дыхательных путях могут встречаться все эти три режима, но наиболее характерным паттерном потока в условиях дихотомического разветвления трахеобронхиального дерева является переходный, тогда как ламинарным поток может быть лишь в мелких дыхательных путях. Будет поток ламинарным или турбулентным, можно предсказать, рассчитав число Рейнольдса (Re) [21]:
Re = |
2× r ×V"× d |
, |
(7) |
|
|||
|
η |
|
|
где d — плотность газа, V" — средняя скорость потока, r — радиус трубки, η — вязкость.
Когда Re более 2000 — поток турбулентный, когда Re менее 2000 — поток ламинарный. При турбулентном потоке движущее давление пропорционально квадрату его скорости, тогда как при ламинарном потоке особенности совершенно иные — давление пропорционально скорости потока и описывается законом Пуазейля [21]:
|
π× r4 |
|
|||
V"= |
|
|
|
×P, |
(8) |
8 |
× |
η l |
|||
|
|
× |
|
|
|
где V" — скорость потока, Р — движущее давление, r — радиус трубки, l — длина трубки, η — вязкость газа. Поскольку сопротивление потоку R равно давлению, деленному на скорость потока, можно записать:
R = |
8× η ×l |
. |
(9) |
4 |
|||
|
π× r |
|
|
Как видно, большую роль играет радиус трубки; когда он уменьшается вдвое, сопротивление потоку увеличивается в 16 раз!
Сопротивление потоку воздуха в дыхательном тракте
Главным компонентом сопротивления дыхательных путей (Raw) является трение, оказываемое стенками трахеобронхиального дерева. Сопротивление дыхательных путей можно рассчитать, разделив разность давлений в ротовой полости (Pрот) и альвеолах на объемную скорость воздушного потока:
R aw = |
PA − Pрот |
. |
(10) |
|
V" |
||||
|
|
|
Объемная скорость потока и ротовое давление могут быть легко измерены, тогда как альвеолярное давление (PA), напротив, нельзя измерить прямым методом. Однако его можно рассчитать, исходя из значений плеврального давления (Ppl).
При одновременной регистрации с помощью пневмотахографа изменения объема легких
(V) и скорости потока (V"), а также изменения плеврального давления (Ppl) (соответствуют изменению давления в пищеводе, измеряемому с помощью баллонного катетера) можно определить движущее давление. Если его разделить на соответствующее значение V", то можно определить искомое сопротивление дыхательных путей (Raw).
При спокойном дыхании движущее давление достигает 0,1 кПа и может существенно возрастать при учащенном дыхании. Соответственно, плевральное давление при вдохе снижается и становится еще более отрицательным, а при выдохе возрастает и может даже стать положительным, что может приводить к сдавлению дыхательных путей, называемому динамической компрессией. У пациентов с повышенным сопротивлением компрессия дыхательных путей может наблюдаться уже при спокойном дыхании.
Альвеолярное давление и сопротивление дыхательных путей можно также измерить методом общей бодиплетизмографии.
При измерении сопротивления дыхательных путей следует учитывать, что в дыхательной системе сопротивление распределяется неравномерно. У взрослого при дыхании через рот на глотку и гортань приходится около 25% общего сопротивления, на долю внутригрудных крупных дыхательных путей (трахеи, долевых и сегментарных бронхов) — около 80% остающегося сопротивления, остальные 20% — на долю периферических дыхательных путей с диаметром менее 2 мм [21]. Мелкие дыхательные пути вносят незначительный вклад в общее сопротивление, так как их общая площадь поперечного сечения велика и, следовательно, сопротивление мало. Клинически это крайне важно, потому что заболевания легких часто начинаются с периферии. Измерение сопротивления дыхательных путей не является в этом случае хорошим диагностическим приемом для распознавания ранних стадий заболеваний. Должны применяться специальные диагностические методы исследования (такие как метод вымывания азота, импульсная осциллометрия (ИОС)).
Факторы, определяющие сопротивление дыхательных путей
На сопротивление воздухоносных путей существенное влияние оказывает объем легких. Бронхи растягиваются окружающей их легочной тканью, и их просвет увеличивается при повышении объема легких, а сопротивление снижается [21]. Кроме того, такие факторы, как тонус гладкой мускулатуры, физические свойства (плотность, вязкость) газа, также влияют на аэродинамическое сопротивление.
Нормальное сопротивление дыхательных путей у взрослых на уровне ФОЕ равно примерно 0,13 кПа/л в 1 с. В клинической практике часто используют величину, обратную сопротивлению, — проводимость дыхательных путей (Gaw = 1/Raw).
Сопротивление может увеличиваться при сокращении гладкой мускулатуры бронхов, при отеке бронхиальной слизистой оболочки и гиперсекреции, при снижении эластичности и растягивающего действия легочной паренхимы на дыхательные пути, при обтурации просвета новообразованиями или инородным телом.
74

Респираторная физиология
Клинические эффекты гелиокса
Гелиокс представляет собой смесь гелия и кислорода, плотность гелиево-кислородной смеси ниже плотности воздуха, а вязкость, наоборот, выше вязкости воздуха. Например, смесь 20% кислорода и 80% гелия имеет плотность 0,33 по отношению к воздуху и вязкость 1,08 по отношению к воздуху [23]. При вдыхании гелиево-кислородной смеси происходят снижение турбулентности потока в верхних дыхательных путях и увеличение скорости потока там, где турбулентность сохраняется. Преобразование турбулентного потока в ламинарный приводит к уменьшению сопротивления. В результате давление, необходимое для перемещения газа через дыхательные пути, уменьшается и разгружаются дыхательные мышцы. Применение гелиокса может быть особенно полезным у пациентов, имеющих сужение верхних дыхательных путей (например, частичную обструкцию трахеи) [24]. Причины положительного эффекта гелиокса у больных БА и ХОБЛ остаются изучены не до конца [25–27], так как, в отличие от верхних дыхательных путей в бронхиолах, которые вносят существенный вклад в повышение общего сопротивления дыхательных путей, воздушный поток остается ламинарным. Эффективность гелиокса при астме может быть связана с преобразованием турбулентного потока в ламинарный в верхних дыхательных путях, суженных из-за избыточной секреции [22].
Форсированный выдох
Исследование функции легких с помощью форсированного экспираторного маневра впервые предложили Тиффно и Пинелли в 1947 г. [28]. Во время исследования испытуемый делает максимально глубокий вдох и резкий максимально глубокий выдох. Максимальная скорость экспираторного потока определяется эластичностью легких, которая обеспечивает прохождение воздуха по дыхательным путям и поддерживает просвет бронхов открытым, а также сопротивлением и диаметром дыхательных путей. С помощью маневра форсированного выдоха измеряют форсированную жизненную емкость легких (ФЖЕЛ) и показатели объемной скорости воздушного потока [объем форсированного выдоха за 1-ю секунду (ОФВ1), отношение ОФВ1/ФЖЕЛ, максимальную усредненную объемную скорость — СОС25–75, пиковую объемную скорость выдоха (ПОСвыд)]. Из всех показателей наиболее важным является максимальный объем воздуха, который человек может выдохнуть за первую секунду маневра ФЖЕЛ — ОФВ1. Он более или менее независим от усилия, приложенного во время маневра выдоха, и отражает свойства легких и дыхательных путей.
У здоровых людей разница между ЖЕЛ, измеренной при спокойной спирометрии, и ФЖЕЛ минимальна. У больных с повышенным сопро-
тивлением дыхательных путей маневр ФЖЕЛ может приводить к сдавлению мелких дыхательных путей, и ФЖЕЛ может быть значительно ниже, чем ЖЕЛ. Значение ОФВ1 зависит так же, как ЖЕЛ (и ФЖЕЛ), от роста, пола, возраста, расы, физического состояния (тренированности организма). Отношение ОФВ1/ЖЕЛ абсолютно не зависит от этих факторов. У здорового человека это соотношение составляет 75–85%, но с возрастом скорость выдоха снижается в большей степени, чем объем легких, и отношение несколько уменьшается. У детей, наоборот, скорости воздушных потоков высокие, поэтому соотношение ОФВ1/ ЖЕЛ у них, как правило, выше — около 90%.
Петля «поток–объем»
Петля «поток–объем» — график зависимости объемной скорости потока от объема легких, состоит из двух половин: экспираторной и инспираторной, форма которых различна (рис. 2.18).
При форсированном экспираторном маневре сразу после быстрого подъема начинается линейное снижение скорости потока вплоть до окончания выдоха. Поэтому экспираторная кривая
· |
|
|
|
V, л/с |
|
|
|
|
|
Усилие: |
|
|
|
максимальное |
|
|
|
сильное |
|
Выдох |
|
умеренное |
зависитнеот усилия |
|
Скоростьпотока |
||
|
|
слабое |
|
поток |
|
|
|
Воздушный |
ОЕЛ |
|
V, л |
|
|
ООЛ |
Вдох
Рис. 2.18. Петли «поток–объем», полученные при выполнении форсированного маневра с различным усилием
75
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 2
«поток–объем» обычно имеет форму почти прямоугольного треугольника, основанием которого является ФЖЕЛ, а вершина соответствует ПОСвыд. После достижения пика скорость потока плавно снижается и становится нулевой при достижении ООЛ, каждая точка этой части кривой определяет максимальную скорость потока при данном объеме легких. При форсированном выдохе плевральное давление становится положительным и превышает давление в мелких дыхательных путях, что вызывает их сдавление и ограничивает скорость воздушного потока (динамическая компрессия дыхательных путей) (рис. 2.19). Ограничение экспираторного потока достигается при умеренном усилии, и дальнейшее повышение усилия увеличивает скорость потока выдыхаемого воздуха только в начальной четверти ФЖЕЛ. При низких и средних объемах легких увеличение усилия не дает прироста потока. Другими словами, при форсированном выдохе у любого человека существует ограничение максимальной скорости потока.
|
|
|
Ppl = –5 |
||
|
|
|
|
|
|
PTM = +5 |
|
|
|
||
0 |
|
|
|
||
|
|
|
|
|
|
PTM = +5 |
|
0 |
|
|
|
|
|
|
|
||
PTM = +5 |
|
|
|
|
|
0 |
|
|
|
||
|
PTP |
= +5 |
|||
|
|
|
|
||
|
|
|
|||
PA = 0
В отличие от выдоха, во время вдоха большее инспираторное усилие вызывает больший поток при всех уровнях ФЖЕЛ. Инспираторная кривая «поток–объем» является симметричной: максимальный инспираторный поток достигается приблизительно в средней точке кривой.
Максимальная произвольная вентиляция легких
Функцию дыхательной системы в целом, включая мышечную силу, можно оценить с помощью максимальной произвольной вентиляции легких (МВЛ), при измерении которой определяют максимальный объем воздуха, который может быть перемещен за 1 мин. Во время исследования испытуемый дышит так часто и глубоко, как только он может. Время измерения обычно составляет 15 с, за исключением процедуры определения максимальной поддерживаемой вентиляции легких, которая занимает до 4 мин. В последнем случае вдыхаемый
Ppl = +10
PTM = –6 

 +4
+4
PTM = –2 
 +8
+8
PTM = +2 |
+12 |
|
|
|
|
PTP |
= +5 |
||||
|
|
|
PA = +15
Давление, см вод.ст.
+20 
+10 
PA |
PAW |
0 |
|
PTM = +5 |
|
–5 |
Ppl |
–10 |
|
Альвеола |
Рот |
Расстояние |
|
Давление, см вод.ст.
+20 |
PA |
|
|
|
|
|
PTM = –2 |
|
|
+10 |
|
|
|
|
|
Ppl |
|
|
|
0 |
|
|
|
|
–5 |
|
PAW |
|
|
–10 |
|
|
|
|
Альвеола |
Рот |
|||
|
||||
Расстояние
а |
б |
Рис. 2.19. Динамическая компрессия дыхательных путей: а — изменение давления в легких в конце вдоха или выдоха, когда поток отсутствует. Давление в альвеолах (PA) и дыхательных путях (Paw) равно нулю (атмосферному давлению). Давление эластической тяги (Pel) уравновешивается плевральным давлением (Ppl). Трансмуральное давление (PTM) в дыхательных путях держит их открытыми; б — при форсированном выдохе PA и Ppl становятся положительными. Возникает градиент давления между альвеолами и ротовой полостью, необходимый для экспираторного потока. Сопротивление дыхательных путей приводит к падению движущего давления по мере движения потока наружу. В результате Ppl превышает Paw, возникает отрицательное PTM, которое сдавливает дыхательные пути (динамическая компрессия дыхательных путей) и ограничивает скорость потока. Дальнейшее повышение экспираторного усилия не приводит к повышению скорости потока. Точка, в которой Ppl = Paw, называется точкой равного давления, которая достигается тем скорее, чем меньше эластичность легких и чем выше сопротивление дыхательных путей
76

Респираторная физиология
газ должен содержать углекислоту для предотвращения гипокапнии. При нейромышечных и неврологических заболеваниях, а также при выраженных вентиляционных нарушениях происходит снижение МВЛ. У пациентов с обструктивными нарушениями снижение МВЛ более выраженное по сравнению с рестриктивными нарушениями, поскольку при снижении объема легких частое поверхностное дыхание компенсирует нарушения вентиляции.
Результаты измерения существенно зависят от прилагаемого усилия и желания испытуемого. Поэтому в настоящее время для оценки МВЛ обычно используют эмпирическое уравнение [29]: МВЛ = 40 × ОФВ1.
Работа дыхания
Дыхательные мышцы, развивая силу, приводящую в движение легкие и грудную стенку, выполняют работу, направленную на преодоление эластических и вязких (неэластических) сопротивлений. Эту работу дыхания (W) можно рассчитать как произведение давления в легких (P) в данный момент дыхательного цикла на их объем (V):
W = P×V. |
(11) |
Работу дыхания измеряют путем непрерывной регистрации внутриплеврального (или внутрипищеводного) давления и сопутствующих ему изменений объема легких. Строится кривая «давле- ние–объем». При спокойном дыхании во время вдоха плевральное давление падает, объем легких становится выше ФОЕ, регистрируется кривая АБС. Работа, затраченная на наполнение легких (вдох), равна площади под кривой и состоит из двух следующих компонентов.
•Один необходим для преодоления эластических сил (эластическое сопротивление при растяжении легких и грудной клетки) и представлен площадью ОАЕСДО.
•Другой — для преодоления вязких сил (сопротивление дыхательных путей, вязкое сопротивление ткани и инерционное сопротивление) и представлен площадью АБСЕА. Инерционное сопротивление трахеобронхиального воздушного столба, легких и грудной стенки при спокойном дыхании составляет примерно 5% общего неэластического сопротивления. При увеличении ЧД
инерционное сопротивление возрастает, однако остается относительно невеликим. Поэтому в механике дыхания его обычно не учитывают.
Произведенная против эластических сил работа (как у металлической пружины) «аккумулируется» и опять применяется для производства работы выдоха. Работа выдоха — это площадь АЕСВА (рис. 2.20), которая находится внутри площади ОАЕСДО. Отсюда следует, что при спокойном дыхании выдох происходит пассивно.
При увеличении легочной вентиляции (например, при физической нагрузке) работа дыхания
резко возрастает. В этом случае работа выдоха не может быть обеспечена потенциальной энергией растянутых легких и выдох становится активным процессом, требующим работы экспираторных дыхательных мышц. При заболеваниях органов дыхания на выдохе также должны включаться экспираторные мышцы.
Величину энергетических затрат организма, связанных с дыханием, можно оценить по количеству кислорода, потребляемому непосредственно дыхательными мышцами. Для этого проводят измерение потребления кислорода в условиях, когда повышается нагрузка исключительно на дыхательные мышцы без активации других скелетных мышц, например при произвольном учащении дыхания, или дыхании с повышенным содержанием CO2 в воздухе, или с созданием искусственного мертвого пространства (трубка, через которую испытуемый дышит).
В норме при спокойном дыхании потребление дыхательными мышцами кислорода и работа дыхания составляют незначительную часть энергозатрат организма. Так, потребление кислорода дыхательными мышцами в покое составляет не более 2–3% общего потребления кислорода (около 3 мл×мин–1), при нагрузке возрастает до 10–15% [30]. На преодоление эластического сопротивления приходится 65%, а неэластического — 35% всей работы дыхания. При патологии органов дыхания работа дыхания возрастает соответственно степени увеличения сопротивления дыхательных путей (например, при БА, ХОБЛ) или снижения растяжимости легких (например, при фиброзе легких). В первом случае повышается в основном неэластическая работа дыхания (увеличение площади АБСЕА), а во втором — эластическая (увеличение площади ОАЕСДО).
л |
|
легких,Объем |
Выдох |
|
|
Вдох |
ФОЕ |
кПа |
|
Рис. 2.20. Работа дыхания. Работа, необходимая для преодоления эластических (площадь ОАЕСДО) и вязких (площадь АБСЕА) сил, может быть определена для каждого дыхательного цикла
Список литературы
См. 
77
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 2
2.3. Кровообращение и регуляция водного баланса в легких
Г.В. Неклюдова, Ж.К. Науменко, З.Р. Айсанов
Введение
Основные функции легочного кровообращения:
1)перенос крови от правых отделов сердца к легочным капиллярам в объеме, равном сердечному выбросу, и обеспечение газообмена через альвеолярно-капиллярную мембрану;
2)выработка гуморальных медиаторов;
3)регуляция водного баланса в легких. Морфологическое строение легочного крово-
обращения идеально приспособлено для выполнения этих функций. Практически весь объем сердечного выброса контактирует с альвеолярным газом, при этом толщина альвеолярно-ка- пиллярной мембраны составляет около 1–2 μm, время контакта газа с кровью около 0,75–1 с, площадь контакта около 50–70 м2. Структура альвеолярно-капиллярной мембраны такова, что расстояние, которое должны преодолеть кислород и углекислый газ, чтобы произошел газообмен, составляет 1/10 часть расстояния, которое необходимо преодолеть этим газам в периферических тканях.
Помимо газообмена легочное кровообращение выполняет еще одну важную функцию — регуляцию баланса жидкости в экстраваскулярном пространстве легкого, что играет важную роль в патогенезе развития легочного отека. Кроме того, эндотелий капилляров легкого осуществляет функцию барьера для гуморальных медиаторов на пути в большой круг кровообращения.
Анатомия
Легочное кровообращение
Легочное кровообращение начинается с ЛА, отходящей от правого желудочка (ПЖ), и заканчивается легочными венами, которые впадают в левое предсердие. Легочное кровообращение обеспечивают ствол ЛА, правая и левая основные легочные артерии и их долевые ветви, внутрилегочные артерии, крупные эластические артерии, мелкие артерии мышечного типа, артериолы, капилляры, венулы и большие легочные вены. В зависимости от функциональных особенностей легочные сосуды подразделяют на экстраальвеолярные и альвеолярные. Кроме того, учитывая тот факт, что многие мелкие сосуды участвуют в регуляции обмена жидкости, выделяют «легочную микроциркуляцию». Анатомические границы экстраальвеолярных и альвеолярных артерий, сосудов, участвующих в микроциркуляции, не определены. Вероятно, эти границы не постоянны,
а изменяются в зависимости от объема легкого, уровня интраплеврального и интерстициального давления.
Диаметр ствола ЛА, отходящего от ПЖ, приблизительно равен 3 см и имеет длину 5 см. Ствол ЛА делится на две основные легочные артерии. Правая основная ЛА немного шире и длиннее, чем левая. Правая основная артерия делится на две ветви: одна из ветвей, более широкая и расположенная чуть ниже второй ветви, кровоснабжает среднюю и нижнюю доли легкого, вторая ветвь — верхнюю долю легкого. Левая основная артерия располагается выше главного бронха до уровня первого деления, а затем спускается вниз за бронхом. В более низких отделах деление артериального русла и справа и слева очень разнообразно. Легочные артериальные сосуды и бронхи заключены в одной и той же соединительнотканной оболочке и вместе достигают самых мелких своих единиц (капилляров и альвеол). Легочные вены также расположены в соединительнотканной оболочке, но не в той, в которой прослеживаются легочные артериальные сосуды и бронхи.
Легочное артериальное кровообращение имеет два вида ветвей: обычные ветви, которые сопровождают воздухоносные пути, и дополнительные артерии (более узкие), которые являются самостоятельными единицами. Все дополнительные артерии расположены интрапульмонально и обнаруживаются там, где находятся концы дыхательных бронхиол. Вклад этих сосудов в кровоснабжение составляет около 25% всего кровоснабжения
вобласти ворот легкого и 40% на периферии. Дополнительные артерии главным образом находятся в местах расположения дыхательных бронхиол, альвеолярных трубочек и альвеол, т.е самых мелких дыхательных единиц, которые участвуют
вгазообмене [1]. Значительный рост обычных и дополнительных артерий наблюдается в первые 18 мес после рождения и сопровождается развитием альвеолярных трубочек и альвеол [2, 3]. Появление новых обычных артерий, как правило, заканчивается в 18 мес, тогда как увеличение числа новых дополнительных артерий продолжается приблизительно до 8 лет. Поскольку к этому возрасту все альвеолы уже сформированы, дополнительные артерии являются вспомогательными сосудами, несущими кровь к терминальным отделам дыхательных путей и, таким образом, представляют собой важнейший источник коллатерального кровотока в участках, где происходит газообмен.
Легочное сосудистое сопротивление составляет приблизительно 1/10 часть системного периферического сосудистого сопротивления. Низкое сосудистое сопротивление легочного кровообращения является результатом морфологических особенностей строения легочных артерий и вен в сочетании с низким тонусом сосудов. Стенки легочных артерий и вен содержат в своей структуре гораздо меньше гладкой мускулатуры, чем сосуды того же
78

Респираторная физиология
диаметра в других органах, причем гладкая мускулатура в легочных сосудах распределена менее равномерно [4]. В стенках легочных артерий имеется больше гладкой мускулатуры, чем в легочных венах [5].
У людей легочные артерии, диаметр которых превышает 1–2 мм, как правило, являются артериями эластического типа. Гладкая мускулатура неравномерно распределяется тонким слоем в середине сосудистой стенки, между внешней
ивнутренней эластическими мембранами. Ствол ЛА, основные ветви и все экстраальвеолярные артерии являются артериями эластического типа. Артерии, диаметр которых менее 1–2 мм, относятся к артериям мышечного типа, причем чем меньше диаметр сосуда, тем меньшее количество мышечных элементов содержится в стенке сосуда [6, 7]. Артерии мышечного типа расположены в пределах легочных долек и сопровождают бронхиолы. Несмотря на то что эти артерии содержат мышечные элементы, толщина слоя гладкой мускулатуры не превышает 5% внешнего диаметра сосуда. Утолщение мышечного слоя происходит при патологических состояниях, связанных с легочной гипертензией [8–10].
Легочные артериолы — терминальные отделы легочной артериальной системы, содержат очень тонкий мышечный слой, расположенный фрагментарно, который постепенно исчезает по мере уменьшения диаметра сосудов. В стенках самых мелких (менее 30 μm) сосудов гладкие мышцы практически отсутствуют. Легочные артериолы расположены на уровне альвеолярных перегородок, сопровождают альвеолярные трубочки и альвеолы. В условиях гипоксии происходит значительная перестройка сосудистой стенки, особенно увеличивается количество гладкой мускулатуры в стенках мелких артерий.
Легочные капилляры составляют значительную часть межальвеолярных перегородок. Стенки легочных капилляров состоят из эндотелиальных клеток, лежащих на базальной мембране.
Легочные вены имеют более тонкие стенки, чем легочные артерии, поскольку мышечный слой развит гораздо слабее. В стенках венул эндотелиальные клетки располагаются на тонкой эластической мембране, стенки легочных вен представлены только внутренней эластической мембраной с периферическим слоем иррегулярных эластических волокон. Подобно артериальной, венозная система состоит из обычных и дополнительных вен. Мелкие интрапульмональные венулы последовательно сливаются, формируя все более и более широкие вены, которые сливаются в долевые вены. Поскольку вены от верхней и средней долей легкого обычно сливаются вместе, то венозный дренаж от каждого легкого заканчивается верхней
инижней легочными венами, которые впадают в левое предсердие. Иногда две вены слева сливаются в одну, которая и впадает в левое предсердие.
Крупные легочные вены у места впадения в левое предсердие имеют мышечные жомы, состоящие из кардиомиоцитов.
Стенки легочных сосудов хорошо растяжимы, их растяжимость в 7 раз выше растяжимости периферических системных артерий [11], так как содержат меньшее количество волокон гладкой мускулатуры, эластических волокон и коллагена, чем системные артерии, кроме того, их окружает меньшее количество тканевых элементов. Особенности строения легочных сосудов позволяют им лучше приспосабливаться к изменяющимся условиям за счет повышения или снижения сосудистого сопротивления. Например, при физической нагрузке эти сосуды способны обеспечить перенос крови большего объема, чем системные артерии того же диаметра.
Легочные сосуды иннервируются холинергическими и симпатическими нервными волокнами, хотя степень иннервации очень разнообразна у разных видов животных [12–14]. В сравнении с периферическими сосудами иннервация крупных сосудов выражена меньше и преимущественно представлена в области ветвления ЛА. Влияние симпатической и парасимпатической системы наиболее выражено в мелких бронхиолах и бронхиальных артериолах [14]. Активация симпатических нейронов в легочных сосудах происходит за счет артериальных хеморецепторов в ответ на снижение PO2 [15].
Бронхиальное кровообращение
Отдельную систему кровообращения составляют бронхиальные артерии, кровоснабжающие воздухоносные пути вплоть до терминальных бронхиол. Кроме того, эти сосуды обеспечивают приток крови к трахее, нервным волокнам, лимфатическим узлам [16, 17]. Объем бронхиального кровообращения составляет менее 3% сердечного выброса. Дренаж бронхиальных сосудов в легочную циркуляцию и в крупные вены имеет сложное строение. Установлены взаимосвязи между бронхиальными артериями, прекапиллярами, капиллярами и посткапиллярами [18]. Бронхиальное кровообращение наиболее развито в эмбриональном периоде и вносит свой вклад в газообмен при многих врожденных пороках сердца. Установлено, что нормальное легкое взрослого человека остается жизнеспособным и без бронхиального кровообращения (как и без иннервации), например в случае пересадки легкого. При некоторых заболеваниях легких, таких как легочный фиброз, карциноматоз легкого, происходит значительное увеличение количества и размеров бронхиальных артерий [19, 20]. В настоящее время многими исследователями признается возможность неоваскуляризации системной циркуляции в легких после обструкции ЛА [16, 20].
Количество и места отхождений бронхиальных артерий у взрослого человека весьма раз-
79
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
