
5 курс / Пульмонология и фтизиатрия / Респираторная_медицина_Руководство_в_3_томах_Том_1
.pdf
Раздел 2
[H+] × [HCO3–] / [H2CO3] = К, |
(3) |
где К — константа диссоциации угольной кислоты. Соответственно:
[H+] = К ×[H2CO3] / [HCO3–]. |
(4) |
Прологарифмировав это уравнение, получаем уравнение Henderson–Hasselbalch:
pH = pK + log [HCO3–] / [Н2СО3]. (5)
Концентрацию угольной кислоты можно определить через растворимость CO2 в плазме:
Н2СО3 = α × PCO2, |
(6) |
где α — коэффициент растворимости, равный 0,0301 ммоль/л мм рт.ст., при физиологическом уровне pH (зависит от температуры). Тогда уравнение (5) можно записать в виде:
pH = pK + log [HCO3–] / (α × PCO2), (7)
где pH представляет собой отрицательный логарифм концентрации ионов водорода;
pK — константа диссоциации угольной кислоты, равная 6,10. pK представляет собой pH, при котором концентрация HCO3– и растворенного CO2 равны; PCO2 — парциальное напряжение CO2.
Значения PCO2 изменяются прямо пропорционально температуре, а значения рН — обратно пропорционально температуре тела.
Бикарбонатная буферная система является метаболической составляющей и контролируется в основном почками. Все метаболические нарушения протекают медленнее дыхательных и могут развиваться в течение нескольких часов или дней. Таким образом, о величине рН крови можно судить по соотношению ионов бикарбоната (НСО3–) и соответствующей кислоты Н2СО3. В здоровом организме соотношение между основанием и кислотой приблизительно равно 24 к 1,2 (20:1). Подставив эти значения в уравнение (5), получаем:
рН = 6,10 + log (24/1,2),
таким образом в норме рН = 7,4.
В физиологических условиях, когда pH = 7,4, концентрация HCO3– в плазме крови в 20 раз больше, чем концентрация растворенного CO2.
Кроме бикарбонатного буфера, который в основном находится в плазме крови, существует группа «небикарбонатных буферов», которые функционируют в эритроцитах. В эту группу входят гемоглобиновая, белковая и фосфатная буферные системы. Буферные емкости распределены неравномерно. Буферная емкость карбонатного буфера составляет около 75%, на долю гемоглобинового буфера приходится 24%, а на белковую и фосфатную буферные системы — 1%.
pH плазмы крови на 0,2 единицы выше, чем pH эритроцитов. Измерение внутриклеточного уровня pH достаточно сложно, попытки его определения немногочисленны. Предполагается, что pH плазмы крови отражает pH внутренней среды всего организма. Однако это упрощение не всегда может быть приемлемо. Например, у пациентов с гипокалиемией клеточный компонент может иметь сниженный pH, а плазма — увеличенный pH. Поскольку pH измеряется в плазме крови, поэтому более правильно называть «ацидемия» или «алкалемия», чем «ацидоз» или «алкалоз». Физиологические значения рН 7,38–7,42. Снижение показателя рН — ацидемия (ацидоз), повышение показателя рН — алкалемия (алкалоз).
Концентрация HCO3– рассчитывается из величин PCO2 и pH, определяемых в образце крови. Содержание CO2 обычно определяется в образце венозной крови. Содержание CO2 в венозной крови приблизительно на 2 мЭкВ/л выше, чем концентрация HCO3– в плазме артериальной крови, рассчитанной по величинам PCO2 и pH, измеренными в артериальной крови. Таким образом, возможно ошибочное определение концентрации HCO3– по величинам PCO2 и pH, измеренным
вобразцах артериальной крови, если разница в
концентрациях HCO3– артериальной и венозной крови более чем 2 мЭкВ/л. Ошибочный результат может быть получен при нахождении образца крови на воздухе, при несоблюдении температурного режима либо при несвоевременном проведении анализа. Экспозиция образца крови на воздухе
снижает PCO2, повышает pH. Синтез молочной кислоты клетками крови снижает pH и повышает
PCO2. Содержание CO2 в венозной крови остается относительно постоянным. Поскольку обычно
разница в содержании CO2 в плазме артериальной и венозной крови достаточно мала, образцы венозной крови могут быть использованы для получения приемлемой оценки концентрации анионов
HCO3– в артериальной крови.
Из уравнения Henderson–Hasselbalch видно, что pH рассчитывается из двух величин: парци-
ального напряжения CO2 и концентрации HCO3–. Показатель PCO2 можно представить как параметр «вентиляции», поскольку он позволяет оценить адекватность вентиляции по отношению к скорости образования двуокиси углерода. Нормальные
значения PCO2 составляют от 38 до 42 мм рт.ст. Кривая диссоциации двуокиси углерода не имеет плато (рис. 2.22). Таким образом, содержание CO2
вкрови сильно зависит от PCO2 и, следовательно, от уровня альвеолярной вентиляции. Если PCO2 выше нормальных значений, отмечается гипо-
вентиляция. При гипервентиляции PCO2 ниже нормальных значений.
Термины «гиповентиляция» и «гипервентиляция» не согласуются с терминами «гипопноэ» и «гиперпноэ» (по отношению к минутной вентиляции) или «тахипноэ» и «брадипноэ» (по отно-
90

Респираторная физиология
|
0,7 |
|
|
|
|
b |
|
|
30 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
ммоль/л |
|
|
0,6 |
Дезоксигенированная |
|
|
|
||||
|
|
|
|
|
|||||
|
|
|
кровь |
|
|
|
|
25 |
|
|
|
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
a |
|
|
|
|
2 |
|
|
|
|
|
|
|
20 |
|
CO |
|
|
|
|
Оксигенированная |
|
|||
0,4 |
|
|
|
|
|
||||
Содержание |
|
|
|
|
кровь |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 |
|
0,3 |
|
|
|
|
|
|
|
|
|
0,2 |
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
0,1 |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
10 |
20 |
30 |
40 |
50 |
60 |
70 |
||
|
|
||||||||
PCO2, мм рт.ст.
Рис. 2.22. Кривая диссоциации CO2
шению к количеству дыхательных движений в минуту). Так, у многих пациентов, страдающих болезнями органов дыхания, отмечается гиповентиляция, хотя может определяться как гиперпноэ, так и тахипноэ при нормальном уровне метаболизма. Это объясняется тем, что пациент вентилирует большой объем мертвого пространства.
Увеличение синтеза двуокиси углерода может быть вызвано увеличением скорости метаболизма (например, при физической активности, лихорадке, перевозбуждении), либо образование CO2 из запасов ионов бикарбоната может быть увеличено при остром метаболическом ацидозе (например, при острых сердечно-легочных патологических состояниях). Итак, гиповентиляция — это несоответствие вентиляции к продукции двуокиси углерода, которая проявляется в увеличении PCO2. При гипервентиляции снижается PCO2 в крови, что приводит к пропорциональному повышению pH. Гипервентиляция часто является компенсаторной реакцией при метаболическом ацидозе.
В отличие от PCO2, интерпретация значимости изменений концентрации HCO3– достаточно сложна. «Метаболический» параметр должен быть независим от изменений PCO2. Однако в некоторых растворах концентрация HCO3– может изменяться значительно по мере изменений CO2. В образце крови in vitro концентрация HCO3– заметно увеличивается с повышением CO2. Образование HCO3– из CO2 увеличивается в эритроците, когда ионы H+ связаны с анионами буфера, который представлен гемоглобином, белками и неорганическим фосфатом. Гемоглобин особенно важен и эффективен как буфер для ионов H+ по нескольким причинам. Во-первых, концентрация гемоглобина высока в эритроцитах; во-вторых, изобилие имидазольных групп в молекуле гемоглобина, которые имеют pK, близкую к pH внутри клеток, могут связывать и высвобождать большое количество
H+; в третьих, молекулы кислорода, связанные с гемоглобином, влияют на буферную емкость молекул гемоглобина. При низких значениях PO2, которые наблюдаются в системных капиллярах и
ввенозной крови, сродство молекул гемоглобина к ионам H+ увеличивается, и большее количество
CO2 превращается в анионы HCO3–. При оксигенации крови в легочных капиллярах ионы H+
высвобождаются из гемоглобина, CO2 образуется из HCO3– и переносится в альвеолярный газ.
Диаграмма Davenport и метод Зигаарда– Андерсон (рис. 2.23) могут быть использованы для того, чтобы in vitro предсказать изменения кислот- но-основного состояния (КОС) крови при добавлении кислот или оснований или при нахождении
вусловиях с высоким или низким парциальным напряжением CO2 [5–7].
Внастоящее время эквилибрационный способ
определения PCO2 не используется. Применяют прямое определение PCO2 с помощью специального электрода и автоматически рассчитывается избыток/дефицит оснований (можно определить по номограмме).
Истинный ответ HCO3– на острое изменение парциального напряжения CO2 может быть определен эмпирически у здоровых лиц. Было пока-
зано, что после экспозиции 10% CO2 в течение
10 мин PCO2 увеличивалось до 78 мм рт.ст., а концентрация HCO3– в плазме артериальной крови повышалась только на 3 мЭкВ/л [8]. При гипервентиляции отмечается тенденция к снижению HCO3– [9]. Например, в случае снижения PCO2 с
мм рт.ст. |
6,9 |
7,0 |
7,1 |
7,2 |
7,3 |
|
7,4 |
7,5 |
7,6 |
7,7 |
|
|
|||
150 |
|
|
|
|
|
|
|
|
|
|
|
|
150 |
||
130 |
|
|
|
|
|
|
|
|
|
|
|
|
130 |
||
|
110 |
|
40 |
45 |
50 55 60 |
|
|
|
|
|
|
|
110 |
||
|
|
|
|
65 |
70 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
90 |
|
35 |
|
|
|
|
|
75 |
|
|
|
90 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
30 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
80Буферные |
|
||||
|
|
70 |
|
|
|
A |
A |
|
|
70 |
|||||
|
|
|
25 |
|
|
|
|
|
основания, |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
ммоль/л |
|
|
||
|
|
50 |
|
|
|
|
|
|
|
B +5 +10 |
|
|
50 |
||
2 |
|
|
|
|
|
–5 |
|
|
|
|
|||||
40 |
|
|
|
|
|
|
|
+15 |
|
|
40 |
||||
CO |
|
20 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
–10 |
|
|
0 |
|
|
|
|
|
|||
P |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
19 |
|
|
|
|
|
|
+20 |
|
|||||
|
|
30 |
|
|
B |
|
|
|
|
|
|
30 |
|||
|
|
18 |
|
|
|
|
|
|
|
|
Избыток |
|
|||
|
|
|
|
|
–15 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
оснований, |
|
||||
|
|
|
|
|
|
|
|
Б |
Б |
|
|||||
|
|
|
17 |
|
|
|
|
|
ммоль/л |
|
|
||||
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
16 |
|
|
–20 |
|
|
|
|
|
Пример |
|
|
|
|
|
|
|
|
|
|
Пример 2 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
–22 |
|
|
|
|
|
|
|
|
|
|
|
10 |
15 |
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
6,9 |
7,0 |
7,1 |
7,2 |
7,3 |
|
7,4 |
7,5 |
7,6 |
7,7 |
pH |
||
Рис. 2.23. Номограмма Зигаарда–Андерсон. Точки А и В соединяет буферная линия конкретного образца крови, получаемая при эквилибрации этого образца с двумя различными концентрациями CO2. По измеренным реальным значениям рН данного образца крови (точка Б) находят фактическое значение PCO2
91
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 2
40 до 20 мм рт.ст., концентрация HCO3– в плазме крови снижается приблизительно на 5 мЭкВ/л. Поскольку отмечаются небольшие изменения в концентрации HCO3– в ответ на острые изменения PCO2 [10], клиницисты рассматривают анион HCO3– как метаболический параметр.
Умеренное увеличение анионов HCO3– вслед за резким повышением парциального напряжения CO2 может объясняться тем, что организм в целом является менее эффективной системой, чем эритроциты. Концентрация HCO3– в легочных капиллярах увеличивается быстро, когда парциальное напряжение CO2 в альвеолярном газе повышается. Когда дополнительное количество растворенного в крови углекислого газа достигает периферических тканей и диффундирует из сосудов, концентрация анионов HCO3– в плазме крови должна снижаться, а концентрации анионов HCO3– в тканях должна увеличиваться. Поскольку буферная емкость тканей слабее, чем буферная емкость крови, увеличение концентрация анионов HCO3– в тканях менее выражено. Концентрация анионов HCO3– в плазме крови превышает таковую в тканях, и анионы HCO3– диффундируют из капилляров в обмен на ионы хлора. При сохранении высокого содержания CO2 в альвеолярном воздухе парциальное напряжение CO2 в крови, возвращенной к легким, увеличивается. Это приводит к менее выраженному увеличению концентрации анионов HCO3– по сравнению с исходным количеством или при исследовании на изолированном образце крови.
Теория «сильных ионов»
В физиологии «теория сильных ионов» впервые была применена Р.А. Stewart [11, 12]. «Метаболический» параметр разделяют на два компонента. Выделяют «сильные» кислоты и основания, которые полностью диссоциируют, и молекулы слабых буферов, которые частично диссоциируют при физиологическом уровне pH. «Сильные» ионы включают электролиты и различные органические и неорганические ионы, такие как лактат, ацетоацетат и сульфат. Слабые буферы состоят в основном из белков серы и фосфата. Величина pH рассчитывается на основании трех предположений: общая концентрация ионов и кислотно-основных пар известна и сохраняется неизменной, раствор остается электронейтральным, константы диссоциации каждых буферов известны. Как уровень pH, так и концентрация анионов HCO3– являются зависимыми величинами, которые могут быть рассчитаны путем вычитания сильных анионов из сильных катионов. Увеличение хлорида по отношению к натрию приводит к уменьшению разницы сильных ионов и кислотности плазмы. Это объясняет тот факт, почему введение солевого раствора приводит к ацидозу. Метод «сильных ионов» позволяет точнее оценить концентрацию ионов HCO3–, чем уравнение Henderson–Hasselbalch [10].
Использование данного подхода в клинической практике ограничено из-за достаточно сложного характера взаимоотношений сильных ионов. Решение этих уравнений требует знание концентраций белков и фосфатов, которые в момент проведения анализа крови не известны. В клинических условиях парциальное напряжение CO2 и pH измеряются, а концентрация анионов HCO3– рассчитывается либо из этих параметров, либо из общего содержания CO2. Традиционный метод Henderson–Hasselbalch позволяет оценить ацидоз и алкалоз, при которых не выявляется разница между сильными и слабыми кислотами и основаниями.
Основные буферные системы крови (респираторный
иметаболические параметры, определяющие рН крови)
Вклинической практике CO2 и HCO3– выбраны в качестве респираторного и метаболического параметров, которые определяют pH, при этом лабораторная оценка нарушений кислотно-ос- новного баланса становится достаточно простой. Компенсация первичных нарушений кислот- но-основного баланса никогда не бывает полной. Если pH в артериальной крови снижен, то возникает ацидоз. И наоборот, если pH увеличен, то это
алкалоз. Поскольку концентрация HCO3– является числителем, а парциальное напряжение CO2 — знаменателем в уравнении Henderson–Hasselbalch,
то изменения в концентрации HCO3– приводит к однонаправленным изменениям pH, тогда как
изменения парциального напряжения CO2 приводят к обратным изменениям pH. Вторичные или компенсаторные изменения респираторного или метаболического параметра направлены в сторону нормализации уровня pH, но не достигают уровня 7,4. В случае когда изменение дыхательных и метаболических параметров происходит параллельно
ипропорционально, рН крови не изменяется и
остается нормальным, это указывает на смешанные нарушения КОС. Такие же нарушения будут наблюдаться и при срыве компенсаторных механизмов.
Оценка и интерпретация нарушений кислотно-основного состояния
Лабораторное определение первичных или вторичных изменений кислотно-основных нарушений основывается на предположении, что при первичных они более выражены, чем при вторичных. Однако в некоторых условиях, с точки зрения физиолога, сложно выделить первичные и компенсаторные изменения. Например, при полной компенсации у больных ХОБЛ с хронической гиперкапнией. Обычно оценка кислотно-основно- го баланса проводится утром, после пробуждения больного, когда пациент откашливает некоторое
92

Респираторная физиология
количество мокроты, что улучшает вентиляцию, парциальное напряжение CO2 в артериальной крови снижается, pH увеличивается до нормального или даже выше нормального уровня.
В клинической практике к непосредственно измеряемым параметрам относятся показатели рН и PCO2, остальные параметры, которые представляют современные газоанализаторы, являются расчетными. На основе рН и PCO2 могут быть рассчитаны следующие величины (наиболее часто используемые в повседневной практике).
•Актуальный (истинный) бикарбонат (НСО3–) (диапазон нормы: 23–27 ммоль/л) — отражение общей буферной емкости крови, согласно уравнению Henderson–Hasselbalch.
•Стандартный бикарбонат (диапазон нормы: 23–27 ммоль/л) — не дает никакой дополнительной информации об истинном бикарбона-
те и сдвиге буферных оснований.
•ВЕ или ВА (сдвиг буферных оснований) (диапазон нормы: от –2,5 до +2,5 ммоль/л). Отрицательное значение этого параметра указывает на сдвиг в сторону метаболического ацидоза. Положительное значение — на сдвиг в сторону метаболического алкалоза. ВЕ позволяет вычислить количество буфера, которое необходимо ввести пациенту с нарушением кислотно-щелочного равновесия.
До 70-х годов XX в. для определения концентрации бикарбоната и сдвига буферных оснований использовали номограммы Зигаарда–Андерсена (см. рис. 2.23). Прямая, проведенная через измеренные значения PCO2 и рН и предварительно определенные значения гемоглобина, бикарбоната и общего содержания CO2 в крови, позволяет получить значение сдвига буферных оснований (табл. 2.1). Современные газоанализаторы позволяют автоматически рассчитать описанные выше параметры.
Измерение множества кислот в плазме крови позволяет определить комплексные нарушения.
Компенсаторные механизмы
При анализе результатов КОС пациента нередко возникает вопрос, какие нарушения первичны, а какие являются компенсаторной реакцией организма для нормализации рН. Так, при гиперкапнии отмечается повышение концентрации анионов HCO3–. Концентрация анионов
продолжает увеличиваться, если гиперкапния сохраняется, и через 5 дней она достигает пиковых значений. Происходят увеличение обмена ионов H+ на ионы Na+ и повышение реабсорбции ионов HCO3– в проксимальном отделе канальцев нефрона. Увеличение концентрации анионов HCO3– в плазме крови сопровождается потерей ионов H+, которая, в свою очередь, становится возможной за счет выведения увеличенного количества ионов NH4+ с мочой. Как только концентрация анионов HCO3– достигает нового стабильного уровня, выведение ионов NH4+ и H+ обычно возвращается к нормальному уровню (рис. 2.24). При хроническом метаболическом ацидозе экскреция как ионов NH4+, так и H+ сохраняется увеличенной. При хроническом респираторном ацидозе жидкость в проксимальном отделе канальцев содержит высокую концентрацию ионов HCO3–, а при хроническом метаболическом ацидозе — низкую концентрацию ионов HCO3–. Увеличение HCO3– в клетках канальцев проксимального отдела нефрона при хроническом респираторном ацидозе сохраняет внутриклеточный уровень pH относительно щелочным по сравнению с изменениями, наблюдаемыми при хроническом метаболическом ацидозе. Внутриклеточный ацидоз стимулирует секрецию ионов NH4+ при хроническом метаболическом ацидозе [13–16].
Таблица 2.1. Интерпретация нарушений кислотно-основного равновесия
HCO – (мЭкв/л) |
pH |
PCO |
, мм рт.ст. |
Интерпретация изменений |
3 |
|
2 |
|
|
23–27 |
7,38–7,42 |
38–42 |
Норма |
|
|
|
|
|
|
25 |
7,12 |
|
80 |
Некомпенсированный респираторный ацидоз |
|
|
|
|
|
35 |
7,25 |
|
80 |
Компенсированный респираторный ацидоз |
|
|
|
|
|
25 |
7,71 |
|
20 |
Некомпенсированный респираторный алкалоз |
|
|
|
|
|
15 |
7,50 |
|
20 |
Компенсированный респираторный алкалоз |
|
|
|
|
|
10 |
7,03 |
|
40 |
Некомпенсированный метаболический ацидоз |
|
|
|
|
|
10 |
7,23 |
|
25 |
Компенсированный метаболический ацидоз |
|
|
|
|
|
35 |
7,56 |
|
40 |
Некомпенсированный метаболический алкалоз |
|
|
|
|
|
35 |
7,46 |
|
50 |
Компенсированный метаболический алкалоз |
|
|
|
|
|
16 |
7,40 |
|
25 |
Метаболический ацидоз и респираторный алкалоз |
|
|
|
|
|
35 |
7,40 |
|
56 |
Метаболический алкалоз и респираторный ацидоз |
|
|
|
|
|
15 |
7,10 |
|
50 |
Метаболический ацидоз и респираторный ацидоз |
|
|
|
|
|
35 |
7,67 |
|
30 |
Метаболический алкалоз и респираторный алкалоз |
|
|
|
|
|
15 |
7,30 |
|
60 |
Ошибочные данные |
|
|
|
|
|
93
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 2
Плазма крови |
Моча |
Клетки CO2 
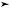 CO2 почечных
CO2 почечных
трубочек
H2O 
 H2O
H2O 
|
|
|
1 |
|
|
|
|
|
|
|
H2CO3 |
|
|
Забуферивание |
|
|
|
|
|
А |
|
мочи |
|
|
|
|
|
P P P |
|
|
|
|
HCO3– |
HCO3– |
H + |
|
H + |
||
|
|
|
|
|
|
2 |
|
|
|
|
|
А |
|
|
|
|
А |
P P |
|
P P |
P |
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
3Na + |
|
3Na + |
|
|
|
Na + |
|
3 |
|
2K + |
|
|
|
|
|
2K + |
|
|
|
|
|
|
|
А |
P P P |
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
|
|
Глутамин |
|
Глутамин |
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
Ala |
|
|
|
|
Аминокислота |
|
|
Ser |
|
|
|
|
|
|
Gly |
Диффузия |
|||
с наиболее высокой |
|
4 |
|||||
|
Asp |
||||||
|
|
|
|||||
концентрацией в крови |
|
|
|
|
|
|
|
|
|
|
|
NH3 |
NH |
3 |
|
|
|
|
|
|
|
|
|
|
Глутамат |
|
Глутамат |
H + |
|
|
H + |
|
|
|
|
|
|||
|
N |
А |
|
H2O |
|
|
|
|
|
|
|
NH |
+ |
NH4+ |
|
|
|
|
5 |
|
4 |
|
|
|
|
|
|
|
|
|
|
1 |
Карбонат-дегидратаза |
|
|
|
|
|
|
4.2.1.1 [Zn2 + ] |
|
|
|
|
|
|
|
2 |
N |
А |
|
|
|
|
|
H + -ATPаза 3.6.1.35 |
|
|
|
|
|
|
|
3 |
Na + /K + -ATPаза |
2-оксоглутарат |
|
Экскреция |
|||
3.6.1.37 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
4 |
Глутаминаза 3.5.1.2 |
|
|
|
|
|
|
5 |
Глутамат- |
Цитратный цикл |
|
|
|
||
дегидрогеназа 1.4.1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б |
|
|
|
|
|
|
|
Рис. 2.24. Роль почек в регуляции рН крови: а — секреция протонов; б — экскреция аммиака
94
|
Респираторная физиология |
|
Гипокапния приводит к уменьшению выведе- |
водой с образованием угольной кислоты, которая |
|
ния кислот почками и уменьшению концентрации |
диссоциирует на ионы водорода и ионы бикарбо- |
|
анионов HCO3–, что становится заметным в тече- |
ната. Жирные кислоты в процессе кетогенеза при |
|
ние 2–3 дней. Уменьшение парциального напря- |
физиологическом значении рН распадаются на |
|
жения CO2 на каждые 10 мм рт.ст. сопровождает- |
ацетоуксусную кислоту и β-оксимасляную кис- |
|
ся снижением концентрации анионов HCO3– на |
лоту. Во время этого процесса ежесуточно обра- |
|
2,5 мЭкв/л [17, 18]. И наоборот, увеличению пар- |
зуется приблизительно 600 ммоль Н+. При анаэ- |
|
циального напряжения CO2 на каждые 10 мм рт.ст. |
робном распаде глюкозы каждый день образуется |
|
соответствует увеличение концентрации анионов |
около 1400 ммоль молочной кислоты, которая |
|
HCO3– на 4 ммоль. |
распадается с образованием Н+. В течение дня |
|
Респираторная компенсация метаболических |
в организме человека образуется около 1 мЭкВ |
|
нарушений осуществляется достаточно быстро и |
связанных кислот (не включая H2CO3) на 1 кг |
|
достигает максимального уровня в течение 24 ч. |
массы тела. Эти нелетучие кислоты не могут быть |
|
Метаболическому ацидозу в качестве компенса- |
выведены легкими. |
|
ции соответствует гипервентиляция с глубоким |
Около 3600 мЭкВ HCO3– ежедневно попадает |
|
дыханием (дыхание Куссмауля). При метаболиче- |
в жидкость клубочков, но лишь следовые количе- |
|
ском ацидозе на каждый миллиэквивалент сни- |
ства этого аниона оказываются в моче и выводятся |
|
жения HCO – приходится снижение парциально- |
из организма. Основная часть HCO – возвращает- |
|
3 |
3 |
|
го напряжения CO2 на 1–1,5 мм рт.ст. [19, 20]. |
ся из мочи в кровь. Это происходит за счет обмена |
|
Существует простое правило, которое позволяет |
внутриклеточных ионов H+ на Na+, а не прямой |
|
оценить, соответствует ли снижение парциаль- |
реабсорбцией HCO3–. Внутриклеточные ионы H+ |
|
ного напряжения CO2 степени метаболического |
образуются путем гидратации CO2 с образовани- |
|
ацидоза. Оно состоит в том, что парциальное на- |
ем H2CO3 и последующей диссоциацией на ионы |
|
пряжение CO2 должно быть равно двум последним |
H+ и HCO3– (уравнение 1). Ионы H+ совместно |
|
цифрам величины pH. Например, компенсация |
с анионами HCO3– поступают в проксимальный |
|
может расцениваться адекватной, если при pH, |
отдел почечных канальцев, где быстро превра- |
|
равном 7,28, парциальное напряжения CO2 со- |
щаются в молекулы CO2 и H2O. Эта химическая |
|
ставляет 28 мм рт.ст. |
реакция ускоряется в присутствии фермента кар- |
|
Компенсация метаболического алкалоза про- |
боангидразы. Анионы HCO3–, которые образу- |
|
является в снижении вентиляции и увеличении |
ются в клетках проксимального отдела почечных |
|
парциального напряжения CO2 приблизительно |
канальцев, проникают через клеточные мембраны |
|
на 0,6–0,7 мм рт.ст. на каждый миллиэквивалент |
в обмен на ионы Cl–. В результате этих процессов |
|
увеличения HCO3– [20]. Парциальное напряжение |
практически все количество профильтрованных |
|
CO2 редко превышает 55 мм рт.ст. [21, 22], так |
анионов HCO3– реабсорбируется и возвращается |
|
как гиперкапния и гипоксия, которые являются |
в кровоток. |
|
результатом гиповентиляции, сами по себе ре- |
Однако реабсорбция анионов HCO3– не при- |
|
спираторные стимулы. Гиперкапния может стать |
водит к выведению кислот в мочу и поэтому не |
|
более выраженной, если пациент получает кисло- |
может компенсировать синтез связанных кислот. |
|
родотерапию. Компенсаторное увеличение парци- |
В отличие от анионов HCO3–, фильтруемые |
|
ального напряжения CO2 может быть более выра- |
кислоты и NH3 действительно достигают мочи. |
|
женным у больных метаболическим алкалозом, |
Основным фильтруемым анионом является H PO |
–. |
|
2 |
4 |
которые не «теряют» ионы K+. Выведение ионов |
Ионы NH4+ секретируются в проксимальный |
|
K+ связано с потоком ионов H+ в клетки, включая |
отдел почечных канальцев. Некоторое количество |
|
клетки центральной нервной системы, которые |
этого иона реабсорбируется в восходящем отделе |
|
стимулируют нейроны дыхательного центра [23]. |
канальцев, а часть превращается в NH3 [25, 26]. |
|
При метаболическом алкалозе повышение пар- |
Транспорт ионов H+ в проксимальном отделе |
|
циального напряжения CO2 снижает внутрикле- |
нефрона отличается от его транспорта в дисталь- |
|
точный уровень pH в почках, повышая секрецию |
ном отделе. Поскольку проксимальный отдел ка- |
|
кислот и увеличивая уровень HCO3– в плазме [24]. |
нальцев участвует в абсорбции наибольшей части |
|
|
анионов HCO –, то значительная часть ионов H+ |
|
Роль почек в поддержании кислотно- |
3 |
|
транспортируется также в этом отделе нефрона. |
||
основного баланса |
Однако способность данного отдела нефрона кон- |
|
центрировать ионы H+ ограничена. Так, жидкость, |
||
Выведение кислот |
прошедшая проксимальный отдел почечных ка- |
|
нальцев, имеет pH около 6,8. Обмен ионов H+ на |
||
Метаболические процессы, постоянно проте- |
Na+ в этом отделе нефрона эквивалентен процессу |
|
кающие в организме, приводят к образованию |
реабсорбции анионов HCO3–. Хотя дистальный |
|
кислот и водородных ионов. Так, при метаболизме |
отдел почечных канальцев гораздо меньше уча- |
|
жиров и углеводов образуется более 13 000 ммоль |
ствует в транспорте ионов H+, этот отдел нефрона |
|
углекислого газа в сутки. CO взаимодействует с |
способен увеличить концентрацию ионов H+ поч- |
|
2 |
|
|
95
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 2
ти в 100 раз по сравнению с концентрацией этого иона в плазме крови.
Поскольку двуокись углерода быстро проходит через клеточные мембраны, то парциальное напряжение CO2 в артериальной крови оказывает быстрое воздействие на парциальное напряжение CO2 и pH в клетках почечных канальцев. Эти изменения, вероятно, могут изменять выведение ионов H+ почками. Так, при гиперкапнии выведение ионов H+ усиливается, а при гипокапнии — ослабевает.
Реакция почек на алкалоз
В норме резкое увеличение концентрации аниона HCO3– в плазме крови (более 25 мЭкВ/л) сопровождается быстрой потерей этого аниона с мочой. Так, при метаболическом алкалозе, обусловленным многократной рвотой, ионы H+ и Cl– выводятся из организма, что приводит к алкалозу и гипохлоремии. В ответ почки увеличивают экскрецию анионов HCO3–, pH мочи повышается. Объем внеклеточной жидкости уменьшается, скорость клубочковой фильтрации снижается. Поскольку фильтрация снижена, меньшее количество анионов HCO3– поступает в проксимальный отдел почечных канальцев, отмечается более полная реабсорбция анионов HCO3– [27–29].
Увеличение поступления и реабсорбции ионов Na+ в дистальный отдел нефрона способствует секреции ионов K+ в этом отделе нефрона. Ионы K+ выводятся из клеток в обмен на ионы Na+ и H+, что способствует развитию внутриклеточного ацидоза. Большинство ионов Cl– после клубочковой фильтрации реабсорбируется, и лишь небольшое количество этого иона попадает в мочу.
Метаболический ацидоз
Теория анионного разрыва
Анионный разрыв представляет собой разницу между концентрациями катионов и анионов в плазме крови (из концентрации катиона Na+ вычитается сумма анионов Cl– и HCO3–). В норме величина анионного разрыва составляет 8–16 мЭкВ/л.
Изменения величины анионного разрыва могут наблюдаться в следующих случаях.
При алкалозе может увеличиваться число анионных групп в молекуле альбумина, и, таким образом, увеличивается величина анионного разрыва. При первичном метаболическом алкалозе величина анионного разрыва больше, чем при вторичной, компенсаторной реакции на дыхательный ацидоз.
Поскольку наибольшее количество анионов связано с молекулами альбумина, то при снижении концентрации альбумина на 1 г/дл вызывает уменьшение величины анионного разрыва примерно на 2,5 мЭкВ/л [30].
Небольшая величина анионного разрыва может быть обусловлена увеличением концентрации
катионов помимо катионов Na+. Это могут быть катионы кальция, магния, лития.
При обезвоживании увеличивается концентрация всех ионов раствора, в том числе и ионов, составляющих анионный разрыв. При задержке жидкости отмечается противоположный эффект.
Введение в организм большого количества солей натрия анионных антибиотиков (например, пенициллина) или других анионов (например, лактата, цитрата или ацетата) может увеличивать величину анионного разрыва без развития ацидоза. Таким образом, если пациент не применял упомянутые выше анионы и не испытывал дегидратацию, то повышение величины анионного разрыва подтверждает наличие метаболического ацидоза, даже если уровень pH составляет нормальное значение или несколько увеличен.
Причины метаболического ацидоза
Лактоацидоз
Ежедневно в организме человека образуется приблизительно 1400 мЭкВ/л лактата. Основным источником лактата являются скелетные мышцы, а печень и почки ответственны за его метаболизм [31]. Гипоксия способствует лактоацидозу за счет повышения образования лактата и уменьшения его метаболизма.
Диагностика лактоацидоза основана на выявлении ацидоза и увеличении концентрации лактата выше нормальных значений (1 мЭкВ/л), обычно выше 5 мЭкВ/л. Для определения концентрации лактата используется артериальная кровь.
При заболеваниях легких не так часто выявляется лактоацидемия. Развитие лактоацидоза более характерно при нарушении перфузии тканей, чем при выраженном снижении парциального напряжения O2 в артериальной крови. Это явление можно объяснить хорошо развитыми механизмами компенсации хронической артериальной гипоксии и механизмами, сводящими к минимуму тканевую гипоксию. Среди этих путей компенсации можно выделить, во-первых, увеличение сердечного выброса, во-вторых, уменьшение сродства гемоглобина к кислороду при снижении pH за счет увеличения концентрации 2,3-дифосфогли- церата, в третьих, полицитемию.
По причинам развития лактоацидоз может быть разделен на две группы [32]. Первый тип лактоацидоза вызван тканевой гипоксией, которая может быть обусловлена недостаточностью кровоснабжения, развиваемой при шоке, вызванным гиповолемией, сепсисом. Кроме того, гипоксия тканей может наблюдаться при тяжелой гипоксемии, например, при заболеваниях легких, остром респираторном дистресс-синдроме, при отравлении угарным газом, тяжелой анемии и т.д.
Развитие второго типа лактоацидоза не связано с тканевой гипоксией, а обусловлено накоплением различных лекарственных или наркотических
96

Респираторная физиология
средств, которые могут вызывать лактоацидоз. Помимо этих причин, лактоацидоз может развиваться при врожденных дефицитах ферментов. Этот тип лактоацидоза развивается при печеночной и почечной недостаточности, при диабете, при накоплении этанола, метанола, эфира салициловой кислоты, при химиотерапии, при врожденном дефиците таких ферментов, как глю- коза-6-фосфатаза, фруктоза-1,6-фосфатаза.
Кетоацидоз
Кетоацидоз обусловлен накоплением ацетоацетата, β-гидроксибутирата, ацетона. Кетоацидоз может быть вызван диабетом, голоданием, приемом этанола, наследственными метаболическими нарушениями.
В нормальных условиях существует равновесие между ацетоацетатом, β-гидроксибутиратом и ацетоном. Однако при тканевой гипоксии это соотношение может нарушаться. В норме отношение β-гидроксибутирата к ацетоацетату составляет 2:1. У больных диабетическим кетоацидозом это соотношение может увеличиваться до 2,5:1 и даже до 3:1, а при сочетании диабетического кетоацидоза с недостаточностью тканевой перфузии, которая обусловливает развитие лактоацидоза, это соотношение может увеличиваться до 8:1 [33]. При улучшении тканевой оксигенации может повышаться количество кетоновых тел за счет преобразования β-гидроксибутирата в ацетоацетат. Это изменение в состоянии больного может быть ошибочно расценено как усугубление кетоацидоза [34].
При голодании уменьшается количество анионов HCO3–, однако концентрация этого аниона редко снижается менее 18 мЭкВ/л. Кроме того, отмечается снижение концентрации инсулина, однако уровень инсулина не снижается столь же значимо, как при диабетическом ацидозе.
У людей, злоупотребляющих алкоголем, может развиваться выраженный ацидоз, который часто сопровождается лактоацидозом [35]. Концентрация глюкозы у этих пациентов снижена, поэтому внутривенное введение декстрозы (Глюкозы♠) стимулирует секрецию инсулина и способствует коррекции кетоацидоза. Применение инсулина в данных обстоятельствах следует избегать.
Уремический ацидоз
Почечная недостаточность не приводит к ацидозу, если скорость клубочковой фильтрации не снижается менее 20 мл/мин, а концентрация азота и креатинина в крови не превышает 40 (14,3 ммоль/л) и 4 мг/дл (354 ммоль/л) соответственно. При развитии ацидоза отмечается уменьшение способности почек экскретировать как катионы NH4+, так и анионы. При острой почечной недостаточности концентрация анионов HCO3– снижается на 1–2 мЭкВ в день. Лечебные мероприятия становятся необходимыми при снижении концентрации анионов HCO3– менее 1 мЭкВ.
Гиперхлоремический ацидоз
Метаболический ацидоз при отсутствии увеличения анионного разрыва обычно сопровождается гиперхлоремией. Развитие гиперхлоремического ацидоза обычно связано с почечными и желудоч- но-кишечными заболеваниями.
Ацидоз, вызванный нарушением функции почечных канальцев, принято делить на 4 формы [36].
1-й тип ацидоза вызван нарушением функции дистальных почечных канальцев. Этот вид ацидоза, называемый «классический», обусловлен нарушением секреции кислот в дистальном отделе почечных канальцев [37]. Поскольку именно дистальная часть нефрона определяет кислотную среду мочи, то при нарушении функции этого отдела нефрона pH мочи обычно не снижается менее 5,3. В сыворотке крови концентрация анионов HCO3– ниже 10 мЭкВ/л. Экскреция анионов HCO3– обычно низкая, поскольку основная часть реабсорбции этого аниона происходит в проксимальном отделе. После дополнительного введения анионов HCO3– у пациентов с этим видом нарушения почечной функции не наблюдается соответствующее повышение парциального напряжения CO2 в моче. У здоровых людей дополнительное введение анионов HCO3– приводит к повышению парциального напряжения CO2 в моче и может достигать уровня более чем 150 мм рт.ст. Эти изменения объясняются тем, что в дистальном отделе нефрона происходит транспорт ионов H+, которые затем участвуют в формировании молекул H2CO3. У больных с нарушением функции почечных канальцев парциальное напряжение CO2 в моче остается на уровне менее 40 мм рт.ст.
Данный вид нарушений может наблюдаться при аутоиммунных нарушениях, при заболеваниях печени и почек, при различных мутациях, которые влияют на фермент — карбоангидразу II. Хронический ацидоз может вызывать деминерализацию костной ткани с высвобождением ионов Ca2+, Mg2+ и PO42– и выведением этих ионов с мочой. Кроме того, наблюдается развитие гипокалиемии, которая может приводить к мышечной слабости и даже к параличу. Лечение взрослых 1 мЭкВ/л NaHCO3 бывает достаточным для уменьшения деминерализации и гипокалиемии.
2-й тип ацидоза вызван нарушением функции проксимальных почечных канальцев.
При этом виде патологии наблюдается нарушение реабсорбции анионов HCO3–. У здоровых людей анионы HCO3– практически полностью возвращаются из мочи в кровь до тех пор, пока концентрация этого аниона в крови не превысит 22–24 мЭкВ/л. У больных с нарушением функции проксимальных почечных канальцев максимальный уровень реабсорбции может достигать лишь 18 мЭкВ/л. Дистальный отдел нефрона может реабсорбировать лишь 15–20% профильтрованного количества HCO3–. Поэтому pH мочи повышается,
97
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Раздел 2
а концентрация анионов HCO3– в плазме снижается. При лечении этого вида ацидоза для взрослых больных требуется введение 10–15 мЭкВ/кг в день NaHCO3.
3-й тип ацидоза вызван нарушением функции почечных канальцев.
Этот тип нарушений включает в себя черты патологии как проксимального, так и дистального отдела нефрона. Однако данный вид патологии не имеет большого клинического значения. Наибольшая часть больных представлена новорожденными и маленькими детьми с наследственной патологией дистального отдела нефрона [38], которая начинается с потери бикарбонатов в проксимальном отделе нефрона.
4-й тип ацидоза Причина данного типа ацидоза — уменьшение
синтеза альдостерона или ответа почек на альдостерон. В отличие от вышеописанных нарушений, при данной патологии наблюдаются гиперхлоремический ацидоз и гиперкалиемия, поскольку альдостерон стимулирует секрецию ионов H+ и K+ в дистальном отделе нефрона. Наиболее часто развитие этих нарушений вызвано снижением секреции ренина у пожилых больных диабетической нефропатией. Снижение синтеза альдостерона может выявляться у больных, находящихся в критическом состоянии при септическом или кардиогенном шоке. У больных, получающих калийсберегающие мочегонные средства, ингибиторы ангиотензин-превращающего фермента (ИАПФ), гепарин натрия (Гепарин♠), также может выявляться гиперкалиемия. С гиперкалиемией связан высокий риск развития аритмий, артериальной гипертензии, слабости.
Существуют непочечные причины гиперхлоремического ацидоза. Наиболее частой причиной развития данного состояния является диарея. С каждым литром жидкости, содержащейся в стуле при диарее, из организма больного выводится около 200 мЭкВ HCO3–. Потеря ионов K+ также весьма существенна, она может составить около 30–60 мЭкВ ионов K+ на 1 л жидкости [39]. Кроме того, уменьшение объема внеклеточной жидкости способствует секреции альдостерона, который увеличивает выведение ионов K+ с мочой.
При респираторном алкалозе компенсаторным механизмом является снижение реабсорбции анионов HCO3– в проксимальном отделе почечных канальцев. Поэтому при компенсаторных реакциях в ответ на респираторный алкалоз может развиваться гиперхлоремический ацидоз.
Клинические проявления
Самым очевидным признаком метаболического ацидоза является реакция респираторной системы, так называемый респираторный ответ. Для больных метаболическим ацидозом характерно медленное глубокое дыхание (дыхание Куссмауля). Такое дыхание наиболее эффектив-
ное, поскольку доля вентиляции мертвого пространства от общей вентиляции минимальна. При более тяжелых формах метаболического ацидоза, помимо одышки, пациенты жалуются на головную боль, тошноту, рвоту, могут развиться ступор или кома, отек легких, аритмия [40–42].
Лабораторные показатели при метаболическом ацидозе (табл. 2.2)
Таблица 2.2. Лабораторные показатели при метаболическом ацидозе
Тип |
рН |
PCO , |
НСО –, |
ВЕ(ВА), |
|
|
2 |
3 |
ммоль/л |
|
|
мм |
ммоль/л |
|
|
|
рт.ст. |
|
|
|
|
|
|
|
Деком- |
<7,37 |
Норма |
<21 |
<–2 |
пенси- |
|
|
|
|
рован- |
|
|
|
|
ный |
|
|
|
|
Субком- |
Норма |
Снижен- |
<21 |
<–2 |
пенси- |
|
ное |
|
|
рован- |
|
(<35) |
|
|
ный |
|
|
|
|
|
|
|
|
|
Терапия
Лечение метаболического ацидоза должно быть направлено на уменьшение метаболических расстройств. Например, при лечении метаболических расстройств, вызванных кетоацидозом, применение инсулина и восстановление объема являются основой терапии. Диализ будет эффективен при уремическом ацидозе. Если лактоацидоз сопряжен
снедостаточной перфузией тканей, то медикаментозные мероприятия должны быть направлены на восстановление кровотока в тканях.
Терапия NaHCO3 показана при гиперхлоремическом ацидозе и менее эффективна при ацидозе
сувеличением анионного разрыва [43]. С осто-
рожностью следует применять NaHCO3 при лечении лактоацидоза [44], поскольку защелачивание может стимулировать синтез молочной кислоты и вызывать высвобождение CO2 из HCO3–.
Метаболический алкалоз
Метаболический алкалоз определяется как избыток бикарбоната или недостаток водородных ионов и, следовательно, как положительный сдвиг буферных оснований.
Метаболический алкалоз всегда сопровождается гипокалиемией, так как ионы водорода Н+ заменяются ионами К+.
Причины метаболического алкалоза
Алкалоз, связанный с уменьшением внеклеточного объема
Длительная рвота — одна из самых частых причин метаболического алкалоза. Потеря кислоты из желудочно-кишечного тракта приводит к алкалозу, который вначале связан с увеличением выделения ионов Na+ почками. Секреция альдостерона увели-
98

Респираторная физиология
чивается, клубочковая фильтрация снижается. Все эти факторы увеличивают реабсорбцию анионов HCO3–. Анионы Cl– значительно реабсорбируются в канальцах, и концентрация их в моче может быть менее 10 мЭкВ. При сохранении поступления ионов Na+ в дистальный отдел нефрона, несмотря на уменьшение внеклеточного объема (например, при мочегонной терапии), секреция ионов H+ увеличена. Диуретические средства (фуросемид, тиазиды), увеличивая секрецию ионов H+ и К+ в дистальном отделе нефрона, могут приводить к развитию гипокалиемического алкалоза.
Метаболический алкалоз может быть выявлен у пациентов с хронической гиперкапнией, находящихся на механической вентиляции легких. Необходимо с осторожностью увеличивать вентиляцию, чтобы избежать развития опасного для жизни пациента алкалоза.
Метаболический алкалоз также может развиваться у больных МВ. У этих больных с потом выводится больше анионов Cl–, чем анионов HCO3–.
Алкалоз при нормальном или увеличенном внеклеточном объеме
Данное состояние может развиваться при чрезмерной секреции альдостерона. Отмечается увеличение секреции ионов H+ и K+, а также задержка ионов Na+ в дистальном отделе нефрона, что приводит
кразвитию гипокалиемического алкалоза [45, 46].
Убольных с отеками, связанными с болезнями печени, нефротическим синдромом, сердечной недостаточностью (СН), назначение мочегонных средств может привести к развитию гипокалиемического алкалоза.
Клинические проявления
При алкалозе увеличивается сродство гемоглобина к кислороду, что уменьшает поступление кислорода в ткани. Алкалоз снижает вентиляцию и вызывает спазм периферических сосудов, что еще больше снижает поступление кислорода в ткани.
Наджелудочковые и желудочковые аритмии могут быть выявлены у больных, находящихся на ИВЛ [47].
Лабораторные показатели при метаболическом алкалозе в таблице 2.3.
Таблица 2.3. Лабораторные показатели при метаболическом алкалозе
Тип |
рН |
PCO2, |
НСО3–, |
ВЕ(ВА), |
|
|
мм рт.ст. |
ммоль/л |
ммоль/л |
|
|
|
|
|
Деком- |
>7,45 |
Норма |
>27 |
>+ 3 |
пенси- |
|
|
|
|
рован- |
|
|
|
|
ный |
|
|
|
|
|
|
|
|
|
Субком- |
Норма |
Повышен- |
>27 |
>+ 3 |
пенси- |
|
ное |
|
|
рован- |
|
(>46) |
|
|
ный |
|
|
|
|
|
|
|
|
|
Терапия
Для адекватной терапии необходимо оценить состояние внеклеточного объема, состояние которого можно косвенно определить по концентрации ионов Cl– в моче. Так, у больных с уменьшением внеклеточного объема эта концентрация будет ниже 10 мЭкВ/л, в то время как у больных с повышенным внеклеточным объемом эта величина будет выше 20 мЭкВ/л.
Для больных с уменьшением внеклеточного объема показано применение жидкостей, содержащих ионы Na+, Cl–, K+ и Mg2+.
При увеличении уровня минералокортикоида может быть полезно назначение спиронолактона.
В некоторых случаях пациенты могут быть интубированы для проведения гиповентиляции, чтобы увеличить парциальное напряжение CO2 и, таким образом, снизить pH. При тяжелых формах метаболического алкалоза уменьшение концентрации анионов HCO3– в плазме крови может быть достигнуто применением гемодиализа.
Респираторный ацидоз
Дыхательный ацидоз определяется как повышение парциального давления CO2 из-за уменьшения его выделения легкими. Из уравнения Henderson– Hasselbalch (pH = pK + log [HCO3–] / (α × PCO2)) следует, что при повышении PCO2 величина рН снижается. Респираторный ацидоз является жизнеугрожающим состоянием, так как, во-первых, при задержке развития компенсаторных реакций со стороны почек происходит значительное снижение рН, во-вторых, гиповентиляция всегда сопровождается недостаточностью кислорода, а из-за гиперкапнии углекислота быстро приникает в клетки.
Парциальное напряжение CO2 сохраняется в достаточно узком диапазоне нормальных значений благодаря контролю со стороны дыхательного центра. На изменения парциального напряжения CO2 отвечают хеморецепторы, которые расположены в продолговатом мозге и в сонных артериях. Однако при хронической гипоксии и гиперкапнии (например, при ХОБЛ) центральные хеморецепторы могут подавляться.
Причины
Любой процесс, который влияет на вентиляцию, может вызвать развитие респираторного ацидоза. ХОБЛ — самая частая причина респираторного ацидоза, связанная с уменьшением альвеолярной вентиляции. Распространенный инфильтративный процесс в легких (например, пневмония, кардиогенный и некардиогенный отек легких) могут заметно уменьшить альвеолярную вентиляцию.
При параличе диафрагмы и обширных переломах ребер также может развиваться респираторный ацидоз.
При тромбоэмболии ЛА легочная вентиляция увеличивается, но без должного эффекта.
99
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
