
8. Биопотенциал. Потенциал покоя или потенциал действия ; Регистрация биопотенциалов в медицинской практике.
Биопотенциалыпо современным представлениям являются мембранными.
Причиной возникновения биопотенциалов является неравномерное распределение ионов кальция и натрия между содержимым клетки и окружающей средой. Через клеточную мембрану ионы К+ и Na+ самопроизвольно передвигаются по ионным каналам в соответствии с градиентом концентрации. Проницаемость клеточной мембраны для ионов К+и Na+ зависит от её состояния – покоя или возбуждения.
Потенциалом покоя называется мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящийся в невозбужденном состоянии. Определить потенциал покоя можно с помощью двух микроэлектродов вводимых внутрь клетки и в наружной раствор. Величину потенциала можно рассчитать по уравнению Нернста для концентрационной цепи
![]()
Потенциал покоя присущ всем без исключения клеткам.
Потенциал
действия
называется быстрое колебание (повышение
и падение) мембранного потенциала,
возникающее при возбуждении клеточной
мембраны. Такие клетки организма как
нервные, мышечные, железистые способны
находиться в состоянии возбуждения.
При раздражении клетки мембрана
становиться более проницаемой для ионов
Na+,
чем для К+, что приводит к очень быстрому
сдвигу мембранного потенциала в
положительном направлении. Величина
потенциала действия определяется
выражением:
Генерирование мембранного потенциала связано с работой сердца, мозга, мышц. Электрические потенциалы, возникающие при деятельность сердца, можно регистрировать с помощью электрокардиографа на электрокардиограмме. ЭКГ- важнейшая характеристика сердечной деятельность. Биоэлектрические потенциалы мозга регистрируются на электроэнцефалограмме, желудка – на электрогастограмме и т.д.
9. Гетерогенные равновесия и организм. Дайте определения ПАВ, ПИВ и ПВН, приведите примеры. Изотермы поверхностного натяжения для ПАВ, ПИВ, ПВН. Особенности строения ПАВ, их условное изображение. Примеры ПАВ в живых организмах. Что такое поверхностное натяжение? От таких факторов оно зависит у чистых жидкостей и у растворов? Когда наблюдается изменение поверхностного натяжения биологических жидкостей?-
Ответ
В организме человека важнейшие гетерогенные процессы с участием неорганических ионов связаны в первую очередь с образованием и растворением костной ткани.
Растворенное вещество понижает О(сигма) растворителя. Это –это поверхностно активные вещества (ПАВ) поотношению. К воде ПАВ являются спирты и кислоты алифатического ряда, сложные эфиры, белки.
Растворенное вещество незначительно повышает О (сигма) растворителя – поверхностно инактивные вещества ПИВ.
о отношению к воде ПИВ являются неорганические кислоты, щелочи и соли.
Растворенное вещество не изменяет о (сигма) растворителя. Это поверхностно неактивные вещества ПНВ. По отношению к воде ПНВ является сахароза.
Зависимость о(сигма) от концентрации раствора показывают изотермы поверхностного натяжения. Биологические наиболее важны ПАВ, которые и будут рассматриваться подробно. Молекулы ПАВ состоят из полярных групп (голова) – ОН, -СООН, NН2 и т.п. и неполярной углеводородной части (Хвост).
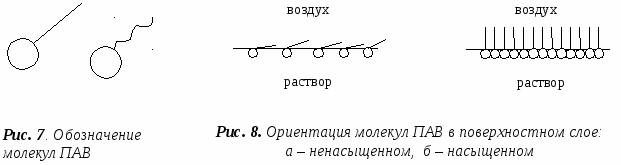
Такое строение придает ПАВ дифильность (двойственность) : полярная группа гидратируется и обуславливает родство ПАВ к воде – дифильность; Хвост имеет малое сродство к воде и придает ПАВ гидрофобность. Примеры: Фосфолипиды, белки, нуклеиновые кислоты, желчные кислоты и их соли.
ПАВ использует для приготовления свечей и мазей, стабилизации эмульсии. Некоторые ПАВ имею антимикробное действие и применяются в хирургии в качестве антисептиков для обработки операционного поля. Антимикробное действие ПАВ связывают на проницаемость с действием мембран а также ингибирующим действием на ферментативные системы микроорганизмов. Значение для живых организмов: большинство пищевых веществ – ПАВ, первый этап их усвоения – положительнаяадсобция, химические превращения вторичны.
Молекулы в объеме жидкости равномерны окружены такими же молекулами, поэтому силовые поля полностью скомпенсированы. Молекулы поверхностного слоя взаимодействуют как с молекулами одной фазы, так и с молекулами другой фазы. Поэтому равнодействующая молекулярных сил в поверхностном слое не равна 0 и направленна внутрь той фазы, с которой взаимодействие больше. Таким образов возникает поверхностное натяжение о(сигма), стремящийся сократить поверхность
Для чистых жидкостей о(сигма) зависит рот 1)природы жидкости, 2)температуры 3)давление на границе жидкость\газ
Для растворов о(сигма) зависит от всех этих факторов, а также от природы и концентрации растворенного вещества. \Измерение о(сигма) биологических жидкостей используют в диагностических целях, т.к она меняется при заболеваниях. Например: о (сигма) плазмы крови меняется при анафилактическом шоке, раке. О (сигма) сыворотки в крови уменьшается с увеличением возраста человека.
Величина поверхностной энергии Гиббса:
Gs=o*S
№13. Альдегиды–это органические соединения, молекулы которых содержат карбонильную группу, связанную с атомом водорода и углеводородным радикалом.
Электронное строение оксогруппы-атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2 гибридизации. Sp-гибридные облака идут на образование σ-связи, а негибридные р-облака атомов углерода и кислорода идут на образование π-связи между собой. При образовании π-связи выделяется меньше энергии, чем при образовании σ-связи, поэтому атом кислорода как более электроотрицательный тянет на себя электронную плотность по π-связи от атома углерода и на нем возникает δ-, а на атоме углерода δ+. Чем больше положительный заряд на атоме углерода карбонильной группы, тем легче идут реакции нуклеофильного присоединения, поэтому альдегиды более реакционно способные соединения по сравнению с кетонами.
Реакции
нуклеофильного присоединения
(АN)-реакцииприсоединения.
В карбонильной группе
 -
гибридизованный атом углерода образует
три δ-связи,
лежащие с ним в одной плоскости, и π-связь
располагается над и под плоскостью
С-Оδ-связи. Она сильно поляризована и
электронная пара смещена к более
отрицательному атому кислорода.
Вследствие этого на нем возникает
частичный отрицательный заряд (-δ), а на
атоме углнрода – частично полож. заряд
(+δ).
-
гибридизованный атом углерода образует
три δ-связи,
лежащие с ним в одной плоскости, и π-связь
располагается над и под плоскостью
С-Оδ-связи. Она сильно поляризована и
электронная пара смещена к более
отрицательному атому кислорода.
Вследствие этого на нем возникает
частичный отрицательный заряд (-δ), а на
атоме углнрода – частично полож. заряд
(+δ).
Т.о. электронодефицитный атом углерода явл. электрофилом. Он склонен подвергаться атаке отрицательно заряженных нуклеофильных реагентов. Поскольку карбонильная группа содержит кратную связь,то для альдегидов и кетонов характерны реакции нуклеофильного присоединения (АN).
Образование открытых полуацеталей и ацеталей.
Если альдегидная и спиртовая группы находятся в одной формуле, то образуется циклический полуацеталь
формула
При обработке полуацеталя избытком спирта в кислой среде его гидроксильная группа замещается с отщеплением воды и образуется ацеталь
Формула


Восстановление.
При восстановлении альдегидов образуются первичные спирты, кетонов – вторичные спирты:

Альдегиды, занимая по степени окисления промежуточное положение между спиртами и кислотами, связаны с этими соединениями окислительно-восстановительными переходами, которые играют важную роль в метаболизме органических веществ.
Окисление.
Окисление кетонов происходит сложнее, с разрывом углеродной цепи и образованием либо двух кислот, либо кислоты и кетона с более короткими цепями.
Присоединение-отщепление.
Взаимодействие альдегидов и кетонов с первичными аминами осуществляются по механизму присоединения-отщепления. Сначала происходит нуклеофильное присоединение по карбонильной группе, затем – отщепление воды с образованием аминов

№14.Альдегиды –это органические соединения, молекулы которых содержат карбонильную группу, связанную с атомом водорода и углеводородным радикалом.
Кето-енольная таутомерия.
Таутомерия – равновесная динамическая изомерия. Она заключается во взаимном превращении изомеров вследствие переноса какой-либо подвижной группы и соответствует перераспределению электронной плотности.
В карбонильных соединениях кето-енольная таутомерияпроявляется в том, что из-за переноса протона карбонильное соединение (кетонная форма)сущ-ет в равновесии с его енольнымизомером (енольная форма).

Реакции альдольной конденсации.
При взаимодействии двух альдегидов в присутствии кислот или щелочей образуется альдоль(альдольная конденсация), который затем, отщепляя молекулы воды, превращается в ненасыщенный альдегид(кротоновая конденсация).

Галомофорные реакции.
Осуществляются при взаимодействии альдегидов или кетонов с галогенами. Галогены замещают один или несколько α водородных атомов в углеводородных радикалах. При этом образуется галогенкарбонильные соединения, которые расщепляются щелочью с образованием галоформа.
№15. Кетоны — органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Электронное строение оксогруппы-атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2 гибридизации. Sp-гибридные облака идут на образование σ-связи, а негибридные р-облака атомов углерода и кислорода идут на образование π-связи между собой. При образовании π-связи выделяется меньше энергии, чем при образовании σ-связи, поэтому атом кислорода как более электроотрицательный тянет на себя электронную плотность по π-связи от атома углерода и на нем возникает δ-, а на атоме углерода δ+. Чем больше положительный заряд на атоме углерода карбонильной группы, тем легче идут реакции нуклеофильного присоединения, поэтому альдегиды более реакционно способные соединения по сравнению с кетонами.
Реакции нуклеофильного присоединения (АN)-реакцииприсоединения. В карбонильной группе - гибридизованный атом углерода образует три δ-связи, лежащие с ним в одной плоскости, и π-связь располагается над и под плоскостью С-Оδ-связи. Она сильно поляризована и электронная пара смещена к более отрицательному атому кислорода. Вследствие этого на нем возникает частичный отрицательный заряд (-δ), а на атоме углнрода – частично полож. заряд (+δ).
Т.о. электронодефицитный атом углерода явл. Электрофилом. Он склонен подвергаться атаке отрицательно заряженных нуклеофильных реагентов. Поскольку карбонильная группа содержит кратную связь,то для альдегидов и кетонов характерны реакции нуклеофильного присоединения (АN).
Образование открытых полукеталей и кеталей.
Кетоны по сравнению с альдегидами взаимодействуют со спиртами значительно труднее, образуя полукетали и кетали.

Восстановление.
При восстановлении альдегилов образуются первичные спирты, кетонов – вторичные спирты:
Присоединение-отщепление.
Взаимодействие альдегидов и кетонов с первичными аминами осуществляются по механизму присоединения-отщепления. Сначала происходит нуклеофильное присоединение по карбонильной группе, затем – отщепление воды с образованием иминов
Билет 16.
Карбоновые кислоты - это производные углеводородов, в которых один или несколько атомов углеводорода замещены карбоксильной группой.
Электронное строение карбоксильной группы:
Карбоксильная группа является сопряжённой системой, в которой не поделённая пара электронов атома кислорода OH- группы вступает в сопряжение сπ–связью/ p, π – сопряжение. Это обуславливает следующее распределение электронной плотности в молекулах кислот:
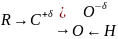
![]()
![]()
![]()
![]()
![]()
![]()
![]()
В
результате атом углерода в карбоксильной
группе, приобретая частичный положительный
заряд
 , становится электрофильным центром.
Он склонен к атаке нуклеофильных
реагентов. Однако, проявление у OH–группы
электродонорных свойств / +М- эффект/ и
наличие сопряжения вызывает смещение
электронной плотности от гидроксильной
группы в сторону молекулы. Вследствие
этого:
, становится электрофильным центром.
Он склонен к атаке нуклеофильных
реагентов. Однако, проявление у OH–группы
электродонорных свойств / +М- эффект/ и
наличие сопряжения вызывает смещение
электронной плотности от гидроксильной
группы в сторону молекулы. Вследствие
этого:
Величина частичного положительного заряда на атоме углерода в карбоксильной группе меньше, чем в карбонильной группе>C=O.Поэтому кислоты менее активны к восприятию атаки нуклеофильного реагента, чем альдегиды или кетоны. Для кислот более характерны реакции нуклеофильного замещения ,а не присоединения
Полярная σ-связь в гидроксильной группе ещё более поляризуется и электронная плотность сдвигается от атома водорода. В результате он приобретает большую активность. Это обуславливает повышенную кислотность карбоновых кислот по сравнению со спиртами.
Кислотные свойства карбоновых кислот:
С разрывом OH-связи:
1.Диссоциация карбоновых кислот в водном растворе с образованием карбоксилат/ацилат/-иона и гидратированного протона:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() +H2O
↔ R
– C
+H2O
↔ R
– C + H3O+
(ацилат ион)
+ H3O+
(ацилат ион)
2.Взаимодействие со щелочными металлами и щелочами с образованием солей:
R-C + NaOH ↔ R-C
+ H2O
+ NaOH ↔ R-C
+ H2O
Поскольку карбоновые кислоты слабее минеральных , их соли в водном растворе гидролизованы и дают щелочную реакцию.
Реакция с разрывом C-OHсвязи , протекающая по механизму нуклеофильного замещения /Sn/:
В этих реакциях атом углерода карбоксильной группы является электрофильным центром. Он атакуется нуклеофильным реагентом с образованием промежуточного нестабильного продукта/аниона/, который далее стабилизируется путём отщепления уходящей группы –OH. Реакция осуществляется либо при наличии сильного нуклеофила, либо в условиях кислотного катализа:
+
:Y-
→
 → R- C
+ :OH-
→ R- C
+ :OH-
Субстрат нуклеофил промежуточный продукт уходящая группа
Образование хлорангидридов:
R
– C+δ + PCl5
→ R
– C
+ POCl3
+ HCl
+ PCl5
→ R
– C
+ POCl3
+ HCl
Хлорангидрид
Образование амидов:
Поскольку аммиак не является достаточно сильным нуклеофилом, амиды карбоновых кислот получают изиххлорангидридов, т.к. хлор- более легко уходящая группа, чем –OH
R+δ – C + H-NH2 → R – C + HCl
Амид
Реакция этерификации:
Это обратимый процесс образования сложных при взаимодействии карбоновых кислот со спиртами в присутствии минеральных кислот (HCl,H2SO4)
R1
– C+δ
+ HO – R2 R1
– C
+
H2O
R1
– C
+
H2O
Сложный эфир
Реакция образования ангидридов при взаимодействии двух карбоновых кислот в присутствии водоотнимающего агента ( P2О5)

Представители и их медико- биологическое значение:
Насыщенные:
м![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() етановая
(муравьиная) кислота. Содержится в
крапиве и выделениях муравьёв. При
попадании на кожу вызывает ожоги.
етановая
(муравьиная) кислота. Содержится в
крапиве и выделениях муравьёв. При
попадании на кожу вызывает ожоги.
Э![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() тановая
(уксусная) кислота – естественный
метаболит, продукт уксуснокислотного
брожения сахаров. В медицине используется
в виде солей.
тановая
(уксусная) кислота – естественный
метаболит, продукт уксуснокислотного
брожения сахаров. В медицине используется
в виде солей.
Б![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() утановая(масляная)
кислота. Имеет неприятный запах,
содержится в поте.
утановая(масляная)
кислота. Имеет неприятный запах,
содержится в поте.
Н
![]()
![]()
![]() енасыщенные:
енасыщенные:
Пропеновая кислота (акриловая). Её эфиры используются в производстве пластмасс для медицинского приборостроения.
