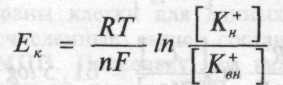Многие клеточные мембраны обладают свойством полупроницаемости. На таких мембранах наблюдается явление осмоса.
Осмос – это односторонняя диффузия молекул растворителя в сторону более концентрированного раствора через полупроницаемые мембраны.
С точки зрения термодинамики движущей силой осмоса является стремление системы к выравниванию концентраций.
Осмотическое давление – величина, измеряемая минимальным гидравлическим давление, которое нужно приложить к раствору, чтобы осмос прекратился.
Закон Вант-Гоффа:
Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объём, равный объёму раствора.
P=CRT
Где P – осмотическое давление
C – молярная концентрация вещества
R – универсальная газовая постоянная (8,314 Дж/моль * К)
T – абсолютная температура
Электролиты создают гораздо большее осмотическое давление, чем неэлектролиты в растворе той же концентрации. Если образуютяассоциаты молекул (т.е. полимерные молекулы), то осмотическое давление меньше.
Для растворов электролитов и веществ, образующих ассоциаты:
P=iCRT
Где i – изотонический коэффициент. Рассчитывается по формуле:
i=a(v-1) +1
где a – степень диссоциации или ассоциации
v - число ионов образующихся при диссоциации одной молекулы
Роль осмотического давления в различных физиологических процессах велика. Постоянство осмотического давления (изоосмия) тех или иных физиологических сред представляет собой фундаментальное физико-химическое требование гомеостаза. Осмотическое давление в клетке всегда несколько выше, чем во внеклеточной жидкости. Осмотическое давление обуславливает упругость клетки – тургор.
Изотонический раствор – это раствор с осмотическим давлением, равным давлению данной жидкости (стандарта). В медицине - плазма крови.
Гипотонический – с меньшим, а Гипертонический – с большим осмотическим давлением, чем стандарт.
В биологических жидкостях в большом количестве содержатся неорганических и органических веществ в виде молекул, ионов и коллоидных частиц. Их суммарная концентрация – Осмотическая концентрация(осмолярность)
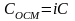
Где i – изотонический коэффициент.
Изотонические растворы широко применяются в медицине. При различных процедурах в кровь человека в больших количествах можно вводить только изотонические растворы.
Гипертонические растворы в небольших количествах часто применяют в медицине, т.к. это позволяет вводить большую дозу препарата в небольшом объеме инъекции. С клетками крови происходит плазмолиз, но это не опасно для здоровья, т.к. объем крови велик, осмотическое давление быстро восстанавливается. Гипертонические растворы применяют для промывания и обработки ран, для очищения ран от гноя.
При помещении клетки в гипотонический раствор наблюдается эндоосмос(или плазмолиз). Вода переходит из раствора внутрь клетки. Процесс сопровождается увеличением клетки в объеме, что может завершится разрывом ее оболочки – цитолизом.
Разрыв эритроцитарных оболочек называется гемолизом. Гемоглобин переходит в раствор и окрашивает его в красный цвет. Поэтому в медицинской практике гипотонические растворы не применяют.
Растворимость газов подчиняется правилу «подобное растворяется в подобном». Поэтому растворимость кислорода и азота, в молекулах которых ковалентная связь, невелика. Растворимость газов так же зависит от температуры и давления. С повышение давления растворимость газов в жидкости увеличивается, а с повышением температуры – падает.
Закономерность растворимости газов от давления описывается законом Генри:
При постоянной температуре масса газа в определенном объеме жидкости прямо пропорциональна давлению газа:
С=k*P
Где С – массовая концентрация газа в насыщенном растворе
k - коэффициент, зависящий от природы газа, растворителя ип от температуры,
P - давление газа над раствором
Если над жидкостью имеется смесь газов, то этот случай описывает Закон Дальтона:
Растворимость каждого из компонентов газовой смеси при постоянной температуре прямо пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси:
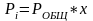
Где х – молярная доля данного газа.
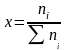
Гдеni – число молей газа,
 -
общее число молей газов, оставляющих
данную смесь
-
общее число молей газов, оставляющих
данную смесь
Исследованием растворимости газов в крови занимался русский физиолог И.М. Сеченов. Он установил, что растворимость газов в растворах электролитов меньше, чем в чистом растворителе.
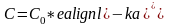
Где С – растворимость газа в растворе электролита
С0 – растворимость газа в чистом растворителе
k- константа, зависящая от температуры и природы компонентов раствора
a- концентрация электролита
е – основание натурального логарифма
В соответствии с законом Сеченова не только низкомолекулярные электролиты, но и белки, липиды и другие вещества, содержание которых в крови может меняться в известных пределах, оказывает влияние на растворимость кислорода и углекислого газа в крови.
Диффузия – самопроизвольный процесс выравнивания концентрации растворенного вещества в результате хаотичного теплового движения частиц раствора.
Скорость диффузии описывается законом Фика:
Скорость диффузии прямо пропорциональна площади, через которую осуществляется диффузия, и градиенту концентрации вещества
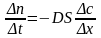
Где
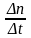 – скорость диффузии
– скорость диффузии
D- коэффициент диффузии
S- площадь, через которую осуществляется диффузия
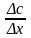 -
градиент концентрации
-
градиент концентрации
Знак минус показывает, что диффузия происходит из области большей концентрации в область меньшей концентрации вещества
Диффузия играет важную роль в биологических системах. Перемещение питательных веществ и продуктов обмена в тканевых жидкостях производится за счет диффузии.
Диффузия играет большую роль в процессе насыщения крови кислородом в легких.
Если растворенные частицы имеют электрический заряд, то скорость диффузии зависит не только от градиента концентрации, но и от электрического градиента мембраны. Может происходить перенос ионов в направлении, противоположном концентрационному градиенту, если есть противоположно направленный электрический градиент. Совокупность концентрационного и электрического градиентов - Электрохимический градиент.
Пассивный транспорт ионов через мембраны всегда происходит по электрохимическому градиенту.
Перенос веществ из области с меньшей концентрацией в область с большей концентрацией против градиента – активный транспорт.Такой процесс не может идти самопроизвольно и требует энергетических затрат.
3.Испарение зависит от температуры и площади поверхности растворителя. В растворах часть поверхности занята растворенным веществом, что препятствует испарению молекул растворителя. Кроме того, растворенные молекулы способны удержать вокруг себя молекулы растворителя, не дают им испаряться. Все это приводит к тому, что наблюдается явление понижение давления пара растворителя над раствором и, как следствие этого, повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем.
1-й закон Рауля
Относительное понижение давления пара над раствором по сравнению с чистым растворителем равно молярной доле растворенного вещества
Для неэлектролитов
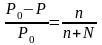
Для электролитов и веществ, образующих ассоциаты
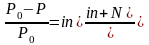
ГдеP0– давление пара чистого растворителя
Р – давление пара растворителя над раствором
n- число молей растворенного вещества
N- число молей растворителя
i- изотонический коэффициент
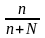 -
молярная доля растворенного вещества
-
молярная доля растворенного вещества
2-й закон Рауля
Повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества
Для неэлектролитов
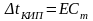
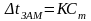
Для электролитов и веществ, образующих ассоциаты
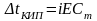

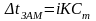
Где
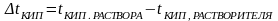
Е – эбуллиоскопическая константа
К – криоскопическая константа
- изотонический коэффициент
- моляльная концентрация
На измерении повышения температуры кипения и понижения температуры замерзания растворов основаны методы исследования – эбуллиометрия ( эббулиоскопия) и криометрия (криоскопия).
Криометрическому методу исследования свойств биополимеров отдается предпочтение, т.к. температуру замерзания можно измерить с большей точностью, и при низких температурах не происходит изменений в структуре растворенных веществ и растворителя.
Понижение температуры замерзания как показатель гомеостаза – постоянная величина.
Молекулярные массы ВМС в разбавленных растворах определяют с помощью метода осмомметрии, измеряя их осмотическое давление.
4. Протолитические равновесия. «Кислота» и «Основание» с точки зрения протолитическиой теории. Какие кислоты и основания называются сопряженными? Приведите примеры. Механизм действия буферных систем (уравнение реакций взаимодействия компонентов буферной системы с сильной кислотой и сильной щелочью в ионном и молекулярном виде).
Ответ:
Буферные системы рассматриваются на основе протолитической теории кислот и оснований (Бренстед и Лоури 1923г). Теория называется протолитической или протонной потому, что главная роль в определении понятий кислота и основание отведена в ней протону Н.
В соотвествии с этой теорией:
Кислота- это вещество, частицы которого (молекулы или ионы) способны отдавать протоны (т.е доноры протонов).
Основание – это вещество, частицы которого (молекулы и ионы) способны присоединять протоны (акцепторы протонов).
Основание и кислота называются сопряженными, если они связаны соотношением:
ОСНОВАНИЕ+ПРОТОН=КИСЛОТА.
Например:
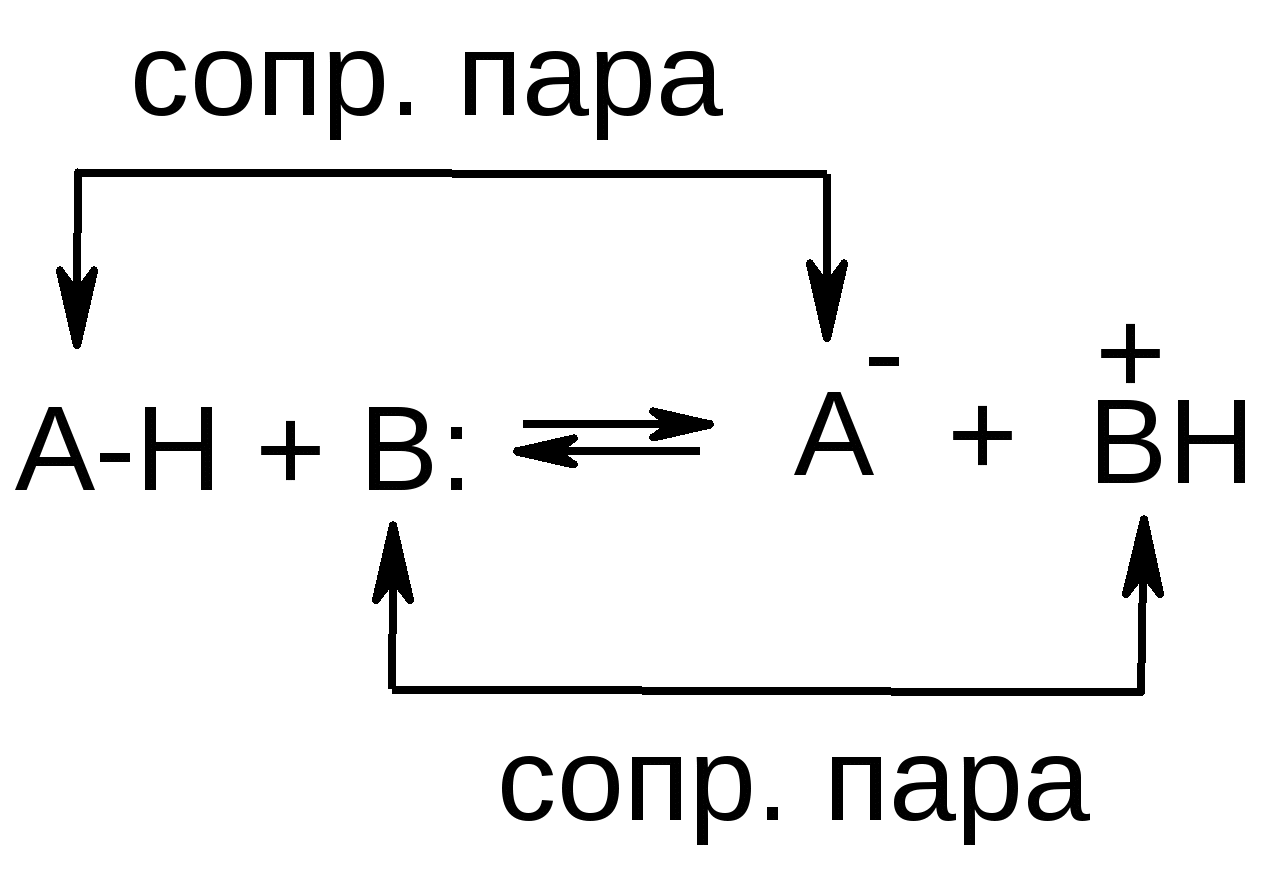
С точки зрения протолитической теории буферные системы - это смесь слабой кислоты и сопряженного ей основания или слабого основания и сопряженной ему кислоты. Механизм(или химизм) буферного действия. Характеризуется теми реакциями, которые протекают в буферном растворе придобавление сильной кислоты или щелочи. Они показывают почему рН при этом не изменяется. При написании уравнении характеризующих механизм буферного действия, нужно меть ввиду, что компоненты буфера придобавление сильной кислоты или сильной щелочи переходят друг в друга, никаких новых веществ не образуются. Это показано на схеме:
5. Кислотно-щелочное равновесие. Чему равно рН некоторых важнейших био жидкостей(крови, желудочного сока, слюны, поджелудочной железы)? Какие показатели используются при оценки KЩР. Что такое ацедоз и алколоз и компенсированный ацидоз и алколоз? Приведи примеры патологий при которых наблюдается ацидоз и алколоз. Что такое метаболический и респираторный ацидоз и алколоз. Коррекция ацидоза и алколоза. Различные среды организма человека имеют в норме следующие значения рН: кровь и спинно-мозговая жидкость 7,36-7,44 желудочный сок около 0,9 слюна 6,8 секрет поджелудочной железы 7,5- 8,0 желчь в пузыре 5, 4- 6, 9
Смещение значения рН крови в кислотную область от нормальной величины называется ацидозом , а в щелочную- алкалозом. Значительное смещение рН крови от нормы( ниже 6,8 или выше 8,0) вызывает смерть, так как при этом необратимо изменяется структура протоплазмы и нарушается течение ферментативных реакций. Важнейшим буферными основаниями являются гидрокарбонат- ионы и анионы группы белков.(НСО3).Пока концепция гидрокарбонат- иона в крови достаточно, образование кислот не приводит к существованию изменению рН. Имеет место компенсированный ацидоз. Но когда концепция НСО3 сильно понизится, ацидоз уже не компенсирован. Сдвиги ионного равновесия в организме наблюдается при травмах, оперативных вмешательствах, наркозе, сердечной недостаточности, нарушении деятельности дыхательных органов, болезнях почек, желудочно- кишечного тракта, эндокринных заболеваниях. ацидоз и алкалоз называются респираторными, если они развиваются в результате нарушения выведения углекислого газа при дыхании. Ацидоз и алкалоз называются метаболическими, если они возникают из-за того, что, или ткани вырабатывают избыток кислотных продуктов, или биожидкости выводят недостаточное количество кислот и основании ворганизма. Респираторный ацидоз— следствие пониженного выведения СО2 легкими- возникает при уменьшении минутного объема дыхания, при недостаточном кровообращении(болезни сердца) и при асфиксии механического порядка. Респираторный алкалоз— состояние, обусловленное избыточным выведением СО2 легкими. Метаболический ацидоз отражает либо накопление нелетучих кислот, либо потерю оснований. Наблюдается при нарушениях межуточного обмена и при недостаточном выделении этих кислот из организма. На нейтрализация кислот кислот расходуется буферные основания. Метаболический алкалоз вызывается уменьшением содержания органических кислот и увеличением содержания их солей(т.е оснований по теории Бренстеда- Лоури). Для проведения коррекции кислотно- щелочного равновесия необходимо выявить, какое звено в его регулировке нарушено. Для этого измеряют след показатели артериальной крови: 1. рН, которое является интегральным показателем кислотно-щелочного состояния. По величине рН можно судить о том, является ли содержание ионов Н+ в крови нормальным(рН 7,36- 7,44) или сдвинуто в ту или иную сторону. 2. рНСО2- парциальное давение углекислого газа- отражает концентрацию углекислоты в крови. 3. Избыток оснований ВЕ (от лат. «би- эксцесс» - избыток оснований). По величине ВЕ можно сделать вывод, о наличии метаболического нарушения КЩР. 4. Стандартный бикартный бикарбонат – это содержание гидрокарбонат- ионов НСО3- в цельной крови, по насыщенный кислородом и уравновешенный с газовой массой при 37^0С.В норме он равен 24 ммоль/л, его содержание возрастает при метаболическом алкалозе и снижается при метаболическом ацидозе.
6.Электропроводность различных систем организмов. Примеры. Электропроводность клеток и жидкостей межклеточных пространств. Как проходит постоянный и переменные токи по ним? Использование явления электропроводности биожидкостей и тканей организма для диагностики для и в лечебной практике
Ответ:
Живой организм с точки зрения можно рассматривать как систему, состоящую из клеток и межклеточного вещества, заполненного растворами электролитов. В проведении электрического тока участвуют ионы калия, натрия, хлора, карбонатов, фосфатов, ионы органических кислот, белков и других соединений. В соответствии с законами электрической проводимости лучше проводят ток ткани небольшой плотности, содержащих много воды и высоподвижных ионов. Это кровь,лимфа, желудочный сок, моча, спинно-мозговая жидкость.Большое влияние оказывают меж- и внутриклеточные мембраны, которые поляризуются и препятствуют движению ионов. Поэтому постоянный и переменный токи низкой частоты идут по межклеточным промежуткам. Переменный ток высокой частоты идет через всю ткань, т.к. в этом случае мембраны клеток не поляризуются в связи с быстрым изменением направления тока. При разрушении клеточным мембран электропроводность для постоянного и переменного тока одинаково.
Так, при воспалительных процессах на первых стадиях уменьшается электропроводоность, т.к. клетки набухают, межклеточный объем уменьшается. Электрический ток и электрическая проводимость широко используются не только для диагностики, но и в лечебной практике. На электрической проводимости основаны такие физтотерапевтические методы лечения, как ионофорез, электростимуляция, диаметрия, ультравысокочастотная терапия. При ионофорезе лекарственные вещества в организм вводятся через неповрежденную кожу, сквозь поры потовых желез.
Измерение электропроводности имеет большое значение для клинической рефлексологии, т.к. позволяет объективно определить местонахождение акупунктурных точек на нашем теле.
Метод изучения кровообращения в печени, сердце, почках, кровотока в сосудах на основе кондуктометрических измерений называется реографией.
Исследования, проведенные на желудочном соке, показали, что его электропроводность зависит от содержания в нем свободной соляной кислоты. Если электропроводность выше нормы- то на гипокислотность и совсем низкая-безкислотность.
7. Окислительно-восстановительные потенциалы биологических систем. Диффузионные потенциалы (лабораторные опыт и живой организм). Уравнение Петерса. Мембранный потенциал. Расчет величины мембранного потенциала.
Биологическое окисление является основным источником энергии в организме и имеет многоступенчатый характер. В организме окислительно-восстановительные реакции могут осуществляться путем переноса либо электронов, либо электронов и протонов одновременно.
Большинство биохимических реакций протекает с участием ионов водорода. Окислительно-восстановительные процессы происходят при окислении субстратов в митохондриях. Изменение окислительно-восстановительного потенциала в виде небольших перепадов и свободной энергии-небольшими порциями имеют биологический смысл, состоящий в эффективности использованной энергии при этом возрастает по сравнению с однократной разностью потенциалов между субстратом и кислородом
Диффузный потенциал.Неравномерное распределение ионов в какой-либо жидкой среде обычно приводит к возникновению диффузного потенциала.
Диффузным называется потенциал, возникающий на границе раздела двух растворов, содержащих один и тот же электролит различной концентрации вследствие различия в подвижности их катионов и анионов.
Лабораторный опыт: при соприкосновении растворов ионы Н и Cl из более концентрационного раствора благодаря диффузии будут перемещаться в разбавленный раствор. В результате разбавленный раствор у поверхности раздела зарядиться положительно за счет более быстрых ионов (Н+), а концентрационный- отрицательно за счет медленных ионов (CL-). На границе раздела двух растворов образуется двойной электрический слой, который постепенно движется в сторону разбавленного раствора и существует пока концентрации ионов не выровняется по всему объему.
В биологических системах: диффузный потенциал проявляется при механическом повреждении клеток. Из места повреждения ионы перемещаются в межклеточную жидкость, за счет чего возникает диффузионный потенциал.
Потенциал окислительно-восстановительного электрода при 298 К рассчитывают по уравнению Петерса:
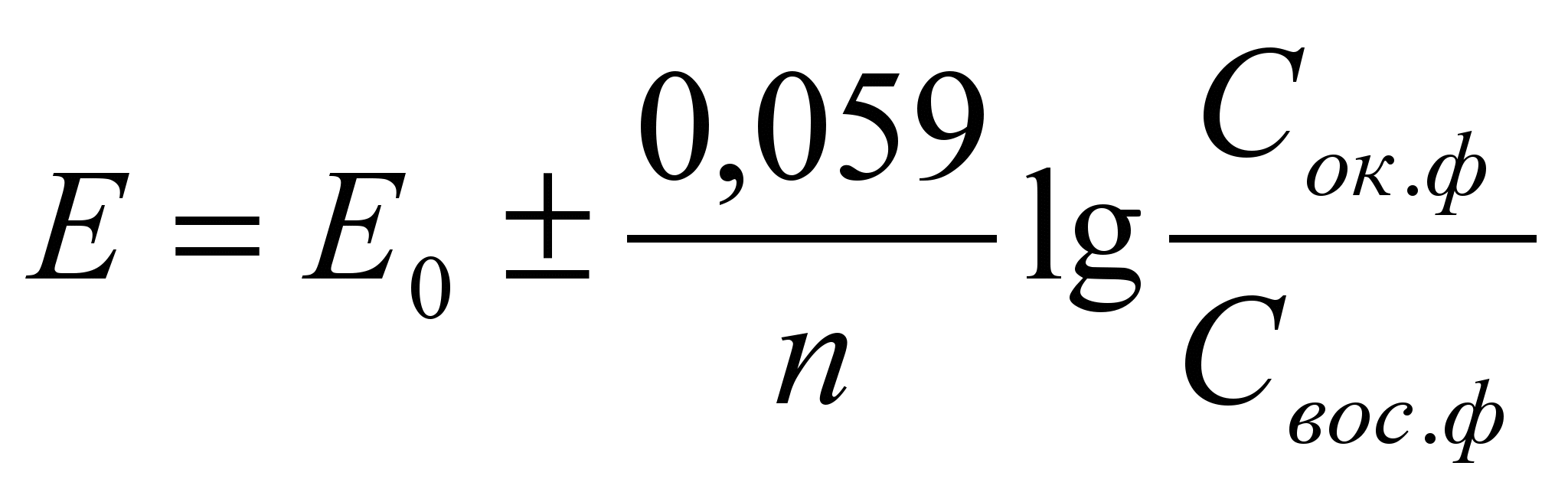
Где n- число электронов
Сокисл/Свосст – концентрации окисленной и восстановлений форм вещества в растворе.
Е0- стандартный окислительно - восстановительный потенциал.
Стандартный окислительно-восстановительный потенциал- это потенциал, возникающий на границе раздела инертный металл – раствор, в котором концентрация окисленной формы равна концентрации восстановленной формы
Мембранный потенциал. Стабилизировать потенциал, возникающий на границе раздела жидкость- можно, если соприкасающиеся растворы разделить мембраной с избирательной проницаемостью. Такая мембрана способна избирательно пропускать те или иные ионы и молекулы, в результате чего возникает мембранный потенциал.