
КИНЕТИКА РЕАКЦИЙ
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Учебное пособие
3

Федеральное государственное бюджетное образовательное учреждение высшего образования
«Саратовский государственный медицинский университет имени В.И. Разумовского»
Министерства здравоохранения Российской Федерации
КИНЕТИКА РЕАКЦИЙ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Учебное пособие
Издательство
Саратовского государственного медицинского университета
2019
4
УДК 544.4(075.8) ББК 24.54 я73
К413
Авторы-составители:
М.И. Скуратова, Т.О. Рябухова, П.В. Решетов
Кинетика реакций. Химическое равновесие: учеб. пособие / авт.-сост.: М.И.
К413 Скуратова, Т.О. Рябухова, П.В. Решетов; Сарат. гос. мед. ун-т. – Саратов: Изд-во Сарат. гос. мед. ун-та, 2019. – 34 с.
В учебном пособии изложены теория, вопросы для самоподготовки, методические указания к выполнению лабораторной работы, упражнения, задачи и тестовые задания для самостоятельной работы. Последовательность расположения заданий служит установлению логической связи между основными понятиями и раскрытию обобщающих закономерностей.
Предназначено для студентов 1-го курса лечебного, педиатрического и стоматологического факультетов Саратовского ГМУ. Пособие создано для самостоятельной работы обучающихся при подготовке к лабораторно-практическим занятиям по темам «Кинетика химических реакций», «Химическое равновесие» по дисциплине «Химия», предусмотренной учебным планом по специальностям «лечебное дело», «педиатрия», «стоматология».
УДК 544.4(075.8) ББК 24.54 я73
Рецензенты:
кандидат химических наук, доцент М.В. Пожаров;
кандидат химических наук, доцент Ю.А. Фомина
Одобрено к изданию ЦКМС СГМУ Текст печатается в авторской редакции
© Скуратова М.И.,
Рябухова Т.О.,
Решетов П.В., 2019 © Саратовский государственный
медицинский университет, 2019
5
ВВЕДЕНИЕ
Химическая кинетика изучает скорость и механизм химических процессов.
Химические реакции протекают с разными скоростями. Некоторые из них пол-
ностью заканчиваются за долю секунды, другие длятся минуты, часы, дни, де-
сятилетия и даже еще большие отрезки времени. Кроме того, одна и та же реак-
ция может в одних условиях, например, при высокой температуре, происходить быстро, а в других, например, при охлаждении, – медленно.
Некоторые биопроцессы осуществляются за тысячные доли секунды, на-
пример, передача нервного импульса. В то же время, большинство биопроцес-
сов относится к медленным химическим реакциям. Это – биосинтез, в том чис-
ле фотосинтез, брожение и др. Так, белки обновляются наполовину в течение
70 суток, а неорганическая основа костных тканей полностью обновляется на протяжении 4 – 7 лет.
3

1.КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
1.1.СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Для того, чтобы определить пойдет или не пойдет та или иная реакция не-
обходимо не только оценить возможность ее протекания с точки зрения термо-
динамики, но также получить сведения о ее скорости, ее кинетике.
Химическая кинетика изучает закономерности протекания реакций во времени.
Основу кинетических исследований составляет измерение скорости реак-
ции в зависимости от различных факторов – концентрации (С), температуры
(Т), общего давления (р), природы растворителей и т.д.
Скорость химической реакции равна изменению концентрации исходных веществ или продуктов реакции в единицу времени. Различают среднюю и ис-
тинную (мгновенную) скорости реакции. Средняя скорость реакции равна:
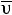 =
= 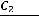

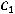 = −
= −
где С2 и С1 – концентрации исходного вещества в моменты времени t2 и t1 (раз-
мерность:  ).
).
Скорость реакции принимается всегда положительной, поэтому знак ми-
нус означает, что концентрация исходного вещества уменьшается. В ходе реак-
ции ее скорость изменяется, так как изменяются концентрации реагирующих веществ. Истинная скорость реакции υ, равна:
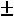
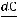 .
.
Производная исходных концентраций берется со знаком минус, а продук-
тов реакции – со знаком плюс.
Изменение числа молей всех реагентов и продуктов в процессе реакции связаны между собой стехиометрическими коэффициентами, поэтому для ре-
акции будет выполняться равенство: I2 + H2 = 2 HI
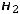 ,
,
4
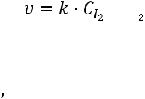
т. е. скорость накопления йодоводорода вдвое больше скорости расходования йода и водорода.
1.2.ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Скорость химической реакции зависит от многих факторов: концентра-
ции реагирующих веществ, природы растворителя и реагирующих веществ,
температуры, объема реакционного сосуда (для газов), давления (для газов),
степени измельчения твердых веществ, катализатора и многих других.
Одним из основных факторов, определяющих скорость химической реак-
ции, является концентрация реагирующих веществ. Для протекания реакций необходимо столкновение частиц реагирующих веществ и чем больше их в единице объема, тем чаще они сталкиваются друг с другом.
1.2.1. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ
Зависимость скорости химической реакции от концентрации определяется
законом действующих масс:
Скорость химической реакции пропорциональна произведению концен-
траций реагирующих веществ, взятой в степени, равной стехиометриче-
скому коэффициенту, стоящему перед формулой вещества в уравнении ре-
акции.
Например, для реакции I2 + H2 = 2 HI

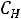 ,
,
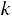 – константа скорости, физический смысл: при концентрации реагирующих веществ равных единице
– константа скорости, физический смысл: при концентрации реагирующих веществ равных единице 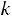 =
= 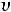 поэтому
поэтому 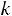 иногда называют удельной скоро-
иногда называют удельной скоро-
стью химической реакции. При данной температуре 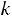 является величиной по-
является величиной по-
стоянной.
5

Константа скорости химической реакции определяется природой реаги-
рующих веществ, зависит от тех же факторов, что и скорость, кроме концен-
трации.
1.2.2.ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ,
УРАВНЕНИЕ АРРЕНИУСА
Температура оказывает на скорость более сильное влияние, чем концен-
трация реагирующих веществ. Сами концентрации либо слабо зависят от тем-
пературы, либо совсем от нее не зависят, поэтому температура влияет на ско-
рость через константу скорости 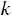 .
.
Известны два вида зависимости скорости реакции от температуры: эмпи-
рическое правило Вант-Гоффа и более строгое уравнение Аррениуса.
В области умеренных температур для гомогенных и многих гетерогенных реакций справедливо правило Вант-Гоффа: при постоянных концентра-
циях реагирующих веществ увеличение температуры на 10 о С
(или 10 К) приводит к возрастанию скорости в 2 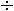
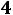 раза:
раза:
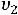 =
= 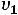 ∙
∙
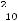
 ,
,
где 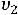
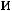
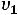 скорости реакций при температурах
скорости реакций при температурах 
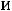
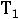 ;
; 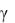 – температурный ко-
– температурный ко-
эффициент Вант-Гоффа, значение которого для эндотермической реакции вы-
ше, чем для экзотермической реакции.
Следует знать соотношения скоростей, констант и времен ( ) протекания реакций:
) протекания реакций:

 =
= 
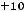
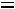
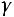 .
.
Уравнение Аррениуса показывает влияние температуры на константу ско-
рости химической реакции
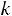
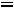


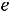
 ,
,
6
где A – предэкспоненциальный множитель (коэффициент, отражающий приро-
ду реагирующих веществ), R – универсальная газовая постоянная (Дж/моль∙К);
Т – абсолютная температура; Еа – энергия активации для данной реакции
(Дж/моль). Для большинства реакций Еа = 50 ÷ 500 кДж/моль.
Поясним смысл энергии активации. Согласно теории активных соударе-
ний любая химическая реакция может происходить только при столкновении активных частиц. Активными называются частицы, которые обладают опреде-
ленной, характерной для данной реакции энергией – энергией активации. Энер-
гия активации необходима частице для преодоления сил отталкивания между электронными оболочками этих частиц.
Энергия активации – это избыточное количество энергии (по сравне-
нию со средней ее величиной), которым должна обладать молекула в мо-
мент столкновения, чтобы быть способной к химическому взаимодейст-
вию.
Энергия активации является характеристикой каждой реакции и определя-
ет влияние на скорость химической реакции природы реагирующих веществ.
Для большинства химических реакций энергия активации меньше энергии дис-
социации наименее прочной связи в молекулах реагирующих веществ.
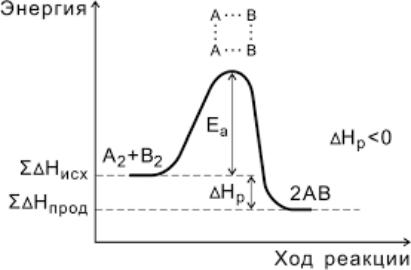
Для реакции А2 + В2 = 2АВ изменение энергии реакции во времени изо-
бражено на рис. 1.
Рис. 1. Энергетический профиль экзотермической реакции
7
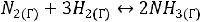
На рис. 1 показано, что в процессе элементарного акта химического пре-
вращения исходных веществ в продукты реакции система должна преодолеть потенциальный барьер, равный энергии активации (Еа). Разность энергий меж-
ду продуктами реакции (АВ) и реагентами (А2 + В2) составляет тепловой эф-
фект реакции или энтальпию. Как следует из рис. 1, в результате реакции энер-
гия выделяется, т. е. реакция является экзотермической.
Чем выше энергия активации, тем очевидно меньше доля частиц, способ-
ных к активному взаимодействию. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Высокие значения энергии активации является причиной того, что многие химические реакции при невы-
соких температурах не протекают, хотя принципиально возможны (


1.3.КЛАССИФИКАЦИЯ РЕАКЦИЙ, ПРИМЕНЯЮЩИХСЯ В КИНЕТИКЕ
I.По фазовому состоянию.
Гомогенные реакции – это реакции, в которых реагирующие вещества нахо-
дятся в одинаковом фазовом состоянии.
Например,
или жизненно – необходимая реакция образования оксигемоглобина является гомогенной, так как гемоглобин и кислород находятся в одной и той же клеточ-
ной жидкости эритроцитов в растворенном состоянии
HHb(р-р) + О2(р-р) 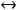 HHbO2(р-р).
HHbO2(р-р).
Гетерогенные реакции – это реакции, в которых реагирующие вещества нахо-
дятся в разных фазовых состояниях.
Например, CaCO3(тв) + 2HCl(р-р) → CaCl2(р-р) + H2O(р-р) + CO2(г).
Большое число биохимических превращений внутри биологических мем-
бран или на их поверхности. В частности, отдельные стадии биоокисления глюкозы связаны с мембранами клеточных органелл – митохондрий. Здесь про-
текают и гомогенные и гетерогенные реакции в зависимости от того к какой фазе относятся мембраны.
8
