

II.По механизму все реакции подразделяются на простые и слож-
ные.
Простые реакции – это реакции, в которых продукт образуется в резуль-
тате непосредственного взаимодействия молекул (частиц) реагентов.
Простые реакции протекают всегда в одну стадию (элементарный акт).
Сложные реакции – это реакции, в которых конечный продукт получает-
ся в результате двух или более простых реакций с образованием промежуточ-
ных продуктов.
Все биохимические реакции являются сложными. Например, окисление глюкозы кислородом в процессе клеточного дыхания.
Сложные реакции по кинетическому механизму подразделяются на два больших класса: последовательные и параллельные (конкурирующие).
Последовательными называются сложные реакции, в которых продукт
Х1 первой элементарной стадии вступает в реакцию второй стадии, продукт Х2
второй стадии вступает в третью и т.д., пока не образуется конечный продукт Р
S |
k1 |
X 1 |
k2 |
X 2 |
k3 |
... |
kn |
P |
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
, |
S – исходный реагент (субстрат);
Х1, Х2 … Хn – интермедиаты.
Практически все процессы метаболизма являются последовательными ре-
акциями. Например, при метаболизме глюкозы исходным субстратом является глюкоза, интермедиатами – глюкоза-6-фосфат, фруктоза-1,6-дифосфат и т.д., а
конечные продукты углерод, углекислый газ, вода.
Параллельными называются сложные реакции, в которых одно и то же вещество А одновременно взаимодействует с одним или несколькими реаген-
тами В1, В2,… и т.д., участвуя в одновременно протекающих реакциях:
А+ В1 → Х1
А+ В2 → Х2 ….
Таким образом, эти реакции конкурируют друг с другом за реагент А. Многие субстраты и интермедиаты метаболизма участвуют в конкурирующих реакци-
9
ях. Использование в зависимости от условий различных конкурирующих путей метаболизма позволяет организму осуществлять регулирование процессов жиз-
недеятельности.
Сопряженными называются такие две реакции, из которых одна вызыва-
ет протекание в системе другой реакции, не осуществимой в отсутствие первой.
Так, большинство биохимических превращений в организме осуществля-
ется в результате сопряжения с процессом метаболического окисления глюко-
зы. Именно это имеют в виду, когда говорят, что глюкоза является источником энергии, обеспечивающим жизнедеятельность организма.
Частным случаем последовательных реакций являются цепные ради-
кальные реакции. В этих реакциях превращение исходного субстрата в продук-
ты осуществляется многократным повторением одних и тех же стадий.
Например, пероксидное окисление липидов, играющее важную роль в жизнедеятельности организма, является цепной реакцией
. .
R + O2 → RO2
. .
RO2 + RH → ROOH + R и т. д.
.
RH – липид, R – органический радикал,
.
RO2 – пероксидный радикал, ROOH – органический пероксид.
1.4.МОЛЕКУЛЯРНОСТЬ ЭЛЕМЕНТАРНОГО АКТА РЕАКЦИИ. ПОРЯДОК РЕАКЦИИ
Молекулярность реакции – число частиц, реагирующих в одном элементарном акте реакции.
Максимальное число частиц, реагирующих в одном элементарном акте,
не может быть больше трех, так как столкновение большего числа частиц мало-
вероятно.
10

Частным порядком реакции являются степени равные коэффициентам в кине-
тическом уравнении реакции. Сумма частных порядков есть полный порядок
реакции.
Например, для реакции I2(г)+ H2(г) = 2 HI(г)

 ,
,
частный порядок по веществу I2 равен 1;
частный порядок по веществу Н2 равен 1;
полный порядок реакции 1 + 1 = 2.
Для простых реакций суммарный (полный) порядок равен числу молекул,
участвующих в элементарном акте. Таким образом, для приведенной выше ре-
акции молекулярность прямой реакции равна 2.
11

2.НАПРАВЛЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
2.1.ОБРАТИМЫЕ И НЕОБРАТИМЫЕ РЕАКЦИИ
Реакции могут протекать как в прямом, так и обратном направлении.
Необратимые реакции − протекают до полного израсходования одного из реа-
гирующих веществ, например, взаимодействие известняка с соляной кислотой:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑.
Обратимые реакции − протекают не до конца: ни одно из реагирующих ве-
ществ полностью не расходуется, например, каталитический синтез аммиака из азота и водорода:
N2 + 3H2  2NH3.
2NH3.
Общий предел прямой и обратной реакции называется состоянием
равновесия.
Рассмотрим на примере реакции образования HI.
I2 + H2 |
|
|
v1 |
|
2HI |
|
|
|
|
||
|
|
v2 |
|
||
|
|
|
|
|
v 
v1
v1= v2
v2
 t
t
Рис. 2. Зависимость скорости прямой и обратной реакции от времени
Допустим, в некоторый сосуд при 700 К введены водород и пары йода так, что их концентрации [H2] = [I2] = 10-2 моль/л. Начинается реакция, скорость кото-
рой в первый момент
12

где 



 .
.
По мере уменьшения концентраций водорода и йода скорость реакции па-
дает (кривая V1 на рис. 2) и должна была бы упасть до нуля, но по мере накоп-
ления HI становится возможной обратная реакция, скорость которой определя-
ется уравнением




 ,
,
При Т=700 К, 


 .
.
Скорость обратной реакции будет увеличиваться (кривая V2 на рисунке 2).
Со временем скорости обеих реакций окажутся равными и наступит состояние равновесия.
Характерным свойством равновесного состояния химически реагирующей системы является то, что неизменность концентраций всех реагирующих час-
тиц во времени есть следствие непрерывно идущих химических процессов.
Химическое равновесие – это динамическое равновесие.
2.2.КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ
Количественной характеристикой химического равновесия является вели-
чина, называемая константой химического равновесия.
Согласно закону действующих масс для реакции образования HI, скорости прямой и обратной реакций выражаются уравнениями
При υ1= υ2 в системе устанавливаются постоянные концентрации исход-
ных и конечных продуктов реакции. Эти концентрации называются равновес-
ными и обозначаются они квадратными скобками. В условиях химического равновесия υ1= υ2, следовательно,
13

Так как константы скоростей химических реакций  и
и  − величины по-
− величины по-
стоянные, то и их отношение будет величиной постоянной, обозначим его
 , тогда
, тогда
 =
=
где  – константа химического равновесия.
– константа химического равновесия.
Константа химического равновесия равна отношению скоростей прямой и обратной реакций.
Константа равновесия обратимой реакции является постоянной величиной,
показывающей соотношение между концентрациями продуктов реакции и ис-
ходных веществ, которое устанавливается при равновесии.
При изменении одной концентрации происходит изменение других кон-
центраций и устанавливаются новые концентрации, а соотношение между ними вновь отвечает константе равновесия. Численное значение последней в первом приближении характеризует выход реакции.
Выход реакции – это отношение количества получаемого вещества к тому его количеству, которое получилось бы при протекании реакции до конца.
Поэтому, если 
 1, то выход реакции большой (в системе преобладают продукты реакции); если же
1, то выход реакции большой (в системе преобладают продукты реакции); если же 
 1, то выход реакции мал (в системе преобла-
1, то выход реакции мал (в системе преобла-
дают исходные вещества).
Все рассмотренное выше касалось гомогенных реакций. В гетерогенной реакции в выражение  входят концентрации только тех веществ, которые на-
входят концентрации только тех веществ, которые на-
ходятся в газовой или жидкой фазе.
Величина  зависит от природы реагирующих веществ и температуры.
зависит от природы реагирующих веществ и температуры.
Катализатор не влияет, так как он может повлиять только лишь на скорость ус-
тановления равновесия.
Установлено, что химически реагирующая система может перейти в со-
стояние равновесия как со стороны чистых исходных веществ, так и со стороны
14

чистых продуктов реакции. Следовательно, обе реакции могут протекать само-
произвольно. Рассмотрим это со стороны химической термодинамики:
где |
|
газовая постоянная, 8,31 |
|
, |
|
изменение энергии Гиббса в |
|
|
|
стандартных условиях. Преобразуем формулу, перейдя к десятичным логариф-
мам
= 





Из формулы видно:
если |
<<0, то |
>>1, следовательно, преобладают продукты реакции; |
если |
>>0, то |
<<1, следовательно, преобладают исходные вещества. |
Вычислив  , можно вычислить равновесные концентрации реагентов.
, можно вычислить равновесные концентрации реагентов.
Таким образом, термодинамический подход, как и кинетический, при-
водит нас к заключению о некотором общем для прямой и обратной реак-
ции концентрационного предела – состояния динамического равновесия.
Кинетический подход, в котором состояние равновесия характеризуется скоростями υ1 = υ2, подчеркивает динамичность, подвижность химического равновесия (в системе непрерывно протекают обратимые реакции, происходит непрерывный процесс разрушения одних и образования других частиц).
Термодинамический подход, в котором состояние равновесия определяет-
ся как состояние, при котором система характеризуется минимумом энергии Гиббса, подчеркивает термодинамическую устойчивость, выгодность такого состояния. Система из любого другого состояния переходит в наиболее выгод-
ное с минимумом энергии Гиббса.
Различают заторможенное и истинное равновесие.
Заторможенное (ложное) равновесие – если состояние системы неиз-
менно во времени, но при изменении внешних условий в системе происходит
15

необратимый процесс. Обычно они характерны для твердофазных систем. Дан-
ное равновесие не является динамическим.
Истинное равновесие – неизменно во времени, но и после взаимодействия
возвращается в прежнее состояние.
2.3.ПРИНЦИП ЛЕ ШАТЕЛЬЕ
Если изменить одно из условий, при которых система находится в со-
стоянии химического равновесия, например, Т, р или концентрации, то равновесие смещается в направлении реакции противодействующей произ-
веденному изменению
Данный принцип качественно описывает состояние химического равнове-
сия. Он применяется к системам, находящимся в состоянии истинного химиче-
ского равновесия.
Поясним этот принцип на примере реакции синтеза аммиака, протекающей по уравнению
N2(Г) + 3H2(Г) 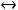 2NH3(Г) ;
2NH3(Г) ;
Если увеличить концентрацию водорода, то равновесие сместится вправо,
ибо прямая реакция (взаимодействие N2 с H2) приведет к уменьшению концен-
трации H2, то есть ослаблению внешнего воздействия.
При повышении температуры равновесие сместится влево, ибо обратная реакция, протекающая с поглощением тепла, приведет к понижению темпера-
туры, то есть уменьшению внешнего воздействия.
Если в нашей системе повысить давление, то равновесие сместится вправо,
ибо прямая реакция сопровождается образованием меньшего числа молекул и,
таким образом, приводит к уменьшению давления, по сравнению с обратной реакцией.
16
Изменение давления не вызывает смещения равновесия, например, в реак-
ции N2 + O2  2NO, так как число молекул в левой части уравнения равно чис-
2NO, так как число молекул в левой части уравнения равно чис-
лу молекул в правой части этой обратимой реакции.
Изменение давления в случае газовых реакций равносильно изменению концентраций реагирующих газов, так как, например, повышение давления осуществляется уменьшением объема реакционной смеси, тогда как количество взаимодействующих веществ остается прежним и, следовательно, концентра-
ция веществ увеличивается.
Изменение давления не приведет к смещению равновесия в конденсиро-
ванных системах, т.е. системах без газовой фазы.
Применение катализатора не вызывает смещения равновесия, так как ка-
тализатор в одинаковой степени ускоряет (отрицательный катализатор – замед-
ляет) прямую и обратную реакции обратимого процесса, то есть лишь укоряет
(или замедляет) достижение состояния равновесия. Процесс синтеза аммиака является экзотермическим, поэтому его следует вести при возможно низкой температуре, что вызывает из-за высокой энергии активации этого процесса за-
метное снижение скорости реакции. Поэтому на практике реакцию проводят при температуре 
 , одновременно повышая давление до 1,013 ∙ 105 Па (с
, одновременно повышая давление до 1,013 ∙ 105 Па (с
целью смещения равновесия вправо). Применение же катализатора, резко уско-
ряющего процесс синтеза аммиака, позволяет снизить давление до 1,013 ∙ 104
Па.
17

3. КАТАЛИЗ
Катализ – процесс изменения скорости химической реакции под дейст-
вием специальных веществ – катализаторов.
Катализатор – вещество, которое изменяет скорость химической реак-
ции, не изменяя свой качественный и количественный состав.
Различают положительный и отрицательный катализ. Положительный катализ – это процесс, при котором скорость химической реакции увеличива-
ется. Отрицательный катализ – это процесс, при котором скорость химиче-
ской реакции уменьшается.
Обычно при положительном катализе вещество катализируемое реакцию называют катализатором, а при отрицательном – ингибитором.
Суть действия любого катализатора состоит в изменении величины энер-
гии активации. При положительном катализе она уменьшается, а при отрица-
тельном она увеличивается.
Рис. 3. Энергетический профиль химических реакций без катализатора и с катализатором
Различают гомогенный и гетерогенный катализы.
Если реагирующие вещества находятся в одинаковой с катализатором фа-
зе, то катализ называется гомогенным.
Если реагирующие вещества находятся в разных с катализатором фазах,
то катализ называется гетерогенным.
18
