

Катализатор не только может изменять скорость реакции, но и ее направ-
ление. В зависимости от природы катализаторов одни и те же реагирующие вещества образуют различные продукты:
ZnO, Cr2O3
ZnO, Cr2O3, KOH
CO + H2
Ni
.
Роль каталитических реакций особенно велика в процессе жизнедеятель-
ности организмов. Подавляющее большинство реакций, протекающих в живых организмах, протекает при участии биологических катализаторов, имеющие общее название ферменты. Характерной особенностью ферментов является
специфичность.
Под специфичностью фермента понимается его свойство изменять скорость химической реакции одного типа, не влияя на другие реакции, проте-
кающие в клетке. Например, пероксид водорода, образующийся как побочный интермедиат в процессе внутреннего дыхания клеток, разрушается ферментом каталазой. В отсутствие каталазы пероксид разлагается медленно и накаплива-
ется в значительных количествах. Это отрицательно для организма, так как пе-
роксид окисляет многие биоорганические вещества, и клетка погибает.
Ферменты относят к микрогетерогенным катализаторам, т. е. реагенты и катализатор находятся в коллоидно-дисперсном состоянии. По отношению к субстратам, частицы которых часто намного меньше, катализаторы являются гетерогенными.
Исследование ферментативных процессов, как в норме, так и при патоло-
гии необходимо для понимания особенностей специфики обменных процессов в организме с целью научиться управлять ими.
19
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
Кинетика химических реакций
1.Что изучает кинетика?
2.Что такое скорость химической реакции?
3.Напишите формулу для расчета скорости химической реакции.
4.Перечислите факторы, влияющие на скорость химической реакции.
5.Сформулируйте закон действующих масс (ЗДМ).
6.Напишите выражение скорости химической реакции через ЗДМ.
7.Каков физический смысл константы скорости химической реакции?
8.Перечислите факторы, влияющие на константу скорости химической
реакции.
9.Сформулируйте правило Вант-Гоффа. Напишите его математическое выражение.
10.Что такое энергия активации? Напишите уравнение Аррениуса.
11.Изобразите энергетический профиль экзотермической реакции.
12.Как будет выглядеть энергетический профиль эндотермической ре-
акции?
13.Что такое гомогенные реакции? Приведите примеры.
14.Что такое гетерогенные реакции? Приведите примеры.
15.Что такое простые реакции?
16.Что такое сложные реакции?
17.Что такое параллельные реакции? Приведите примеры.
18.Что такое последовательные реакции? Приведите примеры.
19.Что такое сопряженные реакции? Приведите примеры.
20
20.Что такое цепные реакции? Приведите примеры.
21.Что такое молекулярность элементарного акта реакции? Приведите
примеры.
22.Что такое порядок простой реакции? Приведите примеры.
Химическое равновесие
1.Что такое необратимые реакции?
2.Что такое обратимые реакции?
3.Дайте определению понятию «химическое равновесие».
4.Какой количественной характеристикой характеризуется «химическое равновесие»?
5.Каковы термодинамические условия равновесия в термодинамических системах?
Катализ
1.Дайте определение понятию «катализ».
2.Дайте определение понятию «катализатор».
3.В чем различие положительного и отрицательного катализов?
4.В чем особенность гомогенного катализа?
5.В чем особенность гетерогенного катализа?
6.Изобразите энергетический профиль каталитической реакции.
7.Что такое ферментативный катализ?
8.Каковы особенности каталитической активности ферментов?
21
ЛАБОРАТОРНАЯ РАБОТА «СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ В РАС-
ТВОРАХ ЭЛЕКТРОЛИТОВ»
Опыт 1 Смещение химического равновесия в растворах сильных электролитов
Налить в пробирку 5 мл разбавленного р-ра хлорида железа (III) и приба-
вить к нему 5 мл разбавленного р-ра роданида аммония или роданида калия.
Полученный окрашенный раствор поделить на 4 части. К первой части приба-
вить р-р хлорида железа (III). Наблюдается усиление окраски в этой пробирке.
Ко второй части р-ра добавьте роданида аммония или роданида калия. В этом случае также наблюдается усиление окраски р-ра. В третью пробирку добавьте кристаллы хлорида калия. Как изменилась окраска р-ра? Объясните направле-
ние смещения химического равновесия. Напишите уравнение химической ре-
акции и выражение для константы химического равновесия.
Опыт 2 Смещение химического равновесия в растворах слабых электролитов
В две пробирки внести 10-15 капель 0,1 N р-ра уксусной кислоты. В каж-
дую пробирку добавить одну каплю метилового оранжевого. Отметить окраску р-ра. Одну пробирку оставить в качестве контроля, а в другую внести прибли-
зительно 10-12 мг сухого ацетата натрия и перемешать р-р. Сравните окраску полученного р-ра с окраской р-ра в контрольной пробирке. Дайте подробное объяснение наблюдаемому.
22

УПРАЖНЕНИЯ И ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Примеры решения задач
Пример 1. Как изменится скорость прямой реакции
при увеличении концентрации СО в при раза?
Решение:
Запишем выражение для скорости реакции согласно закона действующих масс до ( 1) и после ( 2) изменения концентрации СО









 = 9
= 9 



 ;
;
 =
=  = 9.
= 9.
Ответ: скорость реакции увеличится в 9 раз.
Пример 2. Во сколько раз изменится скорость прямой и обратной реакции в системе: 







 если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение:
По закону действующих масс скорости прямой и обратной реакции до из-
менения объема

 ;
;
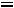


 .
.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза. При новых концен-
трациях скорости прямой и обратной реакции |
|
= 27 |
; |
= 9 |
. |
23 |
|

Отсюда
Ответ: скорость прямой реакции увеличилась в 27 раз, а обратной – только в
9 раз. Равновесие системы сместилось в сторону образования серного ангидри-
да.
Пример 3. Вычислите, во сколько раз увеличится скорость реакции, проте-
кающей в газовой фазе, при повышении температуры от 30 до 70 °С, если тем-
пературный коэффициент реакции равен 2.
Решение:
Зависимость скорости химической реакции от температуры определяет-
ся эмпирическим правилом Вант-Гоффа по формуле:
,
,
Ответ: скорость реакции увеличилась в 16 раз при повышении температуры на
40 0С.
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора про-
текает по уравнению
РС15 (г)  РС13 (г) + С12 (г) ∆Н = +92,59 кДж.
РС13 (г) + С12 (г) ∆Н = +92,59 кДж.
Записать выражение для константы химического равновесия реакции. Как на-
до изменить: а) температуру; б) давление; в) концентрацию, чтобы сме-
стить равновесие в сторону прямой реакции – разложения РСl5?
24
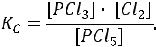
Решение:
Смещением или сдвигом химического равновесия называют изменение рав-
новесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определя-
ется по принципу Ле Шателье:
а) так как реакция разложения РСl5 эндотермическая (∆H>0), то для смещения равновесия в сторону прямой реакции нужно повысить темпера-
туру;
б) так как в данной системе разложение РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смеще-
ния равновесия в сторону прямой реакции надо уменьшить давление;
в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5, так и уменьшением концентрации РС13 или С12.
25
Упражнения и задачи для самостоятельной работы
1. Напишите математические выражения скоростей химических реакций,
применяя ЗДМ для нижеприведенных реакций:
а) 2Al(Т) + 3Cl2(Г) = 2AlCl3 |
е) 2H2(Г) + O2(Г) = 2H2O |
б) 2CO(Г) + O2 (Г) = 2CO2 |
ж) Zn(К) + 2HCl(Р) = ZnCl2 + H2 |
в) 2NO(Г) + O2(Г) = 2NO2 |
з) 3Fe(К) + 4H2О(ПАР) = Fe3O4 + 4H2 |
г) N2(Г) + 3H2 (Г) = 2NH3 |
и) 4NH3(Г) + 5O2(Г) = 4NО + 6H2O |
д) 4HCl(Г) + O2(Г) = 2H2O + 2Cl2 |
к) N2(Г) + 3H2(Г)= 2NH3 |
2. Пользуясь правилом Ле Шателье, объясните, как сместится равновесие:
1)при увеличении концентрации одного из исходных веществ;
2)при понижении температуры;
3)при повышении давления:
а) 4NH3(г)+3О2(г)  6Н2О(г)+2N2(г); ∆H= – 1267 кДж;
6Н2О(г)+2N2(г); ∆H= – 1267 кДж;
б) 2H2S(г)+3О2(г)  2Н2О(г)+2SO2(г); ∆H= – 1220 кДж;
2Н2О(г)+2SO2(г); ∆H= – 1220 кДж;
в) N2О4(г)  2 NО2 (г); ∆H= + 66,5 кДж;
2 NО2 (г); ∆H= + 66,5 кДж;
г) СО(г)+Н2О(г)  СO2(г)+Н2(г); ∆H= + 42 кДж;
СO2(г)+Н2(г); ∆H= + 42 кДж;
д) 2СО2(г)  2СO(г)+О2(г); ∆H= + 1120 кДж;
2СO(г)+О2(г); ∆H= + 1120 кДж;
е) 2СО2(г)  2СO2(г)+С(г); ∆H= – 171 кДж;
2СO2(г)+С(г); ∆H= – 171 кДж;
ж) СОСl2(г)  СO(г)+Сl2(г); ∆H= + 113 кДж.
СO(г)+Сl2(г); ∆H= + 113 кДж.
3. Как изменится скорость реакции 2SO2 + O2 = 2SО3, если уменьшить объ-
ем газовой смеси в 3 раза?
4. Как изменится скорость реакции H2 + Cl2 = 2HCl, если уменьшить дав-
ление в системе в два раза?
26

5. В каких единицах измеряется скорость реакции? Каким законом выра-
жается зависимость скорости реакции от концентрации реагирующих веществ?
Во сколько раз возрастает скорость реакции при повышении температуры с 20
до 40 oС? Температурный коэффициент скорости реакции = 3.
6. Во сколько раз уменьшится скорость реакции при понижении темпера-
туры от 100 до 50 oС, если при охлаждении системы на 10 oС скорость реакции
уменьшается в 2 раза?
7. При увеличении температуры на 50 oС скорость реакции возросла в 32
раза. Вычислить температурный коэффициент реакции.
8. На сколько градусов необходимо поднять температуру реагирующих веществ, чтобы скорость реакции возросла в 30 раз, если температурный коэф-
фициент равен 2,5.
9. Напишите математическое выражение для скорости гетерогенной реак-
ции: 2С(ГРАФИТ) + 3Н2(Г) = С2Н6(Ж) и определите, во сколько раз увеличится скорость при увеличении концентрации водорода в 3 раза.
10. Реакция идет по уравнению 2СО + О2  2СО2. Концентрация исходных веществ: [СО] = 0,02 моль/л; [О2] = 0,03 моль/л. Как изменится скорость прямой реакции, если увеличить концентрацию О2 до 0,10 моль/л и концентрацию СО до 0,05 моль/л?
2СО2. Концентрация исходных веществ: [СО] = 0,02 моль/л; [О2] = 0,03 моль/л. Как изменится скорость прямой реакции, если увеличить концентрацию О2 до 0,10 моль/л и концентрацию СО до 0,05 моль/л?
11. Напишите выражение для константы равновесия гомогенной системы
СН4 + СО2  2СО + 2Н2.
2СО + 2Н2.
Как следует изменить температуру и давление, чтобы повысить выход во-
дорода? Прямая реакция – образования водорода – эндотермическая.
12. Обратимая реакция выражается уравнением А + 2В  С. При устано-
С. При устано-
вившемся равновесии концентрация участвующих в реакции веществ равня-
лась: [A] = 0,3 моль/л; [B] = 0,6 моль/л; [С] =1,08 моль/л. Вычислить константу равновесия и исходные концентрации веществ А и В.
13. Для реакции Н2(г) +Br2(г)  2HBr(г) при некоторой температуре К = 1.
2HBr(г) при некоторой температуре К = 1.
Определить состав (в процентах по объему) равновесной реакционной смеси,
если исходная смесь состояла из 3 моль Н2 и 2 моль Br2.
27

14. Написать выражение константы химического равновесия для обрати-
мого процесса N2 + O2  2NO и вычислить эту величину, если равновесные концентрации (моль/л) равны: [N2] = 0,5; [O2] = 0,02; [NO] = 0,5.
2NO и вычислить эту величину, если равновесные концентрации (моль/л) равны: [N2] = 0,5; [O2] = 0,02; [NO] = 0,5.
15. Определите равновесную концентрацию водорода в системе
2HI  H2 + I2,
H2 + I2,
если исходная концентрация HI составляла 0,05 моль/дм3, а константа равнове-
сия К = 0,02.
16. В реактор объемом 11,42 л для проведения реакции
2SO2(г) +O2(г)  2SO3(г)
2SO3(г)
введены 2,43 моль SO2 и 2,17 моль O2. При некоторой температуре к мо-
менту наступления равновесия количество диоксида серы уменьшилось на 1,85
моль. Определите константу равновесия.
17. Как изменится скорость прямой реакции: 2СО + О2  2СО2 при увели-
2СО2 при увели-
чении: а) концентрации оксида углерода в 2 раза; б) концентрации кислорода в
2 раза; в) концентрации обоих веществ в 2 раза? Напишите выражение для кон-
станты равновесия данной системы.
18. Написать выражение константы химического равновесия для обрати-
мого процесса: С(тв) + 2Н2(г)  СН4 и вычислить ее, если равновесные концен-
СН4 и вычислить ее, если равновесные концен-
трации (моль/л) равны: [Н2] = 0,2; [СН4] = 0,4.
19. Применяя принцип Ле-Шателье, укажите, в каком направлении про-
изойдет смещение равновесие системы
СО(Г) + Н2О(Ж)  О2(Г) + Н2(Г), Н = +2,85 кДж,
О2(Г) + Н2(Г), Н = +2,85 кДж,
если а) повысить давление; б) повысить температуру (температурный коэффи-
циент прямой и обратной реакции одинаковый); в) увеличить концентрацию оксида углерода (II).
20. Исходные концентрации оксида углерода (II) и паров воды равны 0,05
моль/дм3. Вычислить равновесные концентрации СО, Н2О и Н2 в системе СО +
Н2О  СО2 + Н2, если равновесная концентрация СО2 равнялась 0,01 моль/дм3.
СО2 + Н2, если равновесная концентрация СО2 равнялась 0,01 моль/дм3.
Вычислить константу равновесия.
28
