
БУФЕРНЫЕ РАСТВОРЫ
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ
Учебное пособие
1

Федеральное государственное бюджетное образовательное учреждение высшего образования
«Саратовский государственный медицинский университет имени В.И. Разумовского»
Министерства здравоохранения Российской Федерации
БУФЕРНЫЕ РАСТВОРЫ. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ
Учебное пособие
Издательство
Саратовского государственного медицинского университета
2019
2
УДК 544.362.032.73(075.6)(075.8) ББК 24.5 я73
Б93
Авторы-составители:
Р.Т. Куцемако, Т.О. Рябухова, П.В. Решетов
Буферные растворы. Кислотно-основное равновесие: учеб. пособие / авт.-сост.:
Б93 Р.Т. Куцемако, Т.О. Рябухова, П.В. Решетов; Сарат. гос. мед. ун-т. – Саратов: Изд-во Сарат. гос. мед. ун-та, 2019. – 47 с.
Учебное пособие предназначено для подготовки к выполнению лабораторнопрактической работы по теме: «Буферные растворы. Кислотно-основное равновесие». Вопросы теории и практики сведены в единую форму занятий. Выполнение опытов построено как самостоятельное научное исследование. Последовательность расположения заданий служит установлению логической связи между основными понятиями и раскрытию обобщающих закономерностей.
Для студентов по специальностям «лечебное дело», «педиатрия» и «стоматология».
УДК 544.362.032.73(075.6)(075.8) ББК 24.5 я73
Рецензенты:
доктор химических наук, профессор Е.Г. Кулапина; доктор медицинских наук, профессор В.Б. Бородулин
Одобрено к изданию ЦКМС СГМУ Текст печатается в авторской редакции
© Куцемако Р.Т., Рябухова Т.О., Решетов П.В., 2019
© Саратовский государственный медицинский университет, 2019
3
ВВЕДЕНИЕ
Для живых организмов характерно поддержание кислотно-основного гомеостаза на определенном уровне. Это находит выражение в достаточно постоянных значениях рН биологических сред и способности восстанавливать нормальные значения рН при воздействии кислот и оснований. В процессе метаболизма в организме постоянно происходит синтез, распад и взаимодействие огромного количества химических соединений. Все эти процессы осуществляются при помощи ферментов, активность которых связана с определѐнным значением рН.
Обеспечение постоянства рН крови и других органов и тканей является одним из важнейших условий нормального существования организма. Это обеспечение достигается наличием в организме многочисленных регулирующих систем, важнейшими из которых являются буферные системы.
Последние играют основную роль в поддержании КОР в организме как в условиях физиологии, так и патологии.
Кроме того, материал данной темы необходим для изучения последующих тем предмета (потенциометрия, свойства растворов ВМС и т.д.) и таких дисциплин как биохимия, микробиология, гистология, гигиена, физиология, в
практической деятельности врача при оценке типа и тяжести нарушений КОР.
3

СИЛЬНЫЕ И СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Для усвоения этой темы необходимо рассмотреть понятия: сильные и слабые электролиты, Кд – константа диссоциации, – степень диссоциации,
закон разбавления В. Оствальда, ионное произведение воды, понятие о рН и рОН растворов.
Электролиты – вещества, проводящие электрический ток в растворе и расплаве. Поведение электролитов объяснила теория электролитической диссоциации С. Аррениуса (1887 г.). Состояние в растворе сильных электролитов было объяснено теорией П. Дебая и Э. Хюккеля (1923 г.). Для количественной характеристики диссоциации электролитов применяют две величины: константу (Кд) диссоциации и степень диссоциации α.
Сильные электролиты диссоциируют в разбавленных раствора нацело. В
растворах слабых электролитов существует равновесие между ионами и молекулами. Важной характеристикой электролитов служит степень диссоциации α:
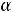

 ,
,
где n – число продиссоциировавших молекул, N – общее число молекул электролита. Степень диссоциации зависит от природы электролита,
природы растворителя, концентрации раствора и температуры, измеряется в процентах или в долях единицы, 
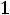

По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, 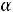 > 30 %. К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
> 30 %. К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.
Важнейшей характеристикой слабого электролита служит константа диссоциации (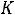 ). Рассмотрим равновесную реакцию диссоциации слабой кислоты НАn:
). Рассмотрим равновесную реакцию диссоциации слабой кислоты НАn:
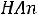
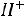
4
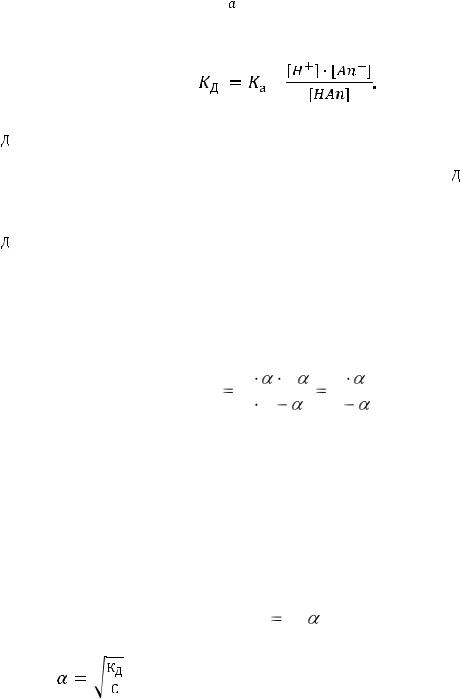
Константа равновесия Кс этой реакции и есть константа диссоциации кислоты, которая обозначается 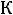 (нижний индекс а от англ. аcid – кислота)
(нижний индекс а от англ. аcid – кислота)
и имеет вид:
=
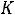
 это отношение произведения концентрации диссоциированных ионов к концентрации непродиссоциированных молекул.
это отношение произведения концентрации диссоциированных ионов к концентрации непродиссоциированных молекул. 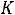 показывает во сколько раз скорость диссоциации больше скорости ассоциации.
показывает во сколько раз скорость диссоциации больше скорости ассоциации.
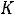 зависит от природы электролита и растворителя, температуры и не зависит от концентрации.
зависит от природы электролита и растворителя, температуры и не зависит от концентрации.
Если выразить равновесные концентрации через концентрацию слабого электролита С и его степень диссоциации α, то получим
|
C |
C |
|
C |
2 |
|
KД |
|
|
. |
|||
|
|
|
|
|
||
C (1 |
) |
1 |
|
|||
|
|
|
||||
Это соотношение называют законом разбавления Оствальда. Его можно сформулировать следующим образом:
степень диссоциации слабого электролита возрастает с разбавлением
раствора.
Для очень слабых электролитов при α << 1 это уравнение упрощается:
KД C  2 .
2 .
Тогда |
|
. |
|
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации 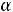 стремится к единице.
стремится к единице.
Рассмотрим диссоциацию N моль электролита, диссоциирующего на n
ионов. Тогда зависимость изотонического коэффициента (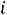 ) от степени диссоциации можно записать в виде:
) от степени диссоциации можно записать в виде:
5

После преобразования 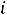 =
= 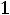
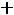
Решая уравнение относительно α, получим
Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента. Следует иметь в виду, что в случае сильных электролитов, найденное таким способом значение α выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ И ГИДРОКСИЛЬНЫЙ ПОКАЗАТЕЛИ
Важное значение имеет диссоциация воды, поскольку она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
Н2О Н+ + ОН‒.
Ее константа при 298 К (25 оС) равна
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
[H2O] |
1000 |
55,6 |
моль∙л–1, |
||
|
|
||||
18 |
|||||
|
|
|
|||
Отсюда произведение постоянных величин
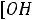


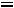 const.
const.
6
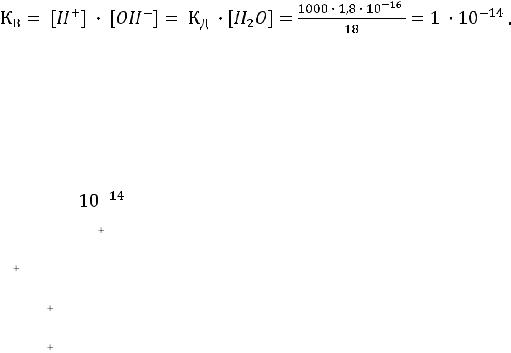
Численная величина произведения ионов, на которые диссоциирует вода,
называемая ионным произведением воды Кв, равна
В чистой воде или любом водном растворе при постоянной температуре произведение концентраций водород- и гидроксид-ионов есть величина постоянная, называемая ионным произведением воды.
Таким образом, в пределах 15–25 °С ионное произведение воды имеет
значение KВ = |
|
|
. |
|
|
|
|||
Равенство [H ] и [OH- ] соответствует нейтральной среде: |
||||
[H ] = [OH- ] = 1 ∙ 10‒7 моль/л, |
||||
при [H ] > 1 |
∙ 10‒7 |
моль/л – кислой, |
||
при [H ] < 1 |
∙ 10‒7 |
моль/л – щелочной. |
||
Для удобства характеристики кислотности среды было предложено использовать отрицательный логарифм от ионного произведения воды.
Очевидно,
− lg[H+] [OH‒] = − lg 1·10‒14;
[OH‒] = − lg 1·10‒14;
Отсюда
− lg[H+] + (− lg[OH‒]) = − lg 1·10‒14.
Величину отрицательного логарифма концентрации ионов водорода назвали водородным показателем и обозначили рН, отрицательный логарифм концентрации ионов гидроксила – гидроксильным показателем и обозначили его рОН.
Так как рН = − lg[H+], рОН = − lg[OH‒], тогда
рН + рОН = 14.
Величина рН впервые была введена датским химиком С. Серенсоном. Буква
«р» − начальная от датского слова potenz (степень), «Н» − символ водорода.
7
Вкислых растворах рН < 7, в нейтральных = 7, в щелочных > 7.
Вобычной лабораторной практике рН измеряют с помощью приборов с погрешностью 0,02.
Величины рН и рОН можно рассчитать, используя значения ионного произведения воды. Например, если концентрация ионов водорода в растворе
[Н+] = 0,001 моль/л = 10–3 моль/л; тогда рН = − lg[Н+],
рН = − lg10–3 = 3,
а рОН = 14 − рН = 14 − 3 =11.
КИСЛОТНОСТЬ СЛАБЫХ И СИЛЬНЫХ ЭЛЕКТРОЛИТОВ
По теории Аррениуса кислотами называются электролиты, диссоцирующие в растворах с образованием ионов водорода. А основаниями − электролиты при диссоциации которых образуются гидроксид-ионы.
В 1923 г. И. Бренстэд и Т. Лоури разработали протонную теорию кислот и оснований. По этой теории кислота – это частица, способная отдавать протон
(Н+), а основания – частицы, способные принимать протон. Это позволило расширить и объяснить кислотно-основные свойства многих соединений.
Так, основанием является ион 
 , так как способен присоединять катион
, так как способен присоединять катион
Н+:
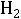
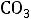 ,
,
где 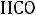
 – основание, а
– основание, а 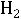
 – кислота.
– кислота.
Согласно этой теории, основание присоединяя Н+, превращается в кислоту,
а кислота, отдавая Н+, превращается в основание. Значит каждой кислоте соответствует сопряженное основание и наоборот.
где 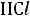 – кислота, а
– кислота, а 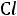
 – основание.
– основание.
8

В водных растворах любой слабой кислоты различают общую, активную и
потенциальную (резервную) кислотность.
Общая кислотность всегда соответствует содержанию всех кислот в
растворе, обозначается 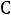 выражается в моль/л.
выражается в моль/л.
Активная кислотность количественно определяется концентрацией свободных гидратированных ионов водорода, выражается в моль/л или единицах рН. Например, если СН+ = 10-7 моль/л, то рН = − lg СН+= − lg 10-7 = 7.
Потенциальная кислотность раствора определяется количеством ионов водорода, содержащихся в недиссоциированных молекулах, но которые смогут еще диссоциировать.
Например, Собщ(СН3СООН) = 0,1N, диссоциирует только 0,01 N кислоты, то Сакт = 0,01N, рН = − lg 10-2 = 2
Спотенц = Собщ − Сакт = 0,1N − 0,01 N = 0,09 N.
Для сильных кислот в разбавленных растворах общая концентрация кислоты и концентрация ионов водорода равны, т.к. сильные электролиты в растворе диссоциируют практически полностью
Собщ = Сакт .
Для слабых кислот или оснований величину СН+(СОН−) и рН (рОН) можно рассчитать, зная степень диссоциации ( ) или константу диссоциации данной кислоты:
) или константу диссоциации данной кислоты:
при α < 1 имеем
или
Соответственно, для слабых оснований
9
