

БУФЕРНЫЕ СИСТЕМЫ
В процессе обмена веществ в организме образуется большое количество кислых и основных продуктов. Значительное количество кислот образуется при обмене белков, липидов, углеводов. 100 г белка приводит к образованию 20 мМ Н2SO4 и Н3РO4, а также большого количества органических кислот и угольной кислоты. Из основных соединений накапливаются аммиак, мочевина,
креатинин, диаминокарбоновые кислоты.
Смещение рН вызывает инактивацию ферментов, влияет на деятельность ЦНС, степень диссоциации электролитов, комплексообразование, нервно-
мышечную возбудимость, секрецию соляной кислоты в желудке и другие процессы.
Все процессы в организме протекают при определенном значении рН (см.
табл. 1).
Таблица 1
Значения рН различных биологических жидкостей и тканей организма
Биологическая жидкость |
|
рН (в норме) |
|
|
|
Сыворотка крови |
|
7,40 ± 0,05 |
|
|
|
Спинномозговая жидкость |
|
7,40 ± 0,05 |
|
|
|
Слюна |
|
6,35–6,85 |
|
|
|
Чистый желудочный сок |
|
0,9–1,1 |
|
|
|
Сок поджелудочной железы |
|
7,5–8,0 |
|
|
|
Желчь в протоках |
|
7,4–8,5 |
|
|
|
Моча |
|
4,8–7,5 |
|
10 |
|
Печень (внутриклеточная жидкость) |
6,4–7,4 |
|
|
Слѐзная жидкость |
7,4 ± 0,1 |
|
|
Молоко |
6,6–6,9 |
|
|
Смещение рН крови на 0,2 единицы приводит к значительному изменению концентрации ионов водорода и приводит к нарушениям биохимических
процессов. |
|
Так, при рН = 7,4 СН+ = 4 ∙ 10-8 моль/л, а при рН = 7,6 |
СН+ = 2,5 ∙ 10-8 моль/л, |
СН+ изменилось на 1,5 ∙ 10-8 моль/л, т.е. на 60% по сравнению с рН 7,4. |
|
Если уменьшить рН на 0,2 единицы, то при рН = 7,2 |
СН+ = 6,3 ∙ 10-8 моль/л |
и СН+ увеличится на 2,3 ∙ 10-8 моль/л, т.е. на 160% по сравнению с рН = 7,4.
Но таких изменений концентраций ионов водорода при нормальных физиологических процессах не происходит.
Одним из основных свойств живых организмов является поддержание кислотно-основного гомеостаза на определенном уровне. Протолитический гомеостаз – постоянство рН биологических жидкостей, тканей и органов. Это находит выражение в достаточно постоянных значениях рН биологических сред (крови, слюны, желудочного сока и т.д.) и способности организма восстанавливать нормальные значения рН при воздействии кислот и оснований.
Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы, но и физико-химические: буферное действие, ионный обмен и диффузию. Основными физиологическими системами, принимающими участие в регуляции рН, являются легкие, почки,
печень, пищевой канал, костная ткань. Восстановление рН за счет буферных систем крови возможно за 30 сек, легочная компенсация осуществляется медленнее, в течение нескольких минут, а иногда и часов, а за счет почек – за
20 часов. Печень регулирует рН за счет синтеза белков. Кости скелета содержат большое количество ионов натрия, в меньшей степени ионы калия, кальция и магния, которые могут замещать ионы водорода в плазме крови. При этом
11

возможна декальцификация скелета. Таким образом, буферные растворы играют важную роль поддержания рН в организме.
Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания.
Буферные растворы представляют собой растворы, содержащие слабую кислоту и сопряженное с ним основание или слабое основание и сопряженную с ним кислоту.
Поэтому различают кислотные, основные и амфотерные буферные растворы.
 Кислотные, т. е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa − ацетатный буфер
Кислотные, т. е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa − ацетатный буфер
СН3СООН + Н2О |
Н3О+ + СН3СОО− |
кислота |
избыток сопряженного |
|
основания |
СН3СООNa → Na+ + CH3COO−
Согласно закону действующих масс константа диссоциации уксусной кислоты может быть записана в виде уравнения:
= 






Отсюда находим концентрацию ионов водорода:

 =
= 





Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде, т.е. диссоциация СН3СООН будет подавлена. Поэтому концентрацию недиссоциированных молекул кислоты можно принять равной общей
12

концентрации кислоты, а концентрацию ацетат-ионов равной концентрации соли. Тогда

 =
= 



 .
.
Так как рН = –lg[Н+], то рН кислотной буферной системы рассчитывается по уравнению:
где 


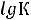

 ,
, 


 и
и 
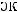

 – количества эквивалентов вещества соли и кислоты соответственно. Из формулы для расчета молярной концентрации эквивалента вещества или нормальности
– количества эквивалентов вещества соли и кислоты соответственно. Из формулы для расчета молярной концентрации эквивалента вещества или нормальности
следует, что величину 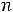
 можно вычислить как
можно вычислить как 




 , тогда уравнение для расчета рН принимает вид:
, тогда уравнение для расчета рН принимает вид:
Это уравнение называют уравнением Гендерсона – Гассельбаха.
Таким образом, рН буферной системы зависит от константы диссоциации и соотношения компонентов буферной смеси.
Важнейшая роль в организме принадлежит буферным системам крови. К
кислотным буферным системам относятся гидрокарбонатная, фосфатная,
гемоглобиновая буферные системы.
 Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O |
OH− + NH4+ |
Основание |
избыток сопряженной |
|
кислоты |
|
13 |

NH4Cl → Cl− + NH4+
Уравнение Гендерсона – Гассельбаха для основной буферной системы
будет иметь такой вид: |
|
|
|
|
|
|
|||
|
|
|
|
|
, а |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где |
|
(основания, |
индекс |
b |
от |
|
англ. |
basis), |
|
|
|
||||||||
(соли) и |
(основания) – количества эквивалентов вещества соли и |
||||||||
основания соответственно. |
|
|
|
|
|
|
|||
Амфотерные буферные растворы. К ним относятся аминокислотные белковые буферные растворы.
Белковая буферная система относится к амфотерным системам, т.к.
способна взаимодействовать как с кислотами, так и основаниями за счет наличия в молекуле как основных (-NH2) так и кислотных (СООН)-групп.
МЕХАНИЗМ ДЕЙСТВИЯ БУФЕРНЫХ РАСТВОРОВ
Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa
1. При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием CH3COO‾ в
слабый электролит СН3СООН.
CH3COO ‾ +H+ CH3COOH |
1 |
Из уравнения (1) видно, что сильная кислота НСl заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В
результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
14

где 

 − объем и нормальность добавленной в раствор кислоты.
− объем и нормальность добавленной в раствор кислоты.
2. При добавлении к буферу небольшого количества щелочи протекает реакция еѐ с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾:
CH3COOН + OH ‾ CH3COO‾ + H2O. |
2 |
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется.
рН остаѐтся постоянным.
При добавлении щелочи рН определяется по формуле:
где |
− объем и нормальность добавленной в раствор щелочи. |
3. При |
разбавлении буфера рН также не меняется, т.к. константа |
диссоциации и соотношение компонентов при этом остаются неизменными.
Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
Для количественной характеристики буфера вводится понятие буферной емкости.
15

БУФЕРНАЯ ЕМКОСТЬ
Буферная емкость это способность буферной системы противодействовать изменению рН среды при добавлении определенных количеств сильной кислоты или сильного основания.
Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия.
Буферная емкость (В) выражается количеством моль эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
где В – буферная емкость, 
 – количество моль эквивалентов сильной кислоты или щелочи,
– количество моль эквивалентов сильной кислоты или щелочи,
рНН – начальное значение рН (до добавления кислоты или щелочи)
рНК – конечное значение рН (после добавления кислоты или щелочи)
рН – изменение рН.
На практике буферная емкость рассчитывается по формуле:
где V – объем кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи,
Vбуф объем буферного раствора,
рН – изменение рН.
О противодействии изменению рН крови свидетельствуют следующие данные. Чтобы сдвинуть рН крови на единицу в щелочную область, нужно прибавить в кровь в 70 раз больше количества NaOH, чем в такой же объем чистой воды. Для изменения рН на единицу в кислую область, следует в кровь
16

добавить в 320 раз больше количества соляной кислоты, чем к такому же объему чистой воды.
Буферная емкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной емкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице, т.е. при рН = рК. Буферная емкость артериальной крови 25,3 ммоль/л,
венозной – 24,3 ммоль/л.
Слюна обладает буферной емкостью и определяется бикарбонатной,
фосфатной и белковой системами, которые играют защитную роль в полости рта. В слюне кислая фосфатаза имеет оптимум рН = 4,7-6,0. От состояния кислотно-основного равновесия слюны зависит и активность гиалуронидазы – фермента, влияющего на проницаемость мягких тканей, степень их гидратации,
транспорт воды и ионов. В норме буферная емкость слюны по кислоте и
основанию имеет следующие значения: ВК = 8,2 


 ВОСН = 47,5
ВОСН = 47,5




 Буферная емкость слюны изменяется под влиянием ряда факторов:
Буферная емкость слюны изменяется под влиянием ряда факторов:
углеводистая диета снижает буферную ѐмкость слюны, высокобелковая диета – повышает еѐ. Поражаемость зубов кариесом меньше у лиц с высокой буферной
емкостью. Следовательно, высокая буферная емкость слюны фактор,
повышающий резистентность зубов к кариесу. Снижение рН до 5,0-4,0
провоцирует деминерализацию зубной эмали, способствует возникновению кариеса.
17

БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА
В организме человека действуют белковый, гемоглобиновый, фосфатный и гидрокарбонатный буферы. Из буферных систем организма наибольшую емкость имеют буферные системы крови. И в плазме, и в эритроцитах находятся и гидрокарбонатный и фосфатный буферы. Только в плазме локализуется буферная система белков (альбуминов, глобулинов и др.).
Гемоглобиновая буферная система и буферные пары органических фосфатов находятся в эритроцитах.
Гидрокарбонатный буфер
Гидрокарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования. Помимо плазмы,
эта буферная система содержится в эритроцитах, интерстициальной жидкости,
почечной ткани. Она состоит из 
 и
и 
 в сыворотке крови или
в сыворотке крови или
 – в клеточной плазме На долю гидрокарбонатной буферной системы приходится 53% буферной емкости крови.
– в клеточной плазме На долю гидрокарбонатной буферной системы приходится 53% буферной емкости крови.
Уравнение Гендерсона Гассельбаха для гидрокарбонатной буферной системы имеет вид:
В условиях плазмы крови (при 37 оС) 





 По уравнению Гендерсона Гассельбаха нетрудно рассчитать соотношение концентраций ионов
По уравнению Гендерсона Гассельбаха нетрудно рассчитать соотношение концентраций ионов 
 и угольной кислоты в крови при рН = 7,4:
и угольной кислоты в крови при рН = 7,4:
7,4 = 6,1 



18

Отсюда следует, что гидрокарбонатная буферная система более эффективно поддерживает рН в организме при образовании кислот. Избыток ионов 
 обеспечивает так называемый щелочной резерв крови.
обеспечивает так называемый щелочной резерв крови.
В вышеприведенном уравнении реальная концентрация 
 определяется концентрацией растворенного углекислого газа, которая находится в прямой зависимости от парциального давления
определяется концентрацией растворенного углекислого газа, которая находится в прямой зависимости от парциального давления 
 При парциальном давлении (
При парциальном давлении ( ) = 40 мм рт. ст. на 1 моль
) = 40 мм рт. ст. на 1 моль 
 приходится 500 моль
приходится 500 моль 
 Следовательно парциальное давление
Следовательно парциальное давление  является одним их важных показателей кислотно-
является одним их важных показателей кислотно-
основного равновесия (КОР) организма.
Механизм действия гидрокарбонатной буферной системы
1. В процессе обмена веществ в организме образуется большое количество кислых продуктов. Кислотность этой массы соответствует 2 л
концентрированной  . В случае накопления кислот в крови они соединяются с анионами гидрокарбоната, что приводит к образованию слабо диссоциирующей угольной кислоты, которая не освобождает так много ионов водорода как сильные кислоты, т.е. сильная кислота заменяется эквивалентным количеством слабой кислоты поэтому рН резко не изменяется. Происходит реакция:
. В случае накопления кислот в крови они соединяются с анионами гидрокарбоната, что приводит к образованию слабо диссоциирующей угольной кислоты, которая не освобождает так много ионов водорода как сильные кислоты, т.е. сильная кислота заменяется эквивалентным количеством слабой кислоты поэтому рН резко не изменяется. Происходит реакция:








 +
+ 
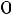
 2. Увеличение концентрации слабой кислоты приводит к уменьшению ее
2. Увеличение концентрации слабой кислоты приводит к уменьшению ее
диссоциации, что еще больше уменьшает концентрацию Н+. Далее с участием угольной кислоты происходит обменная реакция:
следовательно, |
избыток |
устраняется, |
а |
концентрация |
||||||
увеличивается и соотношение |
|
|
|
= |
|
восстанавливается. |
|
|||
|
|
|
||||||||
|
|
|
||||||||
3. Угольная |
кислота легко разлагается с образованием эквивалентного |
|||||||||
количества |
Возникающее небольшое |
|
изменение |
рН тут |
же |
|||||
выравнивается, |
т.к. образующийся |
при |
разложении |
|
углекислый |
газ |
||||
|
|
19 |
|
|
|
|
|
|
|
|
