

в) угнетении дыхательного центра лекарственными средствами или наркотиками – опиатами, барбитуратами и т.п.
Дыхательный алкалоз – это некомпенсированное или частично компенсированное повышение рН в результате гипервентиляции из-за лихорадочного состояния или истерии. Процессы компенсации осуществляются буферными системами, повышенным выведением гидрокарбонат-иона почками.
При нарушении КОР в организме быстро включается буферная компенсация (через 10-15 мин). Легочная компенсация развивается в норме от нескольких минут до нескольких часов и заключается в стабилизации отношения [
 ] / [
] / [ 
 ] путем изменения объѐма легочной вентиляции.
] путем изменения объѐма легочной вентиляции.
Почечная компенсация связана с включением ряда дополнительных ферментативных процессов, поэтому она развивается в течение нескольких часов до 2–3 суток.
Применение реакции нейтрализации в фармакотерапии
Для проведения коррекции кислотно-основного состояния необходимо выявить, какое звено в его регулировке нарушено. Для этого необходимо определить значения рН биологических жидкостей и содержание буферных оснований.
В основе фармакологических действий лежит реакция нейтрализации.
Например, в качестве экстренной меры при ацидозе применяется внутривенное вливание раствора гидрокарбоната натрия 4,5%, а в острых случаях – 8,4%. Второе эффективное средство – трисамин 3,66%, который связывает избыточные протоны. Он эффективен только при внутривенном введении. Также в качестве средства, коррегирующего ацидоз, используют лактат натрия 11% раствор.
Для устранения явления алкалоза в некоторых случаях используют раствор аскорбиновой кислоты 5%. В гастроэнтерологии применяют средства,
30
нормализующие секреторную функцию желудка. При пониженной кислотности желудочного сока назначают разбавленную соляную кислоту, при повышенной кислотности – различные антацидные препараты: оксид магния, основной карбонат магния, карбонат кальция, гидрокарбонат натрия.
31

ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача 1.
Рассчитайте рН 0,01N раствора соляной кислоты. Как изменится рН этого раствора, если к 100 мл его прибавить 20 мл 0,01N раствора NаOH?
Решение:
1. сильная кислота, поэтому
сильная кислота, поэтому 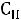
 =
= 












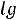
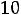

 = 2.
= 2.
2.При действии раствора 
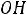 протекает реакция:
протекает реакция:
3.Эквивалентное количество щелочи прореагирует с эквивалентным количеством кислоты.







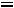








 .
.
До реакции количество  l
l 
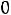








 . Тогда в растворе осталось
. Тогда в растворе осталось
 = 0,001 – 0,0002 = 0,0008 моль,
= 0,001 – 0,0002 = 0,0008 моль,
объем раствора
4.Находим концентрацию кислоты в растворе:
5.Находим рН полученного раствора:
6.Изменение 









Ответ: рН увеличился на 0,18.
Задача 2.
Рассчитайте рН 0,01 N раствора СН3СООН, если 


Решение:
Находим рН раствора по формуле:
32

Ответ: |
|
|
|
|
|
|
|
раствора уксусной кислоты 3,35. |
|||||||||||||||||
Задача 3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Определите рН 0,1 N раствора NH4OH, если α = 1% или 0,01. |
|||||||||||||||||||||||||
Решение. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Первый способ: |
|
|
|
|
|
|
|
|
|||||||||||||||||
1. |
Определяем СОН- раствора NH4OH: |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1 ∙ 0,01 = 0,001 = 10-3 моль/л; |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
тогда рОН = |
|
lg |
|
|
|
|
= |
|
lg10-3 = 3. |
|
|||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
2. |
Определяем рН раствора из уравнения: |
||||||||||||||||||||||||
рН = 14 – рОН = 11. |
|
||||||||||||||||||||||||
Второй способ: |
|
|
|
|
|
|
|
|
|||||||||||||||||
1. |
Определяем СОН- раствора NH4OH: |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1 ∙ 0,01 = 0,001 = 10-3 моль/л. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
2. |
Из ионного произведения воды следует: |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
определяем |
: |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
моль/л |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
3. |
Определяем рН раствора NH4OH: |
||||||||||||||||||||||||
рН = |
|
lg |
= |
|
|
|
|
|
lg10-11 = 11. |
|
|||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
Ответ: рН 0,1 N раствора NH4OH равен 11.
Задача 4.
Можно ли приготовить аммиачный буфер с рН = 4,7, когда
( |
|
|
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Решение: |
|
|
|
|
|
|
|
|
||
1. Определяем рК NH4OH: |
|
|
||||||||
|
|
|
( |
) |
|
|
|
|
|
= 4,74. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||||
2. Определяем интервал буферного действия по формуле:
33

Ответ: значение 


 входит в интервал
входит в интервал 




 , поэтому такой аммиачный буфер можно приготовить.
, поэтому такой аммиачный буфер можно приготовить.
Задача 5.
Для приготовления буфера взяты 70 мл 2 N раствора NH4OH и 140 мл 0,1 N
раствора NH4С1. Как изменится рОН этого раствора, если: а) этот раствор разбавить в 10 раз, б) добавить к нему 10 мл 0,1 N раствора NaОН?

 (
(
 )
) 







Решение:
1. Определяем рК NH4OH:




 (
(
 )
)



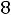



 = 4,74. 2. Определяем начальное значение
= 4,74. 2. Определяем начальное значение  :
:
 = 4,74 +
= 4,74 + 
 ,
,

 = 4,74 +
= 4,74 + 



 = 4,74 +
= 4,74 + 






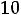






3. Определяем  при разбавлении раствора. При добавлении воды происходит разведение буферного раствора, причем изменение объема компонентов буферной смеси обратно пропорционально изменению концентрации. Тогда
при разбавлении раствора. При добавлении воды происходит разведение буферного раствора, причем изменение объема компонентов буферной смеси обратно пропорционально изменению концентрации. Тогда

 = 4,74 +
= 4,74 + 





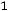

 = 4,74 +
= 4,74 + 



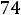









4. Определяем конечное значение  после добавления NaOH:
после добавления NaOH:

 =
= 











 =
= 

5. Определяем изменение 

34

Ответ:  не изменяется при разбавлении буфера в любое число раз, так как при этом не изменится соотношение концентраций компонентов буфера;
не изменяется при разбавлении буфера в любое число раз, так как при этом не изменится соотношение концентраций компонентов буфера;
при добавлении раствора NaОН 
Задача 6.
Рассчитайте буферную ѐмкость фосфатного буфера, если при добавлении 3
мл 0,01 N раствора  к 20 мл этого буфера рН меняется от 7,4 до 7,1?
к 20 мл этого буфера рН меняется от 7,4 до 7,1?
Изменится ли буферная емкость этого буфера при разведении его в 5 раз?
Решение:
1.Определяем 






 –
– 

2.Определяем буферную ѐмкость по формуле:
Ответ: 




 . Буферная емкость буферных растворов зависит от концентрации компонентов буферной смеси и при разведении уменьшается.
. Буферная емкость буферных растворов зависит от концентрации компонентов буферной смеси и при разведении уменьшается.
Задача 7.
В каком соотношении находятся исходные компоненты фосфатной и гидрокарбонатной буферных систем в плазме крови при рН = 7,4, если для плазмы рК (

 ) = 6,8; рК (
) = 6,8; рК (
 ) = 6,1?
) = 6,1?
Решение:
Запишем уравнение Гендерсона – Гассельбаха для двух буферных систем:
 (
(
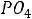



 ) = рК(
) = рК(

 )
) 

 ;
;
35

pH





 = pK(
= pK(
 )
)

 ;
;

 0,6;
0,6;
Ответ: И в фосфатной и в гидрокарбонатной буферных системах сопряженных оснований больше, чем кислот, что необходимо для живых организмов, в результате метаболизма которых образуется значительно больше кислот, чем оснований.
36
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1.Какие электролиты называются сильными, а какие слабыми? Приведите примеры диссоциации таких электролитов.
2.Дайте определение степени и константы диссоциации слабых электролитов. От каких факторов зависят эти величины?
3.Приведите взаимосвязь между степенью и константой диссоциации.
Приведите формулировку и математическое выражение закона разбавления
Оствальда.
4.Диссоциация воды. Ионное произведение воды. Понятие о рН и рОН растворов. Формулы для расчета рН и рОН растворов.
5.Понятие о кислотности среды. Расчет кислотности среды для слабых и сильных кислот и оснований.
6.Какие растворы называются буферными растворами?
7.Классификация буферных растворов.
8.Механизм буферного действия.
9.Уравнение Гендерсона – Гассельбаха для определения рН и рОН протолитических буферных растворов.
10.Факторы, влияющие на рН и рОН буферных растворов.
11.Буферная ѐмкость. Зона буферного действия.
12.Количественное определение буферной ѐмкости.
13.Буферные системы крови: гидрокарбонатная, фосфатная,
гемоглобиновая и протеиновая.
14.Взаимодействие буферных систем в организме.
15.Кислотно-основное равновесие. Основные показатели КОР.
16.Возможные причины и типы нарушений КОР организма.
17.Применение реакции нейтрализации в фармакотерапии для коррекции КОР: лекарственные средства с кислотными и основными свойствами.
37
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ ЛАБОРАТОРНЫЕ РАБОТЫ
1. Определение буферных свойств биологических жидкостей
Опыт 1. В четыре одинаковые пробирки с помощью пипетки отмерить по 1 мл сыворотки крови. Первую пробирку оставить для контроля, во вторую добавить 5 капель 0,025 N раствора NаОН, в третью – 5 капель 0,025 N раствора НСl, в четвѐртую – 5 капель воды. Затем во все пробирки добавить по 1-2 капли универсального индикатора и по цветной шкале универсального индикатора определите приблизительное значение рН.
Опыт 2. В четыре одинаковые пробирки с помощью пипетки отмерить по 1 мл ацетатного буфера. Первую пробирку оставить для контроля, во вторую добавить 5 капель 0,025 N раствора NаОН, в третью – 5 капель 0,025 N раствора НСl, в четвѐртую – 5 капель воды. Затем во все пробирки добавить по 1-2 капли универсального индикатора и по цветной шкале универсального индикатора определите приблизительное значение рН.
Опыт 3. В две одинаковые пробирки с помощью пипетки отмерить: в первую 5 капель воды, во вторую 5 капель слюны. Добавить в каждую пробирку по 1-2 капли универсального индикатора и определить примерное значение рН. Затем добавить в обе пробирки по 1 капле 0,01 N раствора НСl.
Что наблюдаете? Охарактеризуйте буферные свойства слюны. Результаты опытов занесите в табл. № 2.
38

Таблица 2
Определение рН буферных растворов
Исследуемый |
Значение рН по универсальному индикатору |
Вывод |
об |
||||
раствор |
|
|
|
|
изменении |
|
|
Контрольный |
После |
После |
После |
|
|||
|
|
||||||
|
|
раствор |
добавления |
добавления |
добавления |
рН раствора |
|
|
|
|
|
||||
|
|
|
НСl |
NаОН |
воды |
|
|
|
|
|
|
|
|
|
|
1. |
Сыворотка |
|
|
|
|
|
|
крови |
|
|
|
|
|
|
|
2. |
Ацетатный |
|
|
|
|
|
|
буфер |
|
|
|
|
|
|
|
3.Слюна
2.Зависимость рН буферных растворов от соотношения компонентов
Опыт 1. В три пробирки с помощью пипетки отмерить 0,2 N Nа2НРО4 и 0,2
N NаН2РО4 в объемах, указанных в табл. № 2, добавить в каждую пробирку по две капли универсального индикатора и определить рН по цветной шкале универсального индикатора.
Таблица 3
Зависимость рН буферных растворов от соотношения компонентов
№ |
Объем (мл) |
Объем (мл) |
Соотношение |
рН по |
рН по |
|
0,2 N |
0,2 N |
Nа2НРО4 / NаН2РО4 |
индикатору |
формуле |
|
Nа2НРО4 |
NаН2РО4 |
|
|
|
1 |
0,2 |
2,0 |
|
|
|
2 |
1,1 |
1,1 |
|
|
|
3 |
2,0 |
0,2 |
|
|
|
|
|
|
|
|
|
Вычислить рН исследуемых растворов по формуле Гендерсона –
Гассельбаха: |
|
|
; |
( |
) = |
Сделать вывод зависимости рН от соотношения концентраций компонентов буферной смеси.
39
