

УПРАЖНЕНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Величина рН раствора уксусной кислоты равна 4. Определите общую концентрацию кислоты в растворе, если она диссоциирует на 10%.
2.К 99 мл воды прилили 1 мл 0,1 N раствора NаOH. Как изменится рН воды?
3.Кровь, биологическая жидкость, практически имеющая постоянное значение рН. Отклонение значения рН на 0,3 ведет к тяжелому состоянию.
Определите рН крови, если 







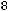 моль/л. Ответ: рН = 7,36.
моль/л. Ответ: рН = 7,36.
4.Во сколько раз 
 в крови больше (рН = 7,36), чем в спинно-мозговой жидкости (рН = 7,53)? Ответ: в 100 раз.
в крови больше (рН = 7,36), чем в спинно-мозговой жидкости (рН = 7,53)? Ответ: в 100 раз.
5.Вычислить константу диссоциации 0,1 N раствора 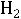
 по первой ступени, если известно, что степень диссоциации кислоты по первой ступени равна 2,11
по первой ступени, если известно, что степень диссоциации кислоты по первой ступени равна 2,11 
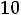

 .
.
6. Можно ли приготовить ацетатный буфер с рН = 5,4, если
(
 )
) 







7.Рассчитайте рОН буфера, состоящего из 50 мл 0,1 N раствора СН3СООН
и100 мл 0,01 N раствора СН3СООNa, если рК = 4,7. Ответ: рОН = 9,0.
8.Для приготовления буфера взяты 50 мл 2 N раствора NH4ОН и 100 мл 0,1
N раствора NH4С1 (рК = 4,4). Как изменится рН этого раствора, если к нему добавить: а) 10 мл раствора 0,1 N НС1, б) 200 мл воды? Ответ: 




 рН не изменится.
рН не изменится.
9.Для приготовления ацетатного буфера взяты 100 мл 0,01 N раствора СН3СООН и 50 мл 0,01 N раствора СН3СООNa, (рК = 4,7). Как изменится рН этого раствора, если к нему добавить: а) 25 мл 0,1N раствора NaОН, б) 25 мл воды? Ответ: а) увеличится на 0,3; б) не изменится.
10.Рассчитайте буферную ѐмкость буфера, состоящего из 0,05 моль экв соли и 0,1 моль экв кислоты, если к 1 л этого буфера добавить 20 мл 0,5 N
раствора  (рК к-ты = 4,7).
(рК к-ты = 4,7).
40
11.Изменится ли рН и буферная емкость крови при введении в кровь 200 мл физиологического раствора 
 ? Ответ мотивировать.
? Ответ мотивировать.
12.Какова буферная емкость крови, если при добавлении 30 мл 0,1 N
раствора  к 200 мл крови рН меняется от7,4 до 7,1? Рассчитайте буферную емкость крови при разбавлении ее в 10 раз. Ответ: В1 = 0,05 моль экв/л, В2 =
к 200 мл крови рН меняется от7,4 до 7,1? Рассчитайте буферную емкость крови при разбавлении ее в 10 раз. Ответ: В1 = 0,05 моль экв/л, В2 =
0,005 моль экв/л.
41
ТЕСТЫ ДЛЯ САМОКОНТРОЛЯ
1. Степень диссоциации показывает:
а) число молекул электролита, распавшихся на ионы;
б) число моль электролита, распавшихся на ионы;
в) концентрацию молекул электролита, оставшегося в растворе;
г) долю молекул электролита, распавшихся на ионы.
2. Укажите выражение ионного произведения воды: а) СН+ + СОН- = 10-14 моль/л; б) СН+ ∙ СОН- = 10-7 моль/л; в) СН+ ∙ СОН- = 10-14 моль/л; г) СН+ – СОН- = 10-14 моль/л.
3. Определите рН раствора, в котором концентрация ионов Н+ равна 10–4
моль/л:
а) 4;
б) 10;
в) 6;
г) 8.
4. Водородный показатель рН представляет собой:
а) показатель активности ионов 
 ;
;
б) отрицательный натуральный логарифм концентрации ионов Н+;
в) отрицательный десятичный логарифм концентрации ионов Н+;
г) константу диссоциации кислот.
5. В соответствии с законом разбавления Оствальда степень диссоциации слабого электролита при разведении:
а) уменьшается;
б) увеличивается;
в) сначала увеличивается, а затем уменьшается;
г) не изменяется.
6. Потенциальная кислотность определяется концентрацией:
а) недиссоциированных молекул кислоты;
42
б) свободных гидратированных ионов Н+;
в) кислот в растворе.
7. Активная основность раствора NH4OH равна:
а) Собщ;
б) α · Собщ;
в) больше Собщ.
8. Константа диссоциации слабого электролита не зависит:
а) от природы растворителя;
б) природы растворенного вещества;
в) концентрации;
г) температуры.
9. Буферные растворы можно приготовить:
а) из HNO3 и КОН;
б) СН3СООН и NaCl;
в) HCl и KNO3;
г) NH4OH и NH4С1.
10. Буферные растворы можно приготовить:
а) из HNO3 и КОН;
б) СН3СООН и NaOH;
в) HCl и KNO3;
г) NH4OH и (NH4 )2S.
11.Щелочной резерв крови определяется количеством мл СО2 в объѐмных
%в расчете:
а) на 1000 мл;
б) 100 мл;
в) 10 мл;
г) 1,0 мл сыворотки крови.
12.Буферная ѐмкость количественно определяется:
а) моль экв сильной кислоты или основания, которое нужно добавить к 1 л
буферного раствора, чтобы изменить его рН на единицу;
43
б) моль/л сильной кислоты или основания, которое нужно добавить к 1 л
буферного раствора, чтобы изменить его рН на единицу;
в) числом мл слабой кислоты или основания, которое нужно добавить к 1 л
буферного раствора, чтобы изменить его рН на единицу;
г) числом мл сильной кислоты или основания, которое нужно добавить к 1 л
буферного раствора, чтобы изменить его рН.
13. Угольная кислота имеет рК = 6,11. Можно ли использовать ее для приготовления буферного раствора:
а) с рН = 4,7;
б) 8,2;
в) 6,8;
г) 10?
14. При рН = 7,4 соотношение компонентов бикарбонатного буфера
H2CO3/NaHCO3:
а) 1:20;
б) 20:1;
в) 1:1;
г) 1:5.
15. При компенсированном алкалозе:
а) рН = 7,4, щелочной резерв 55 объемных %;
б) рН = 7,2, щелочной резерв 70 объемных %;
в) рН = 7,4, щелочной резерв 70 объемных %;
г) рН = 7,4, щелочной резерв 40 объемных %.
16. От чего зависит рН буферной системы:
а) от объѐма буфера;
б) концентрации компонентов;
в) разведения;
г) соотношения концентраций компонентов?
17. В нейтрализации ионов водорода в почечной ткани принимает участие буферная система:
44
а) гидрокарбонатная;
б) фосфатная;
в) гемоглобиновая;
г) ацетатная.
18. Щелочной резерв крови в норме равен:
а) 24%;
б) 55%;
в) 35%;
г) 76%.
19. При разведении буферная ѐмкость уменьшается,
а) так как не изменяется соотношение компонентов;
б) увеличивается объѐм;
в) уменьшается концентрация;
г) изменяется соотношение компонентов. 20. В норме парциальное давление равно:
а) 60 мм рт. ст.;
б) 20 мм рт. ст.;
в) 50 мм рт. ст.;
г) 40 мм рт. ст.
21. При компенсированном ацидозе:
а) рН = 7,4, щелочной резерв 55 объемных %;
б) рН = 7,2, щелочной резерв 40 объемных %;
в) рН = 7,4, щелочной резерв 40 объемных %;
г) рН = 7,5, щелочной резерв 65 объемных %.
22. Какая из двух буферных систем кислотного типа обладает большей буферной емкостью к избытку сильного основания:
а) рН = рК+1,
б) рН = рК – 1,
в) рН = рК,
г) рН = рОН?
45
23. Наибольшим значением рН обладает раствор, состоящий: а) из 6 мл 0,1 N р-ра Nа2НРО4 и 9 мл 0,1 N р-ра NаН2РО4;
б) 7,5 мл 0,1 N р-ра Nа2НРО4 и 7,5 мл 0,1N р-ра NаН2РО4; в) 9мл 0,1 N р-ра Nа2НРО4 и 6 мл 0,1 N р-ра NаН2РО4;
г) 8мл 0,2 N р-ра Nа2НРО4 и 9 мл 0,1 N р-ра NаН2РО4.
24. При прибавлении к 100 мл сыворотки крови 20 мл 5% раствора глюкозы рH сыворотки крови:
а) увеличится;
б) уменьшится;
в) не изменится.
25. При алкалозе в качестве коррегирующего средства можно использовать:
а) раствор гидрокарбоната натрия 4,5%,
б) раствор лактата натрия 11%;
в) раствор аскорбиновой кислоты 5%;
г) раствор трисамина 3,66%.
Эт а ло ны от вет о в к т ест о вым з а да н ия м
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
задания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вариант |
г |
в |
а |
в |
б |
в |
б |
в |
г |
ответа |
|
|
|
|
|
|
|
|
|
№ |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
задания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вариант |
б |
б |
а |
в |
а |
в |
г |
б |
б |
ответа |
|
|
|
|
|
|
|
|
|
№ |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
|
задания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вариант |
в |
г |
в |
б |
б |
в |
в |
|
|
ответа |
|
|
|
|
|
|
|
|
|
46
ЗАКЛЮЧЕНИЕ
В процессе обмена веществ в организме образуется большое количество кислых и основных продуктов. Все процессы в организме протекают при определенном значении рН. Смещение рН крови на 0,2 единицы приводит к значительному изменению концентрации ионов водорода и, как следствие, к
нарушениям биохимических процессов. При этом происходит изменение активности ферментов, нервной возбудимости, комплексообразования и других процессов.
Но таких изменений концентраций ионов водорода при нормальных физиологических процессах не происходит. Нормальные значения рН поддерживаются в организме физиологическими (легкие, печень, почки) и
биохимическими механизмами (диффузия, буферные системы).
Восстановление рН за счет буферных систем крови возможно за 30 сек,
легочная компенсация осуществляется медленнее, в течении нескольких минут,
а иногда и часов, а за счет почек – за 20 часов. Таким образом, буферные растворы играют важную роль поддержания рН в организме, рН буферной системы зависит от константы диссоциации и соотношения компонентов буферной смеси.
Вкрови важную роль играют гидрокарбонатная, фосфатная,
гемоглобиновая и белковая буферные системы. При образовании больших количеств кислот или оснований буферное действие уменьшается и может произойти изменение рН крови. В зависимости от глубины патологических изменений различают компенсированный и некомпенсированный ацидоз и алкалоз В случае компенсированного ацидоза буферная емкость изменяется, но рН сохраняется (7,36–7,44). При некомпенсированном ацидозе кислотная буферная емкость уменьшается и снижается рН крови (7,3–7,2). При некомпенсированном алкалозе кислотная буферная емкость увеличивается и рН увеличивается (7,5–7,6). Метаболический ацидоз связан с нарушением обмена веществ, а респираторный (дыхательный) с нарушением функции легких.
47
Для характеристики кислотно-основного состояния крови определяют величину рН, парциальное давление углекислого газа, величину щелочного резерв, содержание буферных оснований и сдвиг буферных оснований. При обнаружении нарушений кислотно-основного состояния, выявления причин нарушений проводят лечение, коррекцию. Для устранения алкалоза используют
5% раствор аскорбиновой кислоты, а для устранения ацидоза 4,5% раствор гидрокарбоната, 3,66% раствор трисамина.
Знание этого материала важно для будущей профессии врача.
48
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Ершов, Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов [Текст]: учебник для медвузов / Ю.А. Ершов, В.А. Попков, А.С.
Берлянд [и др.]; под ред. Ю.А. Ершова. – 8-е изд. – М.: Высш. шк., 2010. – 560
с.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов [Текст]: учеб. пособие для студентов медвузов / ред. В.А. Попков. – 4-е изд. – М.: Высш. шк., 2008. – 239 с.
3. Пузаков, С.А. Сборник задач и упражнений по общей химии [Текст]:
учеб. пособие / С.А. Пузаков, В.А. Попков, А.А. Филиппова. – 4-е изд. – М.:
Высш. шк., 2010. – 255 с.
4.Попков, В.А. Общая химия [Текст]: учебник для медвузов / В.А.
Попков, С.А. Пузаков. – М.: ГЭОТАР Медиа, 2007. – 976 с.
49
