
- •3.1. Онкогены
- •4.2. Выявление и мониторинг химических канцерогенов
- •5.1. Общая характеристика онкогенных вирусов
- •5.2. Онкогенный потенциал вирусов и механизмы его проявления
- •5.3. Вирусы папиллом и их роль в канцерогенезе шейки матки
- •5.4. Роль вируса гепатита в развитии рака печени
- •5.8. Ретровирусы типа D (SRV)
- •5.9. Эндогенные ретровирусы человека
- •5.10. О возможном участии ретровирусов в индукции рака молочных желез человека
- •7.1. Цитоскелет
- •7.2. Распластывание и локомоция нормальных клеток

шение последних влечет за собой серьезные изменения в организации актиновых микрофиламентов в фибробластах.
7.2. Распластывание и локомоция нормальных клеток
Распластывание |
и локомоция |
кле |
|
||||||||
ток — это проявление их контактного |
|
||||||||||
взаимодействия |
с |
поверхностью |
твер |
|
|||||||
дого субстрата. Под твердым субстра |
|
||||||||||
том мы подразумеваем подложку, к |
|
||||||||||
поверхности |
которой клетки |
могут |
|
||||||||
прикрепляться |
и на |
которой |
они за Рис. 7.4. Фибронектин на поверхности |
||||||||
тем |
будут |
распластываться, |
переме |
фибробластов человека. МНИФ с приме |
|||||||
нением антител против фибронектина. Ув. |
|||||||||||
щаться и |
размножаться. |
В |
условиях |
||||||||
400. (Препарат Л. В. Домниной.) |
|||||||||||
культивирования |
таким |
субстратом |
|||||||||
|
|||||||||||
для |
клеток |
служит |
плоское |
гладкое |
|
||||||
дно |
культурального |
флакона, |
изготов |
|
|||||||
ленного из стекла или пластика. В ор |
|
||||||||||
ганизме субстратом для клеток служит |
|
||||||||||
поверхность |
внеклеточного |
матрикса — |
|
||||||||
вещества, |
|
секретируемого |
самими |
|
|||||||
клетками |
и |
образующего |
упорядочен |
|
|||||||
ный пространственный каркас, на ко |
|
||||||||||
тором и внутри которого клетки могут |
|
||||||||||
перемещаться |
и |
|
взаимодействовать |
|
|||||||
друг с другом. Ввиду того что внекле |
|
||||||||||
точный матрикс является отнюдь не |
|
||||||||||
только инертной подложкой для кон |
|
||||||||||
тактирующих с ним клеток, но суще |
|
||||||||||
ственно влияет на их форму, локомо- |
|
||||||||||
цию |
и |
пролиферацию, |
необходимо |
|
|||||||
дать краткое его описание. |
|
|
|
||||||||
7.2.1. |
Внеклеточный |
|
|
|
|||
матрикс |
|
|
|
|
|
||
Внеклеточный матрикс |
состоит из |
Рис. 7.5. Фибробласты мыши, прикрепив |
|||||
секретируемых |
клетками |
макромоле |
шиеся к |
волокнистому |
внеклеточному |
||
кул |
белков |
и |
гликозаминогликанов |
матриксу. Сканирующая электронная мик |
|||
(мукополисахаридов). Последние, по |
роскопия |
(СЭМ). Ув. |
1700. (Препарат |
||||
Ю. А. Ровенского.) |
|
||||||
кидая клетку и ковалентно связываясь |
|
||||||
|
|
|
|||||
с белками, образуют комплексы — |
|
|
|
||||
протеогликаны. |
|
|
|
|
|
||
Среди белков матрикса важнейши |
новые (коллагены I—III типов), эла |
||||||
ми являются коллагены (их пять ос |
стические (способные к растяжению и |
||||||
новных типов), эластин, а также гли- |
сжатию, эластин) и фибронектиновые |
||||||
копротеины фибронектин и ламинин. |
волокна (рис. 7.4, 7.5), базальные |
||||||
Эти |
белки |
образуют специализиро |
мембраны (коллаген IV типа, лами |
||||
ванные структуры матрикса: коллаге- |
нин, фибронектин). |
|
|||||
382

В группу гликозаминогликанов матрикса входят гиалуронат, хондроитинсульфат, гепарансульфат и др. Пе реплетенные цепи гликозаминоглика нов образуют сильно гидратированный гель (основное вещество), в кото рый погружены коллагеновые, эласти ческие и фибронектиновые волокна. Этот гель создает тургор (упругость), противодействующий сжатию мат рикса.
Компоненты матрикса секретируются клетками не только в организме, но и в условиях культивирования. На пример, фибробласты, эндотелиоциты и многие типы эпителиальных клеток в культурах секретируют фибронектин (см. рис. 7.4), многие типы клеток — коллагены, а эпителиоциты — ламинин. Эти белки, а также секретируемые протеогликаны, сорбируясь на дне культурального флакона или иной искусственной подложки, образуют тонкий промежуточный слой, кото рый фактически выполняет роль твер дого субстрата для клеток. Таким об разом, и в условиях организма, и при культивировании клетки вступают в контактные взаимодействия с поверх ностью сформированного ими вне клеточного матрикса.
7.2.2. Морфология процесса распластывания клеток
Контактное взаимодействие кле ток с твердым субстратом начинается
смомента, когда клетка, взвешенная
вжидкой среде, оседает на адгезив ную (липкую) для нее поверхность субстрата. Во взвеси большинство клеток имеет почти сферическую форму, которую клетки сохраняют в течение нескольких минут после со прикосновения с субстратом, но за тем начинается процесс распластыва ния, в течение которого клетка по степенно приобретает все более уп лощенную форму. В процессе рас пластывания клетка прикрепляется к субстрату в множественных дискрет ных участках ее базальной поверхно сти, в которых формируются специа-
Рис. 7.6. Начальная стадия распластыва ния фибробласта мыши на твердом суб страте: сферическая клетка с филоподиями в основании. СЭМ. Ув. 5000. (Препарат Ю. А. Ровенского.)
лизированные адгезионные структу ры — фокальные контакты.
Распластывание клетки осуществ ляется посредством ее псевдоподиальной активности — формирования раз ной формы выростов (псевдоподий), способных прикрепляться к поверхно сти субстрата. Источником механиче ской силы, осуществляющей протрузию (выпячивание) псевдоподии, яв ляется скорее всего полимеризация актиновых микрофиламентов (из мо номерного актина) (см. раздел 7.2.5).
На I стадии распластывания в ос новании сферической клетки возни кают нитевидные псевдоподии — фи - лоподии различной длины (рис. 7.6). Своими концами они прикрепляются к поверхности субстрата, формируя дискретные участки прочной адгезии — фокальные контакты (см. раздел 7.2.3). Вскоре филоподии сменяются псевдоподиями в виде тонких пла стин — ламеллоподий, которые, сли ваясь, образуют сплошную циркуляр ную пластинку — ламеллярную цито-
383

Рис. 7.7. Стадия радиального распластыва ния фибробласта мыши на твердом суб страте: клетка с выпуклой центральной ча стью и широким кольцом ламеллярной цитоплазмы на периферии. СЭМ. Ув. 1700. (Препарат Ю. А. Ровенского.)
плазму. Последняя довольно быстро распространяется радиально от осно вания клетки — стадия радиального распластывания (рис. 7.7). Сразу по сле своего возникновения филопо - дии и ламеллоподии не содержат миозина, он диффундирует в них не много позже. Взаимодействие миози на II с актиновыми микрофиламен тами приводит к сокращению псев доподий. Если они своими концами не успели прикрепиться к субстрату, то ретрактируют (втягиваются); со кращение прикрепившихся псевдо подий генерирует их центростреми тельное натяжение. Это натяжение приводит к постепенному уплоще нию клетки, которая в конце этой стадии распластывания приобретает форму диска, по всему краю которо го непрерывно образуются псевдопо дии (такой клеточный край называют активным) (рис. 7.8).
У эпителиальных клеток стадия ра диального распластывания является
завершающей, и клетка в дальнейшем сохраняет характерную для эпителиоцитов дисковидную форму; фибробластоподобные клетки переходят в сле дующую, последнюю стадию распла стывания, называемую стадией поля ризации, по окончании которой они приобретают полигональную или вы тянутую форму, характерную для кле ток этого типа (рис. 7.9).
Дисковидная форма фибробласта на стадии поляризации изменяется в результате перераспределения псевдоподиальной активности: на некоторых участках клеточного края псевдопо дии перестают возникать. На других участках образование псевдоподий со храняется, в том же направлении про исходит растягивание тела клетки. Перераспределение псевдоподиальной активности контролируется не только актиновым цитоскелетом, участвую щим в формировании псевдоподий, их прикреплении и натяжении, но и системой микротрубочек. Нарушения в этой системе, вызванные действием колцемида или таксола, в уже поляри зовавшемся фибробласте приводят к утрате поляризации: псевдоподии
Рис. 7.8. Окончание стадии радиального распластывания фибробласта мыши: клет ка уплощенной дисковидной формы. СЭМ. Ув. 800. (Препарат Ю. А. Ровен ского.)
384

морфологической характеристикой. Она регулирует пролиферацию клетки и ее функции (см. раздел 7.2.6).
7.2.3. Фокальные контакты: структура, динамика и функции
Распластавшиеся клетки прикреп ляются к поверхности субстрата — внеклеточного матрикса — посредст вом формирования множественных фокальных контактов, располагаю
ты) контролируют псевдоподий на клеточном крае, "оп
ределяя" участки их формирования. Такой контроль может быть опосредо ван транспортными функциями мик ротрубочек и микрофиламентов — на правленным перемещением на пери ферию клетки каких-то органелл и (или) материалов, необходимых для полимеризации актина, инициирую щей образование псевдоподий в опре деленных участках клеточного края.
По завершении процесса распла стывания клетки достигают высокой
степени |
уплощения. |
Значительная |
|
|||
часть периферической зоны у фибро |
|
|||||
бласта и вся периферия у эпителиоци- |
|
|||||
та представляют собой тонкую ламел- |
|
|||||
лярную |
цитоплазму, по |
краю |
которой |
Рис. 7.10. Фокальные контакты фибробла |
||
продолжают образовываться |
ламелло- |
|||||
ста крысы с внеклеточным матриксом. |
||||||
подии. |
Степень |
уплощения, |
оцени |
|||
МНИФ с применением антител против |
||||||
ваемая по площади, занимаемой клет |
винкулина. Ув. 600. (Препарат А. Ю. Алек |
|||||
кой на |
субстрате, |
является не только |
сандровой.) |
|||
25-7908 Д. Г. Заридзе |
385 |

С х е м а 7.3. Фокальный контакт клетки с внеклеточным матриксом
ПМК — плазматическая мембрана клетки; И — интегриновый рецептор; Τ — талин; F — FAK (протеинкиназа фокального контакта); Ρ — паксиллин; В — винкулин; ТЗ — тензин; а — а- актинин; АФ — пучки актиновых микрофиламентов.
ся в различных сочетаниях, формируя |
стеры (скопления) в участках форми |
||||||||||||||||
более 20 типов интегринов. Разные |
рующихся фокальных контактов. Кла |
||||||||||||||||
сочетания а- и β-субъединиц опреде |
стеризация, а также конформацион - |
||||||||||||||||
ляют специфичность связывания |
вне |
ные |
изменения |
интегриновых рецеп |
|||||||||||||
клеточного |
домена рецептора |
с |
тем |
торов, влияющие на их аффинность |
|||||||||||||
или иным лигандом — белком внекле |
(способность |
связываться |
со |
своими |
|||||||||||||
точного матрикса. |
Большинство |
и н - |
лигандами), |
определяют |
стабильность |
||||||||||||
тегриновых |
рецепторов |
могут |
связы |
интегринопосредованных |
|
контактов |
|||||||||||
ваться с несколькими лигандами: на |
клетки с внеклеточным матриксом. |
||||||||||||||||
пример, интегрин α2β1 связывается с |
Внутриклеточный |
домен |
интегри- |
||||||||||||||
ламинином и коллагенами I и IV ти |
нового рецептора через цепь различ |
||||||||||||||||
па, интегрин α3β1 — с фибронекти- |
ных соединенных между собой цито- |
||||||||||||||||
ном, ламинином и коллагеном I типа |
плазматических |
белков |
|
(талин, |
пак |
||||||||||||
и т. д. Некоторые интегрины связыва |
силлин, винкулин, тензин и др.) свя |
||||||||||||||||
ются лишь с одним лигандом, напри |
зывается с актиновыми микрофила |
||||||||||||||||
мер интегрин α5β1 |
— только с фибро- |
ментами клетки (схема 7.3). Тем са |
|||||||||||||||
нектином, а α6β1 — с ламинином . С |
мым |
интегриновые |
рецепторы, |
свя |
|||||||||||||
другой стороны, с одним и тем же ли |
завшиеся |
с |
белками |
внеклеточного |
|||||||||||||
гандом (например, с ламинином) мо |
матрикса, |
оказываются |
заякоренными |
||||||||||||||
жет связываться несколько |
различных |
изнутри |
клетки |
микрофиламентами, |
|||||||||||||
интегриновых рецепторов. Один и тот |
что |
обеспечивает структурную |
связь |
||||||||||||||
же тип клеток может экспрессировать |
матрикса с цитоскелетом. Благодаря |
||||||||||||||||
сразу несколько |
разных |
интегринов |
этой связи прикрепившаяся к суб |
||||||||||||||
на своей поверхности. Перемещаясь в |
страту клетка |
испытывает |
действие |
||||||||||||||
плоскости клеточной мембраны, и н - |
центростремительных |
сил |
натяжения. |
||||||||||||||
тегриновые |
рецепторы |
образуют |
кла- |
Эти |
силы |
организуют |
|
|
заякоренные |
||||||||
386

Рис. 7.11. Пучки актиновых микрофила ментов, соединенные с фокальными кон тактами в фибробластах человека. Лазер ная конфокальная микроскопия. (Препа рат В. Б. Дугиной.)
бранной тирозиновой протеинкиназой Src, образуя с ней комплекс и кооперируясь в фосфорилировании по тирозину паксиллина и тензина, а также в передаче сигнала на белки се мейства Ras, относящегося к суперсе мейству так называемых малых ГТФаз (см. раздел 7.2.5). Активированные сигналом, полученным от FAK, белки Ras в свою очередь стимулируют ак тивность цитоплазматических протеинкиназ семейства Raf и других эф фекторов, которые активируют каска ды МАР-киназ (Mitogen Activated Pro tein kinases). Конечные продукты МАР-киназных каскадов переходят из цитоплазмы в ядро, где они фосфорилируют и активируют транскрипцион ные факторы — ядерные белки, кото рые могут связываться с определен ными генами и стимулировать их экс прессию. Результатом проведения сиг нала является экспрессия специфиче ских генов, включая гены, побуждаю щие клетку к делению (см. раздел 3.1).
микрофиламенты в пучки — стресс- |
|
Описанная цепь проведения сигна |
||||||||
фибриллы, что приводит к усилению |
лов |
от задействованных интегриновых |
||||||||
натяжения (рис. 7.11). |
|
|
рецепторов обеспечивает также |
прове |
||||||
Крайне важным является то, что |
дение сигналов от рецепторов росто |
|||||||||
связи между внеклеточным |
матриксом |
вых факторов, связанных со своими |
||||||||
и распластавшейся клеткой — не |
лигандами. Однако реализация мито- |
|||||||||
только структурные, но и функцио |
генных сигналов от ростовых факто |
|||||||||
нальные: адгезия клетки к матриксу |
ров осуществляется только при задей |
|||||||||
"включает" цепь передачи сигналов от |
ствовании |
интегриновых рецепторов: |
||||||||
фокальных контактов внутрь |
клетки. |
в случае открепления клетки проведе |
||||||||
У интегринового рецептора, |
связав |
ние сигнала от ростового фактора |
||||||||
шегося со своим лигандом, цитоплаз- |
прерывается на одной из промежуточ |
|||||||||
матический домен индуцирует фосфо- |
ных киназ МАР-киназного каскада, и |
|||||||||
рилирование по тирозину ряда бел |
клетка не может пролиферировать. |
|||||||||
ков, связанных с фокальным контак |
Более того, утратившие контакты с |
|||||||||
том: тирозиновой протеинкиназы фо |
субстратом клетки, в частности эпите- |
|||||||||
кальных контактов — FAK (прямо |
лиоциты, |
могут |
вскоре подвергнуться |
|||||||
связанной с |
цитоплазматическим до |
апоптозу (который в данном случае |
||||||||
меном β-субъединицы интегрина), |
имеет иное название — анойкис). |
|||||||||
паксиллина (связанного с FAK и с |
Причиной анойкиса может быть акти |
|||||||||
винкулином) и тензина (связанного с |
вация в открепившихся клетках белка |
|||||||||
винкулином и с концами актиновых |
р53 — продукта гена — опухолевого |
|||||||||
микрофиламентов) (см. схему 7.3). |
супрессора р53, одной из функций ко |
|||||||||
Главную роль в инициировании внут |
торого является |
индукция |
апоптоза |
|||||||
риклеточной |
сигнализации |
играет |
(см. раздел 3.2). Может быть и другая |
|||||||
FAK, |
активировавшаяся в |
результате |
причина анойкиса, связанная с тем, |
|||||||
автофосфорилирования. |
Активиро |
что |
интегриновые рецепторы |
служат |
||||||
ванная |
FAK |
связывается |
с |
подмем- |
трансдукторами |
сигналов, |
обеспечи- |
|||
2 5* |
|
|
|
|
|
|
|
|
|
387 |
|
|
|
|
|
|
|
|
|
|
|
вающих |
подавление анойкиса: |
акти |
своими концами в фокальных контак |
|||||||||||||||
вированная FAK не только иницииру |
тах (см. рис. 7.11), и аккумулировани |
|||||||||||||||||
ет митогенный сигнал, но и приводит |
ем в последних винкулина, талина, |
|||||||||||||||||
к активации фосфатидилинозитол-3- |
паксиллина и FAK. Необходимым ус |
|||||||||||||||||
киназы (ΡΙ3Κ), которая является эф |
ловием |
для "созревания" фокальных |
||||||||||||||||
фектором |
белков |
Ras |
и |
которая в |
контактов |
является |
центростреми |
|||||||||||
свою очередь активирует серин/трео- |
тельное |
натяжение, |
генерируемое в |
|||||||||||||||
ниновую |
|
протеинкиназу |
АКТ, |
обла |
актиновом |
кортексе |
клетки |
сокраще |
||||||||||
дающую |
антиапоптотическим |
дейст |
нием микрофиламентов, |
заякорен |
||||||||||||||
вием. |
|
|
|
|
|
|
|
|
|
ных в плазматической мембране. На |
||||||||
У одного и того же типа клеток |
тяжение |
|
инициирует |
параллельную |
||||||||||||||
разные |
интегрины |
различаются |
по |
укладку микрофиламентов в пучок. |
||||||||||||||
своей способности подавлять анои- |
|
|
|
|
|
|
|
|
|
|||||||||
кис, |
т. е. |
|
данный |
интегрин |
может |
|
7.2.4. Локомоция |
клеток |
|
|||||||||
обеспечить подавление аноикиса у од |
|
|
|
|
|
|
|
|
|
|||||||||
ного типа клеток и не выполнять эту |
Локомоция (перемещение) клеток |
|||||||||||||||||
функцию у другого типа. |
|
|
|
на поверхности твердого субстрата — |
||||||||||||||
Описанные выше механизмы лежат |
внеклеточного матрикса |
— |
представ |
|||||||||||||||
в основе феномена, называемого суб |
ляет собой координированный цикли |
|||||||||||||||||
стратной |
|
зависимостью |
размноже |
ческий |
процесс, |
который |
включает |
|||||||||||
ния, присущего нормальным клеткам: |
протрузию ламеллоподий на переднем |
|||||||||||||||||
последние могут жить и размножать |
(ведущем) крае клетки, их прикрепле |
|||||||||||||||||
ся, только |
будучи |
прикрепившимися |
ние к субстрату с формированием фо |
|||||||||||||||
и достаточно распластанными на по |
кальных |
|
контактов, |
центростреми |
||||||||||||||
верхности твердого субстрата; в полу |
тельное |
натяжение |
прикрепившихся |
|||||||||||||||
жидкой |
|
среде |
суспендированные |
ламеллоподий, освобождение от |
кон |
|||||||||||||
клетки не размножаются и могут под |
тактов с субстратом задней (хвосто |
|||||||||||||||||
вергнуться |
апоптозу (анойкису). |
|
|
вой) части клетки. |
|
|
|
|
|
|||||||||
Таким |
|
образом, |
фокальные |
|
кон |
|
Клетка, |
движущаяся |
по |
поверхно |
||||||||
такты являются не только адгезион |
сти |
матрикса, приобретает |
отчетливо |
|||||||||||||||
ными |
структурами, |
механически |
свя |
поляризованную форму: |
ее |
передняя |
||||||||||||
зывающими |
клетку |
с |
внеклеточным |
(по |
направлению |
движения) |
часть |
|||||||||||
матриксом, но и трансдукторами раз |
имеет вид широкой и тонкой пла |
|||||||||||||||||
нообразных |
внутриклеточных |
сигна |
стинки, по ее краю непрерывно обра |
|||||||||||||||
лов, |
обеспечивающих |
|
сохранение |
зуются ламеллоподий, которые то вы |
||||||||||||||
клеткой жизнеспособности и проли- |
пячиваются и прикрепляются к под |
|||||||||||||||||
феративной активности. |
|
|
|
|
лежащему |
матриксу, |
то |
втягиваются |
||||||||||
Процесс формирования фокально |
обратно; |
противоположная, |
хвостовая |
|||||||||||||||
го контакта включает две стадии. Вна |
часть клетки ретрактирована и часто |
|||||||||||||||||
чале происходит связывание интегри- |
имеет вид длинного отростка (рис. |
|||||||||||||||||
нового рецептора с белком внеклеточ |
7.12). |
|
|
|
|
|
|
|
||||||||||
ного |
матрикса, что индуцирует |
кон- |
|
Преимущественное |
образование |
|||||||||||||
формационные изменения в цитоламеллоподий на одном из краев
плазматическом |
домене |
рецептора. |
клетки (который |
|
становится |
ведущим |
||
Эти |
изменения |
активируют связыва |
и определяет выбор направления пе |
|||||
ние в данном участке структурных |
ремещения |
клетки) контролируется |
||||||
компонентов формирующегося фо |
цитоскелетом: при действии специфи |
|||||||
кального контакта. Затем следует ста |
ческих агентов, |
нарушающих |
целость |
|||||
дия "созревания" — увеличения разме |
актинового |
цитоскелета или |
микро |
|||||
ров |
фокального |
контакта, |
приобре |
трубочек, |
клетка |
утрачивает |
способ |
|
тающего форму штриха (см. рис. 7.10). |
ность к направленному перемещению. |
|||||||
Эта стадия сопровождается формиро |
Ламеллоподий, |
образующиеся на |
||||||
ванием стресс-фибрилл, заякоренных |
ведущем крае |
движущейся |
клетки, |
|||||
388

прикрепляясь к внеклеточному мат- |
фибриллами |
в фокальных |
контактах |
|
риксу, формируют фокальные контак |
на ведущем крае движущейся клетки, |
|||
ты. Последние эволюционируют, пре |
чем в "хвостовой" ее части. Такая |
|||
терпевая "созревание" |
и обеспечивая |
асимметрия в адгезии к субстрату в |
||
центростремительное |
натяжение ла |
переднем и заднем отделах клетки |
||
меллоподий. Это натяжение является |
приводит к асимметрии сил центрост |
|||
одной из движущих сил, перемещаю |
ремительного |
натяжения, |
генерируе |
|
щих клетку. Другой силой служит |
мого в этих отделах, в результате чего |
||||||||||
контракция (сокращение) сети актин- |
клетка |
смещается вперед. |
|
|
|
||||||
миозиновых |
микрофиламентов, |
рас |
Для |
перемещения клетки |
необхо |
||||||
положенной в зоне между ламеллопо- |
димо сочетание двух условий: воздей |
||||||||||
диями ведущего края и телом клетки. |
ствия |
специфических |
цитокинов — |
||||||||
Контракция |
способствует |
укладке |
ростовых факторов и связывания ин |
||||||||
микрофиламентов в пучки, |
ориенти |
тегриновых |
рецепторов |
с |
внеклеточ |
||||||
рованные параллельно ведущему краю, |
ным матриксом. Целый ряд ростовых |
||||||||||
и генерации механической силы, "под |
факторов является одновременно ми- |
||||||||||
тягивающей" вперед тело клетки. |
|
тогенами и мотогенами, т. е. способ |
|||||||||
Хотя скорость перемещения |
клет |
ны влиять как на пролиферацию, так |
|||||||||
ки прямо зависит от частоты протру- |
и на локомоцию клеток. К митоге- |
||||||||||
зии ламеллоподий и от их эффектив |
нам-мотогенам относятся тромбоци- |
||||||||||
ного прикрепления к субстрату, лими |
тарный |
или |
эпидермальный |
фактор |
|||||||
тирующим |
фактором в локомоции |
роста ( P D F G |
и EGF), |
фактор |
роста |
||||||
оказывается |
также способность |
клет |
фибробластов |
( F G F ) , "рассеивающий |
|||||||
ки при перемещении отрывать от суб |
фактор" (scatter factor, H G H / S F ) и др. |
||||||||||
страта свою "хвостовую" часть. Эта |
Связываясь со специфическими транс |
||||||||||
способность может быть основана, в |
мембранными |
рецепторами |
на |
по |
|||||||
частности, на более прочной связи |
верхности |
определенных |
типов |
кле |
|||||||
интегриновых рецепторов |
со стресс- |
ток, некоторые из этих факторов мо |
|||||||||
|
|
|
|
гут вызывать |
стимуляцию |
подвижно |
|||||
|
|
|
|
сти и пролиферации, другие — стиму |
|||||||
|
|
|
|
лировать только подвижность и тор |
|||||||
|
|
|
|
мозить рост. При этом реакция на |
|||||||
|
|
|
|
данный фактор может варьировать у |
|||||||
|
|
|
|
разных типов клеток. |
|
|
|
|
|||
Рис. 7.12. Поляризованные фибробласты мыши. СЭМ. Ув. 400. (Препарат Ю. А. Ровенского.)
Митогены-мотогены, |
связываясь |
со своими рецепторами, |
инициируют |
внутриклеточные сигналы. Одна из сигнальных цепей является митогенной: связывание рецептора ростового фактора со своим лигандом вызывает автофосфорилирование и активацию рецепторных тирозиновых протеинкиназ, которые осуществляют дальней шую передачу сигнала по Ras-Raf- МАР-киназному пути (см. раздел 7.2.3), приводя к экспрессии генов, побуждающих клетку к переходу из G1 в S-фазу (фазу синтеза Д Н К ) .
Другая сигнальная цепь, "включае мая" рядом ростовых факторов, при водит к изменениям в сборке-разбор ке актинового цитоскелета, формиро вании фокальных контактов и псевдо-
подий. Такие изменения существенно влияют на форму клетки и ее локомоцию. В этой сигнальной цепи ключе вую роль играют белки семейства Rho/Rac: RhoA, Rac1 и Cdc42 (см. раздел 7.2.5).
Среди митогенов-мотогенов осо бый интерес представляет "рассеиваю щий фактор" (SF). Это гликопротеин, являющийся сильным митогеном для гепатоцитов и участвующий в регене рации печени (поэтому его называют
также |
фактором роста гепатоцитов- |
H G F ) , |
стимулирует пролиферацию и |
некоторых других типов эпителиоцитов, а также клеток сосудистого эндо телия. Вместе с тем H G F / S F является сильным мотогеном для различных эпителиальных клеток (например, эпителия молочных желез) и эндотелиоцитов. Этот фактор обладает, кро ме того, морфогенным действием: в его присутствии культивируемые эпи телиальные или эндотелиальные клет ки формируют внутри объемного вне
клеточного матрикса тубулоподобные |
|
структуры. Реакция клеток на |
H G F / |
SF инициируется связыванием |
с его |
специфическим рецептором — транс мембранной тирозиновой протеинкиназой — продуктом протоонкогена С- met. Связывание вызывает в клетке сложный каскад сигналов, ведущих в конечном счете к ее пролиферации или к приобретению поляризованной фибробластоподобной формы и локо-
моции. |
Мотогенное |
|
воздействие |
|
H G F / S F на эпителий |
вызывает нару |
|||
шение |
межклеточных |
контактов в |
||
эпителиальном |
пласте, |
изменение |
||
дисковидной |
формы |
эпителиоцитов |
||
на фибробластоподобную |
и активную |
|||
миграцию клеток из пласта.
7.2.5. Роль малых ГТФаз
врегуляции актинового цитоскелета,
формировании |
псевдоподий |
и локомоции |
клеток |
Rho-ГТФазы (их еще называют ма лыми ГТФазами) действуют как моле кулярные "двусторонние переключа
тели", попеременно переходя то в ак тивное состояние при связывании с ГТФ, то теряя активность в результате гидролиза ГТФ до ГДФ. В регуляции перехода между активной и неактив ной формами малых ГТФаз участвуют три группы факторов: факторы обме на нуклеотидов (guanine nucleotide ex change factors — G E F ) , катализирую щие замену ГДФ на ГТФ, т. е. "вклю чающие" активность; белки, активи рующие ГТФазу (GTPasa activating proteins — GAP), т. е. стимулирующие гидролиз ГТФ и этим "выключающие"
активность; |
ингибиторы |
диссоциации |
|
ГДФ |
( G D P |
dissociation |
inhibitors — |
G D I ) , |
предотвращающие замену ГДФ |
||
на ГТФ, т. е. поддерживающие неак тивное состояние.
Вактивном состоянии малые ГТФазы взаимодействуют с различны ми эффекторными молекулами или молекулами-мишенями, участвуя в "нисходящей" передаче специфиче ских внеклеточных сигналов от "за действованных" рецепторов клеточной поверхности: рецепторов ростовых факторов, гормонов, хемоаттрактантов, а также рецепторных молекул ад гезии клеток с внеклеточным матрик сом. Внутриклеточная передача сигна лов, опосредуемых малыми ГТФаза ми, осуществляет регуляцию широко го спектра процессов, прежде всего сборки и организации актинового ци тоскелета и таких зависимых от него важнейших клеточных функций, как формирование псевдоподий, локомо ция, цитокинез, фагоцитоз и пиноцитоз, а также контактные взаимодейст вия клеток с внеклеточным матрик сом и друг с другом. Помимо этого, малые ГТФазы участвуют в контроле клеточного цикла.
Всемействе малых ГТФаз наибо лее изучены белки Rho (изоформы А,
Ви С), Cdc 42, Rac (изоформы 1, 2, 3). Рассмотрим в общих чертах сиг нальные пути и механизмы, посредст вом которых эти белки контролируют
организацию актинового цитоскелета и формирование псевдоподий (схемы 7.4-7.6).
390

С х е м а 7.4. Регулирующее действие Rho на сборку, организацию
иконтрактильность актиновых микрофиламентов (объяснение в разделе 7.2.5)
С х е м а 7.5. Регулирующее действие Cdc42 на сборку актиновых
микрофиламентов и образование филоподий (объяснение в разделе 7.2.5)
1. Rho активируется при воздейст вии на клетку различных специфиче ских лигандов: митогенов, лизофосфатидиловой кислоты, бомбезина или фетальной сыворотки, а также при интегринопосредованном контактном взаимодействии клетки с внеклеточ ным матриксом. Активация Rho ока зывает в свою очередь активирующее действие на Rho-киназы (их два вида) и белок Dia. Rho-киназы фосфорилируют три субстрата, играющих ключе вую роль в сборке актинмиозиновых
микрофиламентов: легкую цепь мио зина (MLC), фосфатазу легкой цепи миозина (MLC-фосфатазу) и Ы М - к и - назу. Результатом фосфорилирования первых двух субстратов является воз растание АТФазной активности мио зина II, что стимулирует сборку предсуществующих микрофиламентов в пучки, их контрактильность и форми рование фокальных контактов. Фос - форилированная LIM-киназа в свою очередь фосфорилирует и этим ингибирует активность кофилина (препят-
391

С х е м а 7.6. Регулирующее действие Rac на сборку, ветвление актиновых
микрофиламентов и образование ламеллоподий (объяснение в разделе 7.2.5)
ствуюшего полимеризации мономеров |
ние к активации. WASp/Scar активи |
|||||||||
актина; см. раздел 7.1.1), тем самым |
руют белковый комплекс Агр 2/3, ко |
|||||||||
стабилизируя |
актиновые |
микрофила |
торый |
инициирует |
полимеризацию |
|||||
менты. Белок Dia связывается с про- |
актина и рост ответвлений новых |
|||||||||
филином (см. раздел 7.1.1) и совмест |
микрофиламентов (см. раздел 7.1.1). |
|||||||||
но с Rho-киназами участвует в поли |
Cdc 42 также взаимодействует с двумя |
|||||||||
меризации |
актина, |
формировании |
серинтреониновыми |
киназами, |
кото |
|||||
стресс-фибрилл и связанных с ними |
рые содержат Rho-киназоподобный |
|||||||||
фокальных контактов. В контроли |
домен и поэтому способны фосфори - |
|||||||||
рующем |
воздействии |
на |
актиновый |
лировать легкую цепь миозина II, сти |
||||||
цитоскелет участвуют также фосфори - |
мулируя |
сборку |
и |
контрактильность |
||||||
лированные |
фосфолипиды, в частно |
актиновых |
микрофиламентов. Другой |
|||||||
сти РІР2. Последний, |
взаимодействуя |
мишенью для Cdc 42 являются серин- |
||||||||
с кэпирующими белками (в частно |
треониновые киназы РАК 1, 3, 4, уча |
|||||||||
сти, с гельзолином), способствует ос |
ствующие в реорганизации актиново |
|||||||||
вобождению |
оперенных концов мик |
го цитоскелета, в частности путем |
||||||||
рофиламентов и тем самым — поли |
фосфорилирования LIM - киназы, ко |
|||||||||
меризации актина на этих концах. |
торая ингибирует активность кофили - |
|||||||||
Таким |
образом, Rho |
осуществляет |
на и этим способствует полимериза |
|||||||
контроль за сборкой и стабилизацией |
ции микрофиламентов на их оперен |
|||||||||
актиновых микрофиламентов, форми |
ных концах (см. схему 7.5). |
|
||||||||
рованием стресс-фибрилл и связан |
3. Rac активируется при воздейст |
|||||||||
ных с ними фокальных контактов (см. |
вии на клетку ростовых факторов (на |
|||||||||
схему 7.4). |
|
|
|
пример, |
P D G F , |
E G F или инсулина). |
||||
2. Cdc 42 активируется при воздей |
Мишенью |
для |
активированного |
Rac |
||||||
ствии на клетки различных лигандов |
является фосфатидилинозитол-4-фос- |
|||||||||
(брадикинина и др.) и связывается на |
фат-5-киназа (Ρi-4-Ρ5Κ), которая, бу |
|||||||||
внутренней |
стороне |
плазматической |
дучи активированной, вызывает |
обра |
||||||
мембраны |
с |
переместившимися сюда |
зование PiP2. Последний, освобождая |
|||||||
белками WASp/Scar, приводя послед- |
оперенные |
концы |
микрофиламентов |
|||||||
392 |
|
|
|
|
|
|
|
|
|
|
от кэпирующего их гельзолина, спо собствует полимеризации актина на этих концах. Другой мишенью Rac яв ляются киназы РАК 1, 2, 3, активация которых способствует полимеризации микрофиламентов. Наконец, Rac мо жет также прямо взаимодействовать с белком Scar, который, как и WASp, активирует комплекс Аrр 2/3, ини циирующий рост ответвлений новых микрофиламентов (см. схему 7.6).
Результатом активации Cdc 42 или Rac и вызванных ею перестроек акти нового цитоскелета является форми рование клеткой псевдоподий соот ветственно нитевидной формы (фило подий) или ламеллярной формы (ла меллоподий). Механизм их образова ния различен. В основе формирова ния филоподий лежит полимеризация нескольких актиновых микрофила ментов (собранных в пучок) на их оперенных концах: растущие концы филаментов генерируют толкающую силу, которая "выпячивает" плазмати ческую мембрану в виде очень узкого псевдоподиального выроста — фило подий. Ламеллоподия образуется в ре зультате ветвления микрофиламен тов: полимеризация актина на опе ренных концах разветвляющихся мик рофиламентов (их противоположные концы фиксированы в участках от ветвления комплексами Аrр 2/3) соз дает толкающую силу, которая "выпя чивает" относительно широкий уча сток плазматической мембраны, фор мируя ламеллоподию.
Поскольку рост оперенных концов микрофиламентов происходит не по всему краю клетки, а локально, то псевдоподии возникают в дискретных участках клеточного края. Эта дис кретность является необходимой предпосылкой для перемещения клетки.
Таким образом, сигналы, посту пающие от задействованных рецепто ров клеточной поверхности, активи руют малые ГТФазы, инициирующие внутриклеточную передачу сигналов, которые контролируют сборку контрактильных актиновых микрофила
ментов и ассоциированных с ними контактов клетки с внеклеточным матриксом, а также формирование псевдоподий. Сочетания и смена раз личных форм псевдоподий при рас пластывании и перемещении клетки обусловлены "каскадной" активацией малых ГТФаз: Cdc 42 активирует Rac, последний может в некоторых случаях активировать Rho.
Актиновые структуры, индуцируе мые малыми ГТФазами, ассоциирова ны с адгезионными комплексами, связывающими клетку с внеклеточ ным матриксом, однако лишь Rho ин дуцирует сборку классических фо кальных контактов. Rac и Cdc 42 уча ствуют в формировании адгезионных комплексов, которые хотя и интегринзависимы и содержат многие из тех же компонентов, что и классиче ские фокальные контакты, но морфо логически отличаются от них. Роль таких контактов пока не совсем ясна. Они могут служить предшественника ми зрелых фокальных контактов. Воз можно, адгезионные комплексы могут инициировать внутриклеточные сиг налы, подобно тому, как это делают фокальные контакты, осуществляя контроль не только за организацией актинового цитоскелета, но и за про лиферацией клеток (см. раздел 7.2.3).
В образовании псевдоподий и дви жении клетки важную роль играют как актин-миозиновые структуры, так и микротрубочки. Перемещение клет ки сопровождается ориентацией мик ротрубочек таким образом, что их растущие плюс-концы располагаются в основании ведущей ламеллы (на пе реднем крае движущейся клетки), а укорачивающиеся минус-концы — в теле клетки. Есть данные о прямой связи активной формы Rac с тубулином и о возможном освобождении ак тивного Rac в цитоплазму во время роста микротрубочек. Рост микротру бочек на ведущем крае движущейся клетки, возможно, локально освобож дает активный Rac, который вызывает полимеризацию актина и как следст вие протрузию псевдоподий (см. вы-
393
ше), обеспечивающих перемещение клетки. Предполагается, что другой член семейства малых ГТФаз — Rho — тоже связывается с микротрубочками, освобождаясь при их разборке на ми нус-концах в теле клетки, что способ ствует формированию стресс-фибрилл и возрастанию контрактильности (см. выше), обеспечивающей подтягивание "хвоста" движущейся клетки. Возмож но, что с микротрубочками связаны не сами Rac или Rho, а факторы, ре гулирующие переходы между актив ными и неактивными формами этих ГТФаз (например, G E F ) . Возможно также, что микротрубочки доставляют к фокальным контактам какие-то регуляторные молекулы, которые ослаб ляют эти контакты, что вызывает ло кальную ретракцию клеточного края и возрастание поляризации клетки, не обходимой для ее перемещения.
7.2.6.Биомеханический
контроль |
морфогенеза |
и функций |
клеток |
Изометрическое напряжение, по стоянно испытываемое клеткой, рас пластавшейся на поверхности внекле точного матрикса, является важным фактором, контролирующим форму клетки (степень ее распластывания), ее функциональную активность, про лиферацию и локомоцию. Силы на пряжения оказывают модифицирую щее воздействие на внутриклеточную сигнализацию и экспрессию генов, инициируют реконструирование вне клеточного матрикса. В условиях ор ганизма эти механические силы влия ют на развитие тканей и органов, вы полняя формообразовательные функ ции в эмбриогенезе.
Изометрическое напряжение клет ки является результатом взаимодейст вия двух сил: центростремительного натяжения и адгезии клетки к внекле точному матриксу. Центростремитель ное натяжение, генерируемое стрессфибриллами, заякоренными в фокаль ных контактах, контролирует целость последних: ослабление натяжения
(вызванное, например, ингибированием протеинкиназы легкой цепи мио зина II) вызывает дезинтеграцию фо кальных контактов. Натяжению про тивостоят адгезия клетки к матриксу в фокальных контактах, а также внутри клеточные "амортизаторы" в виде микротрубочек: разрушение послед них сдвигает динамическое равнове сие, приводя к преобладанию силы натяжения и тем способствуя "созре ванию" фокальных контактов (воз можно, впрочем, что истинной при чиной "созревания" контактов являет ся нарушение внутриклеточного транспорта, зависимого от микротру бочек). Баланс контрактильных сил, действующих через трансмембранные интегриновые рецепторы, и противо действующих сил со стороны иммоби лизованных фокальных контактов и микротрубочек (а также, возможно, промежуточных филаментов) опреде ляет форму клетки — степень ее рас пластывания на поверхности внекле точного матрикса.
Нарушение баланса механических сил, поддерживающих состояние изо метрического напряжения клетки, приводит не только к изменениям ее формы, но и к функциональной ак тивности. Преобладание в клетке си лы центростремительного натяжения, вызванного разрушением микротрубо чек, стимулирует сборку фокальных контактов и вызывает фосфорилирование FAK и паксиллина, генерируя интегринзависимый митогенный сиг нал. Результатом является переход клеток в S-фазу. Искусственного ос лабления центростремительного натя жения в клетках достигают использо ванием культуральных субстратов с равномерно пониженной адгезивностью или с адгезивными "островками". Такие субстраты затрудняют форми рование фокальных контактов, поэто му степень распластывания клеток значительно снижается, что приводит к торможению пролиферации, а в не которых случаях даже к анойкису кле ток. Нарушаются также синтетические процессы: например, у фибробластов
394
снижается синтез виментина, у эпителиоцитов возрастает синтез некоторых протеаз и т. д.
Состояние изометрического напря жения клеток можно нарушить, под вергая их дополнительным механиче ским воздействиям извне: периодиче скими сгибаниями культурального субстрата или растягиваниями суб стратов, обладающих эластичностью (коллагеновые гели, пленки из латек са и т. п.). На такие воздействия раз ные типы клеток отвечают различны ми реакциями: возрастанием числа и "созреванием" фокальных контактов, стимуляцией пролиферации и синтеза ряда белков, активацией ферментных систем и трансмембранных ионных каналов. Некоторые типы клеток при механических воздействиях усиливают синтез белков внеклеточного матрик са. Так, например, у фибробластов усиливается синтез тенасцина С и коллагена XII типа. Синтезы этих бел ков рассматриваются в качестве инду цируемых механическим стрессом.
Предполагается, что функциональ ные изменения в клетках, индуцируе мые механическими воздействиями на внеклеточный матрикс, опосредуются задействованными интегриновыми рецепторами. Последние рассматрива ются поэтому как трансдукторы не только биохимических, но и механи ческих сигналов от внеклеточного матрикса. Возможно, что деформации в матриксе, вызванные механически ми воздействиями, изменяют конформацию внеклеточных доменов интег ринов, инициируя этим внутрикле точную передачу сигналов. Сигналь ные цепи, индуцируемые механиче скими воздействиями на интегриновые рецепторы клеток, изучены не достаточно. У остеобластов механиче ский стресс вызывает немедленную активацию фосфолипазы С, расщеп ляющей РIР2, что приводит в дальней шем к активации протеинкиназы С и освобождению Са2+ из внутриклеточ ных везикул. Протеинкиназа С фосфорилирует актинсвязывающие бел ки — профилин и филамин, белки
фокальных контактов — винкулин и талин, а также киназу легкой цепи миозина, стимулирует формирование фокальных контактов и стресс-фиб рилл. Са2+ также оказывают регули рующее воздействие на перестройки актинового цитоскелета. И протеин киназа С и Са2+, по-видимому, участ вуют в регуляции пролиферации клеток.
Клетки в свою очередь оказывают механическое воздействие на внекле точный матрикс. Центростремитель ное натяжение клетки через фокаль ные контакты передается на матрикс. Проявление этой силы можно визуа лизировать, используя эластичные культуральные субстраты, коллагено вые гели, пленки из силиконовой ре зины и т. п.: фибробласты и некото рые другие типы клеток, генерируя центростремительное натяжение, вы зывают образование тонких складок на поверхности деформируемого суб страта. Сила сжатия клетками суб страта может быть измерена как опо средованно, так и с помощью специ альных механических датчиков (на пример, куриные фибробласты разви вают напряжение, равное 4,5 · 10-2 дин/см2). Естественно, что нарушение актинового цитоскелета (инициирую щего натяжение) цитохалазином резко ослабляет деформирование клетками субстрата, а нарушение системы мик ротрубочек (противодействующих си лам натяжения) усиливает механиче ское воздействие клеток на субстрат.
Под действием клеток внеклеточ ный матрикс претерпевает реоргани зацию. Натяжение со стороны фиб робластов способствует ориентации волокон в коллагеновом геле. Моле кулы внеклеточного матрикса, кото рые связаны с клеточной поверхно стью (например, фибронектин или ламинин), формируют фибриллы, ори ентированные в направлении сил на тяжения, генерируемых в фибробластах или эпителиоцитах. Ослабление натяжения нарушает ориентацию фибрилл внеклеточного матрикса на поверхности клеток.
395
Реорганизация внеклеточного мат рикса под влиянием натяжения, гене рируемого клетками, происходит при регенеративных процессах (например, при заживлении ран), при формиро вании костной ткани и др.
7.2.7. Реакции клеток на химическую анизотропию и топографию
внеклеточного матрикса
Вышеизложенное (см. разделы 7.2.1—7.2.4) указывает на роль хими ческого состава внеклеточного мат рикса в адгезии клеток: наличие в матриксе специальных белковых мо лекул, с которыми специфически свя зываются интегриновые рецепторы различных клеток, определяет способ ность этих клеток к прикреплению, перемещению и размножению. Оче видно, что если необходимые компо ненты матрикса будут распределены неравномерно — в виде "островков" или узких "дорожек", то клетки смогут прикрепляться и перемещаться лишь в границах таких адгезивных участков. Подобная картина реально наблюда ется в организме в условиях эмбрио генеза или при заживлении ран, когда клетки направленно мигрируют вдоль линейных участков на поверхности внеклеточного матрикса в соответст вии с наличием в этих участках белко вых компонентов, необходимых для адгезии клеток данного типа.
Влияние неоднородности в адге зивных свойствах внеклеточного мат рикса на прикрепление и поведение клеток можно моделировать in vitro в условиях культивирования клеток. Для этого поверхности культуральных субстратов химическим способом придают свойства, исключающие воз можность прикрепления клеток. На такой неадгезивной поверхности раз личными методами (например, по крытием каким-либо белком матрик са) наносят изолированные адгезив ные участки в виде узких полос или различной формы "островков". На рис. 7.13 можно видеть, как вытягива
ются и ориентируются вдоль узких ад гезивных полос фибробласты. Если адгезивные участки имеют вид круг лых или треугольных "островков" дос таточно малых размеров, то прикре пившийся фибробласт принимает форму "островка". Размножение кле ток в таких "островках" резко снижа ется, нередко клетки даже подверга ются апоптозу. Происходит это пото му, что из-за ограниченной площади адгезивного участка клетка не может достаточно широко распластаться, по этому число образуемых ею фокаль ных контактов оказывается снижен ным. В результате ослабляется трансдукция внутриклеточных сигналов, регулирующих функциональную ак тивность клетки, включая ее способ ность к размножению. Возможен и другой механизм, связанный не с де фицитом фокальных контактов, а с ослаблением натяжения у клетки, не достаточно распластанной на адгезив ном "островке". Изометрическое натя жение, испытываемое клетками, пол ностью распластавшимися на поверх ности внеклеточного матрикса, слу жит мощным регулятором формы и функциональной активности клеток, а также оказывает влияние на организа-
Рис. 7.13. Фибробласт мыши на адгезив ном субстрате в виде узкой полосы. Диф ференциальная интерференционно-кон трастная микроскопия. Ув. 400. (Препарат М. А. Харитоновой.)
396

цию самого внеклеточного матрикса (см. раздел 7.2.6).
Помимо химических свойств вне клеточного матрикса, на адгезию кле ток, их распластывание и локомоцию значительное влияние оказывает гео метрическая конфигурация, или топо графия матрикса. Это могут быть раз ного рода волокна, обладающие ци линдрической поверхностью, базальные мембраны со сложным микро рельефом в виде складок или канавок, наличие в матриксе прерывистостей в
виде различных отверстий, |
щелей и |
|
т. п. |
|
|
Как оказалось, клетки |
способны |
|
"чувствовать" |
геометрию |
(топогра |
фию) субстрата и реагировать на нее. Эта способность вначале была выяв лена в опытах с культивированием клеток на таких природных субстра тах, как тонкие нити фибрина или рыбья чешуя (обладающая микро складчатой поверхностью): фибробла сты на таких субстратах вытягивались и ориентировались вдоль нитей или складок, поэтому феномен был назван
"контактной ориентировкой" |
клеток. |
|||||
Позднее начали |
использовать |
специ |
||||
ально |
разработанные |
искусственные |
||||
культуральные |
субстраты, |
обладаю |
||||
щие |
разнообразной |
топографией: |
||||
микрорельефами |
в |
виде |
одиночных |
|||
или множественных |
линейных |
кана |
||||
вок различной глубины и периодич ности, цилиндрическими поверхно стями разной кривизны, прерывистым характером (адгезивные участки пере межаются с отверстиями разной фор мы и размеров).
Такие специальные субстраты мо делируют разнообразную топографию структур внеклеточного матрикса, встречающихся на путях миграции клеток в эмбриогенезе, при регенера ции, а также при опухолевой инвазии.
Различные морфогенетические ре акции клеток — изменения их формы, ориентации и направления движения, перестройки цитоскелета, а также из менения функциональной активно сти, индуцируемые геометрической конфигурацией субстрата (внеклеточ-
Рис. 7.14. Фибробласты мыши на субстра те с глубокими канавками треугольного профиля: клетки не распластываются в глубине канавок и сосредоточиваются на промежутках между ними. Световая мик роскопия. Ув. 120. (Препарат Ю. А. Ровенского.)
ного матрикса), — называются топо графическими реакциями. Рассмот рим наиболее типичные из таких ре акций.
При культивировании фибробластов на субстратах с глубокими (не сколько десятков микрон) линейными канавками треугольного профиля клетки не распластываются в глубине канавок и сосредоточиваются между ними (рис. 7.14). На значительно бо лее мелких канавках (глубиной от де сятых долей до нескольких микрон) фибробласты, эпителиоциты или нервные клетки вытягиваются и ори ентируются вдоль канавок. Эта реак ция усиливается с возрастанием глу бины канавок и уменьшением проме жутков между ними. У фибробластов, кроме того, происходят реорганизация цитоскелета, активация тирозинфосфорилирования ряда белков, а также изменения генной экспрессии, напри-
397

Рис. 7.15. Фибробласты мыши на субстра те с цилиндрической поверхностью: клет ки вытягиваются и ориентируются вдоль цилиндра. СЭМ. Ув. 1300. (Препарат Ю. А. Ровенского.)
мер усиление экспрессии (и секре ции) фибронектина. Другими слова ми, клетки реагируют на геометрию поверхности субстрата не только мор фологическими изменениями, но и серьезными сдвигами во внутрикле точных сигнальных путях, приводя щими к изменениям синтетической и функциональной активности.
На субстратах с цилиндрической поверхностью высокой степени кри визны (радиусом в несколько десят ков микрон) реакция у фибробластов
иэпителиоцитов различна. Первые
Рис. 7.16. Эпителиоцит мыши на субстра те с цилиндрической поверхностью: клетка сохраняет дисковидную форму и перегиба ется поперек цилиндра. СЭМ. Ув. 1300. (Препарат Ю. А. Ровенского.)
Рис. 7.17. Фибробласт мыши на прерыви стом (в виде решетки) субстрате: клетка пересекает отверстие решетки. СЭМ. Ув. 1200. (Препарат Ю. А. Ровенского.)
вытягиваются и ориентируются вдоль цилиндра, в том же направлении ори ентируется большинство пучков акти новых микрофиламентов (рис. 7.15). Эпителиоциты сохраняют дисковид ную форму и перегибаются поперек цилиндра, такую же поперечную ори ентацию приобретают пучки микро филаментов (рис. 7.16).
На прерывистых субстратах (в виде решеток с крупными квадратными от верстиями) клетки, прикрепившиеся к прутьям решетки, вскоре смещаются в ее отверстия: тело клетки почти цели ком оказывается "провисшим" в сво бодном пространстве отверстия, и лишь своими краями или концами от ростков клетка остается прикреплен ной к прутьям решетки. При этом по ведение фибробластов и эпителиаль ных клеток сильно различается: фиб робласт вытягивается и своим веретеновидным телом "пересекает" отвер стие решетки (рис. 7.17), тогда как эпителиоцит, сохраняя дисковидную форму, постепенно полностью "затя гивает" отверстие (рис. 7.18).
Механизмы топографических реак ций клеток изучены недостаточно. В основе многих из них, по-видимому, лежит изометрическое натяжение кле ток, создаваемое актиновым цитоске-
398

Рис. 7.18. Эпителиоциты мыши на прерывистом (в виде решетки) субстрате: клетки "за тягивают" отверстия решетки. СЭМ. Ув. 700. (Препарат Ю. А. Ровенского.)
летом (см. раздел 7.2.6). Сила натяже ния пучков микрофиламентов может зависеть от их формы: прямые пучки развивают более сильное натяжение по сравнению с пучками, находящимися в условиях сгибания. Сгибанию пучков микрофиламентов препятствует также их механическая ригидность. В резуль тате фибробласты проявляют устойчи вость к сгибанию под углом выше "критического" и стремятся занять по ложение, исключающее такое сгибание тела клетки. По-видимому, этим мож но объяснить такие топографические реакции фибробластов, как их вытяги вание вдоль цилиндрических субстра тов, неспособность к распластыванию на дне канавок треугольного профиля или на двух взаимно перпендикуляр ных прутьях решетки. Что же касается эпителиальных клеток, для которых более характерны не линейные, а коль цевидные пучки микрофиламентов, то в таких клетках силы натяжения зна чительно слабее, чем в фибробластах, и соответственно эпителиоциты, по-ви димому, менее устойчивы к сгибанию и поэтому реагируют на топографию субстрата по-иному, чем фибробласты.
В последнее время выдвинуто предположение о наличии у клеток особых "рецепторов растяжения", иг
рающих ключевую роль в топографи ческих реакциях. Эти рецепторы реа гируют на кривизну или микронеров ности поверхности субстрата, "вклю чая" цепь внутриклеточных сигналов, которые приводят к реорганизации актинового цитоскелета, изменениям формы и ориентации клеток, а также изменениям генной экспрессии. Од ним из вероятных кандидатов на роль рецепторов растяжения являются ион ные хлоридные каналы в плазматиче ской мембране клеток: в среде с дефи цитом хлоридов вытягивание фиброб ластов вдоль микроканавок резко ос лабевает. Вопрос о механизме топо графических реакций клеток требует дальнейших исследований.
7.3. Нарушения распластывания и локомоции клеток в результате неопластической трансформации
7.3.1. Морфологические изменения
Подвергшиеся неопластической трансформации клетки, подобно нор мальным, во взвешенном состоянии
399
Рис. 7.19. Стадия радиального распласты вания трансформированного фибробласта мыши: ламеллярная цитоплазма редуциро вана и фрагментирована. СЭМ. Ув. 2100. (Препарат Ю. А. Ровенского.)
имеют сферическую форму и после контакта с поверхностью твердого субстрата (внеклеточного матрикса) проходят процесс распластывания, однако морфология этого процесса существенно отличается от наблюдае мого в норме:
бластоподобную форму, однако никогда не достигают значитель ной степени распластывания, сравнимой с наблюдаемой у нормальных клеток. Трансфор мированные клетки остаются слабоуплощенными, как бы "поджатыми", ламеллярная ци топлазма сильно редуцирована и фрагментарна (в виде отдельных "языков"), ее общая площадь го раздо меньше, а толщина — зна чительно больше, чем у нор мальных фибробластов или эпи телиоцитов. Если у последних дорсальная клеточная поверх ность сглажена, то у "поджатых" трансформированных клеток она имеет сложный микрорель еф, состоящий из множествен ных микроворсинок и складок (рис. 7.20).
В связи с редуцированием и фраг ментацией ламеллярной цитоплазмы у трансформированных клеток, как правило, не формируется широкий ведущий край. Поэтому их перемеще ние в значительной мере утрачивает
•на стадии радиального распла стывания нарушены образова ние и слияние ламеллоподий, в результате чего ламеллярная ци топлазма формируется в виде от дельных "языков", а не цирку лярной пластинки (рис. 7.19). Уплощение клетки идет нерав номерно в разных ее участках, но дисковидная форма не на блюдается;
•на стадии поляризации у транс формированных фибробластов и у эпителиоцитов клеточный край разделяется на активные и стабильные участки, подобно тому, как это происходит у нор мальных фибробластов;
Рис. 7.20. Трансформированный фибро бласт мыши: слабо уплощенная клетка с
•по завершении распластывания резко редуцированной ламеллярной цито
трансформированные клетки (как фибробласты, так и эпите лиоциты) приобретают фибро-
плазмой и сложным рельефом дорсальной поверхности. СЭМ. Ув. 1800. (Препарат Ю. А. Ровенского.)
400

направленный характер, подобно на блюдаемому у нормальных фибробла стов: трансформированные клетки пе ремещаются, часто меняя направле ние движения.
Описанные морфологические осо бенности распластывания и локомо торного поведения трансформирован ных клеток связаны с нарушениями в формировании и функционировании псевдоподий: в их протрузии, прикре плении к субстрату и последующем центростремительном натяжении. Эти процессы контролируются актиновым цитоскелетом и системой микротрубо чек (см. разделы 7.2.2; 7.2.4), а также фокальными контактами (см. раздел 7.2.3). Неопластическая трансформа ция клеток вызывает серьезные нару шения в актиновом цитоскелете, а так же в формировании и функционирова нии фокальных контактов как адгези онных структур и трансдукторов внут риклеточных сигналов. Эти изменения играют важную роль в прогрессии опу холей, в частности в приобретении клетками способности к инвазии.
7.3.2. Нарушения структуры
ифункций фокальных контактов
Нарушения фокальных контактов охватывают все их компоненты: интегриновые рецепторы, цитоплазматические белки и цитоскелетные эле менты, связанные с фокальными кон тактами.
Трансформация клеток чаще всего сопровождается ослаблением экспрес сии и (или) снижением аффинности определенных интегриновых рецепто ров, а также утратой их способности к кластеробразованию. Это касается, например, рецептора α5β1 к фибронектину.
Молекулы, участвующие в форми ровании фокальных контактов (интегрины, FAK, винкулин, паксиллин), являются мишенями для фосфорилирования онкобелками (продуктами онкогенов), обладающими тирозино вой протеинкиназной активностью, в
Рис. 7.21. Редукция пучков актиновых микрофиламентов в цитоплазме трансфор мированного фибробласта крысы. Метод прямой иммунофлюоресценции. Ув. 500. (Препарат Л. В. Домниной.)
частности белком онкогена Src. Гиперфосфорилирование цитоплазматического домена интегрина, возможно, лежит в основе механизма снижения аффинности некоторых типов интег риновых рецепторов к их лигандам и утраты кластерного характера распре деления интегринов на клеточной по верхности. Гиперфосфорилирование интегрина ослабляет также его связь с талином. Гиперфосфорилирование винкулина приводит к нарушению его связей с другими белками фокального контакта. При этом резко снижается способность актиновых микрофила ментов к заякориванию в фокальных контактах, что в свою очередь вызы вает ослабление центростремительно го натяжения микрофиламентов и формирования стресс-фибрилл. Зна чительная редукция последних весьма характерна для многих типов транс формированных клеток (рис. 7.21). Редукция стресс-фибрилл, по-види мому, связана с нарушениями в цепи передачи сигналов от интегриновых рецепторов (см. ниже).
267908 Д. Г. Заридзе |
401 |

Рис. 7.22. Дефектное формирование фо кальных контактов трансформированных фибробластов крысы с внеклеточным мат риксом. МНИФ с применением антител против винкулина. Ув. 500. (Препарат Л. В. Домниной.)
Нарушенное формирование стрессфибрилл, заякоренных в фокальных контактах, и связанное с этим ослаб ление центростремительного натяже ния препятствуют "созреванию" фо кальных контактов и опосредованной ими трансмембранной сигнализации (см. раздел 7.2.3).
Описанные нарушения ведут к де фектности формирования фокальных контактов (рис. 7.22) и ослаблению адгезии трансформированных клеток к определенным компонентам внекле точного матрикса. Снижение адгезии усугубляется тем, что трансформиро ванные клетки частично или полно стью утрачивают способность к синте зу и связыванию с клеточной поверх ностью определенных белков матрик са, например фибронектина или кол лагена.
Ослабление адгезивных связей трансформированных клеток с вне клеточным матриксом приводит к возрастанию их миграционной актив ности (см. раздел 7.3.3).
Нарушения фокальных контактов при трансформации касаются не толь ко их адгезивных функций, но также функций трансдукторов внутрикле точных сигналов.
Все ключевые белки, участвующие
впоследовательной передаче сигналов от интегриновых рецепторов, связав шихся со своими лигандами во вне клеточном матриксе (см. раздел 7.2.3), кодируются протоонкогенами. В ре зультате мутационного превращения протоонкогенов в онкогены одно или несколько звеньев этой сигнальной цепи спонтанно становятся сверхак тивными. FAK может постоянно на ходиться в состоянии автофосфорилирования; постоянно активированной может быть подмембранная тирозиновая протеинкиназа Src. В результате белки семейства Ras будут подвергать ся непрерывному фосфорилированию и пребывать в состоянии активации. Белки Ras в свою очередь могут при обрести мутантные формы, которые будут конститутивно связаны с ГТФ в результате снижения ГТФазной ак тивности этих белков. Таким образом, белки Ras будут постоянно находиться
вактивированном состоянии, переда вая сигналы дальше. Мутации гена ras
втрансформированных клетках встре чаются достаточно часто, они выявля ются более чем в 20 % опухолей чело века. Цитоплазматические протеинкиназы семейства Raf или МАР-киназ- ных каскадов также могут стать по стоянно активированными без необ ходимости в стимуляции. Число транскрипционных факторов, влияю щих на экспрессию определенных ге нов, в частности побуждающих клет ку к делению или оказывающих регу лирующее воздействие на цитоске лет, может резко возрасти, а эти фак торы — приобрести повышенную ак тивность.
Следствием этих нарушений в це пи проведения сигналов от интегри новых рецепторов в трансформиро ванной клетке являются постоянная стимуляция пролиферации, не зави симая от связывания интегринов с внеклеточным матриксом, а также снижение зависимости пролифера ции от ростовых факторов: митогенный сигнал от кодируемых онкогена ми рецепторов ростовых факторов
402
(активированных |
в отсутствие |
|
связей |
левых клеток. Так, например, сниже |
||||||||||
с их лигандами) следует далее |
по тому |
ние аффинности к фибронектину у |
||||||||||||
же пути, что и сигналы от интегринов. |
интегриновых рецепторов α5β1 сопро |
|||||||||||||
Одновременно с этим трансформиро |
вождается |
усилением |
миграции |
опу |
||||||||||
ванные |
клетки |
приобретают |
способ |
холевых клеток. Имеется прямая кор |
||||||||||
ность избегать анойкиса. Последнее |
реляция между степенью фосфорили- |
|||||||||||||
может быть обусловлено как мутацией |
рования FAK и возрастанием скоро |
|||||||||||||
гена-супрессора р53, так и постоян |
сти миграции клеток in vitro; экспрес |
|||||||||||||
ной, не зависимой от связывания ин |
сия FAK повышена во многих инва- |
|||||||||||||
тегринов |
с |
матриксом |
трансдукцией |
зивных |
опухолях. |
|
|
|
||||||
антианойкисных |
сигналов (см. раздел |
Вместе |
с |
тем |
неопластическая |
|||||||||
7.2.3). |
|
|
|
|
|
|
трансформация |
может сопровождать |
||||||
Нарушения в трансдукции |
внутри |
ся не только ослаблением, но и усиле |
||||||||||||
клеточных сигналов приводят также к |
нием адгезии клеток к определенным |
|||||||||||||
изменениям в экспрессии генов, уча |
компонентам внеклеточного |
матрик |
||||||||||||
ствующих в регуляции актинового ци |
са. Например, повышение экспрессии |
|||||||||||||
тоскелета. |
Проявлением |
этого |
служит |
интегриновых рецепторов α6β1 и α6β4 |
||||||||||
резкое сокращение числа стресс-фиб |
к ламинину, по-видимому, способст |
|||||||||||||
рилл в |
трансформированных |
клетках |
вует |
проникновению |
опухолевых |
кле |
||||||||
(см. рис. 7.21), что угнетает формиро |
ток в окружающие ламининсодержа- |
|||||||||||||
вание полноценных фокальных |
кон |
щие структуры матрикса. Формирова |
||||||||||||
тактов (см. рис. 7.22), ослабляет цен |
ние инвазивного фенотипа у клеток |
|||||||||||||
тростремительное |
натяжение |
и |
сни |
рака |
предстательной |
железы |
связыва |
|||||||
жает степень распластывания |
клеток. |
ют |
с |
высоким |
уровнем экспрессии |
|||||||||
Врезультате трансформированные интегрина α6β1.
клетки |
|
приобретают |
|
характерную |
Следует, |
|
впрочем, |
учитывать, |
что |
||||||||||
"поджатую" конфигурацию (см. рис. |
для активного перемещения клетки ее |
||||||||||||||||||
7.20). |
|
|
|
|
|
|
|
|
|
адгезивные связи с субстратом не |
|||||||||
Таким |
образом, |
вследствие |
нару |
должны быть ни слишком прочными, |
|||||||||||||||
шений |
в |
формировании |
фокальных |
ни слишком слабыми: образно говоря, |
|||||||||||||||
контактов и их функционировании в |
одинаково |
трудно |
передвигаться |
как |
|||||||||||||||
качестве |
|
адгезионных структур |
и |
по клею, так и по скользкому льду. |
|||||||||||||||
трансдукторов |
внутриклеточных |
сиг |
Другой способ контроля локомо- |
||||||||||||||||
налов |
трансформированные |
|
клетки |
ции клеток |
осуществляется |
специаль |
|||||||||||||
приобретают |
характерную |
морфоло |
ными цитокинами, называемыми ми- |
||||||||||||||||
гию, утрачивают субстратную |
зависи |
тогенами-мотогенами, которые спо |
|||||||||||||||||
мость размножения, |
становятся |
менее |
собны стимулировать |
|
или (значитель |
||||||||||||||
зависимыми от ростовых факторов и |
но реже) тормозить движение клеток |
||||||||||||||||||
избегают анойкиса. Эти их свойства |
(см. раздел 7.2.4). Эти цитокины, воз |
||||||||||||||||||
играют важную роль в прогрессии |
действуя на опухолевые клетки (кото |
||||||||||||||||||
опухоли, в частности в способности к |
рые сами могут секретировать такие |
||||||||||||||||||
инвазии |
и метастазированию. |
|
|
|
митогены-мотогены, |
|
как P D G F , |
бом- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
безин, |
трансформирующий |
|
фактор |
||||||
7.3.3. Изменения |
|
|
|
|
|
роста T G F - α |
и др.), |
|
стимулируют их |
||||||||||
|
|
|
|
|
размножение |
и локомоцию. Так, |
на |
||||||||||||
локомоторных |
|
реакций |
|
|
|||||||||||||||
|
|
|
пример, |
инсулиноподобный |
фактор |
||||||||||||||
клеток |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
роста (IGF-1) стимулирует локомо |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
Ослабление |
адгезивных |
|
связей |
цию и рост клеток человеческой мела- |
|||||||||||||||
трансформированных |
|
клеток |
с |
вне |
номы, а бомбезин — клеток мелкокле |
||||||||||||||
клеточным |
матриксом |
проявляется в |
точной |
карциномы |
|
|
легких |
человека. |
|||||||||||
возрастании их миграционной |
|
актив |
Обнаружение |
E G F |
и |
|
его рецептора в |
||||||||||||
ности. В условиях организма эта ак |
клетках рака желудка отчетливо кор |
||||||||||||||||||
тивность способствует |
инвазии |
|
опухо |
релирует |
с |
инвазией |
опухолью |
стенки |
|||||||||||
26* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
403 |
этого органа. Рецептором для E G F может служить продукт онкогена егВ2 (или neu). Этот онкоген часто гиперэкспрессируется в клетках ряда кар цином у человека, в том числе карци номы молочных желез, а также во всех случаях болезни Педжета. Его ги перэкспрессия коррелирует с метастазированием этой опухоли, а также ра ка желудка и рака яичника, что, повидимому, связано с мотогенным дей ствием E G F на клетки этих опухолей. Мишенью для F G F служит эндоте лий: стимулируя подвижность и про лиферацию эндотелиоцитов, этот цитокин вызывает активацию эндотелия, способствующую прикреплению к не
му циркулирующих |
опухолевых кле |
|||
ток. |
|
|
|
|
Относящийся к той же группе ци- |
||||
токинов H G F / S F |
является |
сильным |
||
мотогеном |
для |
опухолевых |
клеток. |
|
Вызываемое |
им |
превращение эпите |
||
лия в подвижные фибробластоподобные клетки играет драматическую роль в опухолевой инвазии, облегчая раковым клеткам активное внедрение в окружающие ткани. Так, среди кле ток, полученных из карцином толстой кишки человека, способными к инва зии in vitro были лишь те, которые полностью утратили эпителиоидную морфологию. При воздействии H G F / SF на культивируемые эпителиальные клетки или клетки различных карци ном человека они приобретали спо
собность |
инвазировать внеклеточный |
|
матрикс. |
|
|
Продуцируемый |
мезенхимальны- |
|
ми клетками H G F / S F в нормальных |
||
условиях |
организма |
воздействует на |
эпителий, |
выполняя |
роль посредника |
несколько таких факторов сейчас из вестны: это белки, секретируемые клетками карцином молочных желез и мочевого пузыря у человека. В резуль тате раковые клетки становятся ми шенями для мотогенного воздействия H G F / S F : клетки многих человеческих карцином несут его рецептор, экспрессированный в результате актива ции протоонкогена c-met.
Отдельную группу составляют "чистые" мотогены, стимулирующие локомоцию клеток, не влияя на про лиферацию. К ним относятся, в част ности, аутокринный фактор подвиж ности (AMF) и фактор, стимулирую щий миграцию (MSF). В отличие от
H G F / S F |
с паракринным характером |
|||
действия A M F и |
M S F |
обладают |
ауто- |
|
кринным |
действием, |
стимулируя |
ло |
|
комоцию |
самих |
клеток-продуцентов: |
||
A M F — |
клеток человеческой мелано- |
|||
мы и фибробластов, трансформиро ванных онкогеном ras; M S F — фиб робластов (фетальных или получен ных от больных раком молочных же лез), придавая им, кроме того, спо собность инвазировать внеклеточный матрикс. Описан также мотоген (сход ный с AMF), продуцируемый высоко метастатическими клетками аденокарциномы молочных желез у крысы, стимулирующий локомоцию тех же клеток. Показано, что уровень A M F в моче больных раком мочевого пузыря прямо коррелирует с инвазивностью этой опухоли.
Неопластическая трансформация эпителиальных клеток сама по себе может привести к их поляризации (см. раздел 7.3.1) и приобретению "ло комоторного" фенотипа, столь важно
втканевых мезенхимально-эпители- го для инвазивной активности. На
альных |
взаимодействиях, например |
пример, трансфекция |
эпителиоцитов |
||||
при морфогенезе. В опухолях эти |
онкогеном N-ras приводит |
к |
утрате |
||||
взаимодействия нарушены: возможно, |
клетками дисковидной и приобрете |
||||||
что гиперэкспрессия H G F / S F , наблю |
нию фибробластоподобной |
|
формы. |
||||
даемая во многих солидных опухолях, |
Псевдоподиальная активность, |
преж |
|||||
связана с тем, что опухолевые клетки |
де равномерно выраженная по всей |
||||||
секретируют |
факторы, |
стимулирую |
окружности клетки, |
теперь |
концен |
||
щие продуцирование H G F / S F фиб- |
трируется в нескольких узких участках |
||||||
робластами |
и другими |
стромальными |
клеточного края, создавая тем самым |
||||
клетками |
опухоли. По |
крайней мере |
предпосылки для перемещения клетки. |
||||
404

7.3.4. Изменения топографических реакций клеток
профиля и не сосредоточиваются на промежутках между канавками (рис. 7.23), как это делают нормальные фибробласты (см. рис. 7.14); у них
Неопластическая |
трансформация |
также ослабевают вытягивание и ори |
|||||||||||||
вызывает |
значительные изменения |
в |
ентация |
вдоль |
цилиндрического суб |
||||||||||
способности |
клеток |
реагировать |
на |
страта. |
|
|
|
|
|
|
|
||||
геометрическую |
конфигурацию |
суб |
У эпителиоцитов, |
трансформиро |
|||||||||||
страта. |
|
|
|
|
|
|
ванных онкогеном ras, вместо кольце |
||||||||
У трансформированных фибробла |
вого пучка актиновых микрофиламен |
||||||||||||||
стов по сравнению с их нормальными |
тов появляются линейные (хотя и |
||||||||||||||
прототипами пучки актиновых микро |
весьма немногочисленные |
и |
тонкие) |
||||||||||||
филаментов |
значительно редуцирова |
пучки. На цилиндрической |
поверхно |
||||||||||||
ны, в связи с чем изометрическое на |
сти ray-трансформированные эпите |
||||||||||||||
тяжение |
клеток |
ослабевает и их |
спо |
лиоциты |
не |
перегибаются |
|
поперек |
|||||||
собность к сгибанию возрастает. В ре |
цилиндра, что характерно для |
их нор |
|||||||||||||
мальных |
прототипов (см. рис. 7.16), а |
||||||||||||||
зультате |
трансформированные |
фиб |
|||||||||||||
вытягиваются |
и |
ориентируются |
вдоль |
||||||||||||
робласты |
успешно |
распластываются |
|||||||||||||
субстрата |
(рис. |
7.24), |
подобно |
фиб- |
|||||||||||
на дне глубоких |
канавок треугольного |
||||||||||||||
робластам. |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
На прерывистых субстратах |
транс |
|||||||
|
|
|
|
|
|
|
формированные |
эпителиоциты |
пол |
||||||
|
|
|
|
|
|
|
ностью утрачивают способность |
"затя |
|||||||
|
|
|
|
|
|
|
гивать" крупные отверстия (рис. 7.25), |
||||||||
|
|
|
|
|
|
|
свойственную |
их |
нормальным |
|
прото |
||||
|
|
|
|
|
|
|
типам (см. рис. 7.18). |
|
|
|
|
||||
|
|
|
|
|
|
|
Механизмы изменений топографи |
||||||||
|
|
|
|
|
|
|
ческих реакций клеток в результате их |
||||||||
|
|
|
|
|
|
|
трансформации почти не изучены. |
||||||||
|
|
|
|
|
|
|
Можно предполагать, что в этих меха |
||||||||
|
|
|
|
|
|
|
низмах важную роль играют не только |
||||||||
|
|
|
|
|
|
|
нарушения изометрического |
натяже- |
|||||||
Рис. 7.23. |
Трансформированные фиброб |
|
ласты мыши на субстрате с глубокими ка |
|
|
навками |
треугольного профиля: клетки |
Рис. 7.24. Ras-трансформированный эпи |
распластываются в глубине канавок и на |
телиоцит мыши на субстрате с цилиндри |
|
промежутках между ними. Световая мик |
ческой поверхностью: клетка вытягивается |
|
роскопия. Ув. 120. (Препарат Ю. А. Ровен |
вдоль цилиндра. СЭМ. Ув. 1100. (Препарат |
|
ского.) |
|
Ю. А. Ровенского.) |
405

|
|
|
|
|
|
контакты |
нескольких |
типов: |
замы |
|||||||||
|
|
|
|
|
|
кающие, или плотные контакты (oc |
||||||||||||
|
|
|
|
|
|
cluding, |
tight junctions), |
заякоривающие |
||||||||||
|
|
|
|
|
|
контакты (anchoring junctions) и щеле |
||||||||||||
|
|
|
|
|
|
вые контакты (gap junctions). В плот |
||||||||||||
|
|
|
|
|
|
ных |
контактах |
молекулы |
трансмем |
|||||||||
|
|
|
|
|
|
бранного белка окклудина в плазма |
||||||||||||
|
|
|
|
|
|
тических |
мембранах |
контактирующих |
||||||||||
|
|
|
|
|
|
клеток прямо связываются друг с дру |
||||||||||||
|
|
|
|
|
|
гом. Заякоривающие |
|
контакты |
вклю |
|||||||||
|
|
|
|
|
|
чают две |
разновидности: адгезионные |
|||||||||||
|
|
|
|
|
|
и десмосомальные контакты. При |
||||||||||||
Рис. 7.25. |
Ras-трансформированные эпи |
этих |
контактах |
соединение |
осуществ |
|||||||||||||
ляется |
с |
помощью |
адгезивных |
струк |
||||||||||||||
телиоциты мыши на прерывистом (в виде |
||||||||||||||||||
тур, |
связанных |
с |
цитоскелетом |
кон |
||||||||||||||
решетки) субстрате: клетки не перемеща |
||||||||||||||||||
тактирующих клеток |
|
— |
актиновыми |
|||||||||||||||
ются в отверстия решетки. СЭМ. Ув. 1300. |
|
|||||||||||||||||
микрофиламентами |
(в |
адгезионных |
||||||||||||||||
(Препарат К). А. Ровенского.) |
|
|||||||||||||||||
|
|
|
|
|
|
контактах) или промежуточными фи- |
||||||||||||
|
|
|
|
|
|
ламентами (в |
десмосомальных |
кон |
||||||||||
ния, связанные с дефектностью акти |
тактах). При щелевых контактах меж |
|||||||||||||||||
нового цитоскелета в трансформиро |
ду клетками остается узкая щель. Обе |
|||||||||||||||||
ванных клетках. Нельзя также исклю |
мембраны |
контактирующих |
клеток |
и |
||||||||||||||
чить структурные и (или) функцио |
щель между ними пронизаны цилинд |
|||||||||||||||||
нальные |
изменения |
в |
"рецепторах |
рическими структурами — коннексо- |
||||||||||||||
растяжения" (предположительно ион |
нами (состоящими из белка коннек- |
|||||||||||||||||
ных хлоридных каналах), |
обусловлен |
сина), |
содержащими каналы, которые |
|||||||||||||||
ные трансформацией, в результате че |
могут открываться и закрываться в за |
|||||||||||||||||
го клетки перестают реагировать на |
висимости от изменений конформа- |
|||||||||||||||||
топографические |
свойства |
поверхно |
ции коннексина. Благодаря каналам |
|||||||||||||||
сти субстрата. |
|
|
|
|
осуществляется |
метаболическая |
ко |
|||||||||||
Изменения топографических реак |
операция клеток — прямой межкле |
|||||||||||||||||
ций могут |
играть |
немаловажную роль |
точный обмен ионами и небольшими |
|||||||||||||||
в инвазивном росте опухолевых кле |
молекулами без выхода их в межкле |
|||||||||||||||||
ток, оказывая влияние на пути и ско |
точное |
пространство. |
|
|
|
|
|
|
||||||||||
рость их миграции во внеклеточном |
Контактные |
взаимодействия |
кле |
|||||||||||||||
матриксе, "застревание" в разного ро |
ток друг с другом оказывают регули |
|||||||||||||||||
да тканевых щелях и т. п. |
|
|
рующее влияние на их пролифера |
|||||||||||||||
|
|
|
|
|
|
цию, движение и синтетические про |
||||||||||||
7.4. Межклеточные |
|
|
цессы. |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Размножение нормальных клеток в |
||||||||||||||||
контактные взаимодействия |
||||||||||||||||||
и их нарушения |
|
|
|
культурах тормозится |
при |
достижении |
||||||||||||
при неопластической |
|
такой |
плотности |
клеточного |
моно |
|||||||||||||
трансформации |
|
|
|
слоя, когда на дне культурального со |
||||||||||||||
|
|
|
|
|
|
суда не остается участков, свободных |
||||||||||||
7.4.1. |
Контактные |
|
|
от клеток. Если часть конфлуэнтного |
||||||||||||||
взаимодействия |
|
|
|
монослоя фибробластов или эпите- |
||||||||||||||
нормальных |
клеток |
|
лиоцитов |
механически |
удалять, |
то |
||||||||||||
|
|
|
|
|
|
клетки, оказавшиеся на краю "раны", |
||||||||||||
Адгезивные взаимодействия |
клеток |
начинают |
пролиферировать |
и мигри |
||||||||||||||
друг с другом играют главенствующую |
ровать в свободное пространство "ра |
|||||||||||||||||
роль в эмбриогенезе и сохранении |
ны". Хотя это и не доказывает строго, |
|||||||||||||||||
тканевой целости. |
|
|
|
|
что |
межклеточные |
контакты |
тормозят |
||||||||||
Клетки |
образуют |
друг |
с |
другом |
размножение, |
такая |
|
возможность |
||||||||||
406

представляется очень вероятной. Этот феномен называют контактным тор можением размножения.
Феномен контактного торможе ния движения определяется как свой ство нормальных клеток реагировать на контактные взаимодействия в культуре остановкой направленного движения одной клетки по поверхно сти другой.
В монослойных культурах эпите-
лиоцитов |
соприкосновения |
клеток |
приводят к |
контактному торможению |
|
движения |
и формированию |
вначале |
нестабильных, а затем стабильных ад гезионных межклеточных контактов. Псевдоподиальная активность в зоне соприкосновения клеточных краев и вблизи этой зоны полностью тормо зится, что сопровождается накоплени ем в этой зоне молекул адгезии Е- кадхерин/катенинового комплекса (см. ниже) и реорганизацией актино вого цитоскелета.
Фибробласты в монослойных куль турах также претерпевают контактное торможение движения, однако способ его осуществления иной, чем у эпителиоцитов: при столкновениях фиб робластов происходит наползание друг на друга их ведущих краев, затем наползающий край ретрактирует, и одновременно с этим клетка начинает образовывать другой ведущий край в стороне от участка бывшего контакта. В результате фибробласты меняют на правление движения, "отворачивая" от прежнего места контакта.
Описанные различия в осуществ лении контактного торможения дви жения у эпителиоцитов и фибробла стов, вероятно, имеют в своей основе биомеханический цитоскелетный ме ханизм. У эпителиоцитов в начальной стадии установления контакта проис ходит реорганизация актиновых мик рофиламентов в зоне контакта, в ре зультате чего вектор их натяжения ста новится направленным латерально — вдоль краев контактирующих клеток. Эта механическая сила натяжения приводит к параличу псевдоподиальной активности в зоне контакта и
Рис. 7.26. Межклеточные контакты эпите лиоцитов печени крысы. МНИФ с приме нением антител против Е-кадхерина, кон фокальная микроскопия. Ув. 600. (Препа рат Н. А. Глушанковой.)
вблизи ее, а также обеспечивает экс пансию зоны межклеточного контак та, стабилизируя его. У фибробластов при установлении контакта в отличие от эпителиоцитов не происходит ре организации актиновых микрофила ментов, и их натяжение в зоне кон такта остается направленным центро стремительно — вдоль длинной оси каждой из контактирующих клеток. Это натяжение приводит к ретракции ведущих краев с последующим фор мированием нового ведущего края и расхождением фибробластов. Ингибирования псевдоподиальной активно сти не возникает.
Различное направление сил натя жения в зоне межклеточного контакта у эпителиоцитов и фибробластов оп ределяет различную ориентацию фор мирующихся контактных структур. У эпителиоцитов адгезионные контак ты формируются между краями кле ток и ориентируются тангенциально — вдоль контактирующих краев (рис. 7.26). У фибробластов такие контакты могут образовываться между поверх ностями перекрывающихся ведущих ламелл и ориентированы вдоль длин ной оси контактирующих клеток.
Межклеточные контакты осущест вляются посредством широкого спек тра трансмембранных молекул адге-
407

С х е м а 7.7. Адгезионный межклеточный контакт
ПМК — плазматическая мембрана клетки; К — кадхерин; α, β, γ — α-, β-, γ-катенины; В — винкулин; а — α-актинин; ΑΦ — пучки актиновых микрофиламентов
зии. Подобно интегриновым рецепто рам, связывающим клетки с внекле точным матриксом, молекулы меж клеточной адгезии, помимо механиче ской связи, выполняют также функ ции трансдукторов внутриклеточных сигналов, влияющих на пролифера цию и движение клеток.
Молекулы межклеточной адгезии разделяются на несколько групп: кадхерины, интегрины, иммуноглобу лины и селектины, а также протеогликаны и другие гликоконъюгаты.
Рассмотрим коротко главные харак теристики каждой группы молекул ад гезии.
Кадхерины. Это семейство транс мембранных гликопротеинов разделя ется на несколько субклассов:
• кадхерины, осуществляющие десмосомальные контакты: десмоглеин и десмоколлины I и II.
Подобно интегринам, кадхерины обладают внутриклеточными домена ми, которые через цепь взаимосвя занных белков соединяются с цитоскелетными структурами контакти рующих клеток. Кадхерины адгези онных контактов связываются с актиновыми микрофиламентами через α-, β- и γ - катенины (последние назы ваются также плакоглобинами), вин кулин и некоторые другие белки
(схема |
7.7). |
Десмосомальные |
кадхе |
||
р и н ы |
связываются с |
промежуточны |
|||
ми филаментами |
через плакоглобин, |
||||
десмоплакины |
и |
другие |
белки. |
||
Кадхерины |
могут опосредовать |
кон |
|||
•кадхерины, осуществляющие ад такты между клетками не только од-,
гезионные контакты: Е-кадхе- |
ного и того же типа (гомотипическую |
|
рин (эпителиальный кадхерин), |
адгезию), но и между клетками раз |
|
V-кадхерин |
(эндотелиальный |
ных типов (гетеротипическую адге |
кадхерин) и др.; |
зию). ' |
|
408
Интегрины. Хотя подавляющее большинство интегриновых рецепто ров участвует в формировании кон тактов клеток с внеклеточным мат риксом (см. раздел 7.2.3), некоторые интегрины осуществляют межклеточ ные контакты. К ним относятся лей коцитарные интегрины LFA-1 и Мас- 1, а также интегрин α4β1, для которых лигандами служат молекулы адгезии другого семейства — иммуноглобули нов (см. ниже). Указанные интегрины обеспечивают адгезию лейкоцитов к эндотелию сосудов при воспалении.
Иммуноглобулины — семейство трансмембранных гликопротеинов, у которых внеклеточный домен содер жит несколько иммуноглобулиноподобных доменов. Семейство включает молекулы межклеточной гомо- и гетеротипической адгезии: ICAM-1, VCAM-1, РЕСАМ-1, карциноэмбриональный антиген (СЕА) и др.
ICAM-1, VCAM-1 и РЕСАМ-1 экспрессируются на поверхности различ ных типов клеток, в том числе клеток сосудистого эндотелия. Для выражен ной экспрессии ICAM-1 или VCAM-1 необходима активация эндотелия цитокинами (например, интерлейкином 1β или фактором некроза опухоли TNF-α), экспрессия РЕСАМ-1 явля ется конститутивной. Основной функ цией этих молекул является обеспече ние прикрепления лейкоцитов к сосу дистому эндотелию при воспалении.
Селектины — семейство трансмем бранных молекул, внеклеточный до мен которых содержит лектиноподобную часть. Наличие последней позво ляет селектинам распознавать углево ды на поверхности других клеток и связываться с ними, осуществляя межклеточную адгезию. Представите лями этого семейства являются Е-се- лектин и Р-селектин, которые, экспрессируясь на сосудистом эндотелии, активированном цитокинами, обеспе чивают адгезию к нему лейкоцитов при воспалении.
Хотя пути проведения сигналов от межклеточных контактов, влияющих на пролиферативную и локомоторную
активность клеток, полностью не вы яснены, очевидно, что эти сигнальные пути ведут к изменению регуляции ге нов.
Контактное торможение размно жения связывают с усилением экс прессии определенных генов — опу холевых супрессоров (Kipl и INК4а). Белки этих генов ингибируют циклинзависимые киназы, активностью которых обеспечивается последова тельный переход из одной фазы кле точного цикла в другую. Установление межклеточных контактов вызывает усиление экспрессии этих генов-су- прессоров и блокирование выхода клеток из Gl - фазы . Белок другого ге на — опухолевого супрессора р53, ко торый также препятствует входу кле ток в S-фазу, накапливается при обра зовании конфлуэнтного эпителиаль ного пласта, тогда как при разобще нии клеток этот белок дестабилизиру ется. Достижение конфлуэнтности у фибробластов блокирует передачу сигналов от ростовых факторов на уровне (или "выше") белков Racl и Cdc42. При удалении части монослоя прохождение сигналов восстанавлива ется в клетках на краю "раны", ини циируя их размножение и локомоцию. Достижение конфлуэнтности не ока зывает влияния на классическую Ras- Raf-MAP-киназную сигнальную цепь.
7.4.2. Нарушения межклеточных контактных взаимодействий и их роль в опухолевой инвазии
Неопластическая трансформация вызывает нарушения межклеточных контактов, что приводит к ослабле нию связей между клетками. В основе этих нарушений могут лежать мутации и делеции в генах, кодирующих моле кулы межклеточной адгезии (напри мер, Е-кадхерин) и (или) другие моле кулы, участвующие в межклеточных контактах (например, а- и β-катени- ны). Дестабилизация кадхеринопосредованных контактов может быть так же обусловлена действием онкогенов,
409

Рис. 7.27. Трансформированные фибро бласты мыши: многослойный рост клеток. СЭМ. Ув. 900. (Препарат Ю. А. Ровен ского.)
продукты которых, обладая тирозинпротеинкиназной активностью, вызы вают гиперфосфорилирование β-кате- нина, что приводит к нарушению ад гезивных функций всего Е-кадхерин- катенинового комплекса.
В результате инактивации генов — опухолевых супрессоров, опосредую щих контактное торможение размно жения (см. раздел 7.4.1), трансформи рованные клетки утрачивают эту спо собность.
Ранее общепринятым было мне ние, что трансформированные клетки утрачивают также контактное тормо жение движения. Недавно, однако, было показано, что у эпителиоцитов, трансдуцированных онкогеном N-ras
мые различия в характере роста нетрансформированных и трансформи рованных клеток в культурах (монослойный рост у первых и многослой ный — у вторых), по-видимому, обу словлены ослаблением прикрепления клеток к субстрату и ослаблением межклеточной адгезии — свойствами, характерными для трансформирован ных клеток, что облегчает подползание одной клетки под тело другой и создает эффект многослойного роста (рис. 7.27).
Нарушение межклеточной адгезии, опосредованной Е-кадхерином, вно сит важный вклад в инвазивный по тенциал опухолевых клеток. Мутации в гене Е-кадхерина (наблюдаемые в половине случаев рака желудка и при раке яичников у человека), а также мутации и делеции в генах, кодирую щих а- и β-катенины, рассматривают как условие перехода опухоли к инвазивному генотипу. Снижение экс прессии Е-кадхерина и (или) альфа-кате- нина коррелирует с возрастанием под вижности и инвазивной способности
уклеток рака различных локализаций
учеловека. Трансфекция генов, коди рующих Е-кадхерин или α-катенин, в опухолевые эпителиальные клетки с дефицитом продуктов этих генов сни жает инвазивную активность клеток. Наоборот, блокирование межклеточ ной адгезии антителами к Е-кадхери- ну индуцирует инвазивные свойства у нормальных эпителиоцитов.
Внастоящее время ген Е-кадхери на рассматривается как ген-супрессор инвазии и метастазирования экспери ментальных и человеческих карцином.
иприобретших в результате транс Продукт другого гена опухолевого су-
формации фибробластоподобную форму, а также у трансформирован ных фибробластов контактное тормо жение движения осуществляется тем же способом, что и у нормальных фибробластов (хотя и по-иному, чем у нормальных эпителиоцитов).
Таким образом, контактное тормо жение движения присуще как нетрансформированным, так и транс формированным клеткам. Наблюдае-
прессора АРС может связываться со свободным (не связанным с Е-кадхе рином) β-катенином, функционирую щим как транскрипционный фактор, который стимулирует вход клеток в S- фазу. Связывание с АРС вызывает де градацию этого свободного β-катени- на. Таким образом, инактивация АРС, как и мутации β-катенина, препятст вующие его связыванию с Е-кадхери ном, вызывают возрастание количест-
410
ва свободного β-катенина и стимуля |
вызывая в нем усиление экспрессии |
||||||||||||||||||||||
цию пролиферации клеток (см. раздел |
ICAM-1, VCAM-1 и Е-селектина. В |
||||||||||||||||||||||
3.2). Ген АРС оказывается мутирован |
результате |
усиливается |
адгезия |
опухо |
|||||||||||||||||||
ным в высоком проценте случаев рака |
левых клеток к активированному эн |
||||||||||||||||||||||
толстого кишечника у человека. Вро |
дотелию. Прикрепление к эндотелию |
||||||||||||||||||||||
жденные мутации гена АРС вызывают |
может |
также |
|
осуществляться |
через |
||||||||||||||||||
также наследуемое онкологическое за |
"мостик": интегрин αIIbβ3 (на опухо |
||||||||||||||||||||||
болевание — семейный аденоматоз- |
левой клетке) — фибриноген — интег |
||||||||||||||||||||||
ный полипоз толстого кишечника, пе |
рин αVβ3 на эндотелии. Сходный |
||||||||||||||||||||||
реходящий в инвазивный рак. |
|
"мостик" (интегрин — фибриноген — |
|||||||||||||||||||||
В процессе инвазивного роста опу |
интегрин) |
обеспечивает |
связывание |
||||||||||||||||||||
холевые клетки вступают в контакт |
опухолевых клеток с тромбоцитами и |
||||||||||||||||||||||
ные взаимодействия с клетками окру |
агрегацию |
последних, |
что |
является |
|||||||||||||||||||
жающих нормальных тканей; проник |
важным условием инвазии стенки со |
||||||||||||||||||||||
нув в систему циркуляции, опухоле |
суда (см. ниже). |
|
|
|
|
|
|
||||||||||||||||
вые клетки вступают в контакт с сосу |
|
Динамика |
|
процесса |
установления |
||||||||||||||||||
дистым эндотелием, |
осуществляя за |
контактов |
циркулирующих |
опухоле |
|||||||||||||||||||
тем |
экстравазацию |
и |
формирование |
вых клеток с сосудистым эндотелием |
|||||||||||||||||||
метастатических |
очагов. |
|
|
|
|
сходна с процессом прилипания лей |
|||||||||||||||||
Прочное |
прикрепление |
циркули |
коцитов к эндотелию в очаге воспале |
||||||||||||||||||||
рующих опухолевых клеток к сосуди |
ния и включает две последовательные |
||||||||||||||||||||||
стому эндотелию |
осуществляется по |
стадии: слабую непостоянную адгезию |
|||||||||||||||||||||
средством |
различных |
молекул |
адге |
и |
прочное |
стабильное |
связывание |
||||||||||||||||
зии. |
Такими |
|
молекулами |
являются, |
клетки с эндотелием. |
|
|
|
|
||||||||||||||
например, лейкоцитарные |
интегрины |
|
В начальной стадии важную роль |
||||||||||||||||||||
или |
интегрин |
α4β1, |
экспрессируемые |
играет так называемое углеводное рас |
|||||||||||||||||||
на |
поверхности |
опухолевых |
клеток |
познавание. Опухолевые клетки и эн - |
|||||||||||||||||||
(гиперэкспрессия α4β1 клетками ме- |
дотелиоциты несут на своей поверх |
||||||||||||||||||||||
ланомы способствует их адгезии к эн |
ности |
разнообразные |
олигосахариды |
||||||||||||||||||||
дотелию сосудов и определяет мета |
(в |
составе |
мембранных |
гликолипидов |
|||||||||||||||||||
статическую активность). Эндотели- |
или гликопротеинов). Важно, что раз |
||||||||||||||||||||||
альные ICAM-1, VCAM-1 или РЕ |
личные |
гликоконъюгаты, |
например |
||||||||||||||||||||
САМ-1, связываясь соответственно с |
гликосфинголипиды, |
экспрессируе |
|||||||||||||||||||||
интегринами LFA-1, α4β1 или одно |
мые эндотелием, |
обладают значитель |
|||||||||||||||||||||
именной молекулой РЕСАМ-1 на по |
ной органной специфичностью. Та |
||||||||||||||||||||||
верхности |
циркулирующих опухоле |
ким |
образом, |
взаимное "распознава |
|||||||||||||||||||
вых клеток, также обеспечивают их |
ние" углеводных цепей на поверхно |
||||||||||||||||||||||
прочное прикрепление к эндотелиаль- |
сти опухолевых клеток и эндотелио- |
||||||||||||||||||||||
ной |
выстилке |
сосудов. |
Связывание |
цитов |
может |
|
обеспечить |
начальную |
|||||||||||||||
эндотелиальных Е- и Р-селектинов с |
стадию |
избирательной |
адгезии |
опухо |
|||||||||||||||||||
углеводными |
лигандами |
|
на |
поверхно |
левых клеток к эндотелию сосудов ор |
||||||||||||||||||
сти |
циркулирующих |
опухолевых кле |
гана-мишени. Это начальное очень |
||||||||||||||||||||
ток обеспечивает их слабое сцепление |
слабое |
сцепление |
вскоре |
несколько |
|||||||||||||||||||
с эндотелием, что является необходи |
усиливается |
в |
результате |
активации |
|||||||||||||||||||
мой начальной фазой адгезии, предва |
эндотелия |
тромбином, |
гистамином |
||||||||||||||||||||
ряющей |
формирование |
затем |
более |
или |
различными |
цитокинами, |
веду |
||||||||||||||||
прочного сцепления. |
|
|
|
|
|
щими к экспрессии Е- и Р-селекти |
|||||||||||||||||
Высокометастатические |
клетки ме- |
нов. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
ланомы секретируют цитокин интер- |
|
Во второй, более поздней, стадии |
|||||||||||||||||||||
лейкин-1, который, во-первых, ауто- |
контакты |
между |
опухолевыми |
клетка |
|||||||||||||||||||
кринно |
стимулирует |
|
экспрессию |
ми |
|
и |
эндотелием |
стабилизируются |
|||||||||||||||
ICAM-1 в самих меланомных клетках |
благодаря |
экспрессии |
активирован |
||||||||||||||||||||
и, во-вторых, |
активирует |
эндотелий, |
ным |
эндотелием |
VCAM-1 |
и |
ICAM-1, |
||||||||||||||||
411
которые связываются со своими интегриновыми рецепторами на поверх ности опухолевых клеток. После этого следует ретракция эндотелиоцитов. Ее вызывают тромбоциты, активирован ные опухолевыми клетками: послед ние индуцируют агрегацию тромбоци тов, агрегаты прикрепляются близ участков межклеточных контактов эн дотелиоцитов и вызывают их ретрак цию. Адгезию опухолевых клеток к тромбоцитам с образованием агрега тов стимулирует тромбин, продуци руемый тромбоцитами, а также мно гими опухолевыми клетками. Эти со бытия "открывают дорогу" для про движения опухолевых клеток в субэн дотелий, который обнажается в ре зультате ретракции эндотелиоцитов.
Дальнейшее продвижение опухоле вых клеток в субэндотелий обеспечи вается модификацией экспрессии ин тегриновых и неинтегриновых рецеп торов к различным компонентам вне клеточного матрикса (например, воз растанием экспрессии рецепторов к ламинину и снижением — к фибронектину), а также протеолитической активностью опухолевых клеток: по следние секретируют широкий спектр протеаз, вызывающих деградацию различных структур внеклеточного матрикса и способствуя миграции опухолевых клеток в окружающие ткани.
* * *
Таким образом, морфологическая трансформация может возникать в хо де многостадийной неопластической эволюции, вызываемой различными агентами, например онкогенными ви русами или канцерогенными вещест вами, а также при трансфекции ак тивных мутантных онкогенов. Разно образие форм и степеней морфологи ческой трансформации очень велико, тем не менее можно выявить некото рые общие черты и направления таких изменений.
Одним из таких общих сдвигов яв ляется уменьшение адгезии клеток к
внеклеточному матриксу и к соседним клеткам. Нормальные клетки, контак тирующие с плоскостью культуральной подложки, подвергаются распла стыванию: выпускают и прикрепляют псевдоподии, полимеризуя актин и формируя актиновые пучки и фокаль ные адгезии.
В результате распластывания клет ка становится сильно уплощенной и растянутой на подложке. Трансфор мированные клетки самых разных ти пов выполняют реакции распластыва ния хуже, чем их нетрансформированные предшественники: они приобре тают менее плоскую форму, их пло щадь на подложке существенно уменьшается. Число фокальных адге зии и размеры каждой такой адгезии резко уменьшаются. Число межкле точных контактов снижается; они со всем исчезают во многих типах карци ном в организме и трансформирован ных эпителиоцитов в культуре. У культивируемых трансформированных клеток уменьшаются в числе и часто совсем исчезают пучки актиновых микрофиламентов — кольцевые пучки эпителиоцитов и прямые пучки фиб робластов.
Особого анализа заслуживают из менения формы клеток и распределе ния псевдоподиальной активности. Эпителиоциты образуют псевдоподии, т. е. полимеризуют актин по всему пе риметру дисковидной клетки. После трансформаций, вызванных мутация ми самых разных онкогенов, форма клеток из дисковидной становится вытянутой, фибробластоподобной. Соответственно образование псевдо подий сосредоточивается лишь в од ной части клеточного края — актив ном переднем крае. По-видимому, размеры зоны активного края, т. е. зо ны, полимеризующей актин, при этом сужаются по сравнению с нетрансформированной дисковидной клет кой.
Что является основой тех пере строек цитоскелета, которые опреде ляют морфологию трансформации и о которых говорилось выше? На этот
412
вопрос сегодня ответить окончательно |
гать, каково может быть общее на |
|||||||||||||||||||||||||||
невозможно. |
Единственное, |
что |
мы |
правление поисков. |
|
|
|
|
|
|
|
|||||||||||||||||
можем сделать, — изложить принад |
|
Существенно, |
что |
те |
генетические |
|||||||||||||||||||||||
лежащую авторам этой статьи гипоте |
изменения, |
которые |
выражаются |
в |
||||||||||||||||||||||||
тическую |
модель |
изменений |
динами |
трансформациях, |
имеют |
нормальные |
||||||||||||||||||||||
ки |
цитоскелета при |
трансформации, |
"фенокопии" |
— |
|
аналогичные |
транс |
|||||||||||||||||||||
приложимую и к фибробластам, и к |
формациям |
обратимые |
перестройки, |
|||||||||||||||||||||||||
эпителиоцитам: |
|
|
|
|
|
|
не |
сопровождающиеся |
изменениями |
|||||||||||||||||||
• |
патологическая |
|
активация |
му- |
генома. Одним из примеров такой пе |
|||||||||||||||||||||||
|
рестройки |
является |
|
так |
называемая |
|||||||||||||||||||||||
|
тантных |
|
онкогенов |
приводит к |
|
|||||||||||||||||||||||
|
|
эпителиомезенхимная |
|
трансформа |
||||||||||||||||||||||||
|
снижению динамики актина: по |
|
||||||||||||||||||||||||||
|
ция (ЭМТ): превращение эпителиоци |
|||||||||||||||||||||||||||
|
нижается |
общая |
интенсивность |
|||||||||||||||||||||||||
|
тов в подвижные удлиненные фиброб- |
|||||||||||||||||||||||||||
|
полимеризации |
микрофиламен |
||||||||||||||||||||||||||
|
ластоподобные |
клетки. Э М Т |
вызыва |
|||||||||||||||||||||||||
|
тов |
(образования |
псевдоподий) |
|||||||||||||||||||||||||
|
ется |
группой внеклеточных белков |
— |
|||||||||||||||||||||||||
|
по |
краю |
клетки, |
ослабляется |
||||||||||||||||||||||||
|
лигандов (HSF/SF, F G F и др.), связы |
|||||||||||||||||||||||||||
|
процесс образования из микро |
|||||||||||||||||||||||||||
|
вающихся со специфичными рецепто |
|||||||||||||||||||||||||||
|
филаментов пучков и связанных |
|||||||||||||||||||||||||||
|
рами |
поверхности |
и |
индуцирующих |
||||||||||||||||||||||||
|
с ними фокальных адгезии; |
|
||||||||||||||||||||||||||
|
|
изменения |
реорганизации |
цитоскеле |
||||||||||||||||||||||||
> |
это снижение динамики актина |
|||||||||||||||||||||||||||
та, |
в |
которых |
важную |
роль играет ак |
||||||||||||||||||||||||
|
вызывает |
|
адаптивную |
пере |
||||||||||||||||||||||||
|
|
тивация системы Rac/Rho. |
|
|
|
|||||||||||||||||||||||
|
стройку |
|
системы |
микротрубо |
|
|
|
|||||||||||||||||||||
|
|
|
В |
организме |
|
ЭМТ, |
по-видимому, |
|||||||||||||||||||||
|
чек: |
|
их |
|
расположение |
и |
рост |
|
|
|||||||||||||||||||
|
|
|
играют важную роль в эмбриональном |
|||||||||||||||||||||||||
|
идут не по всему периметру эпи |
|||||||||||||||||||||||||||
|
развитии. |
Например, |
определенные |
|||||||||||||||||||||||||
|
телиоцитов, |
но |
|
сосредоточива |
||||||||||||||||||||||||
|
|
участки |
нервной |
трубки |
("нервный |
|||||||||||||||||||||||
|
ются |
в |
|
определенном |
секторе |
|||||||||||||||||||||||
|
|
гребень") эпителиоцитов |
выселяются |
|||||||||||||||||||||||||
|
этого |
периметра, |
где микротру |
|||||||||||||||||||||||||
|
из |
этой трубки |
и |
поодиночке |
мигри |
|||||||||||||||||||||||
|
бочки |
индуцируют |
образование |
|||||||||||||||||||||||||
|
руют |
в |
разные |
участки |
эмбриона, |
где |
||||||||||||||||||||||
|
псевдоподий. Аналогичным |
об |
||||||||||||||||||||||||||
|
они |
пролиферируют |
|
и |
образуют |
раз |
||||||||||||||||||||||
|
разом |
у |
|
фибробластов |
измене |
|
||||||||||||||||||||||
|
|
ные |
|
типы |
|
дифференцированных |
||||||||||||||||||||||
|
ния |
микротрубочек сужают сек |
|
|
||||||||||||||||||||||||
|
структур. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
тор активного края. В результате |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
Изложенные |
данные |
и соображе |
||||||||||||||||||||||||
|
вся сниженная общая интенсив |
|
||||||||||||||||||||||||||
|
ния |
позволяют |
сформулировать |
но |
||||||||||||||||||||||||
|
ность |
|
полимеризации |
актина |
||||||||||||||||||||||||
|
|
вый |
подход |
к |
биологической |
сущно |
||||||||||||||||||||||
|
компенсируется |
сосредоточени |
||||||||||||||||||||||||||
|
сти морфологической трансформации. |
|||||||||||||||||||||||||||
|
ем этой полимеризации на узком |
|||||||||||||||||||||||||||
|
Можно |
думать, |
что |
нормальные |
тка |
|||||||||||||||||||||||
|
участке края. На этом активном |
|||||||||||||||||||||||||||
|
невые |
клетки |
могут |
существовать |
в |
|||||||||||||||||||||||
|
участке |
интенсивность |
полиме |
|||||||||||||||||||||||||
|
организме |
в |
двух |
морфологических |
||||||||||||||||||||||||
|
ризации |
|
становится |
достаточно |
||||||||||||||||||||||||
|
|
формах, |
которые |
можно |
условно |
на |
||||||||||||||||||||||
|
высокой, |
чтобы |
поддерживать |
|||||||||||||||||||||||||
|
звать |
"оседлой" |
и |
"миграционной". В |
||||||||||||||||||||||||
|
вытягивание |
и |
|
направленные |
||||||||||||||||||||||||
|
|
оседлом |
состоянии |
|
клетки |
прочно |
||||||||||||||||||||||
|
движения |
клеток. |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
прикреплены |
к |
|
внеклеточному |
мат |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Мы совершенно еще не знаем мо |
риксу и к другим клеткам; они вклю |
|||||||||||||||||||||||||||
лекулярных |
механизмов |
этих пере |
чены в состав тканевого комплекса: |
|||||||||||||||||||||||||
строек |
цитоскелета, |
промежуточных |
эпителиоциты — в пласты, трубки и |
|||||||||||||||||||||||||
стадий, ведущих от активации мутант- |
альвеолы эпителия, фибробласты — в |
|||||||||||||||||||||||||||
ных онкобелков до изменений дина |
пластинки и "шнуры" соединительной |
|||||||||||||||||||||||||||
мики цитоскелета. Возможно, что по |
ткани и т. д. Под влиянием регулятор- |
|||||||||||||||||||||||||||
нижение |
полимеризации |
актина |
свя |
ных |
воздействий |
при |
эмбриогенезе, |
|||||||||||||||||||||
зано с возможным снижением актив |
регенерации и гормональных гипер- |
|||||||||||||||||||||||||||
ности ГТФазы Rac. Множество гипо |
плазиях |
клетки |
|
могут |
|
перестроить |
||||||||||||||||||||||
тез такого рода подлежит проверке. |
свою морфологию и перейти обрати |
|||||||||||||||||||||||||||
Сейчас |
мы |
можем только предпола |
мо |
в |
миграционное |
|
состояние, |
при |
||||||||||||||||||||
413
котором они временно выходят из тканевых структур, их контакты с дру гими клетками и матриксом уменьша ются или исчезают. В результате клет ки становятся способными мигриро вать на новые территории и основы вать там новые тканевые структуры, переходя вновь в оседлое состояние под влиянием новой микросреды. В основе этих обратимых переходов ле жат реорганизации цитоскелета, вы зываемые внешними сигналами. В мигрирующем состоянии эпителиоци ты и фибробласты гораздо более сход ны друг с другом, чем в оседлых со стояниях. Это сходство можно обо значить как "физиологическую транс формацию". Как далеко заходит это сходство, мы пока не знаем. При нео пластической эволюции мутации ге нов регуляторных систем блокируют переход в оседлое состояние, клетка постоянно остается в миграционном состоянии независимо от получаемых ею сигналов.
Таким образом, морфологический фенотип опухолевой клетки норма лен, ненормальны лишь время и ме сто его экспрессии. Эти соображения позволяют наметить ряд направлений исследований. Так, необходимо выяс нить не просто природу трансформи рованного фенотипа, но молекуляр ную природу физиологических пере ходов между миграционным и осед лым состоянием клеток, а также при роду блоков перехода к оседлости, вы зываемых разными онкогенами. Очень важным, но совершенно еще не
изученным является выяснение связей между перестройками морфологиче ских состояний и дифференцировками стволовых клеток разных тканей. Природа и границы таких дифференцировок в последние годы изучаются очень активно, но здесь почти все еще не ясно. Ответы на все эти вопросы не получены, но можно надеяться, что основные вопросы уже сформулиро ваны верно.
Рекомендуемая литература
Альбертc Α., Брей Д., Льюис Р. и др. Моле кулярная биология клетки (в 3 т.): Пер. с англ. — М.: Мир, 1994.
Васильев Ю. М. Клетка как архитектурное чудо. — Ч. 2. Цитоскелет, способный чувствовать и помнить // Соросовск. образоват. журн. — 1996. — № 4. — С. 4-10.
Васильев Ю. М. Социальное поведение нормальных клеток и антисоциальное поведение опухолевых клеток. — Ч. 1. Сигнальные молекулы, вызывающие размножение и гибель клеток // Соро совск. образоват. журн. — 1997. — № 4. — С. 17-22.
Васильев Ю. М. Социальное поведение нормальных клеток и антисоциальное поведение опухолевых клеток. — Ч. 2. Клетки строят ткань // Соросовск. об разоват. журн. — 1997. — Т. 5. — С. 20-25.
Ровенский Ю. А. Клеточные и молекуляр ные механизмы опухолевой инвазии // Биохимия. — 1998. — Т. 63, вып. 9. — С. 1204-1221.
Ровенский Ю. А. Как клетки ориентируют ся на местности // Соросовск. образо ват. журн. — 2001. — Т. 3. — С. 4—11.
Г л а в а 8
ЭНДОГЕННЫЕ МОДУЛЯТОРЫ КАНЦЕРОГЕНЕЗА
Н.В. Мясищева, И. А. Кудрявцев
Впоследние годы происходит ин- и паракринные полипептидные фак
тенсивное накопление данных о |
роли |
торы роста, продукцию и секрецию |
|||||||||||||||||||
факторов, модифицирующих |
разные |
которых |
осуществляют |
клетки |
орга |
||||||||||||||||
этапы канцерогенеза. Эта |
многоас |
нов, находящиеся вблизи тканей-ми |
|||||||||||||||||||
пектная |
проблема |
включает |
|
изучение |
шеней, а также аутокринные факто |
||||||||||||||||
разнообразных факторов |
окружающей |
ры, вырабатываемые клеткой для сти |
|||||||||||||||||||
среды и эндогенных биологически ак |
муляции собственного роста. В меж |
||||||||||||||||||||
тивных |
веществ, |
способных |
значи |
клеточных |
взаимодействиях |
особая |
|||||||||||||||
тельно влиять на развитие злокачест |
роль |
принадлежит |
протеогликанам |
||||||||||||||||||
венных новообразований и их про |
внеклеточного |
|
матрикса, |
обеспечи |
|||||||||||||||||
грессию у животных и человека. По |
вающим |
|
направленность |
|
действия |
||||||||||||||||
нимание |
молекулярных |
механизмов |
факторов роста и цитокинов, т. е. вы |
||||||||||||||||||
их действия в организме определяет |
бор клетки мишени. |
|
|
|
|
|
|||||||||||||||
эффективность использования |
моду |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
ляторов канцерогенеза в профилакти |
|
8.1.1. |
|
Модулирующее |
|
|
|||||||||||||||
ке и лечении опухолей разного гисто |
|
|
|
|
|||||||||||||||||
|
влияние |
|
|
|
|
|
|
|
|
||||||||||||
генеза. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
гликозаминогликанов |
|
|
|
|||||||||||
В |
качестве эндогенных |
модулято |
|
|
|
|
|||||||||||||||
|
и |
протеогликанов |
|
|
|
||||||||||||||||
ров прежде всего заслуживают внима |
|
на |
гемопоэз |
|
|
|
|
|
|
||||||||||||
ния гормоны, витамины, полиненасы |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
щенные жирные кислоты и их мета |
|
Модулирующее |
действие |
гликоза |
|||||||||||||||||
болиты, факторы роста и различные |
миногликанов |
|
(ГАГ) |
и |
протеоглика |
||||||||||||||||
цитокины (хемокины), которые участ |
нов (ПГ) обусловлено их ролью в про |
||||||||||||||||||||
вуют в процессах роста и дифферен- |
цессах адгезии, инвазии и миграции |
||||||||||||||||||||
цировки клеток. Особую роль в про |
клеток, а также способностью взаимо |
||||||||||||||||||||
цессах опухолевого роста играют эн |
действовать |
со |
многими |
факторами |
|||||||||||||||||
догенные модуляторы двух классов — |
роста и хемокинами, главными регу |
||||||||||||||||||||
протеогликаны и метаболиты арахи- |
ляторами |
пролиферации |
нормальных |
||||||||||||||||||
доновой |
кислоты, |
которые |
вовлечены |
и опухолевых |
клеток. |
|
|
|
|
|
|||||||||||
во все ключевые стадии канцероге |
|
ГАГ и их конъюгаты с белками — |
|||||||||||||||||||
неза. |
|
|
|
|
|
|
|
ΠГ являются основными компонента |
|||||||||||||
|
|
|
|
|
|
|
|
ми |
внеклеточного |
матрикса |
костного |
||||||||||
8.1. Модулирующее влияние |
мозга |
человека |
наряду |
с |
различными |
||||||||||||||||
гликопротеинами |
(коллагенами, |
фиб- |
|||||||||||||||||||
гликозаминогликанов |
|
|
|||||||||||||||||||
|
|
ронектином, |
ламинином, |
|
тромбос- |
||||||||||||||||
и протеогликанов |
|
|
|
|
|
||||||||||||||||
|
|
|
|
пондином |
|
и др.). |
ГАГ |
продуцируют |
|||||||||||||
в процессах опухолевого |
|
||||||||||||||||||||
практически все типы клеток организ |
|||||||||||||||||||||
роста |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
ма. Они представляют собой линей |
||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
Активность многочисленных |
эндо |
ные полисахаридные цепи, состоящие |
|||||||||||||||||||
генных факторов в организме в из |
из |
повторов |
|
дисахаридных |
единиц |
||||||||||||||||
вестной |
степени |
определяет |
влияние |
гексозаминов |
|
и |
уроновой |
|
кислоты, |
||||||||||||
среды |
микроокружения, |
в |
|
которой |
ковалентно связанных с белком. На |
||||||||||||||||
действуют не только эндокринные, но |
личие |
большого числа |
карбоксильных |
||||||||||||||||||
415

С х е м а 8.1. Синтез гликозаминогликанов в кроветворных клетках и их модулирую
щее влияние на гемопоэз
и сульфатных групп в молекуле ГАГ |
рующего влияния ГАГ-ПГ на кло- |
|||||||||||||||
обусловливает высокую |
плотность их |
нальную пролиферацию клеток-пред |
||||||||||||||
отрицательного заряда и большую ре |
шественников гемопоэза и стромы ко |
|||||||||||||||
акционную |
способность при взаимо |
стного мозга является их способность |
||||||||||||||
действии |
с |
различными |
субстанция |
регулировать |
активность |
факторов |
||||||||||
ми. ΠГ участвуют в регуляции про |
роста и хемокинов, имеющих высо |
|||||||||||||||
цессов роста клеток благодаря присут |
кую аффинность к ГАГ или белковой |
|||||||||||||||
ствию в молекуле корового белка и |
части |
ПГ. |
ПГ действуют |
как |
резерву |
|||||||||||
связанных с ним цепей ГАГ. |
ар, |
представляя рецепторам |
клеток |
|||||||||||||
Основные классы ГАГ |
составляют: |
факторы роста и хемокины, связан |
||||||||||||||
хондроитин-4- и хондроитин-6-суль- |
ные с |
ГАГ (схема 8.1). |
|
|
|
|
|
|||||||||
фаты (Х-4-С и Х-6-С), дерматан- и |
|
|
|
|
|
|
|
|
|
|
||||||
гепарансульфаты (ГС), |
а |
также гепа |
8.1.1.1. Роль гепарансульфата |
|||||||||||||
рин и гиалуроновая |
кислота (ГК), не |
|||||||||||||||
в гемопоэзе |
|
|
|
|
|
|||||||||||
содержащая в своей структуре суль |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
фатных групп и не связанная с бел |
Особая роль в регуляции гемопоэза |
|||||||||||||||
ком. |
|
|
|
|
|
принадлежит ГС, который взаимодей |
||||||||||
ГАГ |
поверхностной . |
мембраны |
ствует с факторами роста, продуци |
|||||||||||||
стромальных |
клеток |
и |
внеклеточного |
руемыми |
стромой, |
связывая |
ГМ- |
|||||||||
матрикса |
участвуют |
в |
межклеточных |
К С Ф , |
IL-3 |
и являясь |
компонентом |
|||||||||
взаимодействиях со |
стволовыми клет |
рецепторов клетки к основному фак |
||||||||||||||
ками и клетками-предшественниками |
тору |
роста |
|
фибробластов (bFGF) |
и |
|||||||||||
гемопоэза, определяя их адгезию, ми |
T G F - β . ГС модулирует митогенную |
|||||||||||||||
грацию, пролиферацию и дифферен - |
активность |
факторов |
роста, |
изменяя |
||||||||||||
цировку. Важным моментом модули- |
их |
конформационные |
свойства |
для |
||||||||||||
4Ι6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
связывания со специфическими ре цепторами. ГС является также медиа тором адгезивных взаимодействий ранних клеток-предшественников ге мопоэза со стромой костного мозга. В процессах адгезии и миграции клеток центральная роль принадлежит интегринам — рецепторам клеток разного типа, которые взаимодействуют с мо лекулами внеклеточного матрикса. Лейкоцитарный интегрин Macl (CD11b/CD 18) и CD45, экспрессируемые на миелоидных клетках, регули руют их адгезию с элементами стромы благодаря специфическому распозна ванию ГС. Наряду с интегринами лей коцитов ГС поверхностной мембраны клеток является гетерофильным лигандом молекулы клеточной адгезии CD31, регулирующей эндотелиальнолейкоцитарное взаимодействие, что составляет необходимый этап при метастазировании опухолевых клеток.
8.1.1.2. Синтез и секреция ГАГ кроветворными клетками при лейкозах
Гемопоэтические клетки, включая стволовые и ранние клетки-предшест венники гемопоэза, синтезируют и секретируют ГАГ. Стимуляция клеток, их адгезия и фагоцитоз сопряжены с усилением синтеза и секреции ГАГ, которые взаимодействуют с элемента ми стромы. В последнее время полу чены принципиально новые данные о том, что ГАГ клеток крови действуют как медиаторы между клетками и эле ментами микроокружения костного мозга.
Изменения в содержании, структу ре и метаболической активности ГАГ клеток крови при миело- и лимфопролиферативных заболеваниях ассо циированы с нарушениями пролифе рации и дифференцировки лейкозных клеток. Для ГАГ лейкозных клеток крови человека характерны повышен ное их содержание, изменение анион ных свойств за счет степени сульфатирования основного компонента Х-4-С и увеличение доли ГС, что может вли-
ять на взаимодействие с белками и модифицировать их биологическую активность. При электрофоретическом анализе ГАГ, выделенных из гранулоцитов крови здорового челове ка и больных ХМ Л, обнаружены их существенные различия. В разной ста дии заболевания ХМЛ (хроническая фаза, акселерация и миелобластный криз) общее содержание ГАГ увеличе но в сравнении с нормой в 2—2,5 раза. При этом снижена степень сульфатирования основного компонента Х-4-С и изменен фракционный состав в результате существенного возраста ния в молекуле содержания ГС (до 50—60 % ) , которое в норме не превы шает 9 %. В межклеточных взаимо действиях с микроокружением важной особенностью лейкозных ГАГ являет ся отсутствие на плазматической мем бране Х-4-С негативного регулятора адгезии, который обнаруживается только на поверхности зрелых грану лоцитов крови здорового человека.
Способность ГАГ лейкозных кле ток модулировать клональную проли ферацию клеток-предшественников стромы костного мозга зависит от их структуры и анионных свойств. Толь ко сульфатированные фракции ГАГ с высоким содержанием ГС оказывали выраженный антипролиферативный эффект на колониеобразующую спо собность (КОС) фибробластов в монослойных культурах костного мозга. Наибольшим ингибирующим дейст вием обладали ГАГ, выделенные у больных ХМЛ в стадии акселерации и миелобластного криза, при воздейст вии которых торможение роста фиб робластов стромы костного мозга со ставляло свыше 60—70 % по отноше нию к контролю. Ингибирующее дей ствие низкосульфатированных ГАГ гранулоцитов больных ХМЛ и здоро вого человека на клональную проли ферацию клеток-предшественников стромы костного мозга было сущест венно ниже. Обнаруженное модули рующее влияние ГАГ клеток крови на клональную пролиферацию клетокпредшественников микрокружения
2 7 - 7 9 0 8 Д. Г. Заридз е |
417 |
составляет важный механизм регуля ции гемопоэтической функции кост ного мозга.
8.1.1.3. Модулирующее влияние ГАГ на митогенную активность bFGF
Модулирующая роль ГАГ лейкоз ных клеток человека включает также их влияние на митогенную активность мультифункционального фактора рос та фибробластов (bFGF), стимули рующего не только рост клеток гемо поэза и стромы, но и пролиферацию, дифференцировку и подвижность ши рокого спектра клеток. b F G F обладает двойной рецепторной системой, со держащей тирозинкиназу и ГС-ПГ. Связывание b F G F высокоаффинным сигнальным рецептором происходит только после его предварительного взаимодействия с ГС плазматической мембраны клеток и/или ГС-ПГ вне клеточного матрикса, необходимого для иммобилизации фактора роста и его представления эффекторным
клеткам |
в биологически активной |
форме. |
Митогенный эффект b F G F |
при этом реализуется путем трансдукции сигнальной системы для актива ции в клетке метаболизма АК.
В системе клонирования in vitro клеток-предшественников стромы ко стного мозга крысы b F G F проявлял высокую митогенную активность, од нако его стимулирующее влияние на рост фибробластов в монослойной культуре костного мозга существенно изменялось при комбинированном действии с ГАГ лейкозных клеток че
ловека. |
Наибольший модулирующий |
|
эффект |
на митогенную |
активность |
b F G F |
оказывали сульфатированные |
|
фракции ГАГ, выделенные |
у больных |
|
с миелобластным кризом и в стадии акселерации, содержащие преимуще ственно ГС. При этом ростстимулирующее влияние b F G F полностью от менялось и торможение роста КОЕ фибробластов в монослойных культу рах костного мозга составляло 75 % по отношению к контрольным культу
рам. Эти результаты являются прин ципиально новыми в понимании ме ханизма модулирующего влияния лей козных клеток крови человека на кло нальную пролиферацию клеток-пред шественников стромы костного мозга и митогенную активность b F G F .
8.1.2. Экспрессия ГАГ и ПГ опухолевыми клетками
Физиологическая роль ГС-ПГ в значительной мере выяснена лишь в последнее десятилетие, установлено их влияние в межклеточной адгезии, связывании клеток с лигандами вне клеточного матрикса и регуляции ак тивности факторов роста. На поверх ности клеток локализованы преиму щественно ПГ, содержащие цепи ГС. Выявлены два класса ГС-ПГ клеточ ной мембраны: белки, родственные синдекану-1 (СД-1) и белки типа глюпикана, заякоренные на мембране с помощью гликозилфосфатидилинозитола. Третье семейство мембраносвязанных ГС-ПГ составляет высокопо лиморфный CD44, или лимфоцитарный Homing-рецептор. ГС-ПГ базальной мембраны клеток представляет перлекан.
Большинство клеток экспрессирует разные формы ГС-ПГ, однако опухо левые клетки часто продуцируют недосульфатированные ГС на своей по верхности. При злокачественной трансформации и потере клеточной дифференцировки экспрессия ПГ из меняется. Так, в кератиноцитах и клетках шейки матки человека, в опу холях кожи мышей, индуцированных химическими канцерогенами и транс формированных онкогеном H-ras клетках эпителия молочных желез мышей, экспрессия СД-1 супрессирована. СД-1 является основным кле- точно-поверхностным ГС-ПГ, содер жит коровый белок с трансмембран ным, С-терминальным цитоплазматическим и N-терминальным экстракле точным доменами. Функциональная активность СД-1 в межклеточных взаимодействиях и связях с внекле-
418
точным матриксом обусловлена при сутствием цепи ГС на эктодомене, благодаря которому возможны ингибиция клеточной инвазии и супрессия роста опухолевых клеточных линий разного типа.
Отсутствие СД-1 на мембране мо жет способствовать миграции метастазирующих клеток, как это наблюдает ся при его сниженной экспрессии в гепатоцеллюлярной карциноме чело века с повышенным метастатическим потенциалом.
8.1.2.1. Экспрессия ГС-ПГ при опухолях легких человека
В опухолях легкого разного гистоге неза и в экстрактах клеточных линий рака легкого человека экспрессия ГС и ГС-ПГ, исследованная на гистологиче ских срезах ткани с использованием МкАТ против корового белка ПГ и ГС-специфических эпитопов, сущест венно различалась. В сравнении с нор мальным эпителием при немелкоклеточном раке легких, обычно низкодифференцированном, часто наблюда лось снижение экспрессии СД-1. При плоскоклеточном раке в клетках, кон тактирующих со стромой, и в менее дифференцированных участках опухо ли иммуногистохимическая реакция на ГС была слабо выражена. При снижен ной экспрессии СД-1 в клетках низкодифференцированной аденокарциномы выраженная реакция на ГС указы вала на структурные изменения цепей ГАГ в сравнении с клетками нормаль ного эпителия. Существенное сниже ние ГС-ПГ экспрессии в низкодифференцированных опухолях легких может индуцировать фенотипические особен ности опухолевых клеток и увеличение их инвазивности. В противополож ность этому присутствие CD-44 обна руживалось в опухолевых клетках неза висимо от степени их дифференцировки. Перлекан, ГС-ПГ базальной мем браны клеток нормального эпителия бронхов, практически отсутствовал при инвазивной бронхиальной карциноме, хотя его экспрессия была существенно
27*
повышена во внеклеточном матриксе метастазирующей меланомы, что ассо циировано с высокой инвазивностью этих клеток.
Эти результаты указывают на раз ное и, возможно, специфическое во влечение ПГ разного класса в опухо лях разного типа.
8.1.2.2. Экспрессия СД-1 при раке желудка
Различие экспрессии СД-1 в клет ках эпителия и стромы при аденокарциноме желудка человека выявило це лесообразность ее иммуногистохимического анализа у оперированных больных в качестве прогностического опухолевого маркера.
Снижение СД-1 в эпителии при раке желудка коррелировало с позд ней стадией заболевания, наличием метастазов и позитивной реакцией на СД-1 стромы. При высокой экспрес сии СД-1 в опухолевых клетках боль ные имели лучший прогноз, чем при его отсутствии в эпителии. Наоборот, высокое содержание СД-1 в строме являлось агрессивным злокачествен ным признаком и наблюдалось у больных с короткой продолжительно стью жизни.
Сниженная экспрессия СД-1 в опухолевых клетках и короткая про должительность жизни больных обна ружены также при других опухолях — при мезотелиоме, раке гортани, опу холях головы и шеи.
Как адгезивная молекула СД-1 способна супрессировать инвазию опухолевых клеток и рост опухоли, поэтому ее отсутствие в опухолевых клетках эпителия ассоциировано со снижением клеточной адгезии, дегра дацией базальной мембраны и появ лением экспрессии СД-1 в строме.
8.1.2.3.Экспрессия СД-44
вопухолевых клетках
В процессах миграции клеток и метастазирования существенное значе ние имеет молекула адгезии клеток —
419
трансмембранный |
|
|
протеогликан |
ли ГК. В настоящее время ведутся ин |
||||||||||||
СД-44, главным лигандом которого |
тенсивные исследования |
модулирую |
||||||||||||||
является ГК внеклеточного матрикса. |
щего |
влияния |
различных |
изоформ |
||||||||||||
СД-44 экспрессируется на многих ти |
СД-44 на процессы метастазирования. |
|||||||||||||||
пах клеток, включая нормальные. Не |
Таким образом, |
обнаруженные из |
||||||||||||||
которые типы клеток могут связывать |
менения в экспрессии ГС-ПГ в опу |
|||||||||||||||
ГК лишь после активации форболо- |
холях разного типа, ее снижение при |
|||||||||||||||
выми эфирами или цитокинами. Не |
низкодифференцированных вариантах |
|||||||||||||||
давно обнаружено, что реагенты, бло |
и структурные особенности цепей ГС |
|||||||||||||||
кирующие |
СД-44/ГК |
взаимодействие |
как рецептора |
белков |
внеклеточного |
|||||||||||
в процессах адгезии клеток, связыва |
матрикса |
оказывают |
модулирующее |
|||||||||||||
ние с гликопротеинами внеклеточного |
влияние на адгезивное и социальное |
|||||||||||||||
матрикса |
(коллагеном, |
фибронекти- |
поведение опухолевых |
клеток. |
|
|||||||||||
ном, ламинином и хондроитинсуль- |
|
|
|
|
|
|
|
|
|
|||||||
фатом), |
влияют на рост |
и |
метастази- |
8.1.2.4. Модулирующее |
|
|
||||||||||
рование |
опухоли. |
|
|
|
|
|
|
|||||||||
|
|
|
|
влияние ХС-ПГ при раке |
|
|||||||||||
Разнообразие функций СД-44 объ |
|
|||||||||||||||
простаты |
|
|
|
|
|
|
||||||||||
ясняется сложной структурой его изо- |
|
|
|
|
|
|
|
|
|
|||||||
форм в |
результате |
альтернативного |
При |
исследовании |
рака |
простаты |
||||||||||
сплайсинга более 10 экзонов, моди |
человека недавно обнаружен ΠГ дру |
|||||||||||||||
фикацией |
молекулы |
при |
включении |
гого класса, модулирующий рост опу |
||||||||||||
ГС или ХС и модулирующего влияния |
холевых |
клеток |
и |
лигандрецепторную |
||||||||||||
цитокинов (TNF-альфа и IFN-γ). |
функцию факторов роста. Ген ΤΕΝΒ2 |
|||||||||||||||
Варианты изоформ СД-44 широко |
кодирует трансмембранный ΠГ, содер |
|||||||||||||||
экспрессированы |
на |
эпителиальных |
жащий в молекуле EGF-домен, 2 до |
|||||||||||||
клетках, карциномах и некоторых ге- |
мена фоллистатина и хондроитин- |
|||||||||||||||
мопоэтических клетках. Данные о ре |
сульфат в цепях |
ГАГ. |
|
|
|
|
||||||||||
гуляции их экспрессии и функции |
При раке простаты возможны из |
|||||||||||||||
еще |
ограничены, |
однако |
определен |
менения путей воздействия паракрин- |
||||||||||||
ные варианты СД-44 связывают с по |
ных факторов роста на аутокринные |
|||||||||||||||
вышением |
метастатической активно |
факторы и их рецепторы, которые мо |
||||||||||||||
сти |
опухолей. Увеличение |
экспрессии |
гут быть up and down регулированы. |
|||||||||||||
СД-44 в тканях ассоциировано с про |
Система |
фолликулин/активин |
пред |
|||||||||||||
грессией |
опухоли, |
ее метастатическим |
ставляет |
новый |
регуляторный |
меха |
||||||||||
потенциалом. Экспрессия разных изо |
низм, |
недавно |
идентифицированный |
|||||||||||||
форм СД-44 обнаружена при раке мо |
в простате. Фоллистатин как мульти- |
|||||||||||||||
лочной железы, раке желудка, толсто |
функциональный |
регуляторный |
бе |
|||||||||||||
го кишечника и поджелудочной желе |
лок, |
необходимый |
для |
нормального |
||||||||||||
зы, меланоме и лимфомах человека. |
развития и обнаруженный в различ |
|||||||||||||||
Недавние исследования |
указывают |
ных тканях, действует путем связыва |
||||||||||||||
на |
корреляцию |
между |
|
углеводным |
ния и инактивации активина, члена |
|||||||||||
профилем СД-44 и метастатическим |
семейства T G F - β , имеющего важное |
|||||||||||||||
потенциалом опухоли. |
Модификация |
значение в канцерогенезе в качестве |
||||||||||||||
молекулы СД-44 при введении кера- |
аутокринного и |
паракринного регуля |
||||||||||||||
тансульфата |
изменяет |
ее |
адгезию с |
тора процессов пролиферации и диф- |
||||||||||||
ГК. Клон карциномы толстой кишки |
ференцировки клеток. |
|
|
|
|
|||||||||||
с большим содержанием кератансуль- |
Присутствие в молекуле ПГ ука |
|||||||||||||||
фата в СД-44 обладал высокой мета |
занных доменов определяет его актив |
|||||||||||||||
статической |
активностью, |
но слабо |
ную роль в регуляции сигналов фак |
|||||||||||||
связывал |
ГК внеклеточного матрикса, |
тора роста как предшественника — |
||||||||||||||
тогда как клетки с меньшим сульфа- |
лиганда мембраносвязанного рецепто |
|||||||||||||||
тированием молекулы СД-44 слабо |
ра либо белка, связывающего факторы |
|||||||||||||||
метастазировали, |
но хорошо связыва |
роста. |
|
|
|
|
|
|
|
|
||||||
420
Экспрессия mRNA TENB2 выявле |
входят в состав сложных липидов, |
||||||||||||||||||||||||
на при раке простаты и в значительно |
прежде всего фосфолипидов мембран, |
||||||||||||||||||||||||
меньшей степени при ее доброкачест |
из которых высвобождаются под воз |
||||||||||||||||||||||||
венных |
опухолях. |
|
Высокая |
тканевая |
действием |
химических, |
механических, |
||||||||||||||||||
специфичность |
и |
|
существенное уве |
термических и прочих стимулов. При |
|||||||||||||||||||||
личение экспрессии TENB2 |
ассоции |
этом ключевую роль в биосинтезе из |
|||||||||||||||||||||||
рованы с появлением андрогеннезави- |
вестных эйкозаноидов играет АК, об |
||||||||||||||||||||||||
симого фенотипа клеток и прогресси |
разующаяся |
эндогенно |
|
из |
линолевой |
||||||||||||||||||||
ей низкодифференцированных вари |
кислоты (схема 8.2). Наиболее изуче |
||||||||||||||||||||||||
антов опухолей |
простаты. |
|
|
ны |
два |
основных |
|
пути |
метаболизма |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
П Н Ж К , |
включая |
АК: |
|
циклооксиге- |
|||||||||||
8.2. Метаболиты каскада |
назный с образованием PG, тромбок- |
||||||||||||||||||||||||
арахидоновой кислоты |
санов (ТХ), простациклинов (PGI) и |
||||||||||||||||||||||||
как активные модуляторы |
липоксигеназный, |
ведущий |
к |
синтезу |
|||||||||||||||||||||
канцерогенеза |
|
|
|
лейкотриенов (LT), |
недавно открытых |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
липоксинов |
(LX), |
гепоксилинов |
(НХ) |
||||||||||||
Метаболиты |
высших |
|
полиненасы |
и триоксилинов (TRX), а также раз |
|||||||||||||||||||||
щенных жирных кислот ( П Н Ж К ) — |
личных гидрокси- и гидроперокси- |
||||||||||||||||||||||||
эйкозаноиды |
— |
представляют собой |
производных. |
|
|
|
|
|
|
|
|
|
|||||||||||||
мощную |
систему |
локальных |
химиче |
Циклооксигеназа |
(СОХ |
— |
более |
||||||||||||||||||
ских медиаторов с высокой биологи |
часто |
употребляемый |
|
термин) |
|
или |
|||||||||||||||||||
ческой активностью и широким спек |
простагландин-синтетаза (PHS) — |
||||||||||||||||||||||||
тром действия. Каскад арахидоновой |
микросомальный |
|
гемосодержащий |
||||||||||||||||||||||
кислоты (АК) является ключевым зве |
ферментный |
комплекс |
|
(ЕС |
1.14.99.1) |
||||||||||||||||||||
ном в биосинтезе известных эйкоза- |
с циклооксигеназной и пероксидаз- |
||||||||||||||||||||||||
ноидов и играет исключительно важ |
ной активностью. В настоящее время |
||||||||||||||||||||||||
ную роль на всех этапах канцерогене |
выявлены две изоформы СОХ (СОХ-1 |
||||||||||||||||||||||||
за, начиная от метаболической акти |
и СОХ-2), причем вторая форма чаще |
||||||||||||||||||||||||
вации |
химических канцерогенов, эф |
обнаруживается |
в |
|
стимулированных |
||||||||||||||||||||
фекта |
промоторов, |
экспрессии онко |
тканях. При участии СОХ окисление |
||||||||||||||||||||||
генов и иммуносупрессии до способ |
АК двумя молекулами кислорода при |
||||||||||||||||||||||||
ности |
метаболитов |
АК |
регулировать |
водит к присоединению пероксидного |
|||||||||||||||||||||
пролиферацию, |
апоптоз, |
дифферен- |
радикала |
в |
положения |
С9 и С П , |
об |
||||||||||||||||||
цировку |
и метастазирование |
опухоле |
разованию |
циклопентанового |
кольца |
||||||||||||||||||||
вых клеток. |
|
|
|
|
|
|
|
через С8 и С12 и введению гидропер- |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
оксигруппы в положение С15, которая |
|||||||||||||||
8.2.1. Биосинтез |
и общие |
затем |
редуцируется |
пероксидазой |
до |
||||||||||||||||||||
гидроксила. Эти два короткоживущих |
|||||||||||||||||||||||||
свойства |
эйкозаноидов |
||||||||||||||||||||||||
эндопероксидных |
|
интермедиата |
— |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Основным источником эйкозанои |
PGG 2 |
и PGH2 , различающихся между |
|||||||||||||||||||||||
собой |
наличием |
в |
положении |
|
С15 |
||||||||||||||||||||
дов, содержащих |
в |
своей |
химической |
|
|||||||||||||||||||||
гидроперокси- |
либо |
гидроксигруппы, |
|||||||||||||||||||||||
структуре |
20 углеродных атомов, явля |
||||||||||||||||||||||||
при |
участии |
различных |
изомераз и |
||||||||||||||||||||||
ются незаменимые линолевая и а-ли- |
|||||||||||||||||||||||||
синтаз |
|
превращаются |
|
в |
первичные |
||||||||||||||||||||
ноленовая |
кислоты, |
содержащиеся |
|
|
|||||||||||||||||||||
циклооксигеназные |
метаболиты |
|
или |
||||||||||||||||||||||
преимущественно |
|
в |
растительных |
|
|||||||||||||||||||||
|
простаноиды: |
|
PGE2 , |
PGD 2 , |
PGF2 a , |
||||||||||||||||||||
маслах. В свободном виде в организме |
|
||||||||||||||||||||||||
тромбоксан А2 |
(ТХА2) и простациклин |
||||||||||||||||||||||||
прямые предшественники эйкозанои |
|||||||||||||||||||||||||
(PGI2). |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
дов — эйкоза-8,11,14-триеновая (ди- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
гомо-у-линоленовая), |
эйкоза-5,8,11, |
Липоксигеназы |
|
|
(LOX; |
|
|
ЕС |
|||||||||||||||||
14-тетраеновая (АК) и эйкоза-5,8,11, |
1.13.11.12) относятся к семейству же |
||||||||||||||||||||||||
14,17-пентаеновая (тимнодоновая) ки |
лезосодержащих диоксигеназ, |
для |
ко |
||||||||||||||||||||||
слоты содержатся в крайне незначи |
торых, как и СОХ, наиболее важным |
||||||||||||||||||||||||
тельном |
количестве. В |
основном они |
субстратом |
в |
организме |
млекопитаю- |
|||||||||||||||||||
421

С х е м а 8.2. Образование эйкозаноидов из незаменимых полиненасыщенных
жирных кислот
щих является АК. Основными фер ментами этой группы являются 5-, 12-
и15-LOX, с их участием окисление
АК одной молекулой кислорода ведет к образованию 5-, 12или 15-гидро- пероксиэйкозатетраеновой кислоты (НРЕТЕ), которая затем превращается в соответствующую моногидроксиэйкозатетраеновую кислоту (НЕТЕ) . По мимо этого, 5-НРЕТЕ является важ ным интермедидтом для синтеза LT, а двойная — 5- и 15-липоксигеназная — активность необходима для продук ции LX. В то же время 12-НРЕТЕ слу жит предшественником в биосинтезе НХ, однако имеются данные о важной роли 12-LOX и в биосинтезе LX и LT.
Эйкозаноиды синтезируются лю бой клеткой, однако для каждого вида клеток характерен свой определенный спектр метаболитов П Н Ж К , в частно сти АК. Так, основными циклооксигеназными метаболитами АК в парен химатозных клетках являются PGE 2 и PGF2 a , в клетках эндотелия — PGI2 , тромбоцитах — ТХА2. Макрофаги спо собны продуцировать все перечислен
ные простаноиды, а такие липоксигеназные продукты АК, как LT и LX, синтезируются кроветворными и сокультивируемыми с ними клетками.
Эйкозаноиды — лабильные эндо генные вещества (продолжительность жизни некоторых из них — секунды) с активностью на порядок выше, чем у гистамина, и обладающие широким спектром действия. Действие эйкоза ноидов включает поддержание нор мального уровня физиологических процессов в организме, модулирова ние активности других регуляторных механизмов, а также медиаторные функции при воздействии на клетки других биологически активных ве ществ. Уникальные свойства эйкоза ноидов как мощной регулирующей системы в организме в полной мере проявляются и при развитии патоло гических процессов. Эйкозаноиды имеют важное патофизиологическое значение в воспалении и аллергиче ских реакциях, вовлечены в патогенез многих заболеваний, включая злока чественные опухоли.
422
8.2.2. Роль каскада арахидоновой кислоты в инициации и промоции
опухолей, индуцированных химическими канцерогенами
Метаболизм многих химических канцерогенов сопряжен с биосинте зом циклооксигеназных метаболитов АК. Как и система цитохрома Р450, СОХ, или PHS, относится к фермен там, катализирующим I фазу метабо лической активации химических кан церогенов, и в ряде случаев не только не уступает цитохрому Р450 в этой ак тивности, но и превосходит его. В ча стности, высокая способность СОХ активировать канцерогены выявлена в микросомах семенных пузырьков ба рана, переходного эпителия мочевого пузыря и сосочкового слоя почек со баки, легких морской свинки, почек кролика. В процессе превращения АК в циклооксигеназные метаболиты могут кооксигенировать in vitro до активных форм такие канцерогены, как 2-нафтиламин, 4-аминобифенил, бенз(а)пирен, бензидин, о-дианизи- дин, диэтилстильбэстрол, фенацетин, нитрофураны, афлатоксины и многие другие. Высокий уровень АК-зависи- мой метаболической активации ряда ароматических аминов обнаружен и в микросомальных препаратах различ ных нормальных тканей человека, включая эпителий мочевого пузыря и простаты, ткань легкого. Эта актив ность в значительной степени подав ляется ингибитором СОХ — индометацином (ИМ) . В опытах на перфузированных животных показано также, что подобная конверсия химических канцерогенов с вовлечением СОХ имеет место и in vivo.
Метаболизм АК в значительной степени взаимосвязан и с действием опухолевых промоторов. Установле но, что одним из плейотропных био химических ответов на опухолепромотирующее действие форболовых эфиров является синтез P G . При этом существует значительная корре ляция между потенцией веществ как
опухолевых промоторов и их способ ностью индуцировать клеточный ме таболизм АК. ТФА (12-О-тетрадека- ноилфорбол-13-ацетат) и другие фор - боловые эфиры, представляющие со бой сильные промоторы, проявляют себя и как чрезвычайно активные
индукторы |
синтеза P G , в то время |
как их |
опухоленепромотирующие |
аналоги (в частности, 4альфа-форбол- 12,13-дидеканоат) не стимулируют высвобождение АК из фосфолипидов мембран и последующий биосинтез P G . Очень высокий уровень биосин теза простаноидов наблюдается и при воздействии промоторов не ТФА-ти- па, таких как тапсигаргин и особенно палитоксин, стимулирующий эффект которого достигает 3000 % по сравне нию с контролем. При этом следует отметить синергизм PG-индуцирую- щего действия палитоксина с форболовыми эфирами и многими факто рами роста ( E G F , TGF-альфа, T G F - β ) . Усиление продукции PG в зависимо сти от дозы промоторов и времени их действия четко показано в коже мы шей in vivo, а также в клетках разного типа, включая клетки эпидермиса мыши и морской свинки, фибробласты человека, клетки почек собаки и т. д. Увеличение биосинтеза не толь ко простаноидов, но и липоксигеназ-
ных (LTB4, 12-НЕТЕ) |
метаболитов |
|
АК под |
воздействием |
тапсигаргина |
выявлено |
в перитонеальных макро |
|
фагах крысы, усиление липоксигенации отмечено также при действии ТФА в лейкемических клетках чело века линии К-562.
С учетом сопряженности метабо лизма АК с метаболической актива цией химических канцерогенов и эф фектом промоторов очень важное значение имеет оценка модулирую щего влияния эйкозаноидов, их предшественников и ингибиторов синтеза на процессы инициации и промоции индуцированных опухо лей. Особое внимание среди различ ных модуляторов метаболизма АК уделяется ингибиторам СОХ, кото рыми являются практически все не-
423
стероидные противовоспалительные |
8.2.3. |
|
Взаимодействие |
|
||||||||||||||||||||||
препараты ( Н С П В П ) . В большей час |
эйкозаноидов |
с онкогенами |
||||||||||||||||||||||||
ти исследований указывается на зна |
и |
другими |
эндогенными |
|
||||||||||||||||||||||
чительное торможение |
ингибиторами |
факторами |
|
|
|
|
|
|
||||||||||||||||||
СОХ |
химического |
канцерогенеза |
в |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
различных органах и тканях экспери |
Исследования |
последних |
|
лет |
ука |
|||||||||||||||||||||
ментальных животных, |
однако |
име |
зывают |
на |
значительную |
индукцию |
||||||||||||||||||||
ются данные и об отсутствии эффек |
цитозольной фосфолипазы А2, СОХ-2 |
|||||||||||||||||||||||||
та |
Н С П В П |
или |
его противополож |
и |
как |
следствие |
усиление |
синтеза |
||||||||||||||||||
ной |
|
направленности |
на |
|
некоторых |
PGE2 онкогенами src и ras в транс |
||||||||||||||||||||
моделях. |
|
|
|
|
|
|
|
|
|
|
|
формированных |
и |
опухолевых клетках |
||||||||||||
Ингибирующее |
действие |
на |
инду |
человека и животных. Вместе с тем |
||||||||||||||||||||||
цированные |
опухоли |
животных |
про |
имеются данные об индукции АК и |
||||||||||||||||||||||
являют |
многие |
Н С П В П , |
|
включая |
различными |
простаноидами |
|
генов |
||||||||||||||||||
И М , |
аспирин, |
меклофенамовую ки |
раннего ответа — c-fos, Egr-1, c-jun, |
|||||||||||||||||||||||
слоту, ибупрофен. В частности, ИМ в |
jun-B и др. |
|
|
|
|
|
|
|
|
|||||||||||||||||
значительной |
|
степени |
ингибирует |
СОХ-2 в отличие от СОХ-1 значи |
||||||||||||||||||||||
развитие |
доброкачественных и злока |
тельно экспрессируется в таких опу |
||||||||||||||||||||||||
чественных опухолей |
молочной |
желе |
холях человека, как карцинома ки |
|||||||||||||||||||||||
зы, |
индуцированных Д М Б А у |
крыс |
с |
шечника, |
плоскоклеточный |
|
рак пи |
|||||||||||||||||||
содержанием на нормальной и высо |
щевода, рак кожи. Помимо онкогенов |
|||||||||||||||||||||||||
кожировой диете. Выраженный анти |
ras и src, высокой способностью инду |
|||||||||||||||||||||||||
канцерогенный эффект ИМ у крыс |
цировать СОХ-2 обладают бенз(а)пи- |
|||||||||||||||||||||||||
также характерен для опухолей тол |
рен, |
ультрафиолетовые |
лучи, |
Helico |
||||||||||||||||||||||
стой кишки, индуцированных Ν - ме- |
bacter |
pylori, |
гипоксия, |
IL-1, |
E G F , |
|||||||||||||||||||||
тил-N-нитрозомочевиной или 1,2-ди- |
T G F - β , |
T N F - α и другие факторы. Ак |
||||||||||||||||||||||||
метилгидразином, |
опухолей |
пищевода |
тивность СОХ-2 значительно повыше |
|||||||||||||||||||||||
и преджелудка, |
индуцированных |
эти |
на при аденоматозном полипозе тол |
|||||||||||||||||||||||
ловым эфиром Ν-нитрозосаркозина, |
стой кишки вследствие мутации гена |
|||||||||||||||||||||||||
опухолей головного мозга и перифе |
АРС. Супрессивное действие на СОХ- |
|||||||||||||||||||||||||
рической |
нервной |
системы, |
индуци |
2 оказывают дексаметазон, антиокси- |
||||||||||||||||||||||
рованных N-этил-N-нитрозомочеви- |
данты, белок р53. СОХ-2, опосредо |
|||||||||||||||||||||||||
ной и т. д. Вместе с тем не обнаруже |
ванный PGE2 , стимулирует экспрес |
|||||||||||||||||||||||||
но ингибирующего эффекта ИМ при |
сию bcl-2, ингибирует апоптоз, инду |
|||||||||||||||||||||||||
индукции N-этил-N-нитрозомочеви- |
цирует продукцию IL-6. Активация |
|||||||||||||||||||||||||
ной опухолей почек или при индук |
СОХ-2 повышает экспрессию ряда |
|||||||||||||||||||||||||
ции |
|
бенз(а)пиреном |
низкодифферен- |
факторов роста: P D G F , b F G F , VEGF . |
||||||||||||||||||||||
цированных сарком. Разнонаправлен |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
ное |
|
действие |
на развитие |
индуциро |
8.2.4. |
Роль |
метаболитов |
|||||||||||||||||||
ванных опухолей |
разного |
гистогенеза |
||||||||||||||||||||||||
арахидоновой |
кислоты |
|
||||||||||||||||||||||||
выявлено |
и |
у |
других |
|
ингибиторов |
|
||||||||||||||||||||
|
в |
|
иммуносупрессии |
|
|
|
||||||||||||||||||||
СОХ. Так, аспирин, более чем в 2 раза |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
угнетающий |
частоту |
развития |
рака |
Опухолеассоциированные PG, пре |
||||||||||||||||||||||
мочевого |
пузыря |
крысы, |
|
индуциро |
||||||||||||||||||||||
|
жде |
всего |
PGE2, |
который в |
большом |
|||||||||||||||||||||
ванного |
производными |
5-нитрофура- |
||||||||||||||||||||||||
количестве определяется |
в опухолевой |
|||||||||||||||||||||||||
на, |
вызывает у 26 % животных разви |
|||||||||||||||||||||||||
ткани, в значительной степени подав |
||||||||||||||||||||||||||
тие |
|
опухолей |
преджелудка, |
которые |
||||||||||||||||||||||
|
ляют |
как гуморальный, |
так |
и |
клеточ |
|||||||||||||||||||||
не |
возникают |
при |
действии |
одного |
||||||||||||||||||||||
ный |
иммунные |
ответы. |
В частности, |
|||||||||||||||||||||||
канцерогена. |
Важно |
отметить, |
что |
|||||||||||||||||||||||
PGE2 |
угнетает ответ Т-лимфоцитов на |
|||||||||||||||||||||||||
значительное |
торможение |
канцероге |
||||||||||||||||||||||||
опухолевые |
|
антигены, |
супрессирует |
|||||||||||||||||||||||
неза |
кожи достигается |
при |
торможе |
|
||||||||||||||||||||||
митогениндуцированную |
пролифера |
|||||||||||||||||||||||||
нии другого — липоксигеназного пути |
||||||||||||||||||||||||||
цию |
Т-клеток, |
депрессирует |
актив |
|||||||||||||||||||||||
метаболизма |
АК. |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
ность |
|
ΝΚ-клеток, |
угнетает |
цитоток- |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
424 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сичность макрофагов. В механизме |
стности, |
значительное |
|
содержание |
|||||||||||||||||
иммуносупрессивного |
действия |
PGE2 |
этого |
простаноида |
и |
выраженный |
|||||||||||||||
важный |
элемент |
составляет |
наруше |
противоопухолевый |
эффект |
ИМ |
на |
||||||||||||||
ние |
баланса |
цитокинов |
вследствие |
блюдаются |
в |
перевиваемых |
опухолях |
||||||||||||||
значительного усиления секреции IL- |
легкого, молочной железы и подче |
||||||||||||||||||||
10 макрофагами и лимфоцитами и од |
люстной слюнной железы. Низкий |
||||||||||||||||||||
новременного торможения продукции |
уровень |
синтеза циклооксигеназных |
|||||||||||||||||||
IL-12 в макрофагах. |
|
|
|
|
|
метаболитов АК и слабое торможе |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
ние роста опухоли ингибитором СОХ |
||||||||||
8.2.5. |
Роль различных |
|
|
выявлены у животных с гемобласто- |
|||||||||||||||||
эйкозаноидов |
в контроле |
зами, |
гепатомами, |
меланомами, |
ра |
||||||||||||||||
роста |
опухолевых клеток |
ком кожи. |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Ростлимитирующие свойства PGE2 |
||||||||||
Роль |
отдельных |
эйкозаноидов в |
характерны для многих линий опухо |
||||||||||||||||||
контроле |
роста |
опухолевых |
|
клеток |
левых клеток животных и человека, |
||||||||||||||||
окончательно не определена. В зна |
однако в последнее время появляются |
||||||||||||||||||||
чительной |
степени |
это |
обусловлено |
данные о важном значении для роста |
|||||||||||||||||
противоречивыми |
данными |
о |
влия |
некоторых |
линий опухолевых клеток |
||||||||||||||||
нии различных PG и ингибиторов их |
и липоксигеназных метаболитов АК — |
||||||||||||||||||||
синтеза на рост перевиваемых опухо |
5-НЕТЕ и 12-НЕТЕ. В частности, |
||||||||||||||||||||
лей разного гистогенеза у экспери |
рост клеток рака простаты человека в |
||||||||||||||||||||
ментальных животных, а также их |
значительной |
степени |
стимулируется |
||||||||||||||||||
неоднозначном действии на опухоле |
5-НЕТЕ, а ингибиторы 5-LOX суще |
||||||||||||||||||||
вые клетки разных линий . Наряду с |
ственно подавляют его и индуцируют |
||||||||||||||||||||
этим установлено, что рост опухоле |
апоптоз. Следует отметить, что высо |
||||||||||||||||||||
вых клеток разного типа может ли |
кую активность в индукции апоптоза |
||||||||||||||||||||
митироваться |
содержанием |
разных |
проявляют и ингибиторы 12-LOX и |
||||||||||||||||||
эйкозаноидов. Не менее важной при |
СОХ-2. |
|
|
|
|
|
|
|
|
||||||||||||
чиной, |
препятствующей |
выяснению |
При изучении действия экзоген |
||||||||||||||||||
роли метаболитов АК в процессах |
ных PG на рост опухолевых клеток in |
||||||||||||||||||||
роста опухолевых клеток, является и |
vivo и in vitro выявлен их как стиму |
||||||||||||||||||||
способность отдельных эйкозаноидов |
лирующий, так и ингибирующий эф |
||||||||||||||||||||
существенно влиять на биосинтез и |
фект в зависимости от гистогенеза |
||||||||||||||||||||
функциональную |
|
активность |
друг |
клеток. Это характерно и для основ |
|||||||||||||||||
друга. |
|
|
|
|
|
|
|
|
|
|
ного |
циклооксигеназного метаболита |
|||||||||
Бурное развитие радиохроматограАК — PGE2 , который часто проявля |
|||||||||||||||||||||
фической |
техники |
в |
исследовании |
ет стимулирующие свойства на эпи |
|||||||||||||||||
эйкозаноидов позволяет в определен |
телиальных |
опухолевых |
клетках, |
но |
|||||||||||||||||
ной степени решать эти проблемы. В |
значительно |
тормозит, |
в |
частности, |
|||||||||||||||||
настоящее |
время |
|
получены |
доказа |
рост многих лейкозных клеток жи |
||||||||||||||||
тельства того, что опухолевые клетки |
вотных и человека. Важно отметить, |
||||||||||||||||||||
и ткани разного гистогенеза сущест |
что |
противоопухолевый |
эффект |
раз |
|||||||||||||||||
венно различаются между собой про |
личных |
PG |
обеспечивается |
разными |
|||||||||||||||||
филем |
синтезируемых |
метаболитов |
механизмами. Так, PGD 2 , значитель |
||||||||||||||||||
АК. При сравнительном анализе ро- |
но |
подавляющий |
рост |
лейкозных |
|||||||||||||||||
стмодулирующего действия PG и их |
клеток, включая линии L-1210 и |
||||||||||||||||||||
ингибиторов с профилем синтезируе |
К562, клеток HR рака яичника, кле |
||||||||||||||||||||
мых |
эйкозаноидов |
в |
перевиваемых |
ток нейробластомы |
N C G |
и др., |
ока |
||||||||||||||
опухолях разного типа у мышей раз |
зывает |
прямое цитотоксическое дей |
|||||||||||||||||||
ных линий обнаружено, что эффек |
ствие на злокачественные клетки с |
||||||||||||||||||||
тивность ингибиторов СОХ в тормо |
торможением |
синтеза Д Н К , |
Р Н К и |
||||||||||||||||||
жении роста опухоли зависит от ин |
белка. В то же время PGA, и PGA2 не |
||||||||||||||||||||
тенсивности биосинтеза PGE2 . В ча |
проявляют |
прямого |
цитотоксическо- |
||||||||||||||||||
425
го действия, однако полностью бло |
8.2.7. Роль различных |
|
|
|
||||||||||||||||||||
кируют |
пролиферацию |
опухолевых |
метаболитов |
|
арахидоновой |
|||||||||||||||||||
клеток |
с |
восстанавлением |
ростового |
кислоты |
|
|
|
|
|
|
|
|
|
|||||||||||
потенциала клеток при удалении PG |
в |
|
метастазировании |
|
|
|
||||||||||||||||||
из культуральной |
среды. |
|
|
опухолевых |
|
клеток |
|
|
|
|
||||||||||||||
Роль |
липоксигеназных |
метаболи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
тов АК, прежде всего различных мо- |
О вовлечении эйкозаноидов в про |
|||||||||||||||||||||||
но-НЕТЕ, в процессах роста опухоле |
цессы |
метастазирования |
опухолевых |
|||||||||||||||||||||
вых клеток изучена недостаточно. В |
клеток |
свидетельствуют |
многочислен |
|||||||||||||||||||||
основном |
проведенными |
исследова |
ные факты. Показано, что клеточные |
|||||||||||||||||||||
ниями |
выявлено |
стимулирующее |
линии рака молочной железы мышей, |
|||||||||||||||||||||
влияние 5-НЕТЕ и 12-НЕТЕ на рост |
продуцирующие |
большее |
количество |
|||||||||||||||||||||
некоторых |
линий |
опухолевых |
клеток |
PGE2 , обладают более высоким мета |
||||||||||||||||||||
человека. Вместе с тем в последнее |
статическим потенциалом. Наряду с |
|||||||||||||||||||||||
время получены данные о негативной |
этим имеются данные о более высо |
|||||||||||||||||||||||
регуляции РGЕ2 -зависимой пролифе |
кой |
метастазирующей |
способности |
|||||||||||||||||||||
рации в PG-синтезирующих нормаль |
подлинии меланомы В-16, которая |
|||||||||||||||||||||||
ных и опухолевых клетках одним из |
синтезирует |
меньшее |
количество |
|||||||||||||||||||||
основных липоксигеназных |
метаболи |
PGD2 . В середине 80-х годов Honn и |
||||||||||||||||||||||
тов АК — 15-НЕТЕ. Учитывая значи |
соавт. предложили гипотезу о том, что |
|||||||||||||||||||||||
тельное влияние на одну из изоформ |
опухолевые |
клетки |
могут |
изменять |
||||||||||||||||||||
15-LOX ингибиторов СОХ-2, угне |
критический баланс TXA2/PGI2, при |
|||||||||||||||||||||||
тающих |
пролиферацию |
и индуцирую |
водя к агрегации тромбоцитов, благо |
|||||||||||||||||||||
щих |
апоптоз |
в опухолевых |
клетках, |
приятствующей |
|
метастазированию |
||||||||||||||||||
это направление исследований, по- |
опухоли. С данной гипотезой хорошо |
|||||||||||||||||||||||
видимому, станет одним из наиболее |
согласуется факт, что наиболее выра |
|||||||||||||||||||||||
важных при изучении роли отдельных |
женным |
антиметастатическим |
свойст |
|||||||||||||||||||||
эйкозаноидов каскада АК в контроле |
вом обладают PGI2 и P G D 2 — самые |
|||||||||||||||||||||||
роста опухолевых клеток и механизме |
эффективные |
ингибиторы |
агрегации |
|||||||||||||||||||||
апоптоза. |
|
|
|
|
|
|
|
тромбоцитов среди метаболитов АК. |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
Получены |
|
данные |
о |
стимулирующем |
||||||||||
8.2.6. |
Влияние |
эйкозаноидов |
влиянии |
PGE2 |
на |
|
метастазирование |
|||||||||||||||||
карциномы |
легкого |
3LL in |
vivo |
и |
на |
|||||||||||||||||||
на |
дифференцировку |
|
||||||||||||||||||||||
|
модели |
диссеминирования |
опухоле |
|||||||||||||||||||||
опухолевых |
клеток |
|
|
|||||||||||||||||||||
|
|
вых клеток in vitro. Предполагается, |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Влияние эйкозаноидов, преимуще |
что |
опухолеассоциированный |
|
PGE2 |
||||||||||||||||||||
является важным |
звеном в |
метастати |
||||||||||||||||||||||
ственно |
PG, |
на |
дифференцировку |
|||||||||||||||||||||
ческом |
процессе, |
способствует |
диссе- |
|||||||||||||||||||||
опухолевых |
клеток |
подробно |
изучено |
|||||||||||||||||||||
минации |
опухолевых |
клеток |
и |
уста |
||||||||||||||||||||
на многих клеточных линиях человека |
||||||||||||||||||||||||
новлению |
|
метастазов |
двумя |
путями: |
||||||||||||||||||||
и животных, включая |
клетки |
лейкоза |
|
|||||||||||||||||||||
повышением |
миграционных |
способ |
||||||||||||||||||||||
Френд, |
клетки |
К562, |
HL-60, |
U-937, |
||||||||||||||||||||
ностей опухолевых клеток и |
супресси |
|||||||||||||||||||||||
клетки |
нейробластомы |
мышей и др. |
||||||||||||||||||||||
ей противоопухолевой |
иммунной |
за |
||||||||||||||||||||||
Эти |
свойства |
наиболее |
выражены у |
|||||||||||||||||||||
щиты. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
PG типа А. В частности, при воздей |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
ствии PGA2 достигают дифференци- |
Исследования |
|
последних |
лет |
в |
|||||||||||||||||||
ровки свыше 90 % клеток нейробла |
этой |
области |
выявили |
активную роль |
||||||||||||||||||||
стомы NBP2. Меньшую активность в |
в процессах адгезии, инвазии и мигра |
|||||||||||||||||||||||
индукции дифференцировки опухоле |
ции опухолевых клеток ряда липокси |
|||||||||||||||||||||||
вых клеток проявляют P G E , и PGE2 . |
геназных |
|
метаболитов |
АК, |
прежде |
|||||||||||||||||||
Важно отметить, что PG типа А обла |
всего 12-НЕТЕ. К важным свойствам |
|||||||||||||||||||||||
дают и более выраженным стимули |
этого |
эйкозаноида |
относится |
взаимо |
||||||||||||||||||||
рующим |
|
влиянием |
на |
продукцию |
действие с интегринами и факторами |
|||||||||||||||||||
цАМФ в клетках. |
|
|
|
|
|
роста, влияние на ангиогенез, |
ретрак- |
|||||||||||||||||
426
цию, пролиферацию и миграцию эн - дотелиальных клеток. При исследова нии особенностей биосинтеза метабо литов [14С]АК в опухолях с разным метастатическим потенциалом у жи вотных и человека установлено, что в метастазирующих опухолях значитель но снижена способность к биосинтезу основных липоксигеназных метаболи тов АК — 12- и 15-НЕТЕ. Вовлечен ность обоих путей метаболизма АК в метастазирование опухолей является важной предпосылкой для детального изучения участия отдельных эйкоза ноидов в метастатическом процессе.
** *
Всложный многоступенчатый про цесс злокачественного роста вовлече ны механизмы, включающие измене ния экспрессии клеточных генов, продукции цитокинов и экспрессии их рецепторов, нарушения сигналь ных внутриклеточных систем. В усло виях мультифакторной регуляции этих процессов особенно важна роль эндо генных модуляторов канцерогенеза — ПГ внеклеточного матрикса и эйкоза ноидов каскада АК, контролирующих адгезию, инвазию, миграцию опухоле вых клеток и способных взаимодейст вовать со многими факторами роста и цитокинами. В реализации митогенного влияния различных факторов роста центральное звено составляет трансдукция сигнальной системы, обеспечивающей в клетках активацию метаболизма АК. С высоким уровнем экспрессии СОХ-2 сопряжены такие процессы, как активация онкогенов и инактивация генов-супрессоров, пре вращение проканцерогенов в канце рогены, эффект промоторов, тормо жение апоптоза, усиление ангиогенеза, иммуносупрессия.
Рекомендуемая литература |
|
|
Голенко O.D., Батрак Ε. Е., |
Харченко |
|
Μ. Ф., Мясищева Н. В. Модулирующее |
||
влияние |
гликозаминогликанов |
лейке- |
мических |
клеток крови человека на |
|
клональную пролиферацию клетокпредшественников микроокружения костного мозга // Экспер. онкол. — 1996. - Т. 18, № 2. - С. 30-36.
Кудрявцев И. Α., Голенко O.D., Гудкова М. В., Мясищева Н. В. Метаболизм ара хидоновой кислоты в контроле роста клеток А549 аденокарциномы легкого человека // Биохимия. — 2002. — Т. 67, № 9. - С. 1233-1240.
Кудрявцев И. Α., Полоцкий Б. Е., Мачаладзе 3. О. и др. Особенности биосинтеза ме таболитов С14-арахидоновой кислоты в
метастазирующих опухолях |
// Докл. |
Акад. наук. — 1996. — Т. 346, № 6. — |
|
С. 822-824. |
|
Мясищева Н. В., Голенко O.D., |
Кудрявцев |
И. А. и др. Модулирующее влияние ге- |
|
парансульфата лейкозных клеток крови |
|
человека на митогенную |
активность |
основного фактора роста фибробластов |
|
и метаболизм С14-арахидоновой ки |
|
слоты в культуре фибробластов стромы |
|
костного мозга крысы // Экспер. он кол. - 1999. - Т. 21. - С. 255-259.
Фрейдлин И. С. Паракринные и аутокринные механизмы цитокиновой иммунорегуляции // Иммунол. — 2001. — № 5. - С. 4-7.
Харченко Μ. Ф., Рыбакова Л. П., Голенко
О.Д. и др. Роль гликозаминогликанов
ипротеогликанов в гемопоэзе и физио логических функциях клеток крови // Физиол. журн. — 1996. — Т. 82, № 5— 6. - С. 18-25.
Calabro L., Musolino С, Spateri G. et al. In creased concentration of circulating acid glycosaminoglycans in chronic lym phocytic leukaemia and essential thrombocythaemia // Clin. Chimica Acta. — 1998. - Vol. 269. - P. 185-199.
Chen Y., Hughes-Fulford M. Prostaglandin E2 and the protein kinase A pathway mediate arachidonic acid induction of c-fos in hu man prostate cancer cells // Brit. J. Can cer. - 2000. - Vol. 82. - P. 2000-2006.
Dempke W., Rie C, Grothey Α., Schmoll H. J.
Cyclooxygenase-2: a novel target for can cer chemoterapy? // J. Cancer Res. Clin. Oncol. - 2000. - Vol. 127. - P. 411.
Fosslien E. Molecular pathology of cyclooxy genase-2 in neoplasia // Ann. Clin. Lab. Sci. - 2000. - Vol. 30. - P. 3-21.
Glynne-Jones E., Happer Μ. E., Seery I. T. et al. TENB2, a proteoglycan identified in prostate cancer that is accociated with dis ease progression and androgen independ ence // Int. J. Cancer. — 2001. — Vol. 94. - P. 178-184.
Huang Μ., Stolina Μ., Sharma S. et al. Nonsmall cell lung cancer cyclooxygenase-2- dependent regulation of cytokine balance in lymphocytes and macrophages: up-regula- tion of interleukin 10 and down-regulation of interleukin 12 production // Cancer Res. - 1998. - Vol. 58. - P. 1208-1216.
Levy G. N. Prostaglandin Η synthases, nons teroidal anti-inflammatory drugs, and co lon cancer // FAS Ε В J. — 1997. - Vol. 11. - P. 234-247.
Nackaerts K., Verbeken E., Deneffe G. et al.
Heparan sulfate proteoglycan expression in
human lung cancer cells // Int. J. Cancer
(Pred. Oncol.). - 1997. |
- Vol. 74. - |
P. 335-345. |
|
Tsuji S., Tsujii M., Kawano S., |
Hori M. Cy- |
clooxygenase-2 upregulation as a perigenic change in carcinogenesis // J. Exp. Clin. Cancer Res. - 2001. - Vol. 20, N 1. - P. 117-129.
Wiksten J. P., Lundin J., Nordling S. et al. Ep ithelial and stromal Syndecan-1 expression as predictor outcome in patients with gas tric cancer // Int. J. Cancer (Pred. On col.). - 2001. - Vol. 95. - P. 1-6.
Г л а в а 9
суды образуются только в результате ангиогенеза. Постнатальный ангиогенез начинается с активации клеток эндотелия: их пролиферации, мигра ции и последующего формирования просвета сосуда, при этом в отличие от васкулогенеза, где происходит диф - ференцировка клеток эндотелия из предшественников, клетки эндотелия, участвующие в ангиогенезе, являются полностью дифференцированными, происходящими из предсуществующих кровеносных сосудов. Активация клеток эндотелия в родительском со суде сопровождается разрушением ба зальной мембраны при участии плазмина и других протеаз, в результате чего облегчается последующая мигра ция клеток эндотелия в интерстициальное пространство. Формирование просвета сосуда, "захват" перицитов и образование базальной мембраны за вершают процесс.
Активация ангиогенеза может про исходить при таких патологических процессах в организме, как заживле ние ран и рост опухоли. Эксперимен тальные данные свидетельствуют о том, что в условиях отсутствия сосу дов опухолевый клон достигает всего лишь нескольких миллиметров в диа метре, и только после того как в опу холи "включится" ангиогенез и пер вичный опухолевый клон получит доступ к сосудистой системе, начина ется его усиленный рост. Действи тельно, для того чтобы популяция опухолевых клеток могла увеличивать ся, необходимо, чтобы клетки были обеспечены питательными вещества ми и кислородом, которые поступают из близлежащих кровеносных сосудов. В отсутствие доступа к адекватному кровоснабжению опухолевые клетки некротизируются и/или вступают в апоптоз, ограничивая тем самым уве
личение |
объема опухоли независимо |
|
от того, |
насколько высокими |
проли- |
феративными возможностями |
облада |
|
ют сами опухолевые клетки. |
|
|
Существуют данные, свидетельст вующие о том, что включение ангио генеза может происходить уже на ран
них, пренеопластических стадиях опу холевого развития. Такие данные по лучены, например, в эксперименталь ных моделях, где злокачественные опухоли возникают у трансгенных мышей, несущих в геноме домини рующие онкогены и/или поврежден ные гены-супрессоры опухолевого роста. При исследовании канцероге неза с использованием некоторых из этих моделей, где опухоли в процессе своего развития проходят через гисто логически различающиеся стадии, "включение" ангиогенеза наблюдалось на ранних стадиях, предшествующих появлению солидных опухолей.
Аналогичные данные получены и для некоторых опухолей человека. В опухолях человека для визуализации капилляров на гистологических срезах широко используются такие иммуно логические маркеры, как фактор фон Виллебранда (vWF) и поверхностный маркер клеток эндотелия CD31, из вестный также как endoCAM - Ι или РЕСАМ-1 и представляющий собой молекулу клеточной адгезии, в высо кой степени экспрессирующуюся на поверхности клеток эндотелия.
В одной из работ при иммуногистохимическом окрашивании на vWF биопсийного материала с такими пренеопластическими изменениями мо лочной железы, как гиперплазия и дисплазия эпителия протоков, а также участков, соответствующих карцино ме in situ, некоторые из участков с карциномой in situ были охарактери зованы как ангиогенные. На основа нии этого наблюдения авторами было сделано предположение, что ангио генные участки карциномы in situ мо гут представлять промежуточную ста дию, разделяющую преангиогенную карциному in situ и инвазивный рак.
При анализе с помощью иммуногистохимического окрашивания на vWF биопсийного материала с изме нениями в шейке матки включение ангиогенеза происходило на стадии дисплазии. Небольшое первоначаль ное увеличение плотности сосудов было отмечено уже на стадии ранней
430
дисплазии, что позволило сделать вы вод о том, что "включение" ангиогене за является, по-видимому, очень ран ним событием при развитии инвазивного плоскоклеточного рака, имею щим, возможно, две фазы — средней и интенсивной неоваскуляризации.
Существуют убедительные дан ные, свидетельствующие о том, что количество капилляров, обнаруживае мых в первичной опухоли, коррелиру ет с появлением метастазов. Так, на пример, была исследована взаимо связь степени васкуляризации опухо лей молочной железы с их размерами, стадией заболевания, метастазированием. Уровень васкуляризации оцени вался по количеству сосудов на 1 мм2 гистологического среза, выявлявших ся с помощью иммуногистохимического окрашивания на CD31 . Было установлено, что плотность сосудов в метастазирующих опухолях сущест венно выше, чем в опухолях без мета стазов и в нормальной ткани. Показа
но также, что если плотность |
сосудов |
|||
в опухоли превышает 100 |
сосудов/ |
|||
мм2, то риск возникновения метаста |
||||
зов |
существенно |
увеличивается. Та |
||
ким |
образом, |
подсчет |
количества |
|
микрососудов в |
опухоли |
позволяет |
||
выделить группу больных с повышен ным риском метастазирования, для которой, возможно, необходимо ис пользование более интенсивной тера пии.
Аналогичные данные о взаимосвя зи между количеством микрососудов в опухоли и метастазированием были получены для меланомы, раков легко го, простаты, шейки матки, толстого кишечника. Показано также, что плотность сосудов является важным прогностическим показателем для карцином молочной железы, опухолей полости рта, рака простаты и инвазивных карцином мочевого пузыря: прогноз считался хорошим в случае низкой плотности сосудов и ухудшал ся с увеличением их плотности.
Вместе с тем следует отметить, что не всегда существует прямая взаимо связь между плотностью сосудов в
опухоли и такими показателями раз вития опухолевого процесса, как метастазирование и продолжительность жизни пациентов. Например, в случае аденокарциномы поджелудочной же лезы не было найдено статистически значимых различий в продолжитель ности жизни групп оперированных пациентов с высокой и низкой плот ностью микрососудов опухоли. Хотя тенденция к увеличению продолжи тельности жизни у пациентов с более низкой плотностью сосудов в опухоли наблюдалась и в этом случае.
Большинство накопленных к на стоящему времени данных говорит о том, что индукция ангиогенеза в опу холи активно регулируется самими опухолевыми клетками. На это указы вает, например, тот факт, что капил лярная сеть развивается в опухоли не зависимо от того, имплантирована ли она в участок ткани с высоким или низким уровнем васкуляризации. Из вестно также, что кондиционирован ная среда от различных культур транс формированных клеток повышает ми тогенную активность клеток эндоте лия. Эти данные указывают на то, что опухоль секретирует растворимые ак тиваторы ангиогенеза, которые явля ются сигналом начала процесса ветв ления новых капилляров для покоя щейся сосудистой системы. Эта гипо теза стимулирует поиск так называе мых факторов ангиогенеза опухоли.
9.1. Ростовые факторы клеток эндотелия сосудов
Известен целый ряд факторов, ангиогенных в условиях in vivo, это — ростовые факторы фибробластов (aFGF и b F G F ) , эпидермальный росто вой фактор (EGF), трансформирую щие ростовые факторы (TGFальфа и TGF1), фактор некроза опухоли (TNFa), гепатоцитарный ростовой фактор (HGF), тромбоцитарный ростовой фактор клеток эндотелия ( P D - E C G F ) , ангиогенин, интерлейкин-8 и некото рые другие. Однако далеко не все из перечисленных факторов могут пре-
431
тендовать на роль основных регулято ров ангиогенеза. Прежде всего боль шинство из них не являются специ фичными для клеток эндотелия, по скольку стимулируют размножение и других типов клеток. Только часть
этих факторов |
(aFGF, b F G F , E G F , |
T G F a , H G F , |
P D - E C G F , интерлей- |
кин-8) способна стимулировать рост клеток эндотелия сосудов при непо средственном воздействии на них в условиях in vitro. Другие факторы практически не вызывают митогенный эффект в условиях in vitro или да же ингибируют рост клеток эндотелия
сосудов |
(например, TGFбета1). Предпо |
|||
лагается, что |
ангиогенное действие |
|||
таких |
факторов |
осуществляется |
за |
|
счет паракринной |
активации других, |
|||
действующих |
непосредственно |
на |
||
клетки |
эндотелия ангиогенных факто |
|||
ров. В настоящей главе будут рассмот рены только ростовые факторы, непо средственно взаимодействующие с ре цепторами, локализованными на по верхности клеток эндотелия сосудов, и регулирующие такие процессы, как
дифференцировка, |
|
пролиферация и |
миграция клеток |
эндотелия, а также |
|
их взаимодействие |
с периэндотели- |
|
альными клетками. |
|
|
Из перечисленных ангиогенных факторов наибольшее внимание в ка честве основных регуляторов ангиоге неза привлекали ростовые факторы фибробластов, a F G F и b F G F . Оба эти фактора высокоэффективны в отно шении индукции пролиферации кле ток эндотелия сосудов in vitro и стиму ляции ангиогенеза in vivo; для них ха рактерна также высокая аффинность связывания с гепарином. Эти свойст ва, а также широкий спектр экспрес сии a F G F и b F G F в нормальных тка нях взрослых мышей и человека дали основание предполагать, что именно эти факторы являются основными ме диаторами ангиогенеза, хотя послед ний — очень редкое событие для большинства тканей.
Необычным оказалось отсутствие в структуре этих факторов сигнального пептида, необходимого для внекле
точного транспорта секретируемых белков. Вследствие отсутствия сиг нального пептида F G F накапливаются внутри вырабатывающих их клеток и, очевидно, не имеют непосредственно го доступа к клеткам-мишеням. Они могут быть инкорпорированы в базальную мембрану и выделяются, ко гда эта структура разрушается специ фическими ферментами. Однако, как уже было отмечено, ангиогенные фак торы, регулирующие ангиогенез в опухоли, должны быть секретируемы-
ми, |
и поэтому F G F не |
подходили на |
роль |
таких регуляторов. |
|
В |
настоящее время |
принято счи |
тать, что среди различных ростовых факторов ключевую роль в ангиогенезе опухолей играет открытый в 1989 г. ростовой фактор эндотелия сосудов — VEGF, мощный митоген клеток эндо телия сосудов. При этом он, очевид но, не обладает заметной митогенной активностью в отношении других ти пов клеток. V E G F вызывает мигра цию клеток эндотелия, их инвазию в коллагеновый гель и образование трубчатых структур. Еще одной важ ной характеристикой V E G F является его способность повышать проницае мость сосудов. Предполагается, что именно этот фактор является специ фическим медиатором, обеспечиваю щим повышенную проницаемость со судов в опухолях.
V E G F экспрессируется клетками большинства солидных опухолей. По вышенная экспрессия этого ростового фактора найдена в карциномах легко го, щитовидной железы, молочной железы, желудка, толстого кишечни ка, почки, мочевого пузыря, яичника и шейки матки, так же как и в ангиосаркомах, опухолях из зародышевых клеток и неоплазиях центральной нервной системы. Высокий уровень экспрессии VEGF, наблюдавшийся в метастатических опухолях головного мозга, возникших из ангиосаркомы, карцином почки, меланом и аденокарцином, свидетельствует о высокой активности V E G F в метастазах опухо лей человека.
432
При исследовании генной экспрес сии VEGF в ткани опухоли методом гибридизации in situ м Р Н К V E G F об наруживается в клетках опухоли, сви детельствуя о том, что именно опухо левые клетки являются клетками-про дуцентами этого ростового фактора. Отсутствие м Р Н К V E G F в клетках эн дотелия указывает на то, что V E G F представляет собой паракринный ме диатор. В опухолях, существенной со ставляющей которых является некроз, таких как мультиформная глиобласто-
ма, распределение экспрессии |
м Р Н К |
||
VEGF |
неравномерно, |
при |
этом |
VEGF-положительными прежде всего |
|||
оказываются кластеры |
опухолевых |
||
клеток, |
непосредственно |
прилежащие |
|
к местам некроза опухоли. Таким об разом, уровень м Р Н К V E G F сущест венно повышается в условиях гипок сии. Показано также, что гипоксия стимулирует экспрессию V E G F не только в опухолевых клетках, но и в таких клетках опухолевой стромы, как фибробласты и гладкомышечные клетки.
Исследование распределения белка VEGF в ткани опухоли с помощью иммуногистохимии выявляет V E G F в продуцирующих его клетках опухоли (где в меньшей части клеток обнару живалась диффузная окраска цито плазмы, а в большей — только окра ска структур аппарата Гольджи или отсутствие окраски) и показывает ин тенсивное специфическое окрашива ние появляющихся в опухоли новых сосудов. Такое распределение указы вает на то, что секретируемый опухо левыми клетками V E G F накапливает ся в клетках-мишенях.
Экспрессия V E G F обнаруживает ся также и в нормальных тканях, та ких как легкие, почки, сердце, надпо чечники, в меньшей степени — в пе чени, селезенке, слизистой оболочке желудка, еще меньше — в молочной железе. Однако эндотелий этих тканей в большинстве случаев находится в покоящемся состоянии, т. е. V E G F в них неактивен. Чаще всего иммуногистохимия обнаруживает V E G F в цито
плазме нормальных клеток. Было сде лано предположение, что этот факт отражает наличие V E G F в этих клет ках в связанной форме, необходимой для быстрой секреции в случае мест ного повреждения или каких-то дру гих стимулов. Оказалось, что действи
тельно |
существуют секретируемые и |
|
связанные изоформы VEGF, кодируе |
||
мые разными транскриптами. |
||
Известны |
четыре основные изо |
|
формы |
V E G F |
- VEGF121, VEGF165, |
VEGF189 |
и VEGF206 — различающиеся |
|
по своей длине и состоящие соответ ственно из 121, 165, 189 и 206 амино кислот (схема 9.1). Первые 26 амино
кислот в |
структуре V E G F представля |
ют собой |
последовательность, харак |
терную для сигнального пептида, ука
зывающую на то, |
что V E G F — секре |
||
тируемые белки. |
В секретирующих |
||
V E G F нормальных и трансформиро |
|||
ванных |
клетках |
обнаруживается пре |
|
имущественно изоформа VEGF165, |
|||
зрелая |
форма |
которой представляет |
|
собой гомодимер с мол. массой 45 кДа. В большинстве экспрессирующих V E G F клеток обнаруживаются
также |
транскрипты, |
кодирующие |
V E G F 1 2 1 и VEGF189, тогда как изофор |
||
ма VEGF206 встречается крайне редко. |
||
Анализ кодирующей V E G F геном |
||
ной последовательности |
показал, что |
|
все 4 изоформы кодируются единст венным геном и образуются в резуль тате альтернативного сплайсинга. Ко дирующая область гена V E G F распре делена между 8 экзонами, при этом в изоформе VEGF165 отсутствуют 24
аминокислоты, |
кодируемые экзоном |
||||
6, а |
в изоформе V E G F 1 2 1 отсутствуют |
||||
аминокислотные остатки, |
кодируемые |
||||
экзонами 6 и 7. |
|
|
|
||
Структурные |
различия |
изоформ |
|||
V E G F обусловливают |
различия в их |
||||
химико-биологических |
|
свойствах. |
|||
Так, VEGF121 — полипептид, обладаю |
|||||
щий |
слабокислотными |
свойствами и |
|||
не |
связывающийся |
с |
гепарином. |
||
VEGF165 — это основной, гепаринсвя- |
|||||
зывающий |
белок, |
а |
изоформы |
||
VEGF189 и VEGF206 — характеризуются |
|||||
еще |
более |
основными |
свойствами и |
||
2 8 - 7 9 0 8 Д. Г. Заридз е |
433 |

С х е м а 9.1. Структура белков семейства ростовых факторов эндотелия сосудов —
VEGF
SP — сигнальный пептид; С — остатки цистеинов; BR3P — остатки цистеинов, образующие мо тив, сходный с повторами (СХ10СХСХС), найденными в белке Balbiani ring 3; "+" — положи тельно заряженные остатки аминокислот, по-видимому, отвечающие за взаимодействие с вне клеточным матриксом
проявляют более высокую аффин ность при связывании с гепарином. Такие различия в свойствах сущест венно влияют на биологическую ак тивность изоформ VEGF . V E G F 1 2 1 — секретируемый белок, полностью рас творимый в кондиционированной среде экспресеирующих эту изоформу клеток. VEGF165 также секретируется из клеток, но при этом значительная его часть остается в связанном состоя нии на клеточной поверхности или во внеклеточном матриксе. Изоформы VEGF189 и VEGF206 практически пол ностью находятся в связанном с вне клеточным матриксом состоянии. Связанные формы V E G F могут вы свобождаться в результате воздействия таких агентов, как сурамин, гепарин или гепариназа. Тот факт, что гепарин высвобождает более длинные формы VEGF, дает основание предположить,
что местами их связывания могут быть содержащиеся на клеточной по верхности или во внеклеточном мат риксе гепаринсодержащие протеогликаны.
Длинные формы V E G F могут быть высвобождены и в результате воздей ствия такой протеазы, как плазмин, образующейся в результате расщепле ния активатором плазминогена протеолитически неактивного плазминогена. Эта протеаза расщепляет VEGF189 или VEGF206 в области СООН - конца с об разованием протеолитического фраг мента с мол. массой приблизительно 34 кДа, проявляющего активность в качестве митогена для клеток эндоте лия и агента, повышающего прони цаемость сосудов. Следовательно, V E G F становится доступным для кле ток эндотелия с помощью по крайней мере двух различных механизмов: как
434
свободный |
полностью |
|
растворимый |
зинкиназный |
домен, |
разделенный |
на |
|||||||||||||||
белок (VEGF121 и VEGF165) или в ре |
2 |
участка |
короткой |
последовательно |
||||||||||||||||||
зультате активации протеаз и расщеп |
стью, |
так |
называемой интеркиназной |
|||||||||||||||||||
ления более длинных изоформ. Обра |
вставкой, |
специфичной |
для |
каждого |
||||||||||||||||||
зование |
биологически |
|
активного |
рецептора (схемы 9.2; 9.3). |
|
|
|
|
||||||||||||||
VEGF |
с помощью |
протеолитического |
|
В |
результате |
взаимодействия |
|
со |
||||||||||||||
расщепления |
может играть |
особенно |
своим лигандом происходит димери- |
|||||||||||||||||||
важную роль в опухолях, поскольку |
зация рецепторов с последующей ак |
|||||||||||||||||||||
известно, что в опухолях наблюдается |
тивацией |
их каталитической |
активно |
|||||||||||||||||||
повышенная |
экспрессия |
протеаз, в |
сти, приводящей сначала к взаимному |
|||||||||||||||||||
том числе активаторов плазминогена. |
фосфорилированию |
самих |
рецепто |
|||||||||||||||||||
Таким образом, |
белковые продук |
ров, а затем к фосфорилированию их |
||||||||||||||||||||
ты, кодируемые |
одним |
единственным |
цитоплазматических |
субстратов, |
осу |
|||||||||||||||||
геном, |
могут обеспечивать достаточно |
ществляющих |
дальнейшую |
передачу |
||||||||||||||||||
гибкую |
систему контроля |
ангиогенеза. |
сигнала в клетке. |
|
|
|
|
|
|
|
||||||||||||
Короткие формы V E G F |
в случае |
не |
|
Рецепторы |
VEGFa |
(VEGFR1 |
и |
|||||||||||||||
обходимости могут быть быстро и эф |
VEGFR2) |
экспрессируются |
почти |
|
ис |
|||||||||||||||||
фективно секретированы из экспрес- |
ключительно |
в |
клетках |
эндотелия |
||||||||||||||||||
сирующих их клеток. В то же время |
кровеносных |
сосудов, |
преимущест |
|||||||||||||||||||
длинные формы, находящиеся в свя |
венно в сосудах, прилегающих к опу |
|||||||||||||||||||||
занном |
состоянии |
во |
внеклеточном |
холи и проникающих в нее. |
|
|
|
|||||||||||||||
матриксе, |
могут |
представлять |
собой |
|
Реакция |
клеток |
на |
воздействие |
||||||||||||||
некий резервуар молекул VEGF, из |
VEGFa может быть различной в зави |
|||||||||||||||||||||
которого более короткие растворимые |
симости от того, с каким из рецепто |
|||||||||||||||||||||
формы могут быть высвобождены при |
ров свяжется |
этот ростовой |
фактор. |
|||||||||||||||||||
разрушении |
этой |
структуры. |
|
|
|
На это указывают, например, резуль |
||||||||||||||||
В |
настоящее |
время |
семейство |
таты опытов, где клетки эндотелия |
||||||||||||||||||
VEGF состоит из 6 ростовых факто |
аорты свиньи, в которых отсутствуют |
|||||||||||||||||||||
ров: VEGFa (более раннее обозначе |
эндогенные рецепторы VEGFa, были |
|||||||||||||||||||||
ние - VEGF), VEGFb, VEGFc, |
трансфицированы |
векторами, |
экс- |
|||||||||||||||||||
VEGFd, VEGFe и плацентарного рос |
прессирующими Flt1 или KDR. При |
|||||||||||||||||||||
тового фактора P1GF. |
|
|
|
|
|
этом VEGFa стимулировал хемотаксис |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
и митогенез только в тех клетках, где |
|||||||||||
9.2. Рецепторы VEGF |
|
|
|
был экспрессирован KDR, но не Fltl. |
||||||||||||||||||
|
|
|
О |
функциональных |
различиях |
сиг |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Реализация |
биологического |
|
эф |
нальных |
путей, осуществляемых |
|
по |
|||||||||||||||
фекта |
VEGFa |
осуществляется |
через |
средством передачи сигнала через ре |
||||||||||||||||||
его взаимодействие со своими высо |
цепторы Flt1 и Flk1/KDR, свидетель |
|||||||||||||||||||||
коаффинными рецепторами. В на |
ствуют также данные, полученные на |
|||||||||||||||||||||
стоящее время известно 2 таких ре |
гомозиготных мышах с поврежденным |
|||||||||||||||||||||
цептора: Flt1 (VEGFR1) и Flk1/KDR |
геном Flt1 или Flk1. В обоих случаях |
|||||||||||||||||||||
(VEGFR2), |
образующих |
отдельную |
такие повреждения приводили к гибе |
|||||||||||||||||||
группу |
в суперсемействе |
рецепторных |
ли эмбриона на 9-й день развития, од |
|||||||||||||||||||
тирозинкиназ. К этой же группе отно |
нако в случае повреждения Flk1/KDR |
|||||||||||||||||||||
сится еще один рецептор — FLT4 |
наблюдалось |
отсутствие |
васкулогенеза |
|||||||||||||||||||
(VEGFR4), |
|
взаимодействующий |
с |
и |
дифференцировки |
клеток |
эндоте |
|||||||||||||||
VEGFc и VEGFd, но не с VEGFa. Эта |
лия, тогда как при повреждении Flt1 |
|||||||||||||||||||||
группа рецепторов представляет собой |
дифференцировка |
клеток |
происходи |
|||||||||||||||||||
трансмембранные |
белки |
со |
сходной |
ла, но при этом наблюдалось расши |
||||||||||||||||||
структурой: их внеклеточная рецеп- |
рение сосудов и дезорганизация сбор |
|||||||||||||||||||||
торная часть состоит из 7 иммуногло- |
ки клеток эндотелия, т. е. нарушались |
|||||||||||||||||||||
булинподобных доменов, а во внутри |
более |
поздние стадии |
васкулогенеза. |
|||||||||||||||||||
клеточной |
области |
находится |
тиро- |
|
В |
эндотелиальных |
клетках пупоч- |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
28*

С х е м а 9.2. Структура семейства рецепторов VEGF (по Fournier
Ε., Birnbaum D., Borg J . - C , 1997) (объяснение в тексте)
ной вены была обнаружена раствори мая форма рецептора Flt1. Эта форма рецептора образуется в результате аль тернативного сплайсинга, и в ней от сутствуют 7-й иммуноглобулин-по добный домен, трансмембранный до мен и цитоплазматический домен. Та кой растворимый рецептор способен ингибировать индуцируемый VEGFa митогенез клеток эндотелия. Авторы предполагают, что растворимая форма Fltl может выполнять роль негативно го регулятора действия VEGFa.
Действительно, данные о торможе нии опухолевого роста при ингибировании активности VEGFa с помощью рекомбинантной растворимой формы другого рецептора — Flk-1 — были получены на клетках глиобластомы линии С6. Рост глиобластомы при пе ревивке клеток С6 мышам существен но подавлялся в том случае, если опу холевые клетки вводились совместно
с клетками, экспрессирующими доми нантно-негативную мутантную форму Flk-1, в которой отсутствовал тиро зинкиназныи домен (схема 9.4).
Третий |
из |
рецепторов ростовых |
||
факторов |
семейства |
V E G F |
— |
|
V E G F R 3 |
или |
FLT4 — |
на ранних ста |
|
диях эмбриогенеза также экспрессируется в эндотелии кровеносных сосу дов, но позднее его экспрессия сосре доточивается в клетках эндотелия лимфатических сосудов и во взрослом организме этот рецептор экспрессируется исключительно в эндотелии лим фатических сосудов. Этот факт дал ос нования предполагать, что лимфан - гиогенез, возможно, регулируется че рез взаимодействие именно этого ре цептора со своими лигандами. Дейст вительно, гиперэкспрессия VEGFc, одного из лигандов V E G F R 3 , в коже трансгенных мышей приводила к ги перплазии лимфатических, но не кро-
436

Схема 9.3. Взаимодействие ростовых факторов семейства VEGF со своими
рецепторами (объяснение в тексте)
VEGFR1 /VEGFR1 |
VEGFR2/VEGFR2 |
VEGFR3/VEGFR3 |
(FLT1/FLT1) |
(KDR/KDR) |
(FLT4/FLT4) |
Схема 9.4. Ингибирующее действие мутантной формы рецептора Flk-1 на
рост опухолей, индуцированных введением клеток глиобластомы человека бестимусным мышам
Время (дни) |
Время (дни) |
а — клетки С6 вводили подкожно мышам — одни или совместно с клетками, экспрессирующими соответствующие рекомбинантные ретровирусы; Flk-1 ТМ — мутантный Flk-1, у которого отсутствует тирозинкиназный домен; Flk-1 — Flk-1 дикого типа; c-fms ТМ — мутантный c-fms со структурой, аналогичной Flk-1 ТМ; б — на 5-й день после подкожного введения мышам клеток С6 в область имплантата опухоли вводили ретровирусный супернатант (по Millauer В. и др., 1994)
веносных сосудов, проявлявшейся в пролиферации эндотелия и увеличе нии размеров сосудов. И наоборот, экспрессия в коже трансгенных мы шей растворимой формы рецептора VEGFR3, связывающей VEGFc и тем самым снижающей эффективность его взаимодействия с клеточным ре цептором, приводит к ингибированию эмбрионального лимфангиогенеза, хо тя кровеносная сосудистая сеть при этом развивается нормально. Для та ких мышей характерен фенотип, схо жий с лимфэдемой человека, при ко тором наблюдаются отеки конечно стей, эдема и фиброз кожи. Кроме то го, при наследственной лимфэдеме человека были найдены 4 близкорас положенные гетерозиготные смысло вые мутации в высококонсервативной области тирозинкиназного домена ре цептора VEGFR3, приводящие к инактивации рецептора. Аналогичная гетерозиготная мутация в той же са мой области тирозинкиназного доме на VEGFR3 была найдена у мышей Chy, представляющих собой экспери ментальный аналог лимфэдемы чело века.
Такого рода мутации приводят к ослаблению сигнала, реализуемого че рез этот рецептор, поскольку в этом случае при димеризации рецептора, взаимодействующего со своим лигандом, наряду с нормально функциони рующим димером образуются димеры, состоящие из 2 мутантных, нефунк циональных форм, и димеры, содер жащие одну нормальную и одну мутантную форму. Таким образом, 2/з образующихся рецепторов либо не способны проводить сигнал вообще, либо проводят его намного хуже, чем нормальные рецепторы. Кроме того, время жизни мутантных рецепторов на поверхности клетки больше, чем у рецепторов, функционирующих нор мально из-за того, что интактные ре цепторы после взаимодействия с лигандом и передачи сигнала подверга ются интернализации и деградации. Увеличение концентрации лиганда может в этом случае частично ком
пенсировать дефектную функцию ре цептора. Так, была предпринята по пытка лечения мышей Chy с помо щью введения экспрессирующей VEGFc аденовирусной конструкции, что привело к развитию в коже мы
шей |
дополнительных лимфатических |
|||
сосудов и уменьшению отеков. |
|
|||
Недавно |
обнаружен |
еще |
один |
|
класс |
рецепторов, обладающих |
спо |
||
собностью |
связываться |
с ростовыми |
||
факторами семейства VEGF, хотя и не являющихся для них специфичными. Это нейропилины, представляющие собой поверхностные рецепторы ней ронных клеток, которые взаимодейст вуют с гликопротеинами семейства коллапсинов/семафоринов, участвую щими в развитии и функционирова нии нервной системы. Факт обнару жения взаимодействия нейропилинов с ростовыми факторами VEGF, при чем с эффективностью, сравнимой со специфичными для V E G F рецептора ми, сам по себе удивителен, посколь ку ранее считалось, что эти рецепторы регулируют рост аксонов в эмбрио нальном развитии. Оказалось, что нейропилин-1 связывается с VEGFa, причем только с изоформой VEGF165, но не V E G F 1 2 1 . Кроме того, нейропи лин-1 проявляет себя как корецептор VEGFR2, усиливая взаимодействие последнего с изоформой VEGF165.
Второй из рецепторов этого класса, нейропилин-2, взаимодействует с VEGFc, причем такое взаимодейст вие, по-видимому, способно вносить определенный вклад в VEGFc-зависи- мую регуляцию лимфангиогенеза. Так, например, дефекты развития лимфатической системы у мышей Chy наблюдаются в коже, но не в кишеч нике. Это, по-видимому, связано с тем, что в кишечнике экспрессируется нейропилин-2, взаимодействие кото рого с VEGFc в какой-то степени компенсирует недостаточно эффек тивную работу VEGFR3 . Экспрессия этого рецептора в коже мышей не об наружена.
Спектр экспрессии нейропилинов в ткани человека достаточно широк:
438
нейропилин-1 экспрессируется в сердце, плаценте, легком, печени, скелетных мышцах, почках и подже лудочной железе. Экспрессия нейро- пилина-1 найдена также в некоторых линиях клеток опухолевого происхож дения, а также в культурах клеток эн дотелия. И хотя доказательства непо средственного участия нейропилинов в регуляции ангиогенеза в настоящее время отсутствуют, уже имеющиеся данные позволяют расширить пред ставления о роли этих рецепторов.
9.3. Семейство рецепторов Tie и взаимодействующие с ними ростовые факторы
На поверхности клеток эндотелия сосудов экспрессируются еще 2 ре цептора — Tiel и Tie2/Tek, также при надлежащих к семейству рецепторных тирозинкиназ и образующих в нем подсемейство Tie (тирозинкиназы с иммуноглобулин- и EGF-гомологич ными доменами).
Аналогично рецепторам ростовых факторов семейства VEGF, экспрессия рецепторов Tie жизненно необходима для формирования эмбриональной сосудистой сети. Мыши, дефицитные по гену Tiel, погибают в пе риод между 13,5 дня эмбрионального развития и рождением, имея дефекты целостности сосудов, приводящие к эдеме и геморрагии. Мыши, у кото рых инактивирован ген Tie2, погиба ют в период между Е9,5 и Ε10,5, сосу дистая сеть таких мышей выглядит незрелой, нарушена типичная для нормальной сосудистой системы орга низация: сосудистая сеть представлена в основном расширенными кровенос ными сосудами, мало различающими ся по диаметру, при этом отсутствуют как крупные собирательные сосуды, так и мелкие капилляры. Эти данные указывают на то, что рецепторы се мейства Tie включаются в регуляцию ангиогенеза на более поздних стадиях, чем рецепторы ростового фактора VEGFa, поскольку в случае, напри мер, инактивации гена VEGFR2 у мы-
шей вообще не происходит дифференцировка клеток эндотелия из их предшественников, тогда как при инактивации Tie2 клетки эндотелия присутствуют в нормальном количест ве и формируют трубочки, но наруше ны более поздние стадии, такие как созревание и стабилизация сосуди стой сети.
Рецепторы семейства Tie не взаи модействуют с ростовыми факторами семейства VEGF . Лигандами рецепто ра Tie2 являются ангиопоэтины (angiopoietins): Ang-1, Ang-2 и Ang-3/Ang- 4. Лиганд рецептора Tiel пока не най ден. Инактивация генов, кодирующих тот или иной ангиопоэтин, по-разно му отражается на эмбриональном раз витии мышей. Мыши, дефицитные по гену Ang-1, погибают на 12,5-й день эмбрионального развития, при этом у них наблюдаются такие же нарушения в формировании сосудистой системы, как и у мышей с неработающим геном Tie2, хотя и в менее выраженной фор ме. Инактивация гена Ang-2 также де тальна: мыши Ang-2-/- погибали неза долго до рождения или в течение пер вых нескольких дней после рождения, тогда как мыши с инактивированным геном Ang-З, по-видимому, жизнеспо собны.
Взаимодействуя с рецептором Tie2, ангиопоэтины Ang-1 и Ang-2 вызыва ют противоположные эффекты. На пример, при эмбриональном развитии мышей, у которых гиперэкспрессирован Ang-2, проявлялся фенотип, сход ный с фенотипом мышей с инактивированными генами Ang-1 или Tie2, при этом наблюдаемые дефекты раз вития сосудистой сети эмбрионов обычно имели даже более выражен ный характер. Противоположность действия ангиопоэтинов Ang-1 и Ang- 2 проявляется и при их воздействии на культуру клеток эндотелия в усло виях in vitro: ангиопоэтин Ang-1 вызы вает миграцию этих клеток, тогда как ангиопоэтин Ang-2 не оказывает тако го эффекта, а избыток этого лиганда рецептора Tie2 ингибирует действие Ang-1. Столь различные действия двух
439
ангиопоэтинов объясняются тем, что последствия их взаимодействия со своим рецептором совершенно раз личны. В опытах in vitro ангиопоэтины Ang-1 и Ang-2 связываются с рецепто ром Tie2 с одинаковой эффективно стью, однако Ang-Ι индуцирует аутофосфорилирование рецептора Tie2 в культуре клеток эндотелия, тогда как связывание Ang-2 не приводит к по следующему аутофосфорилированию цитоплазматического тирозинкиназ ного домена. Таким образом, Ang-2 ингибирует действие Ang-1, конкури руя с ним за связывание с Tie2 и тем самым блокируя вызываемую Ang-1 активацию этого рецептора.
Ангиопоэтин Ang-2, по-видимому, является первым примером естествен ного лиганда-антагониста для рецеп тора тирозинкиназного типа, и суще ствование лигандов с противополож ной направленностью действия гово рит о том, что активация рецептора Tie2 подвергается очень тонкой регу ляции в условиях in vivo.
Возможно, что противоположный характер действия ангиопоэтинов Ang-Ι и Ang-2 является специфиче ским для клеток эндотелия: как оказа лось, в тех редких случаях, когда Tie2 экспрессируется в неэндотелиальных клетках, например в культуре клеток фибробластов, Ang-2, как и Ang-1, индуцировал аутофосфорилирование этого рецептора.
Аналогично Ang-1 и Ang-2, проти воположным действием на рецептор Tie2 обладают ангиопоэтины Ang-З и Ang-4: Ang-4 активировал Tie2, тогда как Ang-З действовал как антагонист. Интересно, что на самом деле ангио поэтины Ang-З и Ang-4 представляют собой гомологи одного и того же ге на, у мыши и у человека соответст венно. Необычным для этих генов является очень высокая степень их дивергенции. Так, если для гомоло гов гена Ang-1 человека и мыши идентичность кодируемых ими ами нокислотных последовательностей в области наиболее консервативного домена достигает 99 %, а для анало
гичных гомологов гена Ang-2 — 87 %, то идентичность аминокислотных последовательностей, кодируемых ге нами Ang-З и Ang-4, в этой же облас ти составляет всего лишь 65 %. Та ким образом, хотя Ang-З и Ang-4 яв ляются гомологичными генами мы ши и человека соответственно, их структурные различия привели к то му, что кодируемые ими белковые продукты обладают совершенно раз личными функциями . Эти данные представляют собой удивительный пример структурной и функциональ ной дивергенции одного и того же генного локуса у мыши и человека.
Какие процессы формирования зрелой сосудистой сети регулирует система Tie2/Ang-1? Ряд данных ука зывает на то, что роль этой системы заключается в осуществлении взаимо действия как между самими клетками эндотелия сосудов, так и между клет ками эндотелия и находящимися в окружающей мезенхиме перицитами и гладкомышечными клетками, т. е. в регуляции процесса сборки мышеч ной стенки сосудов, обеспечивающего созревание и стабилизацию сосуди стой сети.
В пользу такого предположения свидетельствуют прежде всего приво дившиеся выше фенотипические ха рактеристики сосудистой системы эм брионов мышей с инактивированными генами Ang-1 или Tie2, а также паракринный характер экспрессии ангиопоэтина Ang-1, выявляемый во взрослом организме: клетками, кон ститутивно секретирующими этот бе лок, являются периэндотелиальные клетки (перициты и гладкомышечные клетки), но не клетки эндотелия.
Данные, полученные в экспери менте, также подтверждают эту гипо тезу. В опытах in vitro ангиопоэтин Ang-1 стимулирует миграцию клеток эндотелия, но не индуцирует ни про лиферацию этих клеток, ни сборку клеток эндотелия в трубчатые струк туры. В условиях in vivo ангиопоэтин Ang-1 проявляет себя как естествен ный ингибитор проницаемости сосу-
440
дов. Так, при гиперэкспрессии Ang-1 |
вызываемая Ang-2 дестабилизация в |
|||||||||||||||||||||||
сосуды |
становятся более резистентны |
отсутствие VEGFa приводит к регрес |
||||||||||||||||||||||
ми к индуцируемому VEGFa повыше |
сии сосудов, а в присутствии высоко |
|||||||||||||||||||||||
нию их проницаемости. И напротив, у |
го уровня экспрессии VEGFa, стиму |
|||||||||||||||||||||||
мышей |
|
с |
инактивированным |
геном |
лирующего |
пролиферацию и |
мигра |
|||||||||||||||||
Ang-1 клетки эндотелия |
имеют |
более |
цию клеток эндотелия, облегчает ан- |
|||||||||||||||||||||
округлую |
форму, менее |
распластаны, |
гиогенный |
ответ, |
вызываемый |
этим |
||||||||||||||||||
слабо ассоциированы |
с |
прилежащим |
ростовым |
фактором, |
таким |
образом, |
||||||||||||||||||
матриксом, у них нарушено взаимо |
Ang-2 по крайней мере в присутствии |
|||||||||||||||||||||||
действие |
|
с |
|
периэндотелиальными |
VEGFa также ангиогенен. |
|
|
|
|
|||||||||||||||
клетками. Получены также данные о |
Таким |
образом, |
ростовые |
факторы |
||||||||||||||||||||
том, что при наследуемой сосудистой |
семейства V E G F и ангиопоэтины, по- |
|||||||||||||||||||||||
патологии, |
характерной особенностью |
видимому, |
|
играют |
комплементарную |
|||||||||||||||||||
которой является недостаток гладко- |
и координирующую роль в развитии |
|||||||||||||||||||||||
мышечных клеток в крупных сосудах |
сосудов (схема 9.5). В процессе васку |
|||||||||||||||||||||||
человека, была найдена мутация в ти- |
логенеза |
прежде |
всего |
происходит |
||||||||||||||||||||
розинкиназном |
домене |
|
рецептора |
дифференцировка |
|
мезодермальных |
||||||||||||||||||
Tie2. |
|
|
|
|
|
|
|
|
|
|
|
клеток в гемангиобласты. Предполага |
||||||||||||
Созревание |
сосудов |
при |
участии |
ется, что при дальнейшей дифферен- |
||||||||||||||||||||
периэндотелиальных |
клеток |
является |
цировке из |
гемангиобластов |
происхо |
|||||||||||||||||||
важным |
|
этапом |
ангиогенеза: клетки |
дят как предшественники клеток эн |
||||||||||||||||||||
эндотелия, |
которым обычно уделяется |
дотелия (ангиобласты), так и предше |
||||||||||||||||||||||
наибольшее |
|
внимание, |
|
могут |
лишь |
ственники |
гематопоэтических клеток, |
|||||||||||||||||
инициировать, но не завершить про |
поскольку у этих видов клеток-пред |
|||||||||||||||||||||||
цесс ангиогенеза. Клетки стенок сосу |
шественников |
имеется |
несколько |
об |
||||||||||||||||||||
дов стабилизируют вновь |
образован |
щих поверхностных маркеров. После |
||||||||||||||||||||||
ные капилляры, |
ингибируя пролифе |
формирования первичной сети капил |
||||||||||||||||||||||
рацию и миграцию клеток эндотелия |
ляров |
дальнейшее |
развитие |
сосуди |
||||||||||||||||||||
и стимулируя |
развитие внеклеточного |
стой |
сети |
обусловлено ангиогенезом. |
||||||||||||||||||||
матрикса, что защищает новые сосуды |
В |
процессе |
ветвления |
капилляров |
||||||||||||||||||||
от разрушения и регрессии. |
|
|
|
происходят |
деградация |
прилежащей |
||||||||||||||||||
При |
|
активации |
ангиогенеза |
во |
базальной |
|
мембраны, |
миграция |
и |
|||||||||||||||
взрослом организме для того, чтобы |
пролиферация клеток эндотелия и их |
|||||||||||||||||||||||
клетки |
эндотелия могли |
|
мигрировать |
сборка в трубочки. Новые сосуды мо |
||||||||||||||||||||
за пределы сосуда из области своей |
гут также образовываться в результате |
|||||||||||||||||||||||
постоянной |
локализации |
|
на |
внутрен |
разделения |
или |
увеличения |
размеров |
||||||||||||||||
ней стенке сосуда, зрелые сосуды |
уже |
существующих |
сосудов. Дальней |
|||||||||||||||||||||
должны быть дестабилизированы. Для |
шая |
реконструкция |
первичной |
сосу |
||||||||||||||||||||
этого необходимо, чтобы межэндоте- |
дистой сети приводит к образованию |
|||||||||||||||||||||||
лиальные |
клеточные |
контакты |
были |
разветвленной |
|
сосудистой |
системы, |
|||||||||||||||||
ослаблены; также должны быть ослаб |
включающей |
в |
себя |
различающиеся |
||||||||||||||||||||
лены и |
|
периэндотелиальные |
поддер |
по размерам сосуды, при этом проис |
||||||||||||||||||||
живающие |
структуры: контакты |
меж |
ходит |
усечение |
избыточных |
капилля |
||||||||||||||||||
ду гладкомышечными клетками и вне |
ров, регрессия одних сосудов и слия |
|||||||||||||||||||||||
клеточный матрикс. Роль такого дес- |
ние других с образованием сосудов |
|||||||||||||||||||||||
табилизатора может выполнять ангио |
большего диаметра. Далее |
происходит |
||||||||||||||||||||||
поэтин Ang-2, поскольку он является |
созревание |
сосудов |
вследствие |
рекру |
||||||||||||||||||||
ингибитором |
усиливающей |
контакты |
тирования перицитов и гладкомышеч- |
|||||||||||||||||||||
сигнальной системы Tie2/Ang-1. Дей |
ных |
клеток. |
Образование |
внеклеточ |
||||||||||||||||||||
ствительно, |
|
во |
взрослом |
организме |
ного матрикса и базального слоя соз |
|||||||||||||||||||
Ang-2 экспрессируется преимущест |
дает |
|
поддерживающуюу |
основу |
для |
|||||||||||||||||||
венно там, где происходит реконст |
сосудов. |
В |
|
эмбриогенезе |
ростовой |
|||||||||||||||||||
рукция |
сосудов. |
Предполагается, |
что |
фактор |
VEGFa |
через |
|
рецептор |
||||||||||||||||
441

С х е м а 9.5. Иллюстрация процессов васкулогенеза и ангиогенеза (по Saaristo А. и др., 2000)
VEGFR2 стимулирует дифференци ровку и пролиферацию клеток эндоте лия и образование первичной сосуди стой сети. Далее, Ang-Ι через рецептор Тiе2 участвует в реконструкции этой первичной сети, а затем в под держании и стабилизации зрелых сосудов, стимулируя взаимодействие ме-
жду клетками эндотелия и окружающими поддерживающими клетками, о чем свидетельствует и обнаруживаемый в покоящихся сосудах взрослого организма низкий уровень экспрессии этого рецептора.
Вопухолях Ang-2 и VEGFa, очевидно, воспроизводят те же роли, которые они играют во время реконструкции сосудов в нормальных тканях.
Впроцессе индукции ангиогенеза в опухоли происходят как рост новых сосудов, так и их регрессия. Это про демонстрировано на ряде экспериментальных моделей перевиваемых опухолей при исследовании возник новения в опухолевой ткани сосуди стой сети. При этом оказалось, что представления о том, что большинство опухолей и метастазов возникает как лишенная сосудов масса клеток и лишь позднее благодаря индукции ан гиогенеза в ней формируется поддер живающая развитие опухоли сосуди стая сеть, не вполне справедливы. Вначале опухоли быстро кооптируют уже существующие сосуды организмахозяина, образуя достаточно хорошо васкуляризованную опухолевую массу.
Вдальнейшем, возможно, в результа те действия защитных механизмов ор ганизма наблюдается значительная регрессия этих первичных кооптиро ванных сосудов, приводящая ко вто ричной неваскуляризованной опухоли
исущественной потере клеток опухо ли. Однако оставшаяся часть опухоли в конце концов выживает за счет ак тивно идущего ангиогенеза на пери ферии опухоли.
Ростовые факторы VEGFa и Ang-2 непосредственно участвуют в этих процессах. В кооптированных опухо лью сосудах, еще до индукции экс прессии VEGFa клетками опухоли,
наблюдается значительная стимуля ция экспрессии Ang-2, что, возможно, является наиболее ранним признаком возникновения сосудов опухоли. Ин тенсивная аутокринная экспрессия Ang-2 клетками эндотелия сосудов опухоли может нарушать паракринную стабилизацию сосудов, обеспечи ваемую низким уровнем конститутив ной экспрессии Ang-Ι в нормальной ткани. Предполагается, что Ang-2 "по мечает" кооптированные сосуды для регрессии по апоптотическому меха низму, который может включать раз рушение взаимодействия между клет ками эндотелия и окружающими их поддерживающими клетками. Однако активация экспрессии VEGFa одно временно с экспрессией Ang-2 может свести к нулю регрессивный сигнал Ang-2, что согласуется с наблюдением о необходимости VEGFa для выжива ния сосудов опухоли. В таком случае вызываемая Ang-2 дестабилизация со судов фактически может способство вать проявлению ангиогенного дейст вия VEGFa. Таким образом, соотно шение уровней экспрессии VEGFa и Ang-2 может являться важным факто ром, регулирующимбаланс между ростом сосудов опухоли и их регрес сией, и терапия рака, направленная на понижение уровня VEGFa, не только предотвращает дальнейший ангиогенез опухоли, но также может способствовать регрессии вновь обра зованных плохо дифференцированных и недостаточно зрелых сосудов опу холи.
Таким образом, выяснение молеку лярных механизмов ангиогенеза опу холей открывает новые пути регуля ции опухолевого роста. Химиотера пия, направленная на сосудистую сис тему, может основываться на биохи мических различиях между ангиогенными и покоящимися кровеносными сосудами. Мишенями для антиангиогенной терапии могут служить экспрессируемые опухолевыми клетками молекулы, характерные для ангиоген ных сосудов, в частности VEGFa и его рецепторы.

С х е м а 9.6. Ингибирующее действие антител к VEGF на рост опухолей, ин
дуцированных введением линий опухолевых клеток человека бестимусным мы шам
Предположение |
о |
возможности |
системе, связанной с метастазами пе |
||||||||||
влияния на рост опухолей с помощью |
чени. Введение моноклональных ан |
||||||||||||
регуляции |
|
активности |
VEGFa |
под |
тител против VEGFa приводило к зна |
||||||||
тверждается |
рядом |
эксперименталь |
чительному уменьшению количества и |
||||||||||
ных данных. Высокая степень зависи |
размеров метастазов: все опухоли бы |
||||||||||||
мости роста опухолей и развития ме |
ли менее 3 мм в диаметре, причем |
||||||||||||
тастазов от уровня VEGFa была про |
большинство |
из них не |
превышали |
||||||||||
демонстрирована в работах, где актив |
1 мм в диаметре. В метастазах не на |
||||||||||||
ность VEGFa ингибировалась с помо |
блюдалось ни развития сосудов, ни |
||||||||||||
щью моноклональных антител. Такое |
экспрессии Flk-1. |
|
|||||||||||
ингибирование |
приводило |
к |
значи |
Эти данные свидетельствуют о том, |
|||||||||
тельному подавлению роста экспрес- |
что индуцируемый VEGFa |
ангиогенез |
|||||||||||
сирующих |
VEGFa |
опухолевых |
клеток |
действительно является фактором, ли |
|||||||||
человека |
— |
мультиформной |
глиобла |
митирующим рост опухоли. В связи с |
|||||||||
стомы |
G55 |
и |
рабдомиосаркомы |
этим |
важное |
значение |
приобретает |
||||||
А673 — при их подкожной перевивке |
обнаружение |
и исследование всевоз |
|||||||||||
бестимусным мышам (схема 9.6). |
можных ингибиторов ангиогенеза, в |
||||||||||||
Показано также, что VEGFa играет |
том числе эндогенных. |
|
|||||||||||
одну из ключевых ролей в развитии |
|
|
|
|
|||||||||
метастазов. Клетки карциномы тол |
9.4. Ингибиторы ангиогенеза |
||||||||||||
стого кишечника человека при их пе |
|
|
|
|
|||||||||
ревивке в селезенку бестимусных мы |
Новый класс ингибиторов ангиоге |
||||||||||||
шей дают метастазы в печень. При |
неза был обнаружен с открытием |
||||||||||||
этом |
наблюдается |
повышение |
экс |
тромбоспондина-1 (ТСП-1), выделен |
|||||||||
прессии |
м Р Н К |
Flk-1 |
в |
сосудистой |
ного |
из неопухолеродной |
линии кле- |
||||||
444
ток хомяка. Эта линия становилась опухолеродной вследствие появления мутации, инактивирующей опухоле вый ген-супрессор. При сравнении линий клеток, содержащих и не со держащих ген-супрессор, оказалось, что неопухолеродная линия секретирует высокий уровень мощного инги битора ангиогенеза, представляющего собой усеченную форму Т С П - 1 . Позд нее было показано, что и интактная молекула ТСП-1 является ингибито ром ангиогенеза, так же как и содер жащиеся в ее составе небольшие пеп тиды. Высокий уровень экспрессии ТСП-1 найден в ряде нормальных клеток грызунов и человека, тогда как во многих опухолевых клетках уро вень его экспрессии значительно ни же. В фибробластах и клетках эпите лия человека ТСП-1 регулируется бел- ком-супрессором опухоли р53 дикого типа: при утере функций этого белка в трансформированных вариантах этих клеток уровень этого ингибитора ан гиогенеза резко падает. Восстановле ние функции р53 повышало уровень ТСП-1 и подавляло способность к ин дукции ангиогенеза опухолевых кле ток. Таким образом, было продемон стрировано существование эндоген ных ингибиторов ангиогенеза, спо собных препятствовать стимуляции ангиогенеза, а также способность ге- нов-супрессоров контролировать уро вень таких ингибиторов в клетках.
Открытие ингибирующей ангиогенез активности тромбоспондина сти мулировало поиск других эндогенных ингибиторов. Тот факт, что эндотелий является покоящимся в течение дли тельного периода и в то же время мо жет быть индуцирован к появлению новых капилляров в течение несколь ких часов в ответ, например, на рану, уже давно указывал на то, что регуля торы ангиогенеза должны запасаться на случай их использования. Извест но, что F G F s и другие ростовые и ангиогенные факторы могут удерживать ся во внеклеточном матриксе многих типов клеток, включая эндотелиальные, по-видимому, высвобождаясь
вследствие протеолитической деграда ции матрикса.
Оказалось, что ингибиторы ангио генеза также могут быть запасены, но в несколько другой форме, как обра зующие крипты фрагменты молекул большего размера, которые сами не являются ингибиторами ангиогенеза. Примерами таких молекул являются не обладающие ингибиторной актив ностью фибронектин и пролактин, фрагменты которых ингибируют про лиферацию клеток эндотелия. Мощ ный ингибитор ангиогенеза — ангиостатин — также был идентифициро ван как фрагмент протеолитического расщепления плазминогена под дей ствием сериновой протеазы. Ангиостатин специфически ингибирует пролиферацию клеток эндотелия. Циркулирующий ангиостатин спосо бен поддерживать пассивное состоя ние метастазов и первичных опухолей, блокируя рост кровеносных сосудов. Применение ангиостатина в качестве терапевтического средства ингибировало рост трех различных типов пер вичных опухолей у мышей даже в тех случаях, когда лечение не начиналось до тех пор, пока опухоль не достигала 2 % от веса тела. Ни одна из исследо ванных опухолей не была резистент ной к действию ангиостатина и не на блюдалось токсичности к ангиостатину в дозах до 100 мг/кг.
Использование подхода, аналогич ного тому, с помощью которого был выделен ангиостатин, привело к выде лению из гемангиоэндотелиомы мы ши нового ингибитора ангиогенеза, названного эндостатином. Ν - концевая последовательность эндостатина оказалась идентичной С-концевому неколлагеновому домену коллагена XVIII, одного из членов семейства коллагеноподобных белков. При этом ни сам коллаген XVIII, ни более длинные, чем эндостатин, фрагменты его С-концевого домена не являются ингибиторами пролиферации клеток эндотелия. Однако в условиях индук ции ангиогенеза коллаген XVIII мо жет являться источником регулятор-
445
ной активности, высвобождаемой в |
ходы для подавления процесса ангио |
||||||||||||||||||||||
результате |
протеолитического |
расще |
генеза при лечении |
опухолей. |
|
|
|||||||||||||||||
пления |
интактной |
молекулы. |
|
|
В серии экспериментов с переви |
||||||||||||||||||
Эндостатин |
оказался |
специфиче |
ваемыми |
опухолями |
различного |
про |
|||||||||||||||||
ским |
ингибитором |
пролиферации |
исхождения |
(легочная |
карцинома |
||||||||||||||||||
клеток эндотелия и мощным ингиби |
Льюиса, фибросаркома, меланома, ге- |
||||||||||||||||||||||
тором |
ангиогенеза. |
Продемонстриро |
мангиоэндотелиома) |
воздействие |
эн |
||||||||||||||||||
вана |
высокая |
противоопухолевая |
ак |
достатина приводило к регрессии опу |
|||||||||||||||||||
тивность этого соединения. Систем |
холей, при этом какие-либо признаки |
||||||||||||||||||||||
ное |
применение |
эндостатина вызыва |
токсичности для мышей этого препа |
||||||||||||||||||||
ет почти полное подавление индуци |
рата |
отсутствовали. |
|
После прекраще |
|||||||||||||||||||
руемого |
опухолью |
ангиогенеза, |
под |
ния |
воздействия эндостатина |
опухоль |
|||||||||||||||||
держивает |
размеры |
метастазов |
на |
появлялась снова через 5—14 дней, |
|||||||||||||||||||
микроскопическом уровне и вызывает |
становилась |
васкуляризованной |
и |
||||||||||||||||||||
регрессию |
первичных |
|
опухолей |
до |
приводила к гибели |
эксперименталь |
|||||||||||||||||
размеров |
меньше |
1 мм |
3, что является |
ного животного. Действие эндостати |
|||||||||||||||||||
более чем 150-кратным уменьшением. |
на не снижало уровень пролифератив- |
||||||||||||||||||||||
Тот факт, что присутствующие в |
ной активности клеток опухоли, и |
||||||||||||||||||||||
изобилии |
|
в |
циркуляторной |
системе |
уменьшение размеров |
опухоли проис |
|||||||||||||||||
компоненты, |
такие |
как |
фибронектин |
ходило из-за значительного повыше |
|||||||||||||||||||
и плазминоген, а также коллаген |
ния |
частоты |
апоптоза. |
Эндостатин |
|||||||||||||||||||
XVIII, могут быть под действием про |
ингибировал |
пролиферацию |
клеток |
||||||||||||||||||||
теаз преобразованы в мощные инги |
эндотелия in vitro и почти полностью |
||||||||||||||||||||||
биторы |
ангиогенеза, |
предполагает |
но |
подавлял |
ангиогенез |
в |
остаточных |
||||||||||||||||
вую форму регуляции ангиогенеза, а |
микроскопических опухолях у мышей. |
||||||||||||||||||||||
выяснение роли протеаз в подавлении |
Выделение |
ингибиторов |
ангиоге |
||||||||||||||||||||
ангиогенеза может иметь такое же |
неза |
из |
среды, кондиционированной |
||||||||||||||||||||
важное значение, как и нахождение |
культивируемыми |
клетками |
опухоли, |
||||||||||||||||||||
протеаз, участвующих в его инициа |
показало, что сама опухоль может яв |
||||||||||||||||||||||
ции. Количество обнаруживаемых ин |
ляться их источником. Появление ин |
||||||||||||||||||||||
гибиторов |
ангиогенеза, |
представляю |
гибиторов ангиогенеза в опухолях, для |
||||||||||||||||||||
щих |
собой |
фрагменты, |
образующиеся |
которых |
характерен |
ангиогенный |
фе |
||||||||||||||||
под |
действием |
протеаз, |
|
продолжает |
нотип, может быть обусловлено со |
||||||||||||||||||
увеличиваться, |
|
поэтому |
|
выяснение |
провождающей опухолевый рост про- |
||||||||||||||||||
механизмов |
высвобождения таких ин |
теолитической |
активностью, |
которая, |
|||||||||||||||||||
гибиторов |
ангиогенеза |
|
и |
регуляции |
с одной стороны, способствует ангио- |
||||||||||||||||||
этого процесса может оказаться суще |
генезу, |
поскольку |
|
является |
важной |
||||||||||||||||||
ственно важным для разработки но |
составляющей |
для |
роста |
капиллярных |
|||||||||||||||||||
вых |
возможностей |
терапии |
опухолей. |
сосудов и высвобождает связанные во |
|||||||||||||||||||
Таким |
образом, |
поддержание |
кле |
внеклеточном |
матриксе |
ангиогенные |
|||||||||||||||||
ток эндотелия в альтернативных со |
факторы, а с другой стороны, приво |
||||||||||||||||||||||
стояниях покоя или ангиогенеза осу |
дит к появлению ингибиторов ангио |
||||||||||||||||||||||
ществляется регуляторный |
|
механиз |
генеза из белков-предшественников, |
||||||||||||||||||||
мом, |
|
интегрирующим |
кумулятивные |
не обладающих ингибиторными свой |
|||||||||||||||||||
уровни |
сигналов, |
|
индуцирующих и |
ствами. |
|
|
|
|
|
|
|
|
|||||||||||
ингибирующих ангиогенез. Если в та |
Присутствие в кровеносной системе |
||||||||||||||||||||||
ком |
суммарном |
балансе |
превалируют |
ингибиторов ангиогенеза |
способно за |
||||||||||||||||||
ингибиторы, |
ангиогенез |
будет |
"вы |
тормозить рост |
метастазов. Например, |
||||||||||||||||||
ключен", тогда как сдвиг баланса в |
перевиваемая |
легочная |
карцинома |
||||||||||||||||||||
сторону активаторов приведет к ин |
Льюиса при ее подкожном росте у мы |
||||||||||||||||||||||
дукции |
ангиогенеза. Возможность из |
шей дает отдаленные метастазы в лег |
|||||||||||||||||||||
менения |
баланса регуляторов ангиоге |
кое, однако эти метастазы остаются в |
|||||||||||||||||||||
неза |
может |
предоставить |
новые |
под |
покоящемся состоянии |
в виде неболь- |
|||||||||||||||||
446
ших узелков опухолевых клеток, в ко торых отсутствуют сосуды. Причиной этого является высокий уровень содер жания в крови ингибитора ангиоге неза — ангиостатина, который высво бождается из циркулирующего плазми ногена первичной опухолью. При этом уровень пролиферации клеток таких латентных метастазов достаточно вы сок, однако нарастания опухолевой массы не происходит, по-видимому, из-за высокой частоты апоптоза. Уда ление первичной опухоли приводило к снятию ангиогенной блокады, разви тию процесса ангиогенеза и быстрому росту метастазов легкого.
Тот факт, что специфический ин гибитор пролиферации клеток эндоте лия может вызвать регрессию опухоли до микроскопических размеров и под держивать ее в дремлющем состоя нии, указывает на то, что популяция клеток эндотелия может оказывать мощное контролирующее воздейст вие на рост клеток опухоли. В целях успешной терапии опухолей полезно воспринимать опухоль как две различ ные популяции клеток — популяцию собственно опухолевых клеток и по пуляцию клеток эндотелия, каждая из которых способна стимулировать рост другой. Рост каждой из этих популя ций клеток может быть ингибирован селективными агентами, специфиче ски воздействующими на данную по пуляцию клеток цитотоксической хи миотерапией и антиангиогенной тера пией соответственно. Вместе с тем комбинированная терапия, направ ленная на обе эти клеточные популя ции, может быть намного более эф фективна, чем воздействие на каждую из популяций по отдельности.
Опухоли самых различных гистоло гических типов должны индуцировать ангиогенез, для того чтобы выжить, и используемые для этого ангиогенные пути по большей части не зависят от типа опухоли. Таким образом, если для различающихся опухолей характерны большие различия в чувствительности к традиционной противоопухолевой терапии, такой как химиотерапия и ра
диотерапия, эффективная антиангиогенная терапия должна иметь широкий спектр применения в качестве общего противоопухолевого воздействия. Этот подход может также минимизировать или даже исключить некоторые про блемы, связанные с традиционными методами лечения солидных опухолей, такие как низкая проницаемость опу холевой ткани для лекарственных пре паратов и возникновение лекарствен ной резистентности.
Рекомендуемая литература
Ferrara N. The role of vascular endothelial growth factor in pathological angiogenesis // Breast Cancer Res. Treat. — 1995. — Vol. 36. - P. 127-137.
Folkman J. What is the evidence that tumors are angiogenesis dependent? // J. Natl. Cancer Inst. - 1990. - Vol. 82. - P. 4-6.
Folkman J. Angiogenesis and breast cancer //
J. |
Clin. Oncol. - 1994. - Vol. 4. - |
P. |
441-443. |
Hanahan D., Folkman J. Patterns and emerg ing mechanisms of the angiogenic switch during tumorigenesis // Cell. — 1996. — Vol. 86. - P. 353-364.
Lauren J., Gunji Y., Alitalo K. Is angiopoietin- 2 necessary for initiation of tumor angio genesis? // Amer. J. Pathol. — 1998. — Vol. 153. - P. 1333-1339.
Martiny-Baron G., Marme D. VEGF-mediated tumour angiogenesis: a new target for can cer therapy // Current opinion in Biotech nology. - 1995. - Vol. 6. - P. 675-680.
O'Reilly M. S., Воет Т., Shing Y. et al. Endostatin: an endogeneous inhibitor of ang iogenesis and tumor growth // Cell. — 1997. - Vol. 88. - P. 277-285.
O'Reilly M. S., Holmgren L., Shing Y. et al.
Angiostatin: a novel angiogenesis inhibitor that mediates the suppression of metastas es by a Lewis lung carcinoma / Cell. — 1994. - Vol. 79. - P. 315-328.
Risau W. Mechanisms of angiogenesis // Na ture. - 1997. - Vol. 386. - P. 671-674.
Senger D. R., Van De Water L., Brown L. F. et al. Vascular permeabiliy factor (VPF, VEGF) in tumor biology // Cancer and Metastasis Rev. — 1993. — Vol. 12. — P. 303-324.
Witzenbichler В., Maisonpierre P. C., Jones P. et al. Chemotactic properties of angiopoie- tin-1 and -2, ligands for the endothelialspecific receptor tyrosine kinase Tie2.
447
Г л а ва 10
ОПУХОЛЕВЫЕ АНТИГЕНЫ И ПРОТИВООПУХОЛЕВЫЙ ИММУНИТЕТ (ВРОЖДЕННЫЙ И ПРИОБРЕТЕННЫЙ)
Г. И. Дейчман
Успехи микробиологии конца XIX и начала XX столетия породили наде жды на возможность специфической иммунизации и создания "вакцины" против опухолей. Попытки иммуниза ции против так называемых спонтан ных опухолей (т. е. опухолей, возни кающих в естественных условиях и без участия экспериментаторов) с по мощью нативных или убитых нагрева нием опухолевых клеток или их экс трактов были предприняты в опытах на животных, а также на людях более 100 лет назад.
Первые результаты экспериментов, выполненных в начале XX в., тогда еще на беспородных животных (кры сах и мышах) с использованием для иммунизации нативных опухолевых клеток или их экстрактов, казалось бы, свидетельствовали о блестящем успехе такого подхода: при повторной прививке тех же опухолевых клеток иммунизированным животным транс плантат, как правило, быстро оттор гался. Однако при более тщательном исследовании возможность иммуниза ции против опухолей была воспроиз ведена и с помощью нормальных тка ней. Позднее открытие нормальных антигенов гистосовместимости и соз дание на этой основе колоний инбредных лабораторных животных, а также выяснение роли тимуса создали новую, быстро развивающуюся об ласть иммунологии, — Т-клеточного трансплантационного иммунитета, обусловившего успехи в транспланта ции нормальных органов и тканей и понимание общности его механизмов со специфическим противоопухоле вым иммунитетом.
К основным направлениям иссле
дований в этой области, продолжаю щихся уже более 30 лет, относится изучение: механизмов иммунологиче ского распознавания Т-клетками сингенных вирусинфицированных и опу холевых клеток, а также нормальных аллогенных клеток; роли А П К и ОКГ I и II классов в распознавании; моле- кулярно-генетических механизмов ак тивации Т-клеток; характеристик раз личных субпопуляций Т-лимфоцитов и их взаимодействия в цитотоксических реакциях; природы Т-клеточного рецептора; возможности культивиро вания и клонирования Т-клеток in vit ro. Результаты фундаментальных ис следований в области Т-клеточной иммунологии нашли применение в практической медицине, в значитель ной степени определив возможности:
1)трансплантации органов и тка ней при лечении ряда заболева ний человека и создания для этих целей эффективных иммунодепрессантов;
2)понимания патогенеза ряда ау тоиммунных болезней, в том числе иммунопатологии СПИДа;
3)адоптивной иммунотерапии не которых вирусных заболеваний человека.
Однако в области онкологии прак тическое значение достижений Т-кле точной иммунологии все еще остается весьма ограниченным, хотя продолжа ются интенсивные попытки создания "вакцин" против рака и новых схем иммунотерапии опухолей, в послед ние годы основанных на использова нии новых биотехнологий, молеку- лярно-биологических и вирусологиче ских методов антигенной модифика-
448
ции ("гетерогенизации", "аллогенизации") опухолевых клеток, а также ме тодов активации и клонирования Т- клеток (см. главу 11).
Вопрос об антигенности опухоле вых клеток оставался открытым до се редины 50-х годов XX столетия. По пытки иммунизации онкологических больных после радикального хирурги ческого вмешательства, проводившие ся в аутологичной системе с целью профилактики рецидивов и метаста зов опухолей, оказывались, как пра вило, малоэффективными; более того, в ряде исследований отмечено увели чение частоты рецидивов и ускорение метастазирования опухолей. В частно сти, это было показано в эксперимен тах на животных, а также у пациентов, "иммунизированных" термически инактивированными опухолевыми клет ками. Поэтому к середине XX в. остро встал вопрос о наличии в опухолевых клетках антигенов, отличных от нор мальных антигенов гистосовместимости, т. е. антигенов, специфичных для опухолей. Л. А. Зильбер, Г. И. Абелев были в числе первых исследователей в мире, представивших доказательства существования антигенных отличий опухолевых клеток от нормальных и разработавших первые иммунологиче ские методы их определения. Эти от личия, как это стало очевидным в хо де интенсивных исследований в сот нях лабораторий мира, касаются опу холей различной этиологии, гистоге неза и дифференцировки и могут быть связаны с приобретением, реэкспрессией или утратой нескольких ти пов нормальных клеточных антигенов и с приобретением новых специфиче ских трансплантационных опухолевых антигенов, так называемых СТОА, от ветственных за специфический проти воопухолевый иммунитет.
При трансплантации животным сингенных опухолевых клеток, в тех случаях, когда они экспрессируют СТОА, это проявляется в их специфи ческой иммуногенности и иммуночувствительности. Именно по этим свой ствам, определяемым в тестах in vivo,
идентифицируется наличие или отсут ствие в опухоли СТОА. По этим кри териям экспрессия СТОА была уста новлена в экспериментальных опухо лях животных, но не обнаружена в большинстве спонтанных опухолей тех же видов животных.
В некоторых типах новообразова ний были обнаружены эмбриональ ные антигены, из них первым был от крытый Г. И. Абелевым и соавт. аль- фа-фетопротеин, послуживший осно вой для иммунодиагностики и мони торинга этих новообразований, но не обладавший протективными свойства ми СТОА. В опухолях могут обнару живаться также антигенные отличия, связанные с некоторыми продуктами опухолевых клеток (в том числе функ ционально выполняющими роль СТОА), с экспрессией аллоантигенов гистосовместимости и группоспецифических антигенов эндогенных ретровирусов.
Продолжаются исследования по выяснению природы антигенов, рас познаваемых Т-клетками в цитотоксических тестах in vitro в опухолях чело века, и генов, ответственных за их экспрессию; предполагается создание на этой основе противоопухолевых "вакцин" типа MAGE, BAGE и др. Однако вопрос о наличии в клетках опухолей человека СТОА остается от крытым, поскольку методические воз можности испытания противоопухо левого иммунитета у человека в пря мых трансплантационных тестах не возможны; таким образом, они огра ничены в основном цитотоксическими тестами in vitro и использованием бестимусных мышей для опытов адоп тивного переноса Т-клеток. В опытах такого типа установлено, что различ ные типы антигенов в новообразова ниях человека действительно могут распознаваться Т-лимфоцитами (в том числе аутологичными) в тестах in vitro. Однако обнаружение некоторых из этих антигенов в нормальных орга нах и тканях человека, т. е. их тканевоспецифический характер, и отсутст вие доказательств их реального уча-
29-7908 Д. Г. Заридз е
Т а б л и ц а 10.1. Основные характеристики систем защиты организма против опухолей
|
Первичное распознавание |
|
|
Иммуноло |
||
|
опухолевых клеток |
|
|
гическая |
||
|
|
|
|
|
|
память и |
Системы за |
|
необходи |
поро |
Клеточные |
Реакция отторже |
возмож |
щиты |
ми |
мость в |
говая |
эффекторы |
ния |
ность адоп |
|
презента |
доза |
|
|
тивного пе |
|
|
шень |
|
|
|||
|
ции СТОА |
кле |
|
|
реноса (+ |
|
|
|
|
|
|||
|
|
(+ или —) |
ток |
|
|
или —) |
|
|
|
|
|
|
|
Естественный |
?*** |
- |
Еди |
Мф, моно |
Немедленная (не |
|
|
|
|||||
(врожденный) |
|
|
нич |
циты, ДК, |
требует предва |
|
иммунитет |
|
|
ные |
НК-клет- |
рительной имму |
|
|
|
|
|
ки, Нф |
низации) |
|
Специфиче |
СТОА* |
+ |
>105 |
АПК(Мф, |
Замедленная |
+ |
ский противо |
|
|
|
ДК); Т- |
(ГЗТ**) |
|
опухолевый |
|
|
|
лимфоци- |
|
|
иммунитет |
|
|
|
ты |
|
|
|
|
|
|
|
|
|
*Специфический трансплантационный опухолевый антиген распознается преимущественно
вконтексте с антигенами ОКГ I класса.
**ГЗТ — гиперчувствительность замедленного типа.
***Возможно, углеводная часть гликолипидов и гликопротеинов клеточной мембраны (неза висимо от экспрессии СТОА).
стия в индукции противоопухолевого иммунитета in vivo делают сомнитель ными перспективы успешного приме нения их в качестве профилактиче ских вакцин и/или иммунотерапевтических препаратов у онкологических больных.
Отличия антигенной структуры опухолевых клеток от аутологичных или сингенных нормальных клеток являются основой для различных ме ханизмов их распознавания и элими нации двумя эффекторными система ми защиты организма против опухо лей: а) врожденного (естественного, неспецифического) иммунитета и б) приобретенного специфического про тивоопухолевого иммунитета. Основ ные характеристики этих двух систем противоопухолевой защиты организма представлены в табл. 10.1 и разделах 10.1-10.4.
Хотя изменения антигенной струк туры опухолевой клетки в процессе трансформации и прогрессии касают ся также ядра и цитоплазмы, распо знавание опухолевой клетки Т-лим- фоцитами как "чужого" при развитии специфического противоопухолевого
иммунитета связано более всего со СТОА (или их функциональными аналогами), экспрессируемыми на клеточной мембране. Эффекторы сис темы неспецифической естественной резистентности распознают и отторга ют опухолевые клетки независимо от экспрессии на них СТОА.
Процесс возникновения и отбора новых вариантов (клонов) опухоле вых клеток в организме лежит в ос нове теории прогрессии опухоли, на правленной, как правило, в сторону усиления злокачественных свойств опухолевых клеток "от плохого к худ шему".
Естественная прогрессия опухоли включает автономизацию роста (в том числе утрату гормонозависимости), усиление туморогенности и инвазивных свойств, возникновение метаста тической активности. Очевидно, что отбор вариантов опухолевых клеток, резистентных к цитотоксическому действию (ЦТД) эффекторов хозяина и/или обладающих иммунодепрессивной активностью, является сущест венным для их выживания in vivo, т. е. важным фактором, определяющим их
450
туморогенную (ТГА) и спонтанную метастатическую активность (СМА).
Таким образом, при общности ме ханизмов трансплантационного и спе цифического противоопухолевого им мунитетов принципиальные биологи ческие различия между клетками-ми шенями, т. е. нормальными и опухо левыми клетками в значительной сте пени объясняют низкую эффектив ность многих прямых попыток имму нотерапии и иммунопрофилактики опухолей. Очевидно, что успех таких попыток зависит не только от поисков путей повышения эффективности специфической иммунизации против опухолей и повышения уровня неспе цифической, естественной резистент ности организма, но и от понимания биологии опухолевой клетки и, в ча стности, механизмов ее защиты про тив эффекторных систем хозяина.
10.1. Антигены опухолевых клеток
Исследование состава и экспрес сии различных типов антигенов в экс периментальных опухолях различного происхождения свидетельствует о том, что наряду с наличием или отсутстви ем в них общих или индивидуальных СТОА (в том числе в новообразовани ях одного происхождения) антигенная структура каждой опухоли индивиду альна в том смысле, что количествен ные соотношения между различными типами антигенов в ней (в том числе нормальных дифференцировочных и тканевых) могут существенно варьи ровать, вплоть до гиперэкспрессии, или, наоборот, полной утраты (так на зываемого антигенного упрощения) некоторых из них.
Поскольку регуляция роста и функционирования клетки осуществ ляется через молекулы и рецепторы клеточной мембраны, индивидуальная антигенная структура мембраны опу холевой клетки, по-видимому, в зна чительной степени определяет специ фичность и эффективность воспри ятия и передачи внешних сигналов и
29*
индивидуальные биологические ха рактеристики каждой линии транс формированных и опухолевых клеток, в том числе и их злокачественные свойства. Причины антигенного раз нообразия опухолевых клеток изучены недостаточно; предполагается их связь с уровнем дифференцировки клеток в момент трансформации, а также с различными типами мутаций (актива цией генов, их делецией и амплифи кацией), подавлением и/или усилени ем экспрессии некоторых клеточных генов.
Эксперименты на животных убеди тельно показали, что специфический противоопухолевый иммунитет связан главным образом с Т-клеточными ре акциями; гуморальные антитела про тив опухолевых клеток в аутологичной системе возникают нерегулярно и, как правило, не только не защищают жи вотных против опухолей, но могут способствовать их росту, выступая в роли блокирующих распознавание и отторжение. Редким исключением яв ляются антиидиотипические антитела к клеткам В-клеточных лимфом: экс прессия идиотипических иммуногло булинов на поверхности таких клеток делает их уязвимыми для ЦТД антиидиотипических антител (в сочетании с комплементом).
Естественная толерантность к ряду антигенов, экспрессируемых опухоле выми клетками, и иммунодепрессивное действие растущей опухоли не редко препятствуют обнаружению опухолевых антигенов с помощью аутологичных сывороточных антител и цитотоксических клеточных реакций. Клеточные цитотоксические тесты in vitro с использованием Т-лимфоцитов онкологических больных против кле ток аутологичной опухоли в тех случа ях, когда они не подавлены, по-види мому, позволяют обнаруживать изме нения антигенной структуры опухоле вых клеток, но не позволяют иденти фицировать их в качестве СТОА. Единственным убедительным методом обнаружения СТОА в опухолевых клетках и иммунитета к ним остаются
451
различные варианты трансплантаци онных тестов in vivo, использование которых на людях, естественно, не возможно.
Поскольку многие опухоли челове ка относятся к числу спонтанных, по аналогии с "безантигенными" спонтан ными опухолями животных, в них вряд ли можно ожидать наличия СТОА. Наиболее вероятными исключениями могут являться опухоли человека, вы званные УФ-облучением, онкогенными вирусами (например, лимфома Беркитта, Т-клеточная лимфома, папилло мы) и, возможно, некоторые виды профессионального рака, связанные с химическим производством.
Тем не менее иные, не связанные с экспрессией СТОА изменения анти генной структуры клеток спонтанных опухолей могут быть обнаружены и идентифицированы при использова нии клеточных цитотоксических тес тов in vitro, а также с помощью поликлональных (истощенных), монокло нальных и аутологичных антител. Та ким образом были открыты эмбрио нальный альфа-фетопротеин в опухо лях печени и тератобластомах, рако- во-эмбриональный антиген в опухо лях желудочно-кишечного тракта че ловека, а также ядерные Т-антигены опухолей животных, индуцируемых ДНК-содержащими опухолеродньми вирусами. Эти антигены не обладают протективными свойствами в опытах in vivo.
10.2. Специфические трансплантационные опухолевые антигены
Появление инбредных линий мы шей и возможность индукции у них опухолей с помощью химических кан церогенов и опухолеродных вирусов позволили обнаружить наличие в опу холях СТОА, ответственных за специ фический противоопухолевый имму нитет.
Впервые такие данные были полу чены в 50-е годы XX в., когда удалось показать, что опухоли мышей, инду цированные метилхолантреном, им мунизируют других мышей той же линии, а также хозяина первичной опухоли против клеток данной опу холи, но не иммунизируют против клеток других опухолей (в том числе вызванных метилхолантреном) и нормальных тканей мышей той же линии . В начале 60-х годов стало очевидным, что различные типы СТОА экспрессированы также в опу холях, индуцированных Д Н К - и РНК -содержащими онкогенными ви русами (табл. 10.2).
В ходе этих исследований были разработаны строгие критерии доказа тельств обнаружения СТОА в иссле дуемых экспериментальных опухолях с помощью трансплантационного тес та. Тест, используемый для обнаруже ния СТОА в опухолевых клетках, включает в себя (в различных моди-
Т а б л и ц а 10.2. Специфические трансплантационные опухолевые антигены (СТОА) в экс
периментальных опухолях различной этиологии
Индукция опухоли |
Тип СТОА |
Природа СТОА |
|
|
|
ДНК-содержащими он |
Общий для всех опухо |
Новый для клетки гликопротеин, ко |
когенными вирусами |
лей, вызванных данным |
дируемый ранним (трансформирую |
|
вирусом |
щим) геном вируса |
РНК-содержащими он |
Общий для всех опухо |
Структурные белки вируса, созреваю |
когенными вирусами |
лей, вызванных данным |
щего на клеточной мембране |
(экзогенными) |
вирусом |
|
Химическими канцеро |
Индивидуально-специ |
Возможно, измененные рецепторы к |
генами и УФ-облуче |
фический для каждой |
ростовым факторам; экспрессируе- |
нием |
опухоли |
мые в контексте с ОКГ фрагменты |
|
|
мутантных белков |
|
|
|
452
Та б л и ца 10.3. Количественный вариант трансплантационого теста in vivo, позволяющий
определить уровень специфического противоопухолевого иммунитета у иммунизированных животных (пример испытания)
|
ТТ* с клетками опухоли А, |
|
Индекс ре |
||||
|
|
привитыми в дозах: |
|
|
|||
Животные |
|
|
log ПД50** |
зистентно |
|||
|
|
|
|
|
|||
|
|
|
|
|
|
|
сти*** |
|
2х101 |
2х102 |
2· 103 |
|
2х104 |
|
|
Нормальные (контроль) |
0/5**** |
1/5 |
4/5 |
|
5/5 |
2,80 |
— |
Иммунизированные опухо |
|
|
|
|
|
|
|
левыми клетками А |
0/5 |
0/5 |
0/5 |
|
2/5 |
>4,46 |
>1,66 |
Иммунизированные опухо |
|
|
|
|
|
|
|
левыми клетками Б |
0/5 |
1/5 |
3/5 |
|
5/5 |
2,98 |
0,18 |
|
|
|
|
|
|
|
|
*Трансплантационный тест (количественный вариант).
**log 50% прививочной дозы опухолевых клеток.
***Разность log ПД50 в опыте и контроле.
****В числителе — число животных с выросшими опухолями; в знаменателе — число живот ных, привитых данной дозой опухолевых клеток.
фикациях) |
следующие |
основные |
этапы. |
|
|
1. Иммунизация нормальных сингенных животных клетками исследуе мой опухоли. Для иммунизации обыч но используют либо введение убитых (облучением) опухолевых клеток, ли бо хирургическое удаление узлов рас тущей исследуемой опухоли. Одновре менно проводят иммунизацию кон трольной группы животных нормаль ными тканями от животного — носи теля первичной исследуемой опухоли.
2. Прививка клеток исследуемой опухоли на нормальных и предвари тельно иммунизированных сингенных животных. При использовании коли чественного варианта трансплантаци онного теста группам нормальных и иммунизированных животных одно временно прививают несколько (3—5) десятикратно различающихся доз та ких клеток, что позволяет определить 50 % прививочную дозу опухолевых клеток и, таким образом, уровень туморогенности исследуемой опухоли в log ПД50 для каждой из сравниваемых групп животных. Таким образом по подавлению роста исследуемой опухо ли на иммунизированных животных по сравнению с нормальными уста навливаются наличие или отсутствие СТОА в исследуемой тест-опухоли, а
также уровень иммуночувствительности данной опухоли (табл. 10.3).
3. Для подтверждения сингенности системы производится пересадка кож ных лоскутов от животного — носите ля первичной опухоли животным — реципиентам опухолевых клеток (нор мальным и иммунным). Эта процеду ра, как и иммунизация нормальной тканью, широко использовалась в ранних исследованиях и применяется в настоящее время в случаях сомне ний в сингенности животных — носи телей первичной опухоли и реципиен тов опухолевых клеток.
Если исследуемая опухоль хорошо прививается на нормальных синген ных животных (и на животных, имму низированных нормальной тканью), но значительно хуже на животных, иммунизированных клетками иссле дуемой опухоли, и если нет сомнений в сингенности донора и реципиентов опухоли, полученные результаты сви детельствуют о наличии СТОА в ис следуемой опухоли. Специфичность обнаруженного СТОА для данной ис следуемой опухоли проверяется в пе рекрестных трансплантационных тес тах на группах животных, иммунизи рованных клетками других сравнивае мых опухолей. Об общности или раз личиях СТОА для группы опухолей
свидетельствуют данные перекрестной |
тотоксическими |
для |
|
опухолевых кле |
|||||||||||||||||
иммунизации клетками одной из них |
ток и не защищают последние от ЦТД |
||||||||||||||||||||
(и каждой из них) по отношению к |
иммунных |
лимфоцитов, |
монокло- |
||||||||||||||||||
остальным, а также обнаружение пе |
нальные |
антитела |
|
к |
очищенному |
||||||||||||||||
рекрестной |
иммуночувствительности |
большому Т-антигену SV40 распозна |
|||||||||||||||||||
сравниваемых |
линий |
|
опухолевых |
кле |
ют некоторые эпитопы этого антигена |
||||||||||||||||
ток (примером такого испытания мо |
на |
мембране |
трансформированных |
||||||||||||||||||
гут служить данные, приведенные в |
клеток. Однако до настоящего време |
||||||||||||||||||||
табл. |
10.3). |
|
|
|
|
|
|
|
ни неясной остается степень антиген |
||||||||||||
Современные |
представления |
об |
ного родства ядерного Т-антигена и |
||||||||||||||||||
экспрессии и природе СТОА, обнару |
мембранного |
СТОА. |
|
|
|
|
|
||||||||||||||
живаемых в опухолях разной этиоло |
Многочисленными опытами пока |
||||||||||||||||||||
гии, представлены в табл. 10.2. Лишь |
зано, что введение ДНК-содержащих |
||||||||||||||||||||
СТОА |
|
опухолей, |
|
индуцированных |
онкогенных |
вирусов |
иммунологиче- |
||||||||||||||
Д Н К - и РНК-содержащими онкоген- |
ски |
компетентным |
взрослым |
живот |
|||||||||||||||||
ными |
вирусами, |
являются действи |
ным |
приводит |
к |
инфицированию |
|||||||||||||||
тельно "чужими" для клетки и орга |
нормальных |
клеток |
|
хозяина, |
экс |
||||||||||||||||
низма, поскольку они кодируются ге |
прессии в них СТОА и к быстрому |
||||||||||||||||||||
нами этих вирусов. Трансформирую |
(через 4—6 дней) развитию специфи |
||||||||||||||||||||
щая активность ряда других типов он |
ческого |
противоопухолевого |
имму |
||||||||||||||||||
когенов, а также инактивация генов- |
нитета. При этом опухоли у живот |
||||||||||||||||||||
супрессоров (типа р53), по-видимому, |
ных не возникают. Вирусиндуциро- |
||||||||||||||||||||
не приводят к экспрессии СТОА в |
ванный |
противоопухолевый |
иммуни |
||||||||||||||||||
трансформированных |
и |
опухолевых |
тет является |
высокоспецифичным и |
|||||||||||||||||
клетках. |
|
|
|
|
|
|
|
|
|
сохраняется до конца жизни живот |
|||||||||||
СТОА |
опухолей, |
|
индуцированных |
ных. С его помощью можно предот |
|||||||||||||||||
ДНК-содержащими вирусами (в отли |
вратить развитие первичных и пода |
||||||||||||||||||||
чие |
|
от |
|
опухолей, |
|
индуцированных |
вить |
рост |
перевиваемых |
опухолей |
|||||||||||
РНК-содержащими вирусами), не |
данной |
вирусной этиологии. |
Вместе |
||||||||||||||||||
входят в состав вирионов, т. е. не яв |
с тем уровень специфического про |
||||||||||||||||||||
ляются |
структурными |
белками |
виру |
тивоопухолевого |
иммунитета, |
инду |
|||||||||||||||
сов. ДНК-содержащие онкогенные |
цируемого вирусом (а также и опухо |
||||||||||||||||||||
вирусы |
(полиомы, |
SV40, |
некоторые |
левыми |
клетками), |
|
всегда |
является |
|||||||||||||
аденовирусы) |
индуцируют |
специфи |
относительным и, как правило, за |
||||||||||||||||||
ческие для данного вируса (точнее для |
щищает |
иммунизированных |
|
живот |
|||||||||||||||||
его |
трансформирующего гена) |
транс |
ных |
против |
не |
более |
чем |
|
10—100 |
||||||||||||
плантационные |
антигены |
на |
самых |
ПД50 опухолевых клеток. |
|
|
|
||||||||||||||
ранних стадиях (уже в первые 3—6 ч) |
Индуцированный |
|
вирусом |
(или |
|||||||||||||||||
инфицирования клеток, т. е. задолго |
опухолевыми |
клетками) |
специфиче |
||||||||||||||||||
до проявления признаков их морфо |
ский |
противоопухолевый |
иммунитет |
||||||||||||||||||
логической трансформации. Экспрес |
является клеточным: он может быть |
||||||||||||||||||||
сия этих СТОА постоянно сохраняет |
перенесен на нормальных животных с |
||||||||||||||||||||
ся |
на мембране |
трансформированных |
помощью Т-клеток, но не с помощью |
||||||||||||||||||
(и |
опухолевых) клеток. |
|
|
|
гуморальных |
антител |
к |
структурным |
|||||||||||||
Динамика появления СТОА иссле |
вирусным белкам. Этот классический |
||||||||||||||||||||
дована на модели инфекции нормаль |
пример |
развития |
|
специфического |
|||||||||||||||||
ных клеток вирусом SV40, где ранний |
противоопухолевого иммунитета у им- |
||||||||||||||||||||
(А) ген этого вируса индуцирует Т-ан- |
мунологически компетентных |
живот |
|||||||||||||||||||
тиген в ядрах и его процессированную |
ных вошел в литературу как "феномен |
||||||||||||||||||||
форму (СТОА) — на клеточных мем |
вирусиндуцированной |
резистентно |
|||||||||||||||||||
бранах. Хотя гуморальные антитела к |
сти". Наоборот, введение тех же пре |
||||||||||||||||||||
ядерному Т-антигену SV40 животных — |
паратов ДНК-содержащих онкоген |
||||||||||||||||||||
носителей |
опухолей |
не являются |
ци- |
ных |
вирусов |
новорожденным, |
имму- |
||||||||||||||
454
нологически некомпетентным живот |
• |
возможность индукции у них |
||||||||||||||||||||||||
ным, хотя также инфицирует их клет |
|
|
специфического |
противоопухо |
||||||||||||||||||||||
ки и индуцирует в них экспрессию |
|
|
левого |
иммунитета |
(и, следова |
|||||||||||||||||||||
СТОА, |
не |
вызывает |
противоопухоле |
|
|
тельно, |
отсутствие |
толерантно |
||||||||||||||||||
вого иммунитета, но вызывает опухо |
|
|
сти |
к СТОА); |
|
|
|
|
|
|
||||||||||||||||
ли. Очевидно, что быстрый рост ново |
• |
|
возможность |
подавления |
у |
|
них |
|||||||||||||||||||
рожденных животных приводит к то |
|
|
(полностью |
или |
частично) |
ин |
||||||||||||||||||||
му, что при клеточном делении из |
|
|
дукции |
первичных |
опухолей. |
|
||||||||||||||||||||
большинства инфицированных клеток |
На |
схеме |
10.1 |
|
представлены |
дан |
||||||||||||||||||||
геном вируса и его СТОА быстро эли |
|
|||||||||||||||||||||||||
ные |
шести серий |
наших |
опытов |
|
по |
|||||||||||||||||||||
минируются, |
сохраняясь |
к |
моменту |
|
||||||||||||||||||||||
предотвращению |
|
первичных |
(SV40) |
|||||||||||||||||||||||
иммунологического |
|
созревания |
жи |
|
||||||||||||||||||||||
|
опухолей, |
с |
помощью |
однократной |
||||||||||||||||||||||
вотных |
(8—10-й |
день |
жизни) |
лишь в |
||||||||||||||||||||||
иммунизации |
животных тем же |
виру |
||||||||||||||||||||||||
немногих |
трансформированных клет |
|||||||||||||||||||||||||
сом |
на |
различных |
этапах |
латентного |
||||||||||||||||||||||
ках; |
это |
является |
достаточным |
для |
||||||||||||||||||||||
периода |
канцерогенеза. Как видно |
из |
||||||||||||||||||||||||
возникновения |
опухолей, |
но |
недоста |
|||||||||||||||||||||||
этих |
данных, |
эффективность предот |
||||||||||||||||||||||||
точным |
антигенным |
стимулом |
для |
|||||||||||||||||||||||
вращения |
опухолей |
у животных, про- |
||||||||||||||||||||||||
развития |
противоопухолевого |
имму |
||||||||||||||||||||||||
иммунизированных |
в |
первой полови |
||||||||||||||||||||||||
нитета. |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
не латентного периода, достигала |
90— |
|||||||||||||||
Установлено, |
что во время |
латент |
||||||||||||||||||||||||
100 %, |
существенно |
снижалась |
при |
|||||||||||||||||||||||
ного периода |
канцерогенеза |
инфици |
||||||||||||||||||||||||
иммунизации |
в конце латентного |
|
пе |
|||||||||||||||||||||||
рованные |
ДНК-содержащими |
онко- |
|
|||||||||||||||||||||||
риода |
и |
|
была неэффективной |
после |
||||||||||||||||||||||
генными вирусами животные не явля |
|
|||||||||||||||||||||||||
его завершения. |
|
|
|
|
|
|
|
|
||||||||||||||||||
ются ни толерантными, ни иммунны |
|
|
|
|
|
|
|
|
||||||||||||||||||
Как и |
клетки опухолей, |
индуциро |
||||||||||||||||||||||||
ми к СТОА. После окончания латент |
||||||||||||||||||||||||||
ванных ДНК-содержащими вирусами, |
||||||||||||||||||||||||||
ного периода у животных возникают |
||||||||||||||||||||||||||
первичные |
опухоли |
(саркомы), несу |
клетки опухолей и лейкозов, вызван |
|||||||||||||||||||||||
щие СТОА. По мере роста опухолей |
ных РНК-содержащими вирусами, |
|||||||||||||||||||||||||
(приблизительно с 5—10-го дня после |
иммуногенны и также содержат об |
|||||||||||||||||||||||||
появления |
пальпируемых |
опухолевых |
щий для данного вируса СТОА. Но в |
|||||||||||||||||||||||
узлов) у животных — носителей опу |
отличие от первых СТОА опухолей, |
|||||||||||||||||||||||||
холей |
начинает развиваться специфи |
вызванных экзогенными РНК-содер |
||||||||||||||||||||||||
ческий |
противоопухолевый |
иммуни |
жащими |
|
вирусами, |
представляют |
|
со |
||||||||||||||||||
тет к ним. Однако к моменту возник |
бой структурные белки оболочки ви |
|||||||||||||||||||||||||
новения |
этой |
иммунологической |
ре |
руса, |
|
созревающего |
на |
|
клеточной |
|||||||||||||||||
акции опухолевых клеток в организме |
мембране (см. табл. 10.2). Введение |
|||||||||||||||||||||||||
уже настолько много, что лишь незна |
(или индукция) антител к этим бел |
|||||||||||||||||||||||||
чительная часть из них может быть |
кам |
может подавить распространение |
||||||||||||||||||||||||
отторгнута. |
|
|
|
|
|
|
|
|
|
вирусной инфекции, но не защищает |
||||||||||||||||
Возникновение |
первичных |
опухо |
против |
клеток |
солидных |
опухолей, |
||||||||||||||||||||
лей у животных может быть предот |
индуцируемых этими вирусами. Во |
|||||||||||||||||||||||||
вращено |
с |
помощью |
специфического |
прос о наличии в таких опухолях |
||||||||||||||||||||||
противоопухолевого |
|
|
иммунитета. |
СТОА, отличных от структурных ви |
||||||||||||||||||||||
Принципиально эта возможность бы |
русных белков, все еще остается не |
|||||||||||||||||||||||||
ла впервые показана на модели пер |
вполне ясным. Иммунитет к опухолям |
|||||||||||||||||||||||||
вичных |
опухолей, |
индуцируемых |
ви |
и лейкозам, индуцируемых РНК-со |
||||||||||||||||||||||
русом SV40 у сирийских хомячков, за |
держащими вирусами, может быть пе |
|||||||||||||||||||||||||
раженных |
этим |
вирусом |
в |
|
первый |
ренесен |
|
лимфоидными |
клетками |
и |
||||||||||||||||
день жизни. Повторное введение этим |
выявляется с |
помощью транспланта |
||||||||||||||||||||||||
животным вируса SV40 во время ла |
ционного теста. |
|
|
|
|
|
|
|
|
|||||||||||||||||
тентного периода канцерогенеза (т. е. |
Все еще загадочными по своей |
|||||||||||||||||||||||||
после |
достижения |
иммунологической |
природе |
|
остаются |
|
индивидуальные |
|||||||||||||||||||
зрелости) показало: |
|
|
|
|
|
|
СТОА |
опухолей, |
индуцируемых |
у |
|
ла- |
||||||||||||||
455

С х е м а 10.1. Эффективность предотвращения первичных опухолей (SV40)
при специфической иммунизации во время латентного периода канцерогенеза
Латентный период (0-120 дней) |
Появление первичных опухолей (120->300 дней) |
|
у контрольных (неиммунных) животных |
SV40* — заражение новорожденных животных вирусом SV40; SV40** — однократная им мунизация зараженных животных (на разных этапах латентного периода и после его за вершения)
бораторных животных химическими канцерогенами или УФ-облучением. Индуцированные канцерогеном у од ного и того же животного или даже в одном органе (например, в печени) множественные первичные опухоли характеризуются каждая своим уни кальным СТОА. Эти опухоли высокоиммуногенны и иммуночувствительны, в особенности индуцированные УФ-облучением.
Поскольку химические канцероге ны и УФ-лучи являются мутагенами, предполагается, что возникновение индивидуальных СТОА в клетках, трансформированных этими агента ми, связано с генными мутациями. Клональная природа большинства опухолей, в том числе индуцирован ных этими агентами, позволяет объяс нить индивидуальный характер СТОА таких опухолей, как результат экспан сии клеток определенного опухолево го клона, несущего на своей поверх ности уникальный набор измененных антигенов клетки-предшественницы.
В пользу этого предположения свиде тельствуют данные о продукции идиотипических иммуноглобулинов В-кле- точными новообразованиями, обла дающими способностью иммунизиро вать животных против данной опу холи.
С большой степенью вероятности, но косвенно (по результатам испыта ния иммуногенности опухоли) можно предполагать, что количество СТОА на клетках различных опухолей одно го происхождения может существенно варьировать, определяя тем самым эффективность их презентации ДК и Мф и уровень возникающего специ фического противоопухолевого имму нитета. Так, опухоли, индуцирован ные УФ-облучением, как и опухоли, вызванные химическими канцероге нами, содержат индивидуально-спе цифические трансплантационные опухолевые антигены, обладающие выраженной иммуногенностью. Мно гие из опухолей, вызванных УФ-облу чением, подвергаются спонтанной
456
Т а б л и ца 10.4. Возникновение и рост опухолей in vivo, обусловленный неэффективно
стью систем защиты организма
Условие |
Последствия |
|
|
Незрелость эффекторных систем противоопухоле |
Нераспознавание опухолевых кле |
вой защиты новорожденных |
ток; отсутствие ЦТД; возможность |
|
индукции опухолей, в том числе со |
|
держащих СТОА |
Толерантность к СТОА |
То же |
Утрата активности отдельными компонентами |
|
эффекторных систем защиты организма при раз |
|
личных врожденных генетических или приобре |
|
тенных (вторичных) иммунодефицитах |
|
Блокирование эффекторов СТОА ганглиозидами; |
Нераспознавание опухолевых кле |
апоптоз Т- и НК-лимфоцитов FAS-L, продуци |
ток и/или подавление ЦТА эффекто |
руемыми опухолевыми клетками |
ров систем защиты организма |
Блокирование СТОА опухолевых клеток антите |
Нераспознавание опухолевых кле |
лами; утрата СТОА при отборе in vivo; утрата час |
ток; возможность роста опухоли, |
ти антигенов ОКГ I—II классов |
экспрессирующей СТОА; снижение |
|
иммуногенности и иммуночувстви- |
|
тельности опухолевых клеток |
Естественный отбор in vivo опухолевых клеток, |
Резистентность к ЦТА эффекторов |
способных к локальной защите против эффекто |
естественной защиты организма (на |
ров врожденного иммунитета хозяина с помощью: |
пример, к активированным Мф, |
а) активации механизмов катаболизма опухоле |
нейтрофилам и ΗК-клеткам) |
выми клетками цитотоксических факторов |
|
эффекторных клеток (например, Н202); |
|
б) секреции (активного выброса) опухолевыми |
|
клетками иммунодепрессантов быстрого и |
|
локального действия (например, ПГЕ2) |
|
регрессии вскоре после возникнове ния. Некоторые из таких высокоиммуногенных опухолей можно транс плантировать только на бестимусных мышах или на животных, подвергну тых иммунодепрессии, в частности сильному УФ-облучению (как извест но, подавляющему эффекторные ме ханизмы специфического противоопу холевого иммунитета и неспецифиче ской естественной резистентности). В подавлении иммунных реакций при УФ облучении кожи существенную роль играют ДК и Мф-супрессоры.
Сейчас известны лишь некоторые механизмы, определяющие неэффек тивность защитных систем организма против опухолевых клеток (табл. 10.4). Так, селективные преимущества при росте опухолей в организме иммунокомпетентного хозяина имеют клетки: а) опухолевые, утратившие СТОА, или
содержащие этот антиген в меньшем количестве, или имеющие его в доста точном количестве, но в менее дос тупной для распознавания форме (на пример, при блокировании антитела ми); б) утратившие антигены ОКГ I класса, существенные для их распо знавания Т-лимфоцитами; в) обла дающие способностью к секреции факторов иммунодепрессивного дей ствия, например простагландинов ти па Е2 (ПГЕ2), как известно, секретируемых многими типами злокачест венных опухолевых клеток и подав ляющих цитотоксическую активность Т-киллеров и НК-клеток.
Сопоставление двух основных ха рактеристик клеток СТОА-содержа- щих опухолей — их иммуногенности и иммуночувствительности in vivo — свидетельствует о том, что данные ха рактеристики могут не коррелировать.
457
Это относится особенно к злокачест венным опухолям, длительное время росшим в иммунном организме, и, в частности, к их высокометастатиче ским вариантам: сохраняя полностью или частично иммуногенность СТОА, клетки таких опухолей в процессе иммуноселекции приобретают иммунорезистентность, что, естественно, спо собствует их выживанию в организме иммунных животных. Наоборот, СТОА-содержащие опухоли, росшие в организме короткое время после воз никновения противоопухолевого им мунитета и в особенности трансфор мированные in vitro СТОА-содержа щие клетки (т. е. вообще не проходив шие отбора in vivo), как правило, иммуногенны и иммуночувствительны. Соответственно клетки таких опухо лей более эффективно отторгаются in vivo и такие линии клеток относитель но менее туморогенны.
В отличие от индуцированных опу холей спонтанные опухоли животных (и спонтанно трансформированные in vitro линии клеток) не иммуногенны или вызывают чрезвычайно низкий уровень резистентности к повторной прививке опухоли. Такие опухоли, как правило, не иммуночувствительны, т. е. одинаково растут на нормальных и предварительно иммунизированных животных. Однако среди спонтанных опухолей могут быть опухоли, экспрессирующие СТОА. К числу таких исключений относятся некоторые спонтанные опухоли молочных желез мышей, остеогенные саркомы и лимфомы мышей. Такие спонтанные опу холи могут быть иммуногенными и иммуночувствительными. В некото рых из этих случаев, например при спонтанном раке молочных желез мы шей, может быть идентифицирована связь СТОА со структурными белками РНК-содержащего вируса рака молоч ных желез (вируса Биттнера) и/или с часто обнаруживаемыми в таких опу холях вирусами лейкоза мышей (виру са Гросса). Непостоянство иммуните та к опухолям молочных желез мышей в ряде случаев оказалось связанным с
вертикальной передачей этого вируса и соответственно с развитием у мы шей толерантности к структурным ви русным белкам.
Многие опухоли человека и их ме тастазы, а также экспериментальные и спонтанные опухоли мышей сохраня ют нормальный уровень экспрессии антигенов ОКГ I класса. Более зако номерно утрата экспрессии этих моле кул наблюдается лишь при некоторых злокачественных опухолях человека, таких как нейробластомы, мелкокле точный рак легкого и хорионэпителиома. В последнем примере это, воз можно, отражает низкий уровень экс прессии ОКГ в трофобластических клетках-предшественниках данной опухоли. При нейробластоме и мелко клеточном раке легких низкий уро вень экспрессии ОКГ, как предпола гается, связан с активностью (ампли фикацией) гена с-тус.
Исследование экспрессии |
ОКГ |
I класса при других опухолях и |
мета |
стазах человека (рак молочной желе зы, меланома, рак толстой кишки) свидетельствует о том, что профессия опухоли в сторону усиления злокаче ственности лишь в некоторых случаях коррелирует с подавлением экспрес сии этих молекул.
10.3. Эффекторные механизмы противоопухолевого иммунитета
Одним из кардинальных |
свойств |
|
злокачественных |
опухолей |
является |
их способность |
к неконтролируемому |
|
(автономному) росту in vivo. В какой мере этот рост действительно является неконтролируемым? Исследование этого вопроса показывает, что авто номность роста опухоли всегда отно
сительна и |
в организме существует |
ряд систем, |
контролирующих этот |
процесс. К таким системам организма следует, в частности, отнести: 1) эф фекторы врожденного и приобретен ного иммунитета и 2) рострегулирующие сигналы (ингибирующие и сти-
458
мулирующие) нормального клеточно го микроокружения (в том числе органоспецифические и гормональные) (механизмы последних не связаны с эффекторными клетками противоопу холевого иммунитета и не будут рас смотрены в данной главе).
Неблагоприятные условия для вы живания опухолевых клеток in vivo становятся особенно очевидными при их исследовании с помощью мечен ных l25IuDR клеток в условиях их ес тественной или искусственной диссеминации в организме. Как правило, в русле кровяных и лимфатических со судов, а затем в капиллярном ложе органов подавляющее большинство опухолевых клеток, введенных внут ривенно, оседает уже в первые не сколько минут после введения и более 90 % из них погибает в первые 6—10 ч после введения. Лишь редкие вариан ты клеток оказываются способными выжить в капиллярном ложе органов, проникнуть сквозь эндотелий сосудов в паренхиму органа и позднее сфор мировать колонии опухолевых клеток, так называемые экспериментальные метастазы. Зная количество введен ных в кровоток отдельных опухолевых клеток и подсчитав количество вырос ших экспериментальных метастазов (каждый из которых является кло ном), можно определить пропорцию опухолевых клеток в исходной попу ляции, способных выжить и сформи ровать метастазы. Показано, что даже для наиболее злокачественных (высо кометастатических) клеточных линий эта пропорция не превышает 1:103— 1:104 клеток; для низкозлокачествен ных линий эта пропорция часто со ставляет менее 1:10б клеток. Столь массовая и быстрая гибель опухоле вых клеток in vivo, по-видимому, свя зана с крайне неблагоприятными для выживания условиями при их диссеминации, включающими их взаимо действие с эффекторами неспецифи ческого иммунитета (моноцитами, Мф, НК-клетками и Нф) в период на хождения в кровяном русле, и при по следующих контактах с эндотелием и
нормальным клеточным микроокру жением в паренхиме органа. Анало гичный процесс массовой гибели опу холевых клеток и отбора имеет место
ипри их естественной (так называе мой спонтанной) диссеминации in vivo.
При подкожной прививке опухоле вых (или трансформированных in vit ro) клеток пропорция выживших кле ток существенно выше, но, как прави ло, для формирования подкожного
опухолевого узла животным необходи мо ввести 102 —104 или более клеток. Лишь в результате процесса естест венного отбора in vivo туморогенность
иметастатическая активность опухо левых клеток существенно повышают ся, изредка достигая возможности трансплантации единичных клеток.
Таким образом, выживание опухо левых клеток в организме при локаль ном подкожном росте опухоли, их ис кусственной (или естественной) дис семинации и формировании метаста зов является крайне неэффективным процессом, включающим элементы случайности, жесткого отбора предсуществующих вариантов клеток и воз никновения и отбора новых вариан тов.
Изучение свойств опухолевых кле ток, выживших в процессе длительно го отбора in vivo, и их сравнение с ро дительскими клетками свидетельству ют о том, что процесс отбора может идти по множеству признаков (ско рость роста, уровень дифференцировки, антигенные свойства, чувствитель ность к ростовым факторам, клоногенность, зависимость роста от суб страта, гормонозависимость, туморо генность, способность к формирова нию экспериментальных и спонтан ных метастазов и др.). К наиболее ра но отбираемым признакам относится приобретение свойств, обеспечиваю щих опухолевые клетки способностью противостоять ЦТД ДК, Мф и Н К - клеток, т. е. защищаться против эф фекторных систем врожденного им мунитета хозяина.
Надежды на выявление СТОА (от ветственных за специфический проти-
459
воопухолевый иммунитет) в спонтан ных опухолях животных и человека, за редким исключением, до последнего времени не оправдались, поэтому в 60-е годы XX в. казалось, что рост та ких опухолей in vivo в отличие от опу холей, несущих СТОА, происходит вне иммунологического контроля хо зяина. Лишь к концу 70-х — началу 80-х годов возникло представление о том, что весьма существенную (и до настоящего времени недооцененную) роль в защите организма против опу холей играет еще одна система защи ты — система неспецифического есте ственного иммунитета.
При сравнении двух эффекторных систем противоопухолевого иммуни тета организма, специфического Т- клеточного и врожденного (неспеци фического) очевидно, что различия между ними касаются всех аспектов реакции хозяина против опухоли: ти пов и функции эффекторных клеток, мишеней и механизма распознавания,
скорости |
и |
эффективности |
реакции |
отторжения, |
возникновения |
(или от |
|
сутствия) |
иммунологической |
памяти |
|
(см. табл. 10.1). При этом система ес тественного иммунитета является иммунологически неспецифичной, но самодостаточной в распознавании и элиминации опухолевых клеток, в то время как активация специфического Т-клеточного противоопухолевого им мунитета реализуется при участии ДК,
Мф |
и В-клеток, осуществляющих |
свои |
антигенпрезентирующие функ |
ции. Таким образом, эти две системы взаимодействуют, "разговаривая"' друг с другом и с опухолевыми клетками на языке контактных сигналов и про дукции цитокинов. "Язык" этих сигна лов сложен и, в частности, остается неясным механизм возникновения первичного иммунного ответа на опу холевые клетки, экспрессирующие СТОА. По-видимому, А П К могут по
глощать |
СТОА, |
слущивающиеся |
с |
|
клеточной |
мембраны |
опухолевых кле |
||
ток, и в |
этом случае |
презентировать |
||
их в контексте с ОКГ II класса. Уста |
||||
новлено, |
что ДК, |
локализованные |
в |
|
коже и других тканях организма, иг рают особенно важную роль в распо знавании опухолевых клеток: они спо собны поглощать и процессировать антигены и затем экспонировать на своей поверхности большие количест ва ОКГ-пептидных комплексов, вме сте с костимуляторными молекулами В7. Т-клеточные рецепторы распозна ют фрагменты антигена на мембране ДК в комплексе с ОКГ I или II клас сов, что приводит к активации соот ветственно Т-киллеров (CD8) и/или Т-хелперов (CD4). Другой важной функцией ДК является обеспечение толерантности к собственным антиге нам хозяина и, таким образом, защи ты от аутоиммунных реакций. По ана логии с реакциями естественного им мунитета на некоторые Т-зависимые бактериальные и вирусные антигены можно предполагать, что А П К играют инструктивную роль при возникнове нии Т-клеточного противоопухолево го иммунитета.
Распознавание СТОА опухолевых клеток (как и вирусов и вирусных белков на клеточной мембране) может осуществляться и непосредственно Т- лимфоцитами (в этом случае в ассо циации с антигенами I класса ОКГ в условиях генетической рестрикции).
В последние годы стала ясна структура рецептора Т-клеток, распо знающего "чужое": это молекула (90 кДа), состоящая из двух цепей. Меха низм формирования разнообразия Т- лимфоцитов на уровне клеточного ге нома оказался аналогичен механизму формирования разнообразия В-кле- точных иммуноглобулинов. В отличие от большинства последних рецепторы Т-клеток не секретируются, т. е. оста ются связанными с мембраной Т-лим- фоцита. Механизмы распознавания аллоантигенов и иммунорегуляторные взаимодействия между ДК, М ф , В- клетками и субпопуляциями Т-лим- фоцитов (в основном киллеров, хелперов и супрессоров) являются пред метом интенсивных исследований многих лабораторий мира.
Иммунорегуляторные сигналы воз-
460
никают при участии цитокинов, сек- |
ративный стимул как на Т-лимфоци- |
||||||||||||||||||
ретируемых |
эффекторными |
и/или |
ты (при участии костимуляции), так и |
||||||||||||||||
опухолевыми |
клетками |
и работающих |
на НК-клетки. Это обстоятельство по |
||||||||||||||||
по типу локальных ростовых факторов |
зволило в последние годы выращивать |
||||||||||||||||||
позитивного и негативного действия. |
in vitro в присутствии ИЛ-2 Т-лимфо- |
||||||||||||||||||
Примерами |
|
иммунорегуляторных |
циты и НК-клетки и их клоны прак |
||||||||||||||||
взаимодействий |
между |
различными |
тически |
в |
неограниченных |
количест |
|||||||||||||
типами эффекторов могут служить Т- |
вах. Смесь активированных Т-лимфо- |
||||||||||||||||||
хелперы, стимулирующие В-лимфо- |
цитов и НК-клеток, извлеченных из |
||||||||||||||||||
циты к продукции антител и Т-лим- |
крови или опухолевой ткани онколо |
||||||||||||||||||
фоциты к пролиферации, а также Т- |
гических больных и выращенных in |
||||||||||||||||||
супрессоры, |
подавляющие |
продукцию |
vitro в присутствии ИЛ-2, были обо |
||||||||||||||||
антител В-лимфоцитами. |
|
|
|
значены как LAK-клетки (lymphokin- |
|||||||||||||||
Другими |
иммунорегуляторами |
яв |
activated killers) и TIL-клетки (tumor- |
||||||||||||||||
ляются интерфероны α, β и γ. Интер- |
infiltrating |
lymphocytes) |
и |
предложены |
|||||||||||||||
фероны |
α и β , |
имеющие |
общий |
ре |
для иммунотерапии опухоли, в том |
||||||||||||||
цептор, продуцируются вирусинфици- |
числе в аутологичной системе. |
|
|||||||||||||||||
рованными клетками; γ-интерферон |
Реакции специфического противо |
||||||||||||||||||
продуцируется |
активированными |
Т- |
опухолевого иммунитета на рост опу |
||||||||||||||||
клетками. |
Интерфероны |
обладают |
холи, как и реакция на аллотранс- |
||||||||||||||||
способностью |
стимулировать |
цито- |
плантат нормальной ткани, носит ха |
||||||||||||||||
токсическую активность Т-киллеров, |
рактер реакции типа замедленной ги |
||||||||||||||||||
Мф и НК-клеток, а также обладают |
перчувствительности (ГЗТ). Для пер |
||||||||||||||||||
антипролиферативной активностью и |
вичного |
ответа |
при |
возникновении |
|||||||||||||||
способностью к усилению (восстанов |
специфического |
противоопухолевого |
|||||||||||||||||
лению) экспрессии антигенов ОКГ на |
иммунитета необходимо время и по |
||||||||||||||||||
клеточной мембране |
различных типов |
явление в организме довольно значи |
|||||||||||||||||
нормальных и опухолевых клеток. Ак |
тельного |
|
числа |
антигенсодержащих |
|||||||||||||||
тивированные при росте опухоли или |
опухолевых клеток (как правило, не |
||||||||||||||||||
искусственно, Мф и НК-клетки спо |
менее 105—106). При вторичном ответе |
||||||||||||||||||
собны |
неспецифически |
убивать |
опу |
эффективность и темп реакции оттор |
|||||||||||||||
холевые клетки данной, а также и |
жения существенно усиливаются, но в |
||||||||||||||||||
других опухолей без участия Т-лим- |
отличие от реакции на аллотранс- |
||||||||||||||||||
фоцитов. Однако гиперактивация |
Мф |
плантат |
нормальной |
ткани |
отторже |
||||||||||||||
может приводить к проявлению ими |
ние опухолевых клеток редко превы |
||||||||||||||||||
неспецифической |
иммуносупрессор- |
шает 10—100 ПД50: в абсолютных |
|||||||||||||||||
ной активности и подавлению как |
цифрах |
количество отторгаемых |
опу |
||||||||||||||||
врожденного, так |
и |
специфического |
холевых клеток обычно составляет ме |
||||||||||||||||
противоопухолевого |
|
иммунитета. |
|
нее 106. Поскольку возникновение |
|||||||||||||||
К числу |
сильных |
иммунорегуля |
иммунитета и отторжение |
антигенсо |
|||||||||||||||
держащих |
опухолевых |
клеток проис |
|||||||||||||||||
торных |
факторов, |
секретируемых |
Мф |
||||||||||||||||
ходит |
на |
фоне |
быстрого, |
опережаю |
|||||||||||||||
и Т-лимфоцитами, |
|
относятся |
интер- |
||||||||||||||||
|
щего |
иммунный |
ответ |
роста |
опухоли, |
||||||||||||||
лейкины. Сейчас известен ряд различ |
|||||||||||||||||||
этот |
процесс внешне |
остается неза |
|||||||||||||||||
ных по своей функциональной актив |
|||||||||||||||||||
метным. |
|
|
|
|
|
|
|
||||||||||||
ности типов интерлейкинов; из них |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
наибольшее внимание в системе про |
Вместе с тем возможность возник |
||||||||||||||||||
тивоопухолевого |
иммунитета |
привле |
новения и роста любых опухолей в |
||||||||||||||||
кают ИЛ - 1, ИЛ-2, ИЛ-6 и ИЛ-12. |
нормальном организме находится |
под |
|||||||||||||||||
Идентификация |
новых |
типов |
интер |
контролем |
системы неспецифическо |
||||||||||||||
лейкинов и исследования их биологи |
го естественного |
иммунитета, незави |
|||||||||||||||||
ческой |
активности |
|
продолжаются. |
симо от экспрессии СТОА. Об этом |
|||||||||||||||
Наиболее широко используется ИЛ-2, |
свидетельствует |
следующий |
ряд |
на |
|||||||||||||||
который оказывает мощный пролифе- |
блюдений: |
|
|
|
|
|
|
||||||||||||
461
•низкая эффективность и отсут ствие преимуществ при транс плантации СТОА-содержащих опухолей (по сравнению с не со держащими СТОА спонтанными опухолями) на бестимусных мы шах, как известно, обладающих полноценной системой эффек торов естественного иммуни тета;
•высокая скорость элиминации клеток антигенных (как и безан тигенных) опухолей в организме нормальных (неиммунных) жи вотных и снижение эффектив ности такой элиминации на мы шах, дефектных по созреванию НК-клеток (так называемых beige мышах);
•отбор in vivo в процессе роста СТОА-содержащих и безанти генных опухолей, клеточных ва риантов, обладающих резистент ностью к ЦТД Н К - клеток и Мф;
•примерно одинаковая чувстви тельность СТОА-содержащих и безантигенных опухолей к ЦТД М ф , активированных in vitro и/ или НК-клеток (в том числе и ксеногенных).
Поскольку подавляющее большин ство опухолей человека и животных являются спонтанными и, как прави ло, низкоиммуногенными (несмотря на часто сохраняющуюся в них экс прессию ОКГ), а эффекторы системы естественного иммунитета распознают клетки любых опухолей, независимо от экспрессии СТОА, эта система, очевидно, является основным и уни версальным механизмом защиты орга низма как против опухолей различно го происхождения, так и против вирусинфицированных клеток, в то вре мя как специфический Т-клеточный противоопухолевый иммунитет, эволюционно более молодой, по-видимо му, представляет частный механизм такой защиты.
В защите организма против опухо лей система врожденного иммунитета имеет очевидные преимущества по
сравнению со специфическим проти воопухолевым иммунитетом. Важней шими из этих преимуществ являются следующие:
•постоянная (немедленная) го товность к распознаванию опу холевых клеток и их элиминации (цитостатическому и цитотоксическому действию на них); от сутствие необходимости в пре зентации антигена и предвари тельной иммунизации;
•неспецифичность, т. е. незави симость реакции от наличия или отсутствия СТОА в распознавае мых опухолевых клетках и от идентичности антигенов ОКГ в клетках опухоли и эффекторах (независимость от правил гене тической рестрикции). Это под разумевает принципиально иной (по сравнению со специфиче ским иммунитетом) механизм распознавания опухолевых кле ток;
•возможность эффективного рас познавания и элиминации не большого числа или даже еди ничных опухолевых клеток, что особенно важно в периоды воз никновения опухолей и при воз никновении метастазов.
Механизм распознавания опухоле вых клеток эффекторами системы ес тественного иммунитета (как и меха низмы их активации при контакте с опухолевыми клетками) выяснены не достаточно. Предполагается, что ДК, Мф и НК-клетки обладают лектиноподобными рецепторами распознава ния опухолевых клеток, а объектами распознавания для Мф и НК-клеток на клеточной мембране опухолевых клеток являются (вне контекста с ан тигенами ОКГ) различные гликопротеины и гликолипиды (ганглиозиды). Замена отдельных Сахаров в структуре мембранных гликопротеинов сущест венно влияет на распознавание опухо левых клеток активированными Мф; взаимодействие ганглиозидов различ ных типов с Мф и НК-клетками мо-
462
гут в большей или меньшей степени блокировать их ЦТД. Злокачествен ные опухолевые клетки обладают вы раженной способностью слущивать ганглиозиды клеточных мембран в ок ружающую среду (кровь, асцит), где нередко и происходит блокирование ЦТД НК-клеток и Мф .
Цитотоксическое (киллерное) дей ствие активированных Мф и НК-кле ток на опухолевые клетки осуществ ляется с помощью разных механизмов и различных продуктов этих клеток. Так, в гранулах больших гранулярных лимфоцитов (НК-клеток) содержится высокотоксичное для опухолевых кле ток вещество (перфорин), образующее поры в клеточной мембране; при не посредственном контакте перфорин переходит из НК-клеток в опухоле вые, где при участии сериновых про теаз вызывает их апоптоз.
Резидентные Мф в отличие от ак тивированных оказывают на опухоле вые клетки цитостатическое действие. Внутриклеточный механизм актива ции Мф находится под контролем G- белков, определяющих высвобожде ние Са2+ из эндоплазматического ретикулума клетки, а также его поступ ление извне и активацию протеинкиназы С. Накопление Са2+ в Мф акти вирует в них ряд ферментов (в том числе фосфолипазы и кальмодулинзависимую протеинкиназу). Эти внутри клеточные события в Мф осуществля ются чрезвычайно быстро (секунды, минуты, часы) под влиянием сигна лов, поступающих с мембранных ре цепторов. На ранних этапах в Мф ак тивируются так называемые ранние гены (гены компетенции), экспрессия которых ведет к продукции некоторых цитокинов (ИЛ-1 и Ф Н О ) . К числу генов раннего ответа относятся протоонкогены c-fos и с-тус, активируемые ЛПС уже в первые минуты контакта с Мф; экспрессия м Р Н К этих генов достигает пика через 30 мин и снижа ется через 60 мин. Экспрессия этих генов определяется внутриклеточным уровнем Са2+ и связана с инозитолфосфатным путем передачи сигналов;
подавляется при увеличении клеточ ной цАМФ. Известно, что активация Мф только Л П С (наиболее часто ис пользуемый активатор) может быть недостаточным стимулом; в этом слу чае сигнал γ-интерферона может су щественно усилить фосфорилирование ряда белков протеинкиназами и соответственно продукцию Мф неко торых цитокинов и факторов прямого цитотоксического действия. Проявле ние киллерного ЦТД Мф на опухоле вые клетки in vitro требует большего времени (от 24 до 72 ч).
К числу основных факторов пря мого ЦТД активированных Мф при реакции на опухолевые клетки (как и при воспалении) относятся продукты кислородного взрыва (особенно Н202), Ф Н О , ИЛ-1 и азотные оксиды (NO2-/NO3-). Локально в зоне опухоле вого роста их продукция активирован ными Мф может существенно варьи ровать в зависимости от характера ин дуцирующего стимула, положительно го или негативного, и влияния раз личных иммуномодуляторов, секретируемых самим М ф , лимфоидными клетками и клетками опухоли.
Способностью к реакции в форме кислородного взрыва в организме об ладают активированные ДК, Мф (и моноциты крови) и нейтрофилы (по следние без предварительной актива ции). При этом резко возрастает по требление глюкозы и кислорода: при отсутствии глюкозы в среде и в ана эробных условиях кислородный взрыв не осуществляется. Сигнал для взрыва начинается с рецепторов клеточной мембраны активированного Мф (схе ма 10.2) и передается следующим об разом: G-белки -» гидролиз фосфолипазой С фосфотидилинозитола -» по явление инозитолтрифосфата и диацилглицерола -» появление протеинкиназы С и накопление Са2+ -» фосфорилирование белков -» появление NADPH-оксидазы -» возникновение кислородного взрыва и появление в среде 02 , Н2 02 и ОН. Превращение иона супероксида (02 ) в перекись во дорода (Н202) осуществляется супер-
463

С х е м а 10.2. Передача сигнала для двух метаболических взрывов в активиро
ванных Мф: выброс PGE (или LT) и свободных радикалов кислорода, а также инактивация Н202 антиоксидантными ферментами
GP — G-белок; PC — фосфатидилхолин; PLC — фосфолипаза С; DAG — 1,2-диацилгли- церол; PLA2 — фосфолипаза А2; РСс -- протеинкиназа С; PGE — простагландин типа Е; LT — лейкотриены; АА — арахидоновая кислота (по Adams, Nathan, 1983, модифи цировано)
оксидисмутазой. Н2 02 (как и некото |
вреждающему |
действию |
продуктов |
|||||||||||
рые другие реактивные формы кисло |
кислородного |
взрыва |
(в |
том |
числе к |
|||||||||
рода) обладает сильным цитотоксиче- |
Н202) и иммунодепрессивному дейст |
|||||||||||||
ским действием на бактерии, а также |
вию |
ПГЕ2. |
|
|
|
|
|
|||||||
на нормальные и опухолевые клетки. |
Одним из наиболее активных ци- |
|||||||||||||
Накопление |
внутри |
активирован |
тотоксических |
факторов активирован |
||||||||||
ного |
Мф Са2+ приводит также к акти |
ных |
Мф является Ф Н О - α , или кахек- |
|||||||||||
вации фосфолипазы А2, которая, |
тин, секретируемый Мф уже через |
|||||||||||||
окисляя |
арахидонат |
фосфолипидного |
30—60 мин после совместного дейст |
|||||||||||
слоя |
мембраны |
М ф , |
является |
сигна |
вия γ-интерферона и |
Л П С . |
Близким |
|||||||
лом для активации метаболизма ара |
ему по активности и структуре (около |
|||||||||||||
хидоновой кислоты по циклооксиге- |
30 % гомологии по аминокислотным |
|||||||||||||
назному (или липооксигеназному) |
пу |
последовательностям) |
является Ф Н О - |
|||||||||||
ти. В среде при |
этом |
быстро |
(в тече |
β (лимфотоксин), |
секретируемый ак |
|||||||||
ние |
нескольких минут) |
появляются |
тивированными |
|
Т-лимфоцитами. |
|||||||||
простагландины типа Е2 (или лейко |
Кроме ЦТД, |
на |
опухолевые |
клетки |
||||||||||
триены), |
обладающие многообразной |
Ф Н О оказывает регуляторное |
влияние |
|||||||||||
биологической |
активностью, |
в |
том |
на многие типы клеток и их функции |
||||||||||
числе |
сильным |
иммуносупрессивным |
и, в частности, усиливает экспрессию |
|||||||||||
действием. Предполагается, что не |
О К Г II класса и рецепторов к ИЛ-2 на |
|||||||||||||
специфическая |
иммуносупрессивная |
активированных Т-клетках, усиливает |
||||||||||||
активность |
гиперактивированных |
их |
пролиферацию, |
восстанавливает |
||||||||||
Мф-супрессоров |
обусловлена |
их |
ЦТД |
Т-киллеров, |
подавленную T G F - |
|||||||||
способностью |
секретировать |
ПГЕ2, |
β; увеличивает ЦТД НК-клеток и дей |
|||||||||||
как известно, подавляющие ЦТД Т- |
ствует вместе с ИЛ-2 в образовании |
|||||||||||||
киллеров, НК-клеток и Нф . Сами Мф |
LAK-клеток; |
увеличивает |
продукцию |
|||||||||||
относительно более резистентны к по |
O-2 и Н2 02 моноцитами и нейтрофила- |
|||||||||||||
464
ми и соответственно их бактерицидность и "опухолецидность"; усиливает экспрессию антигенов HLA-A-B на опухолевых клетках человека и стиму лирует выброс простагландинов этими клетками. Однако при длительном введении животным Ф Н О вызывает у них кахексию, напоминающую кахек сию онкологических больных.
ЦТД активированных Л П С Мф опосредовано Ф Н О - α , и антитела к последнему отменяют активирующее Мф действие Л П С . Резидентные Мф почти не продуцируют определимые количества Ф Н О - α , но при активации ЛПС продукция этого белка увеличи вается подчас в 1000 раз. γ-Интерфе- рон сам не. вызывает продукцию этого белка, но усиливает транскрипцию ге на Ф Н О - α (находящегося в области генов ОКГ в хромосоме 6 человека и хромосоме 17 мыши). Синтез Ф Н О Мф регулируется in vivo глюкокортикоидами и простагландинами типа Е2 (последние подавляют его продук цию). В то же время Ф Н О - α может индуцировать продукцию ПГЕ2 рези дентными Мф . Синтез Φ Η Ο - β акти вированными Мф осуществляется при постоянном присутствии в среде Л П С и останавливается при удалении по следнего. Период полувыведения ФНО очень короток (6—20 мин), по этому поддержание высокого уровня ФНО in vivo сложно. Вместе с тем оно опасно из-за выраженных побочных явлений.
Наряду с ЦТД на опухолевые клет ки Ф Н О - α увеличивает продукцию клетками эндотелия прокоагулянтного фактора и способствует образованию фибрина в сосудистом ложе, окру жающем очаг прилипших опухолевых клеток. Возникающее нарушение кро воснабжения растущей опухоли, ее ге моррагический некроз являются ха рактерными патоморфологическими картинами действия Ф Н О - α на опу холь in vivo. Побочное действие Ф Н О - α было исследовано на добровольцах: повышение температуры, озноб, тахи кардия, боли в мышцах и другие сим птомы, характерные для начала ин
30- 7 9 0 8 Д. Г. Заридз е
фекционного заболевания, а также падение кровяного давления были от мечены у большинства здоровых лю
дей, |
подвергнутых |
воздействию |
Ф Н О - α . |
|
|
ИЛ - 1, секретируемый |
активиро |
|
ванными Мф, как и Ф Н О - α , обладает цитотоксическим действием на опухо левые клетки и по ряду биологических свойств весьма сходен с Ф Н О . Одна ко, как правило, опухолевые клетки, чувствительные к ИЛ - 1, нечувстви тельны к Ф Н О , и наоборот. Различ ными являются рецепторы к Ф Н О - α
иИЛ-1, но внутриклеточные механиз мы действия этих факторов, по-види мому, сходны и их противоопухолевое действие синергично. ИЛ-1 в комби нации с Ф Н О - α , в частности, усили вает перифокальное воспаление в оча ге опухолевого роста, поскольку ИЛ-1 увеличивает экссудацию белых клеток крови, в том числе Т-лимфоцитов и НК-клеток из кровяного русла в опу холевую ткань и регионарные лимфа тические узлы. ИЛ-1 усиливает ЦТД НК-клеток за счет их лучшего связы вания с опухолевыми клетками. Так же как и в случае секреции активиро ванным Мф Ф Н О - α , γ-интерферон существенно усиливает ЦТД ИЛ - 1 . Кроме того, ИЛ-1 оказывает влияние на дифференцировку моноцитов, Мф
иНК-клеток при их активации, опре деляя функциональную активность этих эффекторов неспецифического естественного противоопухолевого иммунитета.
Исследования механизмов естест венного и адоптивного противоопухо левого иммунитета легли в основу не скольких серьезных попыток иммуно терапии спонтанных опухолей челове ка и животных с помощью активиро ванных эффекторов преимущественно системы естественного иммунитета (Мф, НК-клетки), но также в смеси с
Т-лимфоцитами |
(LAK-клетками). |
LAK-клетки больных, |
выращиваемые |
в огромных количествах in vitro в при сутствии ИЛ-2, или большие дозы ИЛ-2 вводили пациентам с запущен ными формами рака. При этом в от-
465
дельных случаях авторы наблюдали частичную регрессию первичной опу холи и ее метастазов. Однако ограни ченный и, как правило, временный успех, тяжелейшие осложнения (поч ти непереносимость) такой терапии, ее индивидуальный характер и исклю чительная дороговизна сделали невоз можным дальнейшее использование этого метода. Теми же авторами в ка честве альтернативного источника бо лее цитотоксичных эффекторных кле ток позднее были предложены TILклетки (tumor-infiltrated lymphocytes), размножаемые в присутствии ИЛ-2; такие клетки, по данным автора, об ладают в 100 раз более высоким уров нем цитотоксического действия на опухоль и, следовательно, могут быть введены в меньших дозах. Однако применение и этого материала для иммунотерапии опухолей оказалось недостаточно эффективным.
Многочисленные попытки исполь зования активированных Мф для им мунотерапии опухоли, начатые еще в 60-е годы XX в., продолжаются и со вершенствуются до настоящего време ни. В последние годы для этих целей предложены различные способы акти вации Мф и НК-клеток in vivo. Пока зано, что внутривенное введение жи вотным липосом, содержащих различ ные активаторы ЦТД Мф (в том числе цитокины), защищает их от экспери ментальных и спонтанных метастазов.
В эксперименте на животных было показано, что трансфузия клеток интактного нормального костного мозга (содержащего М ф , моноциты, Н К - клетки, Нф и их предшественники) также защищает животных против экспериментальных и спонтанных ме тастазов. Представлена серия доказа тельств того, что НК-клетки могут эффективно подавлять развитие экс периментальных легочных метастазов.
Иммунотерапия эксперименталь ных вирусиндуцированных опухолей, несмотря на достаточно высокий уро вень экспрессии СТОА, оказалась не эффективной, поскольку позволяет отторгать весьма ограниченное число
опухолевых клеток (~ до 106), не со поставимое с числом имеющихся в пальпируемой (и растущей) опухоли. Наиболее доступный для специфиче ской иммунизации против СТОА-со- держащей опухоли материал — опухо левые клетки (инактивированные тем или иным способом), помимо имму низирующего эффекта, нередко обла дают иммунодепрессивной активно стью. К тому же гетерогенность попу ляции опухолевых клеток, формирую щих опухолевый узел, в условиях спе цифической иммунизации (естествен ной или искусственной) против СТОА данной опухоли, как правило, посте пенно приводит к отбору иммунорезистентных вариантов опухолевых клеток. Попытки справиться с этими ограничениями в эксперименте с клетками опухолей животных, напри мер усилением в них экспрессии СТОА, или антигенов ОКГ, путем введения в опухолевые клетки генов, ответственных за продукцию опреде ленных антигенов и/или иммуномодуляторов (ИЛ-2 и др.), а также чуждых СТОА (так называемая гетерогенизация опухоли), использование для им мунизации очищенных СТОА или их пептидов, а также различных методов активной и пассивной иммунизации (в том числе адоптивного переноса иммунных Т-лимфоцитов) до настоя щего времени имели ограниченный успех.
Более широкое применение полу чило сочетание неспецифической им мунотерапии опухоли (в частности, введение некоторых цитокинов) с другими методами лечения онкологи ческих больных. При некоторых фор мах лейкозов у детей, а также при ра ке почки человека использование альфаинтерферона отдельно, а также в со четании с химиотерапией оказалось эффективным у некоторых из таких пациентов. Ряд ранних публикаций о клиническом успехе применения вак цины Б Ц Ж для неспецифической им мунотерапии опухолей человека не были подтверждены при последующих испытаниях и, более того, в экспери-
466

менте на |
животных |
было показано, |
|
что введение Б Ц Ж |
подавляет |
специ |
|
фический |
противоопухолевый |
имму |
|
нитет. |
|
|
|
Этиология и патогенез некоторых видов опухолей человека связаны с инфекционными вирусными заболе ваниями, приводящими к необрати мым повреждениям органа. Напри мер, некоторые формы рака печени человека этиологически связаны с ви русным гепатитом В, перенесенным подчас за 20—30 лет до возникнове ния опухоли. В этом случае профи лактическая вакцинация против гепа тита В защищает человека не только против гепатита, но также против воз никновения рака печени. Применение такой вакцины в настоящее время по лучило широкое распространение во многих странах.
Моноклональные антитела к опу холевым маркерам пока не нашли ши рокого применения для иммунотера пии опухолей человека, поскольку они не обладают цитотоксической ак тивностью и, являясь Ig мыши, быст ро нейтрализуются антимышиными антителами. Более перспективно их применение для терапии В-клеточных лейкозов в виде препаратов, связан ных с клеточными ядами типа рицина А. Такие препараты уже применяются in vitro для освобождения костного мозга от лейкозных клеток.
Следует признать, что иммунотера пия опухолей, как и иммунопрофи лактика рецидивов и метастазов опу холи, имеет принципиально те же ог раничения, что и химиотерапия опу холей или антибиотикотерапия бакте риальных инфекций: гетерогенность популяции опухолевых клеток (как и бактерий), способность их отдельных вариантов к выживанию при токсиче ских воздействиях (и таким образом к отбору) создают условия для возник новения (в процессе лечения и в ре зультате лечения) популяций клеток, резистентных к данному виду тера пии. В этой связи очевидно, что спе цифическая иммунизация при опухо-
зо*
левом процессе может быть эффек тивной лишь при определенных огра ничивающих условиях:
1)в период, когда опухолевых кле ток в организме очень мало и все они иммуночувствительны (экспрессируют СТОА);
2)если в момент иммунизации иммунная система хозяина не подавлена (способна к ответу);
3)если имеется соответствующий препарат для эффективной им мунизации.
Очевидно, что такие условия скла дываются лишь до появления опухо ли, на самом раннем этапе первично го опухолевого процесса, индуцируе мого известным онкогенным вирусом, что возможно только в эксперименте на животных. Примеры успешной реализации таких условий показаны на схеме 10.1, где на самых ранних этапах вирусного (SV40) канцерогене за (во время латентного периода) у подавляющего большинства животных удается с помощью однократной спе цифической иммунизации предотвра тить возникновение первичных опухо лей.
Для спонтанных опухолей эти ус ловия реализовать невозможно, по скольку этиология индивидуальных опухолей и стадия канцерогенеза (до момента возникновения опухоли) ос таются неизвестными. Для предотвра щения таких опухолей представляется важным сохранение функциональной активности всех типов эффекторов системы неспецифического естествен ного иммунитета и выявление групп риска возникновения тех или иных опухолей с целью максимально ран ней их диагностики. Поскольку мно гие типы канцерогенных агентов (хи мические канцерогены, УФ- и рентге новское облучение) одновременно об ладают способностью к подавлению врожденного иммунитета хозяина, очевидно, что вдвойне важно устране ние этих агентов из окружающей че ловека среды.
10.4. Иммунологический надзор организма и отбор опухолевых клеток в процессе роста
и прогрессии опухоли
В конце 60-х годов XX в. Φ. М. Барнет сформулировал концепцию имму нологического надзора организма над возникновением опухолей. Созданию этой концепции предшествовали два важных обстоятельства: выяснение роли Т-лимфоцитов в реакциях транс плантационного иммунитета и обна ружение СТОА во многих типах экс периментальных опухолей. В соответ ствии с концепцией иммунологиче ского надзора Φ. М. Барнета основ ной функцией Т-клеточного иммуни тета является распознавание и оттор жение "чужого" (или "измененного своего").
Φ. М. Барнет высказал предполо жение, что в организме постоянно по являются мутантные клетки, обладаю щие потенциями опухолевого роста, но подавляющее большинство из них распознается как чужое и элиминиру ется еще до сформирования опухоли. Распознавание таких клеток, по Барнету, осуществляется Т-лимфоцитами и обусловлено антигенными отличия ми опухолевых клеток от нормальных клеток хозяина. Из концепции следо вало, что рост антигенно-чуждых опу холей должен способствовать разви тию специфического Т-клеточного противоопухолевого иммунитета, а иммуносупрессия (например, с помо щью тимэктомии) — увеличению час тоты возникновения опухолей.
Экспериментальные исследования отчасти подтверждали правильность концепции иммунологического надзо ра Барнета. Так, было показано, что рост многих типов эксперименталь ных опухолей вирусного происхожде ния, а также опухолей, индуцирован ных химическими канцерогенами, действительно сопровождается разви тием специфического противоопухо левого Т-клеточного иммунитета. Бо лее того, удаление тимуса у мышей, а
также другие способы подавления Т- клеточного иммунитета делают жи вотных более восприимчивыми к воз никновению вирусных опухолей и их трансплантации на таких животных. Однако частота возникновения спон танных опухолей у бестимусных мы шей оказалась примерно такой же низкой, как и у мышей тех же линий с нормально функционирующим ти мусом. Постепенно стало ясно, что Т- клеточная система иммунитета крайне важна для защиты против вирусных инфекций, а также вирусиндуцированных и СТОА-содержащих опухо лей; ее роль в контроле возникнове ния и роста спонтанных опухолей жи вотных не получила подтверждения, как не получила подтверждение гипо теза X. Т. Прэна о стимулирующем рост опухоли действии Т-лимфоцитов.
В клинической практике 60—90-х годов XX в. при трансплантации орга нов и тканей у пациентов, подвергаю щихся иммуносупрессии, было отме чено увеличение частоты возникнове ния спонтанных опухолей преимуще ственно В-клеточной природы, иногда содержавших геном вируса Эпштей- на—Барр. Однако у пациентов, под вергавшихся иммуносупрессии, не возникали опухоли, относящиеся к наиболее распространенным нозоло гическим формам рака у человека (рак легкого, рак желудка и толстого ки шечника, рак молочной железы).
Открытие в 60—70-е годы неспеци фической цитотоксической активно сти активированных Мф, а позднее — естественных киллеров (НК-клеток), идентификация последних как боль ших и средних гранулярных лимфо цитов, отличающихся от Т-лимфоци тов по морфологии и экспрессии не которых мембранных рецепторов, привлекли внимание многих исследо вателей к системе неспецифического естественного иммунитета организма к опухоли. Одновременно стало оче видным, что ЦТД in vitro любых типов эффекторов (Т-лимфоцитов, НК-кле ток, ДК, активированных Мф), как правило, не коррелируют с уровнем
468
противоопухолевого иммунитета in vi vo. Естественно, возникал вопрос о природе антигенов, распознаваемых этими эффекторами в опухолевых клетках in vitro. Неясно, в какой сте пени реакции клеточного противоопу холевого иммунитета in vitro (специ фического и неспецифического) отра жают уровень противоопухолевого иммунитета in vivo.
Наиболее адекватным подходом к исследованию поставленных вопросов являются опыты по индукции опухо лей или трансплантации опухолевых клеток на нормальных и иммунных животных, а также на животных, имеющих генетические или приобре тенные (т. е. вторичные) дефекты сис тем как врожденного, так и приобре тенного противоопухолевого иммуни тета. Для Т-лимфоцитов такими де фектными животными являются бестимусные животные, а также мыши с тяжелым комбинированным иммуно дефицитом (SCID); для ДК, Мф и НК-клеток — это животные с подав ленной различными методами функ цией ДК, Мф и НК-клеток; для Н К - клеток — это животные с генетиче ским дефектом созревания НК-кле ток, например beige (бежевые) мыши.
Возможности возникновения, рос та и прогрессии опухоли in vivo, обу словленные первичным или вторич ным (т. е. приобретенным) иммуноде фицитом систем противоопухолевой защиты организма, многообразны и все еще недостаточно изучены. К ним относятся как дефекты самих систем защиты организма (врожденные или приобретенные), так и свойства опу холевых клеток, препятствующие их распознаванию эффекторными систе мами и/или цитотоксическому дейст вию этих систем (см. табл. 10.4). Опу холевый (и метастатический) фенотип трансформированных клеток, как правило, включает признаки, опреде ляющие большую или меньшую рези стентность опухолевых клеток к ЦТД эффекторов систем защиты организ ма. По-видимому, механизмы защиты опухолевых клеток против эффекто
ров систем защиты организма не ис черпываются примерами, приведен ными в табл. 10.4. Например, секре ция простагландинов опухолевыми клетками осуществляется немедленно, в течение нескольких минут после их непосредственного контакта с М ф , НК-клетками или нейтрофилами. По следствием этой активной защитной реакции опухолевых клеток является быстрое (практически немедленное) подавление ЦТД НК-клеток и Т-лим фоцитов и способности нейтрофилов к кислородному взрыву; активирован ные Мф, сами обладающие способно стью к кислородному взрыву и выбро су ПГЕ2, существенно более рези стентны к иммунодепрессивному дей ствию ПГЕ2. Параллельно включается другой механизм защиты опухолевых клеток против продуктов кислородно го взрыва активированных Мф и ней трофилов, который связан с актива цией катаболизма Н2 02 (в частности, каталазы, а также окислительно-вос становительного цикла глютатиона), позволяющий опухолевым клеткам выживать в присутствии в 10—100 раз более высоких концентраций переки си водорода по сравнению с нормаль ными клетками.
Интересно, что приобретение этих двух механизмов защиты опухолевых клеток, т. е. Н202-катаболизирующей активности и способности к выбросу ПГЕ2, происходит синхронно в про цессе отбора in vivo трансформирован ных in vitro клеток, исходно не обла дающих этими свойствами. Синхрон ный характер возникновения феноти па [H202R + ΠΓΕS ] в опухолевых клет ках, отобранных in vivo, выглядит так, как если бы эти два механизма в опу холевых клетках были биохимически сопряжены, подобно тому как они со пряжены в активированных Мф (см. рис. 10.2).
Показано, что экспрессия феноти па [H202R + ΠΓΕS ] не связана с транс формирующей активностью ряда из вестных онкогенов. По-видимому, единственным исключением является онкоген v-src, индуцирующий экс-
469
прессию фенотипа [H202R + ПГES] в процессе трансформации нормаль ных клеток in vitro и in vivo. Соответ ственно такие клетки без отбора in vi vo высокорезистентны к ЦТД Мф и НК-клеток и обладают практически максимальным уровнем туморогенной активности in vivo. Селективные пре имущества других отобранных in vivo редких вариантов опухолевых клеток, обладающих этим фенотипом, корре лируют с их резистентностью in vitro к ЦТД активированных Мф, моноци тов, нейтрофилов и НК-клеток, и со ответственно с уровнем их туморогенности.
Отмечаемое многими исследовате лями отсутствие корреляции между уровнем специфического (и неспеци фического) противоопухолевого им мунитета, определяемого in vivo и ЦТД in vitro активированных Т-лим фоцитов, М ф , НК-клеток и Нф, объ ясняется:
ного переноса, но с трудом — в цитотоксических тестах с им мунными Т-лимфоцитами in vit ro. Эти обстоятельства не позво ляют переносить полученные in vitro результаты таких тестов (по ложительные или отрицатель ные) на перспективы иммуноло гического отторжения тех же опухолевых клеток in vivo.
Подобно патогенным микробам и вирусам, обладающим множеством различных механизмов защиты про тив антибактериальных и антивирус ных эффекторных систем организма, генетически лабильная злокачествен ная опухолевая клетка в процессе опу холевой прогрессии также развивает различные механизмы защиты и отби рается в организме по признакам, по зволяющим ей выжить in vivo во враж дебном клеточном окружении. Следу ет подчеркнуть, что основные меха низмы антибактериальной и антиви
•несопоставимостью условий, в русной защиты используются эффек
которых реализуются эти актив ности in vitro и in vivo. ЦТД in vit ro определяется в каждой реак ции одним из этих эффекторов по отношению к определенной дозе опухолевых клеток, в опре деленной среде, в течение огра ниченного времени. В распозна вании и отторжении этих же клеток in vivo соучаствуют и взаимодействуют все перечис ленные выше эффекторы на протяжении более длительного периода времени в условиях не ограниченного числа и продол жающегося роста (и отбора) опу холевых клеток;
• различиями в антигенах, распо знаваемых в цитотоксических тестах in vitro и реакциях оттор жения опухолевых клеток in vivo. Эти различия особенно очевид ны в случае СТОА-экспресси- рующих опухолевых клеток, лег ко распознаваемых в количест венных трансплантационных тестах in vivo и опытах адоптив-
торами врожденного иммунитета так же и для защиты против опухолевых клеток.
Показано, что варианты опухоле вых клеток отбираются в организме прежде всего по множеству связанных с выживаемостью in vivo свойств, в том числе:
•способность защищать себя про тив эффекторных систем хозяи на (Мф, Нф и НК-клеток), не специфически распознающих "чужое";
•способность секретировать фак торы, подавляющие эти эффек торы (иммунодепрессивное дей ствие опухоли);
•(менее регулярно) снижение экспрессии антигенов ОКГ I класса.
В результате такого отбора выжив шие варианты опухолевых клеток, как правило, более резистентны к ЦТД активированных М ф , НК-клеток и Т- лимфоцитов. Соответственно опухо левые клетки приобретают селектив-
470
ные преимущества in vivo, развивая и используя для своей защиты против этих эффекторов вполне адекватные и специфические механизмы (напри мер, как уже было отмечено выше, усиленный катаболизм Н2 02 в ответ на его продукцию активированными Мф и Н ф , а также выброс иммунодепрессанта ПГЕ2 при контакте с Н К - клетками и Мф) .
Другой механизм защиты опухоле вых клеток против активированных Мф, ДК, Τ и НК лимфоцитов связан с FAS-FAS-L взаимодействием. FAS (АРО-1, CD-95) является трансмем бранным белком. Показано, что боль шинство клеток иммунной системы организма экспрессируют FAS и/или FAS-L либо конститутивно, либо при активации, что предполагает возмож ность различных регуляторных взаи модействий между ними (в том числе при создании иммунологически при вилегированных зон). Трансформиро ванные и опухолевые клетки (как и нормальные) обычно экспрессируют мембраносвязанную форму FAS бел ка, и в этом случае активированные эффекторные клетки, экспрессирующие FAS-L, могут вызывать их апоптоз. Однако для ряда опухолей челове ка (меланомы, рак толстого кишечни ка и др.) показано, что клетки их наи более злокачественных вариантов экс прессируют также и FAS-L, в том чис ле в секретируемой форме, при этом экспрессия FAS снижается и клетки таких опухолей становятся резистент ными к ЦТД FAS-экспрессирующих Т- и НК-клеток, вызывая апоптоз по следних. Данные экспериментальной иммунологии опухолей свидетельству ют, что эти коллизии нередко реали зуются в процессе роста и прогрессии как СТОА-экспрессирующих, так и неэкспрессирующих опухолей.
Приведенные примеры не исчер пывают все возможности опухолевых клеток для защиты против эффектор ных систем организма и для выжива ния in vivo, но позволяют лучше по нять, в чем состоят биологические от личия злокачественной опухолевой
клетки от трансформированной. В процессе отбора и прогрессии in vivo трансформированные клетки переста ют быть пассивными мишенями для ЦТД эффекторов систем защиты орга низма и отбираются in vivo, в том чис ле и, по-видимому, в первую очередь по способности к активной локальной защите. Приобретение опухолевыми клетками в процессе такого отбора ре зистентности к ЦТД эффекторов есте ственного иммунитета организма оп ределяет их лучшую выживаемость in vivo и соответственно более высокий уровень туморогенности.
Количественные трансплантацион ные тесты in vivo свидетельствуют, что чем выше уровень туморогенной (и метастатической) активности СТОАэкспрессирующих (или неэкспресси рующих) опухолевых клеток, тем эф фективнее они преодолевают реакции отторжения специфического и неспе цифического противоопухолевого им мунитета и тем меньше опухолевых клеток (в абсолютных значениях) бу дет отторгнуто. Эти данные обнару живают наличие важной для иммуно терапии опухолей связи (обратной за висимости) между уровнем злокачест венности опухолевых клеток и воз можностями иммунологического кон троля их роста in vivo.
Таким образом, теперь уже столет няя история попыток создания клеточ ных, антигенных, вирусных и рекомбинантных "вакцин" против рака с их, как правило, временным и частичным успехом (как и более успешный почти 50-летний опыт химио- и лучевой те рапии новообразований человека) сви детельствует о том, что в разной степе ни, но общим камнем преткновения при этих воздействиях является биоло гия злокачественной опухолевой клет ки. Приобретаемая in vivo злокачест венными вариантами опухолевых кле ток резистентность к ЦТД Мф, Н К - клеток и Т-лимфоцитов, как и рези стентность к химио- и лучевой тера пии, имеют разные механизмы, но как явления, обусловленные отбором, име ют общую биологическую природу.
471
* * *
Обнаружение в 50—60-е годы XX столетия специфических транспланта ционных опухолевых антигенов в большинстве экспериментальных (ин дуцированных) опухолей лаборатор ных животных и сформулированная А. М. Барнетом концепция иммуно логического надзора на десятилетия определили основные направления в изучении противоопухолевого имму нитета. Казалось, что Т-клеточный иммунитет является единственной за щитной реакцией организма против опухолей. Огромному числу исследо вателей, привлеченных в эту область прежде всего перспективами специ фической иммунотерапии и иммуно профилактики опухолей, мы обязаны рядом крупных достижений и собст венно созданием области Т-клеточной иммунологии.
Позднее стало очевидным, что большинство спонтанных опухолей животных в отличие от эксперимен тальных не является ни иммуногенными, ни иммуночувствительными при испытании in vivo. Они могут приобретать свойства СТОА при не которых мутагенных воздействиях. Важно подчеркнуть, однако, что и в этом случае, как и в случае опухолей, исходно экспрессирующих СТОА, специфический противоопухолевый иммунитет в отличие от транспланта ционного иммунитета к нормальным аллоантигенам всегда является отно сительным и может быть преодолен при прививке больших доз опухоле вых клеток.
Эта существенно более низкая эф фективность отторжения сингенных опухолевых клеток связана не только с тем, что СТОА по иммуногенности, по-видимому, сопоставимы со слабы ми (минорными) антигенами гистосовместимости, но также с принципи альными биологическими отличиями опухолевых клеток от нормальных. В то время как трансплантат нормаль ной аллогенной ткани является гене тически стабильным и не располагает
механизмами защиты против эффек торных систем хозяина, распознаю щих и отторгающих его как "чужое", к числу основных характеристик расту щей in vivo опухоли относится практи чески неограниченная на популяционном уровне возможность возникно вения и отбора новых и устойчивых к токсичным (и иным) воздействиям опухолевых клонов. Уже в 50-е годы XX в. появились первые и основопо лагающие наблюдения о роли мута ций и отбора в прогрессии опухолей. Эти данные были получены в процес се искусственного отбора in vivo асцитных вариантов опухолевых клеток из солидных опухолей. Роль естест венного отбора в канцерогенезе и опухолевой прогрессии и, в частно сти, возможное влияние реакций вро жденного иммунитета на эти процес сы при развитии спонтанных, не экс прессирующих СТОА опухолей оста вались практически неизвестными до конца 70-х — начала 80-х годов. Тогда впервые возник вопрос, в какой сте пени реакции естественного (врож денного) неспецифического иммуни тета хозяина, осуществляемые Мф, ДК, Нф и НК-клетками, являются факторами естественного отбора и эволюции опухоли in vivo. Открытие Мечниковым еще в начале XX в. роли Мф в воспалении и много позже от крытие антигенпрезентирующей функции Мф, ДК и В-лимфоцитов в реакциях Т-клеточного и гуморально го иммунитета (и продукции различ ных типов цитокинов Мф и другими эффекторными клетками) создавали впечатление, что система естественно го иммунитета, играя существенную роль в воспалении, выполняет лишь некоторую вспомогательную роль при Т-клеточных иммунологических реак циях на опухоли и вирусные инфек ции. Влияние эффекторов системы естественного иммунитета на канце рогенез in vivo в течение многих лет рассматривалось как незначительное.
Наблюдаемая сейчас переоценка роли реакций естественного иммуни тета в канцерогенезе и интерес к ис-
472
следованиям в этой области связаны с выявлением трех аспектов функцио нирования этой системы:
•эффективного распознавания и прямого цитотоксического дей ствия эффекторов врожденного иммунитета против опухолевых (а также вирусинфицированных клеток) in vivo и in vitro;
•участия в естественном отборе опухолевых клеток in vivo;
•осуществления антигенпрезентирующих функций (пускового механизма) в реакциях Т-кле точного противоопухолевого иммунитета.
Новейшие представления о воз можной инструктивной функции эф фекторов врожденного иммунитета при развитии Т-зависимых антибакте риальных иммунологических реакций [Medzhitov R., Janeway С. Α., 1997; Janeway С. Α., 1998] радикально меня ют и общую картину взаимодействия этих двух систем в организме — древ нейшей системы естественного и не специфического иммунитета и эволюционно более молодой системы спе цифического Т-клеточного иммуни тета.
Независимость распознавания и естественного отбора опухолевых кле ток in vivo от наличия или отсутствия в них экспрессии СТОА, обязатель ный характер приобретения опухоле выми клетками в процессе естествен ного отбора дискретных механизмов локальной защиты против эффекто
ров врожденного иммунитета хозяина и соответственно экспрессии нового фенотипа — все это свидетельствует об активном участии системы естест венного иммунитета не только в за щите организма против опухолей, но и в эволюции опухоли in vivo.
Рекомендуемая литература
Брондз Б. Д. Т-лимфоциты и их рецепторы в иммунологическом распознавании. — М.: Наука, 1987.
Дейчман Г. И. Естественный отбор и ран ние изменения ' фенотипа опухолевых клеток in vivo: приобретение механиз мов защиты // Биохимия. — 2000. — № 65. - С. 92-111.
Суслов А. П. Макрофаги и противоопухо левый иммунитет // ВИНИТИ. Итоги науки и техники. Серия Онкология. — 1990.. - Т. 19. - С. 1-162.
Boon Т., Cerottini J.-C, Van den Eynde В. et al. Tumor antigens recognized by T-lym- phocytes // Ann. Rev. Immunol. — 1994. - Vol. 12. - P. 337-365.
Deichman G. I. Cell transforming genes and tumor progression: in vivo unified sec ondary phenotypic cell changes // Int. J. Cancer. - 1998. - Vol. 75. - P. 277283.
Medzhitov R., Janeway C. A. Innate immunity: impact on the adaptive immune response // Current Opinion in Immunology. — 1997. - Vol. 9. - P. 4-9.
Medzhitov R., Janeway С A. Innate immunity: the virtues of a nonclonal system of recog nition // Cell. - 1997. - Vol.91. - P. 295-298.
Schreiber H. Tumor immunology // Funda mental Immunology. Third Edition. W. E. Paul, editor. — New York: Raven Press, Ltd., 1993. - P. 1143-1178.
Г л а в а 11
ИММУНОЛОГИЯ ОПУХОЛЕЙ ЧЕЛОВЕКА
Г.И. Абелев
Многие тысячи исследований на тия В-лимфоцита, на которых только
экспериментальных системах и в кли нике создали область онкологии, в которой стало возможным говорить
об иммунодиагностике, иммунопрофи
лактике и иммунотерапии опухолей че ловека. Рассмотрим кратко, что же во шло и входит в практическую онколо гию в результате полувековых иссле дований по иммунологии рака.
11.1. Иммунодиагностика
Иммунодиагностика (ИД) — наи более разработанная область иммуно логии рака, прочно вошедшая в кли ническую практику. Она основана на одном из фундаментальных свойств опухоли — сохранении ею направле ния и уровня дифференцировки клет ки-предшественницы. Все антигены, используемые в ИД опухолей, — это дифференцировочные антигены соот ветствующей нормальной ткани, ха рактеризующие определенный этап ее созревания (табл. 11.1). Это особенно ярко выражено в иммунофенотипировании гемобластозов, каждая из форм которых в точности соответствует по антигенам клеточной мембраны как бы "замороженной" стадии дифферен цировки той или иной ветви крове творения. Эта закономерность соблю дается настолько четко, что некото рые ранние и быстропреходящие ста дии развития лимфоцитов впервые были выявлены и охарактеризованы только благодаря существованию со ответствующих острых лейкозов. Так, например, ретровирус Абельсона, вы зывающий острый пре-В-клеточный лейкоз у мышей, позволил идентифи цировать самые ранние стадии разви
начинается рекомбинация D- и J- фрагментов тяжелой (Н) цепи имму ноглобулина (Ig). Точно так же один из характерных антигенных маркеров ранних В-лимфоцитов, так называе мый общий антиген острых лимфати ческих лейкозов человека (CALLA), был вначале обнаружен как специфи ческий лейкозный антиген, а затем найден и в нормальном ряду диффе ренцировки В-лимфоцита.
Результаты иммунофенотипирования лейкозов особенно впечатляющи при анализе острых, морфологически неразличимых гемобластозов, где с помощью иммунофенотипирования можно вычленить острые эритро-, миело- и лимфобластные лейкозы, от личающиеся по прогнозу и схемам ле чения. Иммунофенотипирование по зволяет также дифференцировать В- и Т-лимфолейкозы, притом находящиеся на разных стадиях дифференцировки.
Таким образом, иммунофенотипи рование дало бесценный материал для анализа патогенеза гемобластозов и одновременно вошло в их клинику как необходимый и сегодня уже ру тинный компонент в диагностике и классификации гематологических новообразований. Едва ли не исчерпы вающая полнота знаний в области им мунофенотипирования лейкозов обя зана в основном методу гибридом. Именно этот метод, обладающий аб солютной разрешающей способно стью в идентификации и характери стике отдельных эпитопов дифференцировочных антигенов, позволил по строить точнейшие эпитопные карты поверхности клеток кроветворного ряда. Современная классификация
474

Т а б л и ц а 11.1. Опухолевые маркеры как дифференцировочные антигены
Антиген
Миеломный Ig, Белок Бене-Джонса Альфа-фето- ротеин АФП)
Раково-эм- бриональный антиген (РЭА) СА-125
Антиген про статы (PSA) Хорионический гонадогропин (β- цепь) Her2/neu
Дифференци ровочные ан тигены гемопоэтических клеток ( C D - антигены)
Маркер опухоли |
Дифференцировочный |
Причина продукции анти |
|||||
антиген |
гена опухолью |
||||||
|
|||||||
Плазмоцитома и |
Моноклональные плаз |
Сохранение |
нормальной |
||||
В-клеточные |
матические клетки и |
функции |
|
|
|||
лейкозы |
клоны В-лимфоцитов |
|
|
|
|||
Терминальные |
Висцеральная энтодерма |
Сохранение |
нормальной |
||||
опухоли |
желточного |
мешка |
функции |
|
|
||
Гепатобластома |
Гепатобласт |
|
|
Сохранение |
нормальной |
||
|
|
|
|
функции |
|
|
|
Гепатоцеллюляр- |
Фетальный |
гепатоцит |
Возобновление эмбрио |
||||
ный рак |
|
|
|
нального синтеза |
|
||
Коло-ректаль |
Гликокаликс фетального |
Избыточная продукция и |
|||||
ные опухоли |
и взрослого |
кишечного |
нарушение |
нормальной |
|||
|
эпителия |
|
|
локализации в клетке |
|||
Рак яичников |
Гликопротеин |
целоми- |
Избыточная |
продукция |
|||
|
ческого эпителия |
|
|
|
|||
Рак простаты |
Специфическая протеа- |
Избыточная продукция и |
|||||
|
за простаты |
|
|
нарушение |
путей |
секреции |
|
Терминальные |
Специфический гормон |
Сохранение |
нормальной |
||||
опухоли, Хори- |
хориона |
|
|
функции ХЭ элементов |
|||
онэпителиомы |
|
|
|
опухоли |
|
|
|
(ХЭ) |
|
|
|
|
|
|
|
Рак молочной |
Рецептор к эпидермаль- |
Гиперпродукция |
опухолью |
||||
железы |
ному ростовому фактору |
|
|
|
|||
|
(растворимая |
форма) |
|
|
|
||
Различные фор |
CD-маркеры |
клеток |
"Замороженные" |
стадии |
|||
мы опухолей |
крови разных направле |
дифференцировки |
|||||
кроветворной |
ний и стадий дифферен |
|
|
|
|||
ткани |
цировки |
|
|
|
|
|
|
дифференцировочных антигенов это го типа основана на моноклональных антителах.
В случае лейкозов речь идет о диф ференцировочных антигенах клеточ ной мембраны, не секретируемых в циркуляцию, но именно опухоли этой группы дали первый пример серологи ческого маркера самой высокой спе цифичности. Речь идет о моноклональ ных иммуноглобулинах (Mlg ) и белке Бенс-Джонса (ББД) — моноклональ ных легких (mL) цепях Ig, продуци руемых плазмоцитомами и секрети руемых ими в кровь. Поскольку опу холи, в том числе и плазмоцитомы, моноклональны, то их продукт — Mlg резко отличается от высокогетероген ных Ig нормальной сыворотки крови
и служит превосходным маркером этих неоплазий. Динамика MIg в кро ви и ББД в моче пациентов до и в про цессе лечения служит чувствительным индикатором сохранения остаточного клона и доклиническим маркером рецидирования опухоли.
Плазмоцитома, как и ее предшест венник плазмоцит, — активный про дуцент MIg и ББД, но и В-клеточные гемобластозы, особенно относящиеся к хроническим В-клеточным лейкемиям,
продуцируют низкие количества MIg и ББД, которые могут быть выявлены специальными высокочувствительны ми реакциями и использованы для иммунодиагностики и мониторинга этих опухолей.
Миеломные белки долгие годы ос-
475
Т а б л и ц а 11.2. Возможности |
серологических маркеров опухолей в |
иммунодиагностике |
|||||
рака |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оста |
Ре |
|
|
|
Ранняя диагно |
Дифференциаль |
|
точ |
Lead |
|
Маркер |
Опухоль |
|
ци |
||||
стика |
ная диагностика |
|
ный |
time |
|||
|
|
|
див |
||||
|
|
|
|
|
клон |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АФП |
Терминальные |
— (нет групп |
+++ |
|
+++ |
+++ |
Ме |
|
раки |
высокого риска) |
|
|
|
|
сяцы |
|
Гепатобластомы |
(нет групп вы |
+++ |
|
+++ |
+++ |
+ |
|
|
сокого риска) |
|
|
|
|
|
|
Гепатоцеллю- |
+ (у носителей |
+ + (небольшое |
|
++ |
+++ |
? |
|
лярные раки |
HBV*, в энде |
совпадение с ге |
|
|
|
|
|
|
мичных районах |
патитами и цир |
|
|
|
|
|
|
мира) |
розами печени) |
|
|
|
|
РЭА |
Колоректаль- |
— |
++ |
|
++ |
+++ |
+++ |
|
ные карциномы |
|
|
|
|
|
|
PSA |
Рак простаты |
+ + + (в группе |
+++ |
|
++ |
+ |
? |
|
|
риска) |
|
|
|
|
|
СА125 |
Рак яичников |
|
++ |
|
++ |
+ |
? |
mlg и белок |
В-клеточные не- |
+/- |
+++ |
|
++ |
+++ |
++ |
Бенс-Джонса |
оплазии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*HBV — вирус сывороточного гепатита.
Здесь и далее плюсы — субъективная оценка показателей.
тавались, казалось бы, не имеющими аналогов среди солидных опухолей. Обнаружение алъфа-фетопротеина
(АФП) при гепатоцеллюлярных раках животных и человека положило нача ло открытию ряда серологических маркеров солидных опухолей, широко применяемых в иммунодиагностике рака (см. табл. 11.1). АФП указал на неизвестный ранее тип дифференцировочных антигенов — онкофетальных, т. е. тканеспецифических антиге нов, экс премирующихся в нормаль ном развитии только в эмбриональ ном периоде, но вновь появляющихся в опухолях. Вслед за А Ф П был открыт
раково-эмбриональный антиген (РЭА) опухолей ободочной и прямой кишки, попадающий в кровь и являющийся маркером опухолей кишечника. РЭА — антиген, наиболее часто используе мый в клинике для оценки эффектив ности операции и обнаружения реци дивов за месяцы до их клинического проявления. Это дает так называемое lead time — клинически бессимптом ный период, когда может быть прове дена повторная операция или начата
химиотерапия. За РЭА последовал СА 125 — мукопротеидный антиген, обра зуемый опухолями яичника и попа дающий в кровь. Особую популяр ность получил серологический маркер
рака простаты (PSA-prostate specific antigen), применяемый не только для дифференциальной диагностики и мониторинга, но и для скринингового выявления клинически не проявляю щихся опухолей. Серологический маркер рака молочной железы челове ка — Her 2/neu, попадающий в кровь растворимый рецептор одного из эпидермальных факторов роста человека. Его присутствие в крови является пло хим прогностическим признаком. Кро ме антигенов, указанных в табл. 11.1, природа и происхождение которых полно изучены, равно как и причины их появления при определенных опу холях, имеется ряд антигенов опухо лей (поджелудочной железы, легких), находящихся в процессе изучения.
Вопросом принципиальной важно сти является возможность ранней ди агностики опухолей по серологиче ским маркерам. Однако это зависит
476
не столько от маркера, сколько от возможности формирования группы высокого риска для возникновения данной опухоли. Там, где такие груп пы существуют, скрининг по сероло гическим маркерам дает хорошие ре зультаты (табл. 11.2). Так, исследова ние на АФП всего населения в районе Шанхая (Китай) и хронических носи телей вируса гепатита В среди эски мосов Аляски выявило больных раком печени без клинических симптомов в операбельной стадии. Целесообразно систематическое исследование на АФП больных циррозом печени.
Группа высокого риска по раку простаты — мужчины в возрасте стар ше 50 лет. Систематическое обследо вание их на PSA выявляет самые ран ние стадии этой формы рака, включая карциному in situ. При этом обнару живается и гипердиагностика соответ ствующей опухоли. Тем не менее скрининг населения Европы и Север ной Америки по PSA уже позволил рассчитывать на снижение заболевае мости раком простаты на 15—20 %.
Группой "самого высокого риска" являются оперированные или лечен ные химиотерапией больные. Здесь речь идет о выявлении остаточного клона заболевания и клинически не манифестируемого рецидива. В этих ситуациях все перечисленные выше маркеры незаменимы, они, как пра вило, дают lead time для своевремен ного вмешательства хирурга или хи миотерапевта (см. табл. 11.2).
В настоящее время тест-системы на опухолевые маркеры производятся ве дущими фармацевтическими компания ми и образуют солидную область фар мацевтической промышленности. При этом иммунодиагностика рака открыта для поисков новых маркеров и разра ботки новых методов их определения.
11.2. Иммунопрофилактика
Общий принцип иммунопрофи лактики опухолей должен быть осно ван на способах усиления иммунологи ческого надзора над их возникновени
ем. Концепция иммунологического надзора была предложена Φ. М. Бернетом еще в период становления им мунологии рака и предполагала уча стие приобретенного иммунитета в контроле над возникающими опухо лями. Нормальная частота появления опухолей у бестимусных мышей зна чительно снизила интерес к возмож ной роли приобретенного иммунитета в предполагаемом надзоре, но резко усилила внимание к факторам врож денного иммунитета. Такой подход получил и дополнительные стимулы в экспериментальных данных, показав ших, что спонтанные опухоли в отли чие от вирусных и вызванных химиче скими канцерогенами либо низкоиммуногенны, либо вовсе не индуциру ют специфического иммунитета. В то же время высокая и универсальная эффективность врожденного иммуни тета в контроле над малыми популя циями опухолевых клеток была убеди тельно показана экспериментами на животных с подавленной естествен ной резистентностью (см. главу 10). Факторы естественной резистентно сти эффективно контролируются цитокинами, но детали этого контроля и тем более способы манипулирования ими еще недостаточно изучены, чтобы их можно было использовать в имму нопрофилактике опухолей.
Однако в случае опухолей, возник новение которых включает этап ви русной инфекции, такая иммунопро филактика вполне реальна.
В настоящее время известны не сколько типов опухолей человека, возникновение которых ассоциирова но с вирусами (табл. 11.3). При этом необходимо подчеркнуть, что речь идет не о стопроцентной и однознач ной зависимости "вирус — рак", а о формировании групп высокого риска по определенной форме рака среди людей, зараженных вирусом или хро нических носителей данного вируса. Это относится ко всем тем вирусам, чья специфическая ассоциация с кон кретными опухолями вполне доказа на. В группах риска возможно приме-
477
Т а б л и ц а 11.3. Иммунопрофилактика вирусных опухолей человека
Опухоль |
Ассоциированный ви |
Вакцинация |
Ожидаемый |
||
|
|
рус |
эффект |
||
|
|
|
|
||
|
|
|
|
|
|
Первичный рак пе |
Вирус |
гепатита В |
H B V + + + (Юго-Восточ |
Снижение за |
|
чени |
(HBV) и C(HCV) |
ная Азия, Африка — Гам |
болеваемости |
||
|
|
|
|
бия) |
|
Рак шейки матки |
Вирусы |
папиллом |
|
Снижение за |
|
|
человека |
16-го и 18- |
В разработке |
болеваемости |
|
|
го типов (HPV) |
|
|||
|
|
|
|||
Лимфома Беркитта |
Вирус Эпштейна— |
|
Снижение за |
||
Рак носоглотки |
Барр |
|
|
В разработке |
болеваемости |
Лимфогранулематоз |
|
|
|
|
|
|
|
|
|
|
|
Т-клеточная лимфома |
Вирус |
HTLV-I |
|
|
|
Саркома Капоши |
Вирус |
KSHV |
|
|
|
|
|
|
|
|
|
нение противовирусных вакцин, и та кой подход уже дает реальные резуль таты в случае вакцинации против ви руса сывороточного гепатита В (HBV) (см. раздел 5.4). Заражение HBV и хроническое носительство этого виру са охватывает огромные районы ми ра — Юго-Восточную Азию, Африку, Аляску. Оно создает группу риска по раку печени. В этих районах вирус пе редается от матерей новорожденным при родах и в первые дни кормления. Вакцинация имеет целью прервать циркуляцию вируса от матери к по томству. Разработаны эффективные вакцины против HBV, и уже в течение более чем 15 лет ВОЗ проводит широ кие программы вакцинации новорож денных против HBV в Юго-Восточной Азии, в Гамбии и среди эскимосов Аляски. Хронические носители HBV — это группа очень высокого риска для первичного рака печени, и если она совпадает с потреблением афлатоксина, мощного печеночного канцероге на, находящегося в арахисе, заражен ном плесневым грибком Asp. flavus, то риск возрастает в десятки раз. Пер вичный рак печени в этих районах мира находится среди первых по час тоте, и, учитывая величину эндемич ных районов, эту форму рака рассмат ривают в десятке наиболее частых его форм в мире. Ожидается, что про грамма вакцинации против HBV даст снижение заболеваемости раком,
сравнимое с программой борьбы про тив курения. Данные по Тайваню уже показывают, что снижение носительства HBV у детей значительно уменьшает процент хронических носителей виру са, что неизбежно скажется на сниже нии заболеваемости раком печени.
В последнее десятилетие были по лучены доказательства связи вирусов папилломы (HPV) 16-го и 18-го типов с раком шейки матки (см. раздел 5.3). Здесь, как и в случае HBV, речь идет о группе высокого риска, образуемой носителями вируса HPV. Очевидно, что перерыв в распространении этого вируса и, возможно, его искоренение должны привести к снижению этой весьма распространенной формы ра ка. В настоящее время ведутся работы по созданию анти-HPV вакцины.
Вакцинация против вируса Т-кле- точной лейкемии человека (HTLV-I) хотя в принципе вполне возможна, но ввиду ограниченного распространения опухолей, вызываемых этим вирусом, сейчас не проводится. Однако вполне вероятно, что она будет использована в эндемичных для этого вируса районах.
Вирусы группы герпеса привлекли в последние годы очень большое вни мание (см. раздел 5.5). Помимо хоро шо изученной и твердо доказанной роли вируса Эпштейна—Барр (EBV) в этиологии африканской лимфомы Беркитта и карциномы носоглотки в Юго-Восточной Азии, этот вирус ока-
478
зался ассоциирован с гораздо более распространенной лимфомой Ходжкина, или лимфогранулематозом. Очевидно, что вакцинация против EBV — назревшая проблема, и соот ветствующие вакцины находятся в процессе разработки.
Недавно выделен еще один вирус из группы герпеса (KSHV), ассоции рованный с так называемой саркомой Капоши. Специфика этого вируса в том, что он активируется у иммунодефицитных больных, в частности, при СПИДе. Это, конечно, резко ослож няет проблему вакцинации против KSHV, а в группе больных С П И Д о м делает ее еще и нецелесообразной.
Такова современная ситуация с иммунопрофилактикой вирусных опу холей человека.
11.3. Иммунотерапия
Моноклональные антитела (МкАТ), стремительно вошедшие в иммунологию в конце 70-х — начале 80-х годов казалось бы, были специ ально созданы для иммунотерапии ра ка: как для обнаружения специфиче ских мишеней на опухолевых клетках, так и для направленного поражения этих клеток. Разработанная вскоре технология получения иммунотоксинов для прямого и непрямого токси ческого воздействия на опухоль или для привлечения к опухоли и актива ции Т-киллеров должна была обеспе чить специфическую иммунотерапию опухолей на основе антител. Однако лишь немногие антигены клеточной поверхности, которые могли бы слу жить более или менее специфически ми мишенями для антител, например РЭА или идиотипические детерми нанты при В-клеточных лимфомах, привели пока к ограниченному ис пользованию МкАТ или иммунотоксинов в иммунотерапии рака, скорее, — еще только к попыткам такого ис пользования (табл. 11.4). Среди МкАТ, применяемых в клинике, — антитела к CD20, блокирующие про ведение Са2+ в клетку, и Herceptin —
МкАТ к Неr2 — рецептору эпидермального ростового фактора. В обоих случаях речь идет не о цитотоксичности антител, а о блокаде физиологиче ской функции мембранных молекул.
Главная роль МкАТ — в иммунофенотипировании гемобластозов, о чем речь была в первом разделе на стоящей главы. Столь же эффективно МкАТ используются и в иммунодиагностикумах на серологические марке ры опухолей. Ближе всего к иммуно терапии приближаются работы по иммунолокализации опухолей и метаста зов с помощью МкАТ или их Fabфрагментов, меченных радиоактивны ми изотопами. Этим способом можно локализовать небольшие метастазы в организме, а в некоторых случаях на копить терапевтические дозы радио изотопа в опухоли или метастазах. Ан тиген, используемый в качестве ми шени в этих исследованиях, — РЭА, а опухоли, соответственно наиболее бо гатые РЭА, — ободочной и толстой кишки и опухоли щитовидной желе зы. Следует подчеркнуть, что исследо вания по иммунолокализации опухо лей и метастазов, несмотря на самый серьезный характер, еще не вошли в регулярную клиническую практику.
Иммунотерапия опухолей на осно-
Т а б л и ц а 11.4. Моноклональные |
антите |
|
ла в онкологии |
|
|
|
|
|
Иммунофенотипирование гемо |
++++ |
|
бластозов |
|
|
Иммуногистохимический |
диагноз |
+++ |
Радиоиммунолокализация |
мета |
++ |
стазов |
|
++ |
"Очистка" костного мозга от мик |
||
рометастазов |
|
|
Блокировка функций молекул |
++ |
|
клеточной мембраны (CD20 и |
|
|
Her2/neu |
|
|
Иммунотоксины |
|
+ |
|
|
|
++ + + — широкое клиническое применение.
++ + — клиническое применение.
++— клиническое применение в отдель ных случаях.
+— положительные результаты в от дельных исследовательских группах.
479
ве Т-клеточного иммунитета, к 80-м годам XX в. почти замершая, получи ла новый стимул в работах С. Розенберга, показавших терапевтический эффект IL-2 по отношению к метаста тическим меланомам и опухолям поч ки. В дальнейшем С. Розенберг ис пользовал Т-лимфоциты, накапли вающиеся в опухолях (TIL), активиро вал их IL-2 и вместе с этим цитокином вводил больному. Подходы, пред ложенные С. Розенбергом, применя ются в клинике, хотя и в ограничен ных масштабах из-за высокой токсич ности IL-2 и непредсказуемости эф фекта в конкретных ситуациях. Одна ко они дали стимул как для примене ния цитокинов в терапевтических це лях, так и для попыток создания про тивораковых вакцин, использующих цитокины.
Попытки вакцинации против опу холей почти полностью прекратились уже к 70-м годам, во-первых, из-за твердо установленного факта неиммуногенности спонтанных опухолей у животных (а большинство опухолей человека относится именно к этой группе), во-вторых, вследствие отсут ствия четких реакций Т-клеток на собственные опухоли и, наконец, вследствие способности опухолей те рять иммуночувствительность в про цессе роста в иммунном организме. Основное препятствие в идентифика ции специфических опухолевых анти генов, ответственных за противоопу холевую реакцию организма человека, определялось невозможностью экспе римента in vivo при отсутствии тестов in vitro, позволяющих изучать взаимо действие Т-клеток с антигенами в бес клеточных системах. Антиген для его распознавания Т-лимфоцитом (а именно Т-лимфоциты определяют специфический противоопухолевый иммунитет) должен быть фрапиентирован и представлен Т-клетке в ком плексе с презентирующей молекулой — М Н С I или II классов. Фрагментация (процессинг) и комплексирование с презентирующей молекулой происхо дят только в живой клетке. Кроме то
го, для индукции иммунного ответа на клетке-мишени должна присутство
вать |
молекула костимулятора, напри |
мер |
В7. Со стороны распознающей |
Т-клетки участвуют несколько моле кул: антигенраспознающий рецептор (TCR), корецепторы CD8 или CD4, распознающие презентирующую мо лекулу, комплекс молекул C D 3 , пере дающий сигнал внутрь клетки, и дру гие рецепторы, необходимые для прочного взаимодействия двух живых клеток, что принципиально отличает эту систему от системы антиген—ан титело.
Открытие IL-2 (интерлейкина-2), ростового фактора Т-клеток, способ ного в присутствии антигена поддер живать рост и размножение антигенспецифических Т-клеточных клонов, дало в руки исследователей объектив ный и воспроизводимый in vitro тест для идентификации опухолевых анти генов, способных вызывать специфи ческий Т-клеточный иммунитет. Бо лее того, возникла возможность путем трансфекции опухолевой Д Н К полу чить клеточные линии, содержащие гены, которые контролируют антиге ны, вызывающие противоопухолевый иммунологический ответ. Таким обра зом была создана возможность иден тификации и клонирования генов, ко-
дирующих |
антигены, |
ответственные |
за противоопухолевый |
иммунитет у |
|
человека. |
Открытие костимуляторных |
|
молекул семейства В7 и клонирование их генов создало уже совершенно но вые возможности для конструкции ге нетических противоопухолевых вак цин на основе вирусов, бактериаль ных или опухолевых клеток, несущих гены специфических для данной опу холи антигенов (СТОА), одновремен но с генами цитокинов, активирую щих Т-клетки, и генами костимуляторов иммунитета. Можно ожидать, что индуцированные таким способом Т-киллеры будут уничтожать любые клетки, несущие соответствующие ан тигены, независимо от того, содержат
ли |
они |
костимуляторные молекулы |
или |
нет. |
К настоящему времени наи- |
480

Рис. 12.1. Метод FISH (флюорес центная гибридизация in situ): уча стие гена MLL (красные гранулы) в неслучайной хромосомной трансло кации между хромосомами 2 и 11 при остром миелобластном лейкозе.
К с. 486.
Рис. 12.2. Метод FISH на интерфазных ядрах диффузной крупноклеточной лимфомы. Использован зонд для центромеры хромосомы 12. Видны клетки с тремя сигналами (сле ва), четырьмя сигналами (в центре) и шестью сигналами (справа) Б, что соответствует трисомии, тетрасомии и гексасомии [Jounes et al. Genes, Chromosomes a. Cancer. — 1994. — V. 9. - P. 161-167]. Kc. 486.
Рис. 12.3. Метод FISH. Применение центромерного зонда на хромосому 7 для идентификации кольцевой хромосомы в клетках костного мозга больного миелофиброзом. Зонд гибридизовался как с нор мальной хромосомой 7 (нижняя стрелка), так и с маркерной хромосомой (верхняя стрелка), что свидетельствует о происхож дении маркера из хромосомы 7 [Gibbons et al. Genes, Chromosomes a. Cancer. — 1994. — V. 10. - P. 244 - 249] . К с. 486.
Зак. 7908 3аридзс. Вклейка

Рис. 12.4. Метод FICTION . Выявление иммунофенотипических маркеров и цитогенетических аномалий в одной и той же клет ке на стадии интерфазы. Фолликулярная лимфома. Трисомия 8 (три сигнала) в клет ке с красным окрашиванием цитоплазмы (ламбда-позитивная клетка) и в клетке без красного окрашивания. Клетка первого ти па помечена большой стрелкой, клетка вто рого типа — малой стрелкой [Weber,
Vathiessen et al. Genes, Chromosomes a. |
Can |
cer. - 1995. - V. 14. - P. 2 2 - 2 7 ] . К с. |
486. |
Рис. 12.5. Кариотип клетки костного мозга больного с миелодиспластическим синдро мом (RAEB). Спектральное кариотипирование позволило расшифровать транслокации между хромосомами 5 и 17, 12 и 17, а также 17 и 22. Маркеры, возникшие в результате транслокаций, при данной методике выглядят разноцветными. К с. 486.

ис. 12.6. Метафазная пластинка з клетки костного мозга болього острым промиелоцитарным лейкозом. Многоцветное спек тральное кариотипирование SKY. Видны 4 маркерные хромосомы, возникшие в результате двух реципрокных транслокаций — |(15;17) и t(3;9). Нормальные го мологи хромосом 15 и 17 окра шены в голубой и синий цвет со ответственно, а образовавшиеся маркеры — двухцветные сине-го лубые. Нормальный гомолог хро мосомы 3 окрашен в серый цвет, хромосомы 9 — в белый. Два маркера, возникшие в результате второй транслокации, состоят соответственно из серых и белых участков. К с. 486.
Рис. 12.7. Метафазная пластинка из костного мозга больной острым миелобластным лейкозом. Инверсия хромосомы 16, характерная для острого миеломонобластного лейко за с эозинофилией (М4Ео). Хромосомы 16-й пары показаны стрелками: сверху — мар кер, снизу — нормальный гомолог. К с. 497.

Рис. 12.8. Метафазная пластинка из костного мозга больного ХМЛ: нормальная хромо сома 22 отмечена кружком. Ph — нижняя стрелка и 9q+ — верхняя стрелка. К с. 497.
Рис. 12.9. Хромосомные маркеры, характерные для рака толстой кишки. К с. 505.

Т а б л и ц а 11.5. Пути иммунотерапии
Воздей |
Фактор |
|
ствия |
||
|
||
цитоки- IL-2 |
||
ны |
IL-12 |
|
|
||
|
T N F |
|
Вакци- |
Молекулярно генетиче |
|
ны |
ские (СТОА, В7, IL-2) |
|
Эффект
++(на экспериментальных моделях) + (на экспериментальных моделях)
++(на экспериментальных моделях)
Клиника
+ (непред сказуемый) Изучение Изучение Изучение
более детально изучены иммунизи рующие антигены меланом человека и открыты неизвестные ранее семейства генов, экспрессирующиеся только в меланомах, некоторых других опухо лях и в тканях яичка, т. е. контроли рующие дифференцировочные анти гены, сходные с онкофетальными (cancer-testis антигены). Они относят ся к генетическим семействам, на званным MAGE и BAGE. Соответст вующие антигены индуцируют специ фические клоны Т-киллеров. Одно временно идентифицированы гены дифференцировочных антигенов меланоцитов, иммуногенные в организме человека. Генетические вакцины дают впечатляющие результаты на экспериментальных моделях и в на стоящее время испытываются в кли нике (табл. 11.5). Один из главных во просов в этой области — способны ли опухоли "ускользать" от действия вак цин такого типа.
Перспективным, хотя и не вошед шим еще в регулярную клиническую практику, представляется и использо вание цитокинов для иммунотерапии опухолей, особенно IL-2 и IL-12, и это является областью интенсивных исследований.
Таким образом, вклад современной иммунологии рака в онкологию мож но суммировать следующим образом:
•иммунодиагностика ряда опухо лей, включая иммунофенотипирование лейкозов;
•иммунопрофилактика первично го рака печени на основе вакци нации против вируса гепатита В.
Перспективы иммунопрофилак тики рака шейки матки путем вакцинации против вирусов па пилломы, разработки вакцин против вируса Эпштейна—Барр с целью предотвращения лимфомы Беркитта, рака носоглотки
и лимфогранулематоза;
•использование немногих еще моноклональных антител (антиCD20, Herceptin'a) для иммуно терапии лимфатического лейко за и рака молочных желез;
•иммунолокализация опухолей и их метастазов (доведение до ре гулярного использования в кли нике);
•обнадеживающие перспективы создания противораковых гене тических вакцин и цитокиновой иммунотерапии опухолей.
Рекомендуемая литература
Абелев Г. И. Моноклональные антитела // Соросовск. образоват. журн. — 1998. — № 1. — С. 16 - 20 .
Abelev G. J., |
Sell S. (eds). |
Tumor |
markers. |
||||
Seminars |
in |
Cancer |
Biology. |
— |
Vol. 9, |
||
N 2. — London: Acad. Press, 1999. |
|||||||
Auvinen |
F. E., |
Alexander |
H. J., |
de |
Koning, |
||
Miller |
A. |
B. |
Should |
we |
start |
population |
|
screening for prostate cancer? Randomised trials are still needed // Int. J. Cancer. —
2002. |
- Vol. 97. - P. 377-378. |
|||
Blumberg |
B. |
Hepatitis B-virus, the vaccine, |
||
and the control of primary cancer of the |
||||
liver |
// |
Proc. Nat. Acad. Sci (USA). — |
||
1997. |
- Vol. 94. |
- P. 7121-7124. |
||
Boon Th., |
Cerrotini |
J.-Ch., |
Van den Eynde B. |
|
et al. Tumor (antigens recognized by T- |
||||
lymphocytes // Ann. Rev. Immunol. — |
||||
1994. |
- |
Vol. 12. |
- P. |
337 - 363 . |
31-7908 Д. Г. Заридзе |
481 |
|
Bubenic J. Genetically modified dendritic cellbased vaccines // Folia Biol. (Praha). —
2001. |
- Vol. 47. - P. |
153-155. |
|
|
Chu |
Т. M. Prostate-Specific Antigen and early |
|||
detection of prostate Cancer // Tumor Bi |
||||
ol. - |
1997. - Vol. 18. |
- P. 123-134. |
||
Finn |
O. |
Tumor-specific Immune responses |
||
and oppotunities for tumor vaccines // |
||||
Clin. Immunol. Immunopathol. — 1994. |
||||
- Vol. 71. - P. 260 - 262 . |
|
|||
Herberman |
R. В., Mercer D. |
W. (eds). |
Immu- |
|
nodiagnosis of Cancer. — II ed. — |
Marcel |
|||
|
Dekker, Inc. — N. Y. — Basel — |
Hong |
||
|
Kong, |
1990. |
|
|
IARC monographs on the evalution of carci nogenic risks to humans. — Vol. 59. — Hepatitis viruses. — IARC, Lyon, France, 1995.
IARC monographs on the evalution of carci nogenic risks to humans. — Vol. 64. — Human papilloma viruses. — IARC, Lyon, France, 1995.
Golab J., Zagozdon R. Interleukin 12 — a nov el cytokine in Cancer immunothergos // Centr. Europ. J. Immunol. — 1997. — Vol. 22. - P. 211 - 224 .
Juweid M., Sharkey R. M., Behr Th.M. et al.
Clinical evaluation of tumor targeting with the anticarcinoembryonic antigen murine monoclonal antibody fragment, MN 14 F(ab)2 // Cancer. - 1996. - Vol. 78. - P. 157-188.
Kao J. H., |
Chen D.-Sh. Recent |
updates |
in |
|||
hepatitis |
vaccination and |
the |
prevention |
|||
of hepatocellular |
carcinoma |
// |
Int. |
J. |
||
Cancer. - 2002. - Vol. 97. |
- |
P. 2 6 9 - |
||||
271. |
|
|
|
|
|
|
McMahon, London T. Workshop on |
screening |
|||||
for hepatocellular carcinoma // J. Nat. |
||||||
Cancer |
Inst. — |
1991. |
— |
Vol. 83. |
— |
|
P. 916 - 918 . |
|
|
|
|
|
|
Shreiber H. |
Tumor |
Immunology |
// |
Funda |
||
mental Immunology / W. Paul (ed.). Ill |
||||||
edition. — N. Y.: Raven Press, |
1993. |
— |
||||
P. 1143-1178. |
|
|
|
|
|
|
Vallera D. A. Immunotoxins: will their clinical promise be fulfilled? // Blood. — 1994. - Vol. 83, N 2. - P. 309.
Wu T. Ch. Immunology of the human papillo ma virus in relation to cancer // Current opinion in immunol. — 1994. — Vol. 6. — P. 746-754.
Г л а ва 12 ПРАКТИЧЕСКИЕ ВЫХОДЫ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
12.1. Практические выходы |
предшественницы: |
все |
аномальные |
|||||||||||||
современной цитогенетики |
клетки |
опухоли |
имеют |
идентичные |
||||||||||||
опухолей |
|
|
|
|
|
хромосомные нарушения, |
но, |
кроме |
||||||||
|
|
|
|
|
|
|
общих черт, нередко обладают разли |
|||||||||
Е. В. Флейшман |
|
|
|
|
чиями, |
характерными |
для отдельных |
|||||||||
Многолетние цитогенетические и |
субклонов, |
возникших |
внутри |
основ |
||||||||||||
ного |
клона. |
|
|
|
|
|
|
|
||||||||
молекулярно-генетические |
исследова |
2. Нарушения кариотипа малигни- |
||||||||||||||
ния самых разнообразных опухолей и |
зированных |
клеток являются |
приоб |
|||||||||||||
практическое использование получен |
ретенными, они характерны для опу |
|||||||||||||||
ных данных в клинике позволили со |
холевых элементов, но отсутствуют в |
|||||||||||||||
брать огромный фактический |
матери |
нормальных |
(неопухолевых) |
клетках |
||||||||||||
ал, важный для понимания процессов |
того же организма. Необходимо на |
|||||||||||||||
возникновения и развития опухолей, а |
помнить, что врожденные |
хромосом |
||||||||||||||
также для их диагностики, прогнози |
ные аномалии в отличие от приобре |
|||||||||||||||
рования и мониторинга. |
|
|
|
тенных изменений, ассоциированных |
||||||||||||
Закономерности |
хромосомных на |
с малигнизацией, |
обнаруживаются |
во |
||||||||||||
рушений в новообразованиях из кле |
всех клетках пациента. Эти аномалии, |
|||||||||||||||
ток кроветворной системы (гемобла- |
создавая |
несбалансированность |
|
ка |
||||||||||||
стозах) изучены лучше, чем в солид |
риотипа, |
предрасполагают |
клетки |
к |
||||||||||||
ных опухолях. Эта ситуация обуслов |
появлению новых изменений и повы |
|||||||||||||||
лена рядом важных причин в основ |
шают риск возникновения |
опухолей. |
||||||||||||||
ном технического свойства. |
|
|
3. В ходе опухолевой прогрессии |
|||||||||||||
При злокачественных |
заболеваниях |
вследствие генетической нестабильно |
||||||||||||||
системы |
крови |
хромосомный |
анализ |
сти выраженность хромосомных изме |
||||||||||||
прочно вошел в комплекс важнейших |
нений обычно нарастает, |
происходит |
||||||||||||||
диагностических |
и |
прогностических |
так |
называемая |
клональная |
эволюция. |
||||||||||
методов, без которых немыслима работа |
Постепенно |
формируется |
гетероген |
|||||||||||||
современной гематологической |
клини |
ность клеточной популяции. |
|
|
|
|||||||||||
ки. Постепенно накапливаются данные, |
4. |
Гистогенетически |
близкие |
опу |
||||||||||||
свидетельствующие |
о |
практической |
холи |
характеризуются |
сходными |
хро |
||||||||||
важности |
цитогенетических |
исследо |
мосомными |
аномалиями. |
Новообра |
|||||||||||
ваний в других областях онкологии, в |
зования |
разной природы |
отличаются |
|||||||||||||
частности |
при солидных опухолях. |
друг от друга по характеру хромосом |
||||||||||||||
Анализ |
фактического |
материала, |
ных нарушений. |
|
|
|
|
|
|
|||||||
полученного в результате цитогенети- |
5. |
Повторяющиеся |
(специфиче |
|||||||||||||
ческого и молекулярно-генетического |
ские, |
неслучайные) перестройки |
мар |
|||||||||||||
изучения |
злокачественных |
новообра |
кируют те участки хромосом, где ло |
|||||||||||||
зований, |
позволяет |
сформулировать |
кализованы гены, участвующие в кан |
|||||||||||||
ряд основных положений, важных для |
церогенезе. Это онкогены и гены-су- |
|||||||||||||||
клинической практики. |
|
|
|
прессоры опухолевого роста. К на |
||||||||||||
1. Каждая опухоль представляет со |
стоящему времени уже выявлено не |
|||||||||||||||
бою клон — потомство одной клетки- |
сколько десятков таких генов. |
|
|
|
||||||||||||
31* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
483 |
6.В опытах in vivo и in vitro показа на этиологическая роль генетических изменений, ассоциированных со спе цифическими хромосомными наруше ниями, в канцерогенезе.
7.Частота распространения анома лий кариотипа, характерных для опу холей определенного гистогенеза, сильно варьирует в разных возрастных группах и имеет значительные геогра фические различия.
Материал, приведенный в данной главе, далеко не исчерпывает литера турные данные о практическом при менении хромосомного анализа в он кологической и онко-гематологиче- ской клинике. Работа в этой области сейчас ведется очень интенсивно и постоянно приносит новые важные выводы. Сочетание хромосомного и клинического анализа позволяет по стоянно маркировать новые участки генома, изучение которых ведется мо- лекулярно-генетическими методами. Здесь освещены лишь наиболее яркие и наиболее полно изученные законо мерности.
12.1.1. Основные
цитогенетические
термины
Каждая хромосома разделена цен тромерой (перетяжкой) на два плеча: короткое, которое по международной номенклатуре обозначают латинской буквой р, и длинное — q. Терминаль ные участки хромосомных плеч назы вают теломерными. При специальной окраске каждая хромосома имеет свой индивидуальный рисунок, плечи хро мосом выглядят поперечно исчерчен ными, в них видны светлые и темные полосы (bands) разной интенсивности. Эти полосы пронумерованы и объеди нены в районы (regions). Район может содержать несколько полос. При опи сании любого перестроенного участка используют 4 показателя: номер хро мосомы, плечо, район, полосу. На пример, I4q32 (область перестроек, специфичных для В-клеточных злока чественных лимфом): изменение каса
ется длинного плеча хромосомы 14 и захватывает вторую полосу района 3.
Различают числовые и структурные изменения кариотипа.
Числовые: увеличение числа или утрата целых хромосом. Клетки с из мененным числом хромосом называ ют анеуплоидными в отличие от дипло идных (нормальных клеток с 23 пара ми хромосом). Клетки с нормальным числом хромосом (46), но содержащие перестроенные хромосомы, обознача ют псевдодиплоидными. Клетки, чис ло хромосом в которых увеличено, на зывают гипердиплоидными, если это число уменьшено, — гиподиплоидными. Увеличение числа хромосом в 1,5 раза и более приводит к образованию поли плоидных клеток: три-, тетра-, пентаплоидных и т. д.
Структурные: транслокации (t) — перенос хромосомного участка, изме нение его локализации; делеции (del) — утрата хромосомного материала или инверсии (inv) — поворот сегмента в пределах одной хромосомы на 180°. Транслокации могут быть сбалансиро ванными и несбалансированными. При первых хромосомный материал не теряется: хромосомы обменивают ся участками; при несбалансирован ных транслокациях происходит утрата части генетического материала. Деле ции могут быть концевыми и интерстициальными. При первых происхо дит утрата терминальных районов хромосом, а при вторых выпадают (ут рачиваются) участки хромосомного плеча между центромерой и теломерой. Перестроенные хромосомы назы вают маркерными.
12.1.2. Основные
методические приемы
При стандартном анализе исследу ют хромосомы, зафиксированные на стадии метафазы митоза. На цитогенетическом препарате видны отдель ные интерфазные ядра и метафазные пластинки, при полном отсутствии клеточных структур, позволяющих оп ределить морфологию изучаемых кле-
484
ток. Следовательно, проводя хромо сомный анализ морфологически гете рогенной клеточной популяции, ис следователь не может определить, из какой именно клетки происходит ка ждая конкретная метафазная пластин ка, в частности из нормальной или из опухолевой.
Методика приготовления препара тов включает: 1) введение митостатиков (колхицин, колцемид, винбластин), останавливающих митозы на стадии метафазы; 2) гипотоническую обработку, после которой хромосомы лежат на стекле отдельно друг от дру га; 3) фиксацию; 4) нанесение приго товленной суспензии на предметные стекла путем раскапывания. Затем проводят дифференциальное окраши вание, после которого каждая хромо сома приобретает индивидуальный рисунок поперечной исчерченности, позволяющий идентифицировать не только хромосомы, но и отдельные их участки.
В настоящее время наибольшее распространение приобрела так назы ваемая методика G-banding, при кото рой хромосомные препараты окраши вают красителем Гимзы после предва рительной обработки трипсином или другим веществом, позволяющим вы явить поперечную исчерченность. Ис пользуют и другие методики: Q-band- ing — окраска флюоресцентными кра сителями, в частности кинакрином (quinacrine), R-banding — окраска, вы являющая рисунок, где полосы, белые при G-banding, выглядят черными (re verse), и C-banding — окраска, позво ляющая обнаружить околоцентромерный гетерохроматин.
Систематизация хромосом по па рам и идентификация маркеров в ка ждой отдельной метафазной пластин ке согласно общепринятой междуна родной номенклатуре создает кариотип клетки.
Поскольку опухолевые клетки обычно имеют клональное происхож дение, основная работа цитогенетика сводится к обнаружению и выявле нию характера опухолевого клона. В
ряде опухолей высокозлокачествен ные клетки не имеют видимых хромо сомных нарушений. Генетические из менения могут быть вне пределов раз решающей способности светового микроскопа.
В последние годы в клиническую практику все шире внедряются мето ды молекулярно-генетического иссле дования, главным образом полимеразная цепная реакция ( П Ц Р , PCR) и флюоресцентная in situ гибридизация (FISH). Эти методы высокоспецифич ны: они не определяют все изменения кариотипа, а отвечают на конкретный вопрос об отсутствии или наличии аномалии, молекулярный зонд на ко торую применяют в каждом изучае мом случае.
П Ц Р основана на специфическом многократном копировании (ампли фикации) определенных участков Д Н К с помощью фермента Д Н К - п о - лимеразы. Работа ведется не с цитогенетическими препаратами, а с Д Н К или Р Н К , выделенными из клеток, которые нуждаются в исследовании.
Если |
в материале имеется участок |
|
Д Н К , |
перестроенный в |
результате, |
например, хромосомной |
транслока |
|
ции, это можно обнаружить, проведя П Ц Р с использованием специальных молекулярных зондов — праймеров. Эти праймеры должны быть компле ментарны Д Н К , ограничивающей ис комый участок с обеих сторон. Если клетки с искомой перестройкой при сутствуют в материале, проба, взятая для исследования, обогащается in vitro именно той Д Н К , праймеры к кото рой были использованы. Даже если клеток с искомой перестройкой очень мало, количество перестроенной Д Н К в пробирке достигает определимой ве личины за счет многократного копи рования (раундов полимеризации). Ме тод очень чувствителен: можно обна ружить клетки с аномалиями, если да же их количество не превышает 1 на 106. Результат получается быстрее, чем при хромосомном анализе.
FISH позволяет метить и изучать конкретные участки Д Н К (в том чис-
485
ле уникальные гены) и получать све |
ществуют опухоли и лейкозы, где про |
||||||||||||||||
дения о числовых и структурных пе |
исхождение |
маркерных |
хромосом не |
||||||||||||||
рестройках кариотипа. В основе мето |
возможно установить без применения |
||||||||||||||||
да лежит |
способность |
однонитчатой |
SKY или некоторых других модифи |
||||||||||||||
Д Н К связываться |
(гибридизоваться) с |
каций FISH. Изредка надежную ин |
|||||||||||||||
комплементарной |
Д Н К . FISH |
может |
формацию о кариотипе можно полу |
||||||||||||||
быть проведена только для тех участ |
чить лишь при сочетанном использо |
||||||||||||||||
ков Д Н К , для |
которых уже разработа |
вании |
перечисленных |
методических |
|||||||||||||
ны молекулярные зонды. Методика |
приемов. |
|
|
|
|
||||||||||||
имеет целый ряд преимуществ перед |
|
|
|
|
|
|
|||||||||||
стандартным |
цитогенетическим |
ана |
12.1.3. |
Клиническое значение |
|||||||||||||
лизом: |
результат |
получают |
|
быстрее, |
|||||||||||||
|
хромосомного анализа |
||||||||||||||||
можно |
исследовать |
не |
только |
мета- |
|||||||||||||
в |
онкологии |
|
|
||||||||||||||
фазные пластинки, но и интерфазные |
|
|
|||||||||||||||
|
|
|
|
|
|
||||||||||||
ядра. |
Однако |
метод требует |
гораздо |
1 2 . 1 . 3 . 1 . Изменения кариотипа |
|||||||||||||
более |
дорогого оборудования |
и |
реак |
||||||||||||||
и малигнизация (краткие |
|||||||||||||||||
тивов, |
чем стандартный хромосомный |
||||||||||||||||
сведения) |
|
|
|
||||||||||||||
анализ. Интерфазный FISH-анализ |
|
|
|
||||||||||||||
|
|
|
|
|
|
||||||||||||
позволяет за короткое время изучить |
Цитогенетический |
анализ |
позво |
||||||||||||||
сотни клеток. Метод быстро развива |
лил выявить целый ряд фактов, свиде |
||||||||||||||||
ется и совершенствуется, число зон |
тельствующих о ключевой роли при |
||||||||||||||||
дов растет. В настоящее время уже |
обретенных генетических изменений в |
||||||||||||||||
многие специфические |
хромосомные |
малигнизации и прогрессии опухолей. |
|||||||||||||||
аномалии |
могут |
быть |
обнаружены |
с |
Самыми |
частыми |
хромосомными |
||||||||||
помощью |
FISH |
|
(рис. |
12.1—12.4, |
|||||||||||||
|
аномалиями, |
характерными для гемо |
|||||||||||||||
вклейка). При этом FISH можно про |
|||||||||||||||||
бластозов и для ряда солидных опухо |
|||||||||||||||||
водить |
на |
клетках, |
окрашенных |
по |
|||||||||||||
лей, являются |
транслокации. |
Различа |
|||||||||||||||
Романовскому—Гимзе |
или |
в |
сочета |
||||||||||||||
ют два основных типа специфических |
|||||||||||||||||
нии с |
различными |
цитохимическими |
|||||||||||||||
хромосомных |
транслокаций: |
первые |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
ииммунохимическими методиками. приводят к активации протоонкогенов
Это создает условия для изучения гис тогенеза клеток, в которых произошли изменения кариотипа.
В самые последние годы в хорошо оборудованных зарубежных лаборато риях используют дорогостоящую уста новку для спектрального анализа хро мосом, в основе которой тоже лежит принцип FISH—SKY (multicolor spec tral karyotyping). Эта установка позво ляет увидеть весь кариотип, причем каждая хромосома окрашивается в свой цвет. Использование SKY дает возможность улавливать большинство транслокаций, поскольку маркеры, возникшие в результате обмена между хромосомами, окрашенными в разные цвета, состоят из разноцветных участ ков. Такие маркеры очень демонстра тивны, и при определенном опыте легко увидеть и понять, какие хромо сомы приняли участие в их формиро вании (рис. 12.5, 12.6, вклейка). Су
без изменения их структуры за счет перемещения кодирующей области одного гена к промотору другого гена; в результате транслокаций второго ти па возникают совершенно новые уни кальные гены, образовавшиеся при слиянии фрагментов нормальных ге нов. Нередко участниками специфи ческих транслокаций являются протоонкогены или гены, кодирующие бел ки, важные для пролиферации и диф ференцировки, в частности транс крипционные факторы и протеинкиназы.
Примером аномалии первого типа является транслокация t(8;14)(q24; q32), в результате которой происходит перемещение гена МYC из области 8q24 в область гена тяжелых цепей иммуноглобулинов (14q32). Вследст вие этого события нарушается регуля ция продукции белка (транскрипци онного фактора), кодируемого геном
486
Т а б л и ц а 12.1. Основные хромосомные аномалии, характерные для ОНЛЛ
Аномалии |
Частота (%) |
Аномалии |
Частота (%) |
|
|
|
|
t(l;3)(p36;q21) |
< 1 |
+ 21 |
1-2 |
t(l;7)(pll;pll) |
< 1 |
- Υ |
1 - 2 |
inv(3)(q21q26) |
< 1 |
del(7q) |
3 - 4 |
t(3;5)(q21;q31) |
< 1 |
- 7 |
3 - 4 |
t(8;16)(pll;pl3) |
< 1 |
del(9q) |
3 - 4 |
+13 |
< 1 |
del/t(12p) |
3 - 4 |
+4 |
1 - 2 |
del(5q) |
5 - 6 |
t(6;9)(q23;q34) |
1 - 2 |
+ 8 |
5 - 6 |
t(9;22)(q34;q11) |
1-2 |
del/t(llq23) |
5 - 6 |
del/t(llql3-14) |
1 - 2 |
inv(l6) |
8 |
i(17q) |
1 - 2 |
t(8;21)(q22;q22) |
12 |
del(20)(q11) |
1-2 |
t(15;17)(q22;q21) |
12 |
|
|
|
|
МYC. Здесь мы вводим очень важное понятие — дерегуляция функционирова ния генов как важнейшее следствие хромосомной транслокации. Дерегу ляция — нарушение нормальной свя зи между фазами клеточного цикла и продукцией белка MYC, что в конеч ном счете усиливает пролиферацию клеток и приводит к их малигнизации. Эти данные были среди самых первых свидетельств важнейшей роли хромосомных транслокаций в малигнизации. Транслокация t(8; 14) наблю дается в 90 % случаев лимфомы Бер китта, ее считают характерной для мелкоклеточных лимфом с нерасчлененными ядрами и одного из вариан тов острого лимфобластного лейкоза (L3), а также изредка обнаруживают при других морфологических вариан тах злокачественных лимфом (табл. 12.1—12.6). Ген MYC — это первый онкоген, клонированный из места слияния хромосом при специфиче ской транслокации.
Различают два вида химерных или слитных (fusion) генов, образовавших ся в результате хромосомных трансло каций. Вид первый — кодирующая часть одного гена может быть соеди нена (слита) с промотором другого ге на. Примеры: слияние кодирующих областей гена MYC с промоторными областями генов тяжелых или легких цепей иммуноглобулинов при В-кле точных лимфомах или с промоторны
ми областями Т-клеточных рецепто ров при Т-клеточных лимфомах. При втором типе химерных генов наблю дается слияние кодирующих областей двух генов Примером может служить, в частности, специфическая трансло кация t(8;21)(q22;q22), при которой происходят разрывы в двух генах: ЕТО (хромосома 8) и AML1 (хромосома 21). При слиянии образовавшихся фраг ментов Д Н К на хромосоме 8 образует ся химерный ген, кодирующий новый химерный белок. Продукты этого ге на — Р Н К и белок — можно обнару-
Т а б л и ц а |
12.2. Параллелизм между осо |
||
бенностями |
кариотипа и |
морфологической |
|
формой ОНЛЛ |
|
|
|
|
|
|
|
Хромосомные аномалии |
|
FAB вариант |
|
|
|
|
|
t(l;3)(p36;q31) |
|
M4 |
|
t(l;22)(p13;ql3) |
|
M7 |
|
t(7;ll)(pl3;ql3) |
|
M2 |
|
t(l; 7)(p10;q10) |
|
M 1 - M 2 |
|
t(8;16)(pll;pl3) |
|
M5 |
|
t(8;21)(q22;q22) |
|
M2 |
|
t(9;22)(q34;qll) |
|
M 1 - M 2 |
|
t(9;ll)(p21-p22;q23) |
|
M5 |
|
t(11;V)(q23; V) |
|
M 4 - M 5 |
|
t(15;17)(q22;qll) |
|
M3 |
|
inv(l6)(pl3;q22) |
|
M4E0 |
|
или t(16;16)(pl3;q22) |
|
|
|
t(16;21)(pll;q22) |
|
M 1 - M 2 |
|
+4 |
|
|
M 1 - M 2 |
+ 11 |
|
|
M 1 - M 2 |
+22 |
|
|
M4 |
|
|
|
|
487
Т а б л и ц а 12.3. Основные повторяющиеся хромосомные перестройки при остром лимфоб-
ластном лейкозе (ОЛЛ)
Аномалии |
Частота (%) |
Аномалии |
Частота (%) |
|
|
|
|
t(1;11)(p32;q23) |
< 1 |
t(8;14)(q24;qll) |
1-2 |
t(l;14)(p32-34;q11) |
< 1 |
t(8;22)(q24;qll) |
1-2 |
(l)(ql2-21q31-32 |
< 1 |
+8 |
1-2 |
t(2;8)(pl2;q24) |
< 1 |
i(9q) |
1-2 |
i(6p) |
< 1 |
t/dic(9;12)(p11-12;p11-12) |
1-2 |
dic(7;9)(p11-13;p11) |
< 1 |
t(ll;14)(pl3;qll) |
1-2 |
t(7;14)(pl5;q32) |
< 1 |
t(ll;19)(q23;pl3) |
1-2 |
(10;14)(q24;q11) |
< 1 |
del(12)(p11-12) |
1-2 |
t(12;17)(pl2-13;ql2) |
< 1 |
del(9)(p21-22) |
4 |
t(14;22)(q32;q11) |
< 1 |
t(l;19)(q23;pl3) |
6 |
-20 |
< 1 |
t(8;14)(q24;q32) |
6 |
+21 |
< 1 |
del(6q) |
9 |
- Y |
< 1 |
t(4;11)(q21;q23) |
10 |
i(7q) |
1-2 |
t(9;22)(q34;q11) |
18 |
|
|
|
|
жить у всех больных с данной транс локацией. Аномалия характерна для острого миелобластного лейкоза, при чем для конкретного морфологиче ского субварианта (М2) (здесь и далее использованы обозначения гемобла стозов по международной классифи кации — FAB). AML1 является транс крипционным фактором, регулирую щим экспрессию ряда генов-мише ней, важных для пролиферации, диф ференцировки и функционирования гемопоэтических клеток. В норме AML1 экспрессируется в клетках всех линий кроветворения.
Поскольку изменения гена AML1
Т а б л и ц а 12.4. Хромосомные транслока
ции, характерные для В-клеточных ОЛЛ
Транслокации |
Гены |
Частота, % |
||
|
|
|
|
|
t(9;22)(q34;qll) |
BCR, |
ABL |
Взрослые |
— |
|
|
|
20, дети — 4 |
|
t(l;19)(q23;pl3) |
E2A, |
PBX1 |
Взрослые |
— |
|
|
|
2, дети — 5 |
|
t(ll;V)(q23;V) |
MLL, |
раз |
Дети до 1 |
|
|
ные |
|
года — 75, |
|
|
|
|
остальные — |
|
t(17;19)(q22;pl3) |
E2A, |
HLF |
3 |
|
< 1 |
|
|||
t(5;14)(q31;q32) |
IL3, |
IgH |
|
|
< 1 |
|
|||
t(8;14)(q24;q32) |
MYC, IgH |
2 - 5 |
|
|
t(8;22)(q24;qll) |
MYC, IgL |
< 15 |
|
|
|
|
|
|
|
играют важную роль при новообразо ваниях кроветворной системы, кратко приведем новые данные об этом гене как пример расшифровки важных ге нетических событий, без которых не возможны возникновение и развитие отдельных вариантов острого лейкоза человека.
Ген AML1 изолирован из лейкозных клеток человека, несущих транс локацию t(8;21)(q22;q22), в нем иден тифицирован домен, высокогомоло гичный гену runt дрозофилы. Послед ний необходим для связывания Д Н К и гетеродимеризации с белком CBFбета. У человека ген AML1 кодирует транс крипционный фактор, который обра зует комплекс с так называемым core binding factor β (CBFбета). Ген AML1 во влечен в различные транслокации, ха рактерные для острых лейкозов чело-
Т а б л и ц а 12.5. Хромосомные транслока
ции, характерные для Т-клеточных ОЛЛ
Транслокации |
Гены |
Часто |
|
та, % |
|||
|
|
||
|
|
|
|
t(l;14)(p32;qll) |
TAL/SCL, TCRбета |
< 1 |
|
t(8)(q24;14;q32) |
MYC, TCRальфа |
< 1 |
|
t(ll;14)(pl5;qll) |
TTG2, TCRбета |
< 1 |
|
t(7;10)(q34;q24) |
HOX11, TCRбета |
< 1 |
|
t(7;9)(q34;q34) |
TAN1, TCRбета |
< 1 |
|
|
|
|
488
Та б л и ца 12.6. Изменения кариотипа, характерные для злокачественных лимфом
Аномалии карио |
Вовлеченные |
Морфоиммунологические особенности |
|||
типа |
|
гены |
|||
|
|
|
|||
|
|
|
|
|
|
1р и lq |
|
? |
|
В- и Т-клеточные лимфомы, лимфогранулематоз |
|
t(2;3)(р12;q27) |
|
AGК; |
LAZ3 |
Диффузные крупноклеточные и фолликулярные В- |
|
|
|
|
|
лимфомы |
|
t(2;5)(p23;q35) |
|
ILK; NPM |
Ki-1 лимфома |
||
t(2;8)(pl2;q24) |
|
IGK; MYC |
Лимфома |
Беркитта |
|
t(2;18)(pl2;q21) |
IGK; |
FVTI |
Фолликулярные В-клеточные лимфомы |
||
+3 |
|
? |
|
Различные В- и Т-клеточные лимфомы |
|
Перестройки 3q |
? |
|
Различные В- и Т-клеточные лимфомы, лимфогра |
||
|
|
|
|
нулематоз |
|
t(3;14)(q27;q32) |
LAZ3; |
IGH |
Диффузные крупноклеточные и фолликулярные В- |
||
|
|
|
|
лимфомы |
|
t(3;22)(q27;qll) |
LAZ3; |
IGL |
Диффузные крупноклеточные и фолликулярные В- |
||
|
|
|
|
лимфомы |
|
Перестройки 6p |
? |
|
Т-клеточные лимфомы |
||
del(6q) |
|
? |
|
Различные лимфомы (в основном В-клеточные), |
|
|
|
|
|
лимфогранулематоз |
|
+7 |
|
? |
|
Различные В- и Т-клеточные лимфомы |
|
Перестройки 7q |
? |
|
Лимфогранулематоз |
||
t(8;14)(q24;q32) |
MYC; IGH |
Лимфома |
Беркитта |
||
t(8;22)(q24;q11) |
MYC; IGL |
Лимфома |
Беркитта |
||
Перестройки 9q |
? |
|
Различные В- и Т-клеточные лимфомы |
||
I(9;14)(pl3;q32) |
?; IGH |
Лимфоцитарные В-лимфомы |
|||
t(10;14)(q24;q32) |
LYT10; |
IGH |
Различные В-клеточные лимфомы |
||
del(11q) |
|
? |
|
Лимфоцитарные В-лимфомы |
|
t(ll;14)(ql3;q32) |
BCL1/PRAD1; |
Лимфоцитарные или центроцитарные В-лимфомы |
|||
|
|
IGH |
|
|
|
t(ll;18)(q21;q21) |
? |
|
Лимфоцитарные В- и MALT-лимфомы |
||
+12 |
|
? |
|
Лимфоцитарные и диффузные крупноклеточные |
|
|
|
|
|
В-лимфомы |
|
Перестройки |
12p |
? |
|
Лимфогранулематоз |
|
Перестройки |
13p |
? |
|
Лимфогранулематоз |
|
Перестройки 14ql 1 |
TCRA; |
TCRD |
Т-клеточные лимфомы |
||
del(14q) |
|
7 |
|
Различные В- и Т-клеточные лимфомы |
|
Перестройки |
14q32 |
IGH |
|
Различные В-клеточные лимфомы, лимфогрануле |
|
|
|
|
|
матоз |
|
t(14;18)(q32;q21) |
IGH; |
BCL2 |
Фолликулярные и диффузные крупноклеточные В- |
||
|
|
|
|
лимфомы |
|
+ 18 |
|
? |
|
Различные В- и Т-клеточные лимфомы |
|
t(18;22)(q21;q11) |
BCL2; |
IGL |
Фолликулярные В-клеточные лимфомы |
||
-X/+X/-Y |
|
? |
|
Различные В- и Т-клеточные лимфомы |
|
|
|
|
|
|
|
века: кроме t(8;21)(q22;q22), это еще транслокация t(3;21), характерная для вторичных острых миелоидных лейко зов и миелобластных кризов ХМЛ, и транслокация t(12:21) — одна из са мых частых генетических аномалий при остром лимфобластном лейкозе (ОЛЛ) детей.
В настоящее время имеется описа ние нескольких родословных, в кото
рых по аутосомно-доминантному типу передается мутантный аллель гена AML1. При этом, несмотря на разно образие наблюдаемых мутаций, фено тип пациентов имеет ряд общих черт: это тромбоцитопения с нарушениями функциий тромбоцитов в сочетании с признаками миелодисплазии клеток костного мозга. В ряде случаев через несколько лет от манифестации тром-
489
боцитопении развивались новообра |
ластные лейкозы, но никогда не лим- |
|||||||||||||||||||||
зования |
миелоидной |
природы, |
боль |
фобластные. |
|
|
|
|
|
|
|
|||||||||||
шей частью острые миелоидные лей |
Установлено, что нормальный ге- |
|||||||||||||||||||||
козы. Синдром получил название |
мопоэз невозможен без гена AML1 и |
|||||||||||||||||||||
FPD/AML — familial platelet disorder |
комплекса AMLl-CBFбета. Химерный |
|||||||||||||||||||||
with predisposition to acute myeloid |
ген AML1-ETO, образовавшийся в ре |
|||||||||||||||||||||
leukemia. |
Интересно, |
|
что хромосом |
зультате |
хромосомной |
транслокации |
||||||||||||||||
ный анализ лейкемических клеток у |
t(8;21), |
ингибирует нормальное |
функ |
|||||||||||||||||||
больных с острым лейкозом, развив |
ционирование |
комплекса |
AML1 — |
|||||||||||||||||||
шимся у носителей мутантного гена |
CBFбета и тем самым ингибирует диф- |
|||||||||||||||||||||
AML1, не выявлял перестроек хромо |
ференцировку |
ранних |
гемопоэтиче- |
|||||||||||||||||||
сомы 21, где этот ген в норме локали |
ских |
предшественников. |
Попытки |
|||||||||||||||||||
зован. Обычно в таких случаях обна |
инициировать в эксперименте лейке- |
|||||||||||||||||||||
руживали утраты |
|
и делеции хромосом |
мическую трансформацию с помощью |
|||||||||||||||||||
5 или 7, характерные для миелодис- |
химерного гена AML1-ETO оказались |
|||||||||||||||||||||
плазий и вторичных лейкозов [Но et |
безуспешными. Однако было показа |
|||||||||||||||||||||
al., |
1996; |
Michaud et al., |
2002]. |
|
|
но, что экспрессия продуктов этого |
||||||||||||||||
На |
основании |
многочисленных |
гена in vivo и in vitro вызывает значи |
|||||||||||||||||||
экспериментов был сделан вывод, что |
тельные нарушения гемопоэза. Ост |
|||||||||||||||||||||
лейкемогенное |
действие |
|
химерных |
бел |
рый миелоидный лейкоз может быть |
|||||||||||||||||
ков, |
включающих |
|
AML1, |
прежде |
всего |
индуцирован у трансгенных мышей с |
||||||||||||||||
обусловлено |
блоком |
нормального |
AML1. |
экспрессией химерного белка AML1 - |
||||||||||||||||||
Кроме того, химерные белки, на |
ЕТО под промотором hMRP8 после |
|||||||||||||||||||||
пример AML1-ETO, активируют про |
обработки |
этих |
экспериментальных |
|||||||||||||||||||
моторы отдельных генов, что тоже иг |
животных |
сильным |
мутагеном |
N- |
||||||||||||||||||
рает определенную роль в лейкемоге- |
этил-N-нитрозомочевиной. При этом |
|||||||||||||||||||||
незе. |
|
|
|
|
|
|
|
|
именно |
|
миелобластный |
вариант |
лей |
|||||||||
При |
острых |
миелоидных |
лейкозах |
коза |
|
развивается |
|
у |
большинства |
|||||||||||||
трансгенных |
животных |
после |
обра |
|||||||||||||||||||
описаны |
субмикроскопические |
мута |
||||||||||||||||||||
ботки |
мутагеном, |
у |
остальных |
же |
||||||||||||||||||
ции в гене AML1, |
причем эти мутации |
|||||||||||||||||||||
трансгенных мышей и в контроле по |
||||||||||||||||||||||
наблюдают не так уж и |
редко: их час |
|||||||||||||||||||||
сле аналогичной обработки возникают |
||||||||||||||||||||||
тота |
составляет |
|
5—7 |
% всех |
|
острых |
||||||||||||||||
|
|
не миелобластные, |
а лимфобластные |
|||||||||||||||||||
нелимфобластных |
лейкозов |
с |
нор |
|||||||||||||||||||
лейкозы. Из этих и других опытов был |
||||||||||||||||||||||
мальным |
кариотипом. |
|
|
|
|
|||||||||||||||||
|
|
|
|
сделан однозначный вывод о том, |
что |
|||||||||||||||||
Необходимо |
также |
сказать, что |
||||||||||||||||||||
онкогенный |
потенциал |
белка |
AML1 - |
|||||||||||||||||||
ген |
CBFбета, белок которого |
образует |
||||||||||||||||||||
ЕТО может |
быть |
проявлен |
только в |
|||||||||||||||||||
комплексы |
(гетеродимеры) с |
белком |
||||||||||||||||||||
кооперации |
с |
другими |
дополнитель |
|||||||||||||||||||
AML1, |
является |
участником |
другой |
|||||||||||||||||||
ными мутациями [Yuan et al., |
2001]. |
|||||||||||||||||||||
специфичной перестройки, характер |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
ной для ОМЛ, — инверсии хромосо |
Изучены уже десятки специфиче |
|||||||||||||||||||||
мы 16, в результате которой образу |
ских транслокаций, ведущих к актива |
|||||||||||||||||||||
ется химерный ген CBFбета-MYH11. |
ции протоонкогенов, в частности, за |
|||||||||||||||||||||
Упомянутая |
специфическая |
анома |
счет |
формирования |
химерных |
генов. |
||||||||||||||||
лия кариотипа — инверсия хромосо |
Идентифицировано |
несколько |
десят |
|||||||||||||||||||
мы |
16 — характерна для миеломоноб- |
ков генов из точек соединения хромо |
||||||||||||||||||||
ластных лейкозов. Она обнаружива |
сом |
при |
транслокациях, характерных |
|||||||||||||||||||
ется практически во всех случаях |
для |
острых лейкозов, |
злокачественных |
|||||||||||||||||||
миеломонобластного лейкоза с эози- |
лимфом и сарком (см. табл. 12.4, |
|||||||||||||||||||||
нофилией и у 40 % больных с миело- |
12.11). Функции этих генов интенсив |
|||||||||||||||||||||
монобластным лейкозом без эозино- |
но изучаются. Многие из них кодиру |
|||||||||||||||||||||
филии. Примерно половину лейкозов |
ют белки, важные для пролиферации, |
|||||||||||||||||||||
с инверсией хромосомы 16 составля |
дифференцировки |
и |
запрограммиро |
|||||||||||||||||||
ют не миеломонобластные, а миелоб- |
ванной |
|
клеточной |
смерти (апоптоза). |
||||||||||||||||||
490
Установлено, что они могут кодиро вать ростовые факторы, рецепторы ростовых факторов, сигнальные моле кулы (signal transducers), протеинкиназы, транскрипционные факторы, регу лирующие уровень транскрипции оп ределенных генов-мишеней, причем изменения каждого из них могут при вести к бесконтрольной пролифера ции. Все эти данные — свидетельство ключевой роли хромосомных трансло каций в канцерогенезе.
Многочисленные эксперименталь ные данные, часть из которых приво дится в этой главе, показывают, что для проявления онкогенного потен циала химерных белков, кодируемых химерными генами, необходимы до полнительные генетические измене ния.
Как правило, протоонкогены отно сятся к высококонсервативным генам, чьи гомологи обнаруживаются у дрозо филы, дрожжей и других микрооганизмов. В этом отношении весьма интере сен онкоген BCL2 (В cell leukemia/lymphoma), локализованный в 18q21 и идентифицированный при расшифров ке транслокации t(14;18) (q21;q22), специфичной для фолликулярной лим фомы. Обнаружена очень высокая го мология между геном BCL2 и геном ced 9 у С. elegans, где этот ген играет важную роль в регуляции процесса апоптоза. Твердо установлено, что у человека ген BCL2 участвует в регуля ции апоптоза: повышение его экспрес сии тормозит апоптоз. В данном случае мы видим другой механизм участия онкогенов в малигнизации: удлинение жизни клетки, а не изменение проли ферации и дифференцировки. Приве денный пример демонстрирует участие в специфической транслокации одного из целого ряда уже известных генов, связанных с апоптозом.
Другой яркий пример — трансло кация t(9;22), при которой происходит активация гена ABL при хроническом миелолейкозе и острых лимфобластных лейкозах. Это приводит к тормо жению апоптоза и удлинению жизни клеток. Ген ABL был идентифициро
ван ранее в одном из вирусов лейкоза мышей. У человека он локализован в длинном плече хромосомы 9 (9q34).
Мышиный ген аbl хорошо изучен; установлено, что белок аbl является тирозинкиназой.
В хромосоме 22 наблюдается раз рыв гена BCR (breakpoint cluster re gion). В результате слияния фрагмен тов ABL и BCR образуется химерный (гибридный) ген BCR-ABL, располо женный, как правило, на укороченной хромосоме 22 (Ph-хромосоме). Этот ген кодирует белок с мол. массой 210 кДа, обладающий более высокой тирозинкиназной активностью, чем продукт нормального протоонкогена ABL (Р145). При лейкозе, вызванном у мышей вирусом Абельсона, онкогенной активностью обладает белок — продукт гибридного гена gag/abl с вы сокой тирозинкиназной активностью. Тирозинкиназы — это ферменты, спо собствующие переносу фосфора с АТФ (аденозинтрифосфата) на белко вый субстрат и играющие важнейшую роль в таких процессах, как пролифе рация и дифференцировка. В экспе рименте проводили вырезание гена gag/abl, что лишало вирус способно сти вызывать лейкоз у мышей.
Решающая роль гена BCR-ABL и его белка Р210 в развитии хрониче ского миелолейкоза была убедительно продемонстрирована на разных мо дельных системах in vivo и in vitro.
Так, трансдукция bcr/abl в стволо вые гемопоэтические клетки мыши с последующей трансплантацией этих клеток облученным сингенным жи вотным вызывает у них миелопролиферативное заболевание, сходное с хроническим миелоидным лейкозом человека. Установлено, что онкогенный потенциал химерного белка BCR-ABL обусловлен его высокой ти розинкиназной активностью. Дерегуляция тирозинкиназной активности — одно из центральных событий в зло качественной трансформации клеток.
В последние годы в клиническую практику вошел новый эффективный препарат — селективный ингибитор
491
некоторых тирозинкиназ, а именно белков abl, bcr-abl, c-kit. Препарат на зывается STI 571 (Signal transduction inhibitor 571), glevec. При введении по 300 мг в сутки у 98 % пациентов с ХМЛ наблюдается существенное ге матологическое улучшение. Примерно в половине случаев получен выражен ный цитогенетический ответ. Такой яркий клинический эффект ингибито ра тирозинкиназ подтверждает решаю
щую роль белка BCR-ABL, обладающе го тирозинкиназной активностью, в возникновении ХМЛ.
Пока неясно, при каких условиях введение химерного белка Р210 BCRABL вызывает у экспериментальных животных именно ХМЛ, а не другие гемобластозы. Неясно, почему при введении клеток, экспрессирующих Р210 BCR-ABL, группе летально облу ченных мышей в условиях одного и того же эксперимента у одних живот ных развивается лейкоз, очень похо жий на ХМЛ человека, а у других воз никают самые разнообразные гемато логические новообразования: миеломоноцитарные лейкозы, макрофагальные опухоли, пре-В- и Т-клеточные лимфомы, ретикулоклеточные сарко мы и эритроидные опухоли? Эти опы ты, так же как и эксперименты с трансгенными мышами, показывают, что вся цепь событий, приводящая к развитию картины ХМЛ, пока еще не выяснена.
Сейчас получена хорошо воспроиз водимая модель ХМЛ у трансгенных мышей, у которых химерный ген BCR-ABL находится под промотором гена tec, который экспрессируется преимущественно в клетках-предше ственницах гемопоэтической ткани. На этой же мышиной модели показа но, что приобретенные мутации гена р53 могут играть важную роль в разви тии опухолевой прогрессии при ХМЛ, т. е. в переходе болезни в терминаль ную фазу [Honda et al., 2000].
Как уже упоминалось, патогенез ХМЛ до конца не ясен. В последние годы получены данные о том, что мас са кроветворных и кровяных клеток в
организме больных существенно уве личена главным образом за счет рез кого повышения времени жизни этих клеток, поскольку активированный ген ABL (в гене BCR-ABL) ингибирует апоптоз-запрограмированную клеточ ную смерть. Кроме того, этот ген уси ливает пролиферацию миелоидных клеток. Есть основания считать, что при ХМЛ изменена функция специ альных клеточных белков-интегринов, в результате чего нарушается адгезия молодых миелоидных клеток к стромальным элементам и стволовые лейкемические клетки избегают негатив ных регуляторных влияний.
Клонирование точек разрыва и слияния хромосом при специфиче ских хромосомных транслокациях — один из важных путей идентификации генов, вовлеченных в канцерогенез.
Сейчас идентифицировано около 50 транслокаций, которые составляют примерно 1 % всех перестроек, на блюдаемых при лейкозах, лимфомах или солидных опухолях. Клонированы гены, которые претерпевают измене ния при этих наиболее частых транс локациях, однако механизмы возник новения транслокаций пока не ясны. При лимфоидных опухолях, когда транслокации вовлекают гены имму ноглобулинов (В-клеточные лимфо мы) или Т-клеточных рецепторов (Т- клеточные опухоли), причиной воз никновения транслокаций считают ошибки ферментов-рекомбиназ, дей ствующих в ходе созревания лимфо идных клеток. Эта гипотеза прямо не подтверждена, хотя имеется ряд кос венных данных, свидетельствующих в пользу ее правомерности.
Активация протоонкогенов (про дукция активных онкопротеинов) мо жет осуществляться не только за счет хромосомных транслокаций, но и дру гими путями, например в результате точковых мутаций или генной ампли фикации. В настоящее время ни у ко го не вызывает сомнения постулат: опухоль возникает в результате много ступенчатого процесса накопления ге нетических изменений. К этим изме-
492
нениям относится не только актива |
|
|
ляет |
слитный |
|
ген |
BCR-ABL |
у |
|||||||||||||||||||||
ция проонкогенов, но и инактивация |
|
|
30 |
% здоровых взрослых людей. |
|||||||||||||||||||||||||
генов |
— |
супрессоров |
|
злокачествен |
Уровень |
экспрессии |
|
лейкозассо- |
|||||||||||||||||||||
ности. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
циированных |
химерных |
генов |
у |
здо |
||||||||||||||
В |
многочисленных |
публикациях |
|||||||||||||||||||||||||||
ровых |
людей обычно |
весьма |
низок |
и |
|||||||||||||||||||||||||
последних лет отражен большой |
опыт |
||||||||||||||||||||||||||||
не нарастает. |
Следует заметить, |
что |
|||||||||||||||||||||||||||
по |
индукции |
|
различных новообразо |
||||||||||||||||||||||||||
|
пока |
|
нет |
систематизированных |
ре |
||||||||||||||||||||||||
ваний, |
в |
частности эксперименталь |
|
||||||||||||||||||||||||||
зультатов |
длительного |
наблюдения |
за |
||||||||||||||||||||||||||
ных лейкозов |
и |
лимфом с |
помощью |
||||||||||||||||||||||||||
здоровыми |
людьми, |
у |
которых |
обна |
|||||||||||||||||||||||||
химерных |
белков, |
продуцируемых |
|||||||||||||||||||||||||||
ружена экспрессия |
химерных продук |
||||||||||||||||||||||||||||
химерными генами. Установлено, что |
|||||||||||||||||||||||||||||
тов, |
характерных для |
опухолевых |
кле |
||||||||||||||||||||||||||
только |
при |
|
воздействии |
дополни |
|||||||||||||||||||||||||
|
ток. Принято считать, что для эффек |
||||||||||||||||||||||||||||
тельных генетических |
событий |
|
удает |
||||||||||||||||||||||||||
|
тивной продукции опухолевого |
фено |
|||||||||||||||||||||||||||
ся |
получить |
|
опухоли, |
|
морфологиче |
||||||||||||||||||||||||
|
|
типа |
|
слитный |
ген, |
возникший |
в |
ре |
|||||||||||||||||||||
ски |
|
весьма сходные с таковыми у че |
|
||||||||||||||||||||||||||
|
зультате |
фундаментальных |
ошибок |
||||||||||||||||||||||||||
ловека, |
т. е. |
|
напрашивается |
вывод: |
|||||||||||||||||||||||||
|
репликации |
и |
репарации |
Д Н К , |
дол |
||||||||||||||||||||||||
несмотря |
на |
|
важнейшую роль химер |
||||||||||||||||||||||||||
|
жен |
обладать |
способностью |
продуци |
|||||||||||||||||||||||||
ных белков в малигнизации, для зло |
|||||||||||||||||||||||||||||
ровать полноценный белок с онкоген- |
|||||||||||||||||||||||||||||
качественной |
|
трансформации |
клеток |
||||||||||||||||||||||||||
|
ным потенциалом и сформироваться в |
||||||||||||||||||||||||||||
воздействие |
|
этих |
белков |
недоста |
|||||||||||||||||||||||||
|
ранних |
клетках-предшественницах, |
|||||||||||||||||||||||||||
точно. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
способных к самоподдержанию. Ины |
||||||||||||||||||
Существует еще одна группа фак |
|||||||||||||||||||||||||||||
ми словами, возникновение специфи |
|||||||||||||||||||||||||||||
тов, |
|
свидетельствующих |
о недостаточ |
ческого слитного гена в молодой |
|||||||||||||||||||||||||
ности химерных генов и экспресси- |
клетке-предшественнице может дать |
||||||||||||||||||||||||||||
руемых ими белков для злокачествен |
этой |
клетке селективные |
преимущест |
||||||||||||||||||||||||||
ной трансформации клеток. Это дан |
ва, в результате которых и |
может |
|||||||||||||||||||||||||||
ные о том, что в клетках крови здоро |
иметь место экспансия нового опухо |
||||||||||||||||||||||||||||
вых |
|
людей |
|
нередко |
|
обнаруживают |
левого клона. Возникновение слитно |
||||||||||||||||||||||
слитные (химерные) гены, ассоцииро |
го гена в относительно зрелых клет |
||||||||||||||||||||||||||||
ванные |
с |
конкретными |
злокачествен |
ках, возможно, является безвредным. |
|||||||||||||||||||||||||
ными новообразованиями: |
|
|
|
Кроме того, весьма вероятно, что для |
|||||||||||||||||||||||||
• |
BCR-ABL (Р210 |
и |
Р190, |
|
харак |
целого ряда лейкозов, |
в том числе для |
||||||||||||||||||||||
|
ХМЛ, |
необходимы |
|
дополнительные |
|||||||||||||||||||||||||
|
|
терные для ХМЛ и ОЛЛ соответ |
|
||||||||||||||||||||||||||
|
|
мутации, |
чтобы |
клетка |
с |
химерным |
|||||||||||||||||||||||
|
|
ственно); |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
геном |
стала |
бы |
стволовой |
для |
нового |
|||||||||||||||
• |
BCL2-IgH, |
|
характерный |
|
для |
||||||||||||||||||||||||
|
|
опухолевого |
клона. |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
фолликулярной лимфомы и воз |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
никающий |
в |
результате специ |
Кроме |
специфических |
хромосом |
||||||||||||||||||||||
|
|
фической транслокации t(14;18); |
ных транслокаций, при изучении раз |
||||||||||||||||||||||||||
• |
MYC-IgH, |
специфичный |
для |
личных |
новообразований |
регулярно |
|||||||||||||||||||||||
|
|
лимфомы Беркитта и обнаружи |
обнаруживают |
|
повторяющиеся |
|
(не |
||||||||||||||||||||||
|
|
ваемый |
|
при |
некоторых |
других |
случайные) делеции. Опыт показыва |
||||||||||||||||||||||
|
|
злокачественных |
|
лимфомах и |
ет, что за неслучайными хромосомны |
||||||||||||||||||||||||
|
|
ОЛЛ |
со |
специфической хромо |
ми делениями стоит, как правило, |
||||||||||||||||||||||||
|
|
сомной транслокацией t(8;14); |
инактивация |
генов |
|
— |
|
супрессоров |
|||||||||||||||||||||
• |
NPM-ALK, |
|
характерный |
|
для |
злокачественности. |
К |
|
настоящему |
||||||||||||||||||||
|
|
СD30-позитивной |
крупнокле |
времени |
идентифицировано |
около |
20 |
||||||||||||||||||||||
|
|
таких |
генов. |
Наиболее |
известны |
RB, |
|||||||||||||||||||||||
|
|
точной анапластической лимфо |
|||||||||||||||||||||||||||
|
|
p53, |
|
BRCA1, |
BRCAII, |
АРС, |
WT1 |
и |
це |
||||||||||||||||||||
|
|
мы со |
специфической |
трансло |
|
||||||||||||||||||||||||
|
|
лая |
группа |
генов, |
тесно |
ассоцииро |
|||||||||||||||||||||||
|
|
кацией |
|
t(2;5); |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
ванных с |
наследственным |
неполипо- |
||||||||||||||||||
• |
некоторые |
|
перестройки |
|
гена |
||||||||||||||||||||||||
|
|
зным |
раком |
толстой |
кишки: |
MSH2, |
|||||||||||||||||||||||
|
|
MLL, |
причем |
высокочувстви |
|||||||||||||||||||||||||
|
|
MLH1, |
PMS1, |
PMS2. |
Многие |
из |
этих |
||||||||||||||||||||||
|
|
тельная гнездная О Т - П Ц Р выяв |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
493
генов |
|
кодируют |
|
транскрипционные |
ких случаях обе мутации появляются в |
||||||||||||||||
факторы. |
|
|
|
|
|
|
соматической |
|
клетке |
в |
постэмбрио |
||||||||||
Современное |
представление о ге |
нальном периоде. Тогда возникает |
|||||||||||||||||||
нах |
— |
|
супрессорах |
злокачествнности |
спорадическая |
|
односторонняя |
рети- |
|||||||||||||
сложилось при изучении двух типов |
нобластома. |
|
В |
опухолевых |
клетках |
||||||||||||||||
опухолей: ретинобластомы и нефро- |
всех |
ретинобластом |
|
наблюдается |
|||||||||||||||||
бластомы (опухоли Вильмса). Эти |
инактивация двух аллелей гена RB. |
|
|||||||||||||||||||
опухоли наблюдаются у маленьких де |
Сказанное не означает, что все ге |
||||||||||||||||||||
тей, |
причем |
различают |
ненаследст |
ны—супрессоры |
злокачественности |
||||||||||||||||
венную |
(спорадическую, |
односторон |
претерпевают идентичные изменения, |
||||||||||||||||||
нюю) |
и наследственную |
(двусторон |
приводящие к |
малигнизации |
и/или |
||||||||||||||||
нюю) ретинобластому. Ключевым со |
опухолевой |
прогрессии. |
Подробное |
||||||||||||||||||
бытием |
при |
ретинобластоме |
является |
изложение |
этого |
вопроса |
читатель |
||||||||||||||
инактивация RB, а при опухоли |
найдет в разделе данной монографии, |
||||||||||||||||||||
Вильмса — WT1 |
гена. Ген RB локали |
посвященном |
|
генам |
— |
супрессорам |
|||||||||||||||
зован в области 13ql4. Для развития |
злокачественности. |
|
|
|
|
|
|||||||||||||||
опухоли |
необходима |
инактивация |
Несмотря на то что биологическое |
||||||||||||||||||
двух аллелей RB. Обычно первым со |
значение не всех повторяющихся хро |
||||||||||||||||||||
бытием |
|
является |
делеция |
длинного |
мосомных делеций понятно в деталях, |
||||||||||||||||
плеча в одном из гомологов хромосо |
их обнаружение имеет большое кли |
||||||||||||||||||||
мы 13. Величина делеций сильно |
ническое значение: эти |
перестройки, |
|||||||||||||||||||
варьирует — от хорошо видимых |
так же как и несбалансированные |
||||||||||||||||||||
крупных до субмикроскопических. Во |
транслокации, |
более |
характерны |
для |
|||||||||||||||||
втором аллеле присходит обычно му |
солидных опухолей, чем для гемобла |
||||||||||||||||||||
тация. При наследственных ретино- |
стозов. Такие аномалии часто наблю |
||||||||||||||||||||
бластомах все клетки ребенка несут |
даются при |
вторичных |
(возникших |
||||||||||||||||||
мутацию или делецию в 13q. |
|
после химио-, лучевой или комбини |
|||||||||||||||||||
Как уже говорилось, при нефро- |
рованной терапии) лейкозах и миело- |
||||||||||||||||||||
бластоме центральным событием яв |
дисплазиях. |
|
|
|
|
|
|
|
|
|
|||||||||||
ляется |
инактивация |
WT1 гена, лока |
|
|
|
|
|
|
|
|
|
|
|
||||||||
лизованного в коротком плече хромо |
12.1.3.2. Диагностика |
|
|
|
|||||||||||||||||
сомы 11, при этом на цитогенетиче- |
и дифференциальная |
|
|
|
|||||||||||||||||
ских препаратах из клеток крови мож |
диагностика опухолей* |
|
|
|
|||||||||||||||||
но обнаружить маркер 11p-. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Выявление делеций 13q или 11p в |
Хромосомный |
анализ используется |
|||||||||||||||||||
крови |
|
ребенка |
служит |
диагностиче |
в онкологической клинике для реше |
||||||||||||||||
ским критерием наследственных форм |
ния следующих важных вопросов: |
|
|||||||||||||||||||
ретинобластомы |
и |
|
нефробластомы и |
• |
опухоль — |
не опухоль? |
|
|
|||||||||||||
используется |
при |
генетическом кон |
|
|
|||||||||||||||||
• |
доброкачественная |
опухоль |
или |
||||||||||||||||||
сультировании в онкологии. |
|
||||||||||||||||||||
|
|
злокачественная? |
|
|
|
|
|||||||||||||||
На основании изучения ретинобла- |
|
|
|
|
|
||||||||||||||||
• |
какой конкретный тип опухоли? |
||||||||||||||||||||
стом в 1971 г. известным генетиком |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Кнудсоном была создана теория воз |
Конечно, |
цитогенетика |
не |
всегда |
|||||||||||||||||
никновения опухолей в результате по |
отвечает на эти вопросы, однако в ря |
||||||||||||||||||||
следовательного развития двух генети |
де конкретных обстоятельств она мо |
||||||||||||||||||||
ческих событий. Одно из этих собы |
жет иметь решающее значение. |
|
|
||||||||||||||||||
тий может быть врожденным и при |
Выше мы уже останавливались на |
||||||||||||||||||||
сутствовать во всех клетках организ |
том, что каждая опухоль представля |
||||||||||||||||||||
ма, а второе происходит в соматиче |
ет |
собой |
клон |
измененных |
клеток. |
||||||||||||||||
ских клетках, которые становятся ро |
Этот факт может быть использован в |
||||||||||||||||||||
доначальницами |
опухолевых |
клонов. |
тех случаях, когда комплекс классиче |
||||||||||||||||||
В этом случае развиваются наследст |
ских |
диагностических |
критериев |
не |
|||||||||||||||||
венные двусторонние опухоли. В ред |
дает |
ответа |
на |
|
вопрос, о |
каком про- |
|||||||||||||||
494
цессе идет речь — неопластическом |
частотой наблюдаться как в морфоло |
||
или воспалительном (опухоль — не |
гически сходных, так и в совершенно |
||
опухоль?), в частности, при неясных |
различных опухолях. |
Понятие |
неслу |
лимфаденопатиях или экссудатах. Ес |
чайные изменения шире |
понятия |
спе |
ли в таких случаях удается обнаружить |
цифические |
|
изменения. |
|
|
|||||||||
клоны клеток с выраженными хромо |
Нарушения |
|
кариотипа |
злокачест |
||||||||||
сомными перестройками, диагноз опу |
венных |
новообразований |
принято |
|||||||||||
холи можно считать стопроцентным. |
подразделять на первичные и вторич |
|||||||||||||
На протяжении многих лет и до |
ные. Первичные — это те, которые |
|||||||||||||
последнего |
времени |
принято |
было |
обнаруживаются |
на |
ранних этапах |
||||||||
считать, что любой клон клеток с ано |
развития опухоли и определяют ее |
|||||||||||||
малиями кариотипа — признак злока |
становление. Специфические измене |
|||||||||||||
чественности. |
Сейчас |
накопились |
ния кариотипа обычно первичны. |
|||||||||||
данные о том, что это правило имеет |
Вторичные возникают в ходе опухоле |
|||||||||||||
исключения. Во-первых, показано что |
вой прогрессии, позже первичных из |
|||||||||||||
в нормальной (без опухолевых пора |
менений. Они тоже являются неслу |
|||||||||||||
жений) |
слизистой |
оболочке полости |
чайными. |
|
|
|
|
|
|
|||||
рта могут быть обнаружены множест |
Практически |
все |
морфологиче |
|||||||||||
венные клоны с хромосомными абер |
ские типы |
изученных |
новообразова |
|||||||||||
рациями — как числовыми, так и |
ний отличаются друг от друга по сво |
|||||||||||||
структурными. Чаще всего количество |
им цитогенетическим особенностям: в |
|||||||||||||
таких |
клеток |
не |
превышает |
2—3 % |
ряде опухолей обнаружены специфи |
|||||||||
всей популяции, а изменения числа и/ |
ческие, характерные только для них |
|||||||||||||
или структуры |
хромосом |
небольшие, |
хромосомные изменения, причем они |
|||||||||||
однако |
опубликованы |
единичные на |
выявляются |
в |
значительном проценте |
|||||||||
блюдения о больших клонах с множе |
случаев. При других типах новообра |
|||||||||||||
ственными |
аномалиями |
кариотипа в |
зований |
специфические |
изменения |
|||||||||
неопухолевых |
тканях. |
Во-вторых, |
кариотипа не обнаружены, но имеют |
|||||||||||
имеются сообщения о том, что клоны |
ся данные о наборе хромосомных ано |
|||||||||||||
клеток |
с дополнительной |
хромосомой |
малий, характерных для опухолей оп |
|||||||||||
7 были выявлены при неопухолевых |
ределенного |
гистогенеза. |
Например, |
|||||||||||
процессах, например в атеросклероти- |
спектр хромосомных нарушений при |
|||||||||||||
ческих бляшках, при гиперплазии щи |
гемобластозах |
миелоидной |
природы |
|||||||||||
товидной и предстательной желез, ва |
отличается от такового при лимфо- |
|||||||||||||
рикозном расширении вен и некото |
пролиферативных заболеваниях. В то |
|||||||||||||
рых других. |
|
|
|
|
|
|
же время |
для |
|
В-клеточных опухолей |
||||
Вдиагностическом отношении характерны иные хромосомные пере
весьма важны данные о специфиче ских или патогномонических измене ниях кариотипа. Речь идет о хромо сомных нарушениях, которые ассо циированы с морфологическим типом опухоли и наблюдаются в группе со ответствующих новообразований с от носительно высокой частотой (20— 100 % ) , причем в опухолях другого ти па такие аномалии не наблюдаются или обнаруживаются редко.
В специальной литературе исполь зуется термин неслучайные хромосом ные изменения. При этом имеются в виду повторяющиеся нарушения, т. е. такие, которые могут с определенной
стройки, чем для Т-клеточных (см. табл. 12.4-12.6).
Специфические хромосомные ано малии могут иметь решающее диагно стическое значение при атипичной клинико-морфологической картине, поскольку позволяют отвергнуть оши бочный диагноз. В частности, хромо сомный анализ важен в тех случаях, когда на основании морфологических данных не представляется возможным провести дифференциальный диагноз между доброкачественной и злокаче ственной опухолью одной и той же локализации, например между адено мой и карциномой почек, щитовид-
495
нои железы, слюнных желез, а также текомой и карциномой яичника, при чем это относится не только к эпите лиальным, но и к мезенхимальным опухолям (см. табл. 12.9, 12.10).
Т а б л и ц а 12.7. Изменения кариотипа, ха
рактерные для миеломной болезни
Аномалии кариотипа |
Частота, % |
|
|
Перестройки хромосомы 1 |
4 0 - 5 0 |
14q+ |
2 0 - 2 5 |
6q- |
1-12 |
7q- |
6 - 4 0 |
13q- |
3 0 - 5 0 |
t(9;22)(q34;qll) |
< 5 |
t(8;14)(q24;q32) |
< 5 |
t(14;18)(q32;q21) |
< 5 |
17p+ или i(17q) |
< 5 |
|
|
В настоящее время известно не сколько десятков специфических хро мосомных аномалий. Самыми яркими примерами являются транслокация t(9;22)(q34;q11), обнаруживаемая у по давляющего большинства (95—98 % случаев) больных хроническим миелоидным лейкозом (ХМЛ); транслока ция t(8;14)(q24;q32), которую находят в 98—100 % случаев лимфомы Бер китта, транслокация t(15;17)(q22;q21), выявляемая почти у каждого больного острым промиелоцитарным лейкозом, и транслокация t(11;14)(q13;q32), ха рактерная для лимфом из клеток ман тийной зоны (70 % случаев), а также инверсия хромосомы 16, которую об наруживают практически у всех боль ных острым миеломонобластным лей-
Т а б л и ц а 12.8. Частота (%) характерных аномалий кариотипа при различных миелодис-
пластических синдромах
Аномалии |
RA |
RARS |
RAEB(T) |
CMML |
|
|
|
|
|
Перестройки 3q21q26 |
1-5 |
< 1 |
1-5 |
< 1 |
-5 |
5 - 1 0 |
5 - 1 0 |
10 - 1 5 |
1- 5 |
5q- |
50 |
25 |
25 |
20 |
-7 |
10 - 1 5 |
10 |
25 |
20 |
7q- |
1-5 |
1-5 |
5 - 1 0 |
5 - 1 0 |
+8 |
20 |
30 |
20 |
20 |
l l q - |
1-5 |
10 |
1-5 |
1-5 |
20q- |
5 - 1 0 |
10 - 15 |
5 - 1 0 |
1-5 |
|
|
|
|
|
Т а б л и ц а 12.9. Цитогенетические различия между доброкачественными и злокачествен
ными эпителиальными опухолями
|
Тип опухоли |
|
Хромосомные изменения |
|
|
|
|
|
|
Опухоли |
почек |
|
|
|
Аденома |
|
|
+ 7 , +17, -Y |
|
Карцинома |
|
del(3p), |
der(3p), t(X;l)(pll;q21) |
|
Опухоли |
щитовидной |
железы |
|
|
Аденома |
|
|
+ 5 , +7, +12, структурные аномалии 19q |
|
Папиллярная карцинома |
inv(10)(qllq21) |
|||
Опухоли |
слюнных желез |
|
|
|
Плеоморфная аденома |
Структурные изменения Зр21, 8q12 и 12ql5 |
|||
Аденокарцинома |
|
del(6q) |
|
|
Аденоидная цистокарцинома |
t(6;9)(q21-23;pl3-22) |
|||
Мукоэпидермальная |
карцинома |
del(6q), |
t(ll;19)(ql4-21;pl2-13) |
|
Опухоли |
яичника |
|
|
|
Текома |
|
|
+12 как единственная аномалия |
|
Карцинома |
|
Сложные перестройки |
||
|
|
|
|
|
496
Т а б л и ц а 12.10. Цитогенетическая характеристика доброкачественных и злокачествен
ных опухолей из клеток жировой и мышечной ткани
|
|
Тип |
опухоли |
|
|
|
|
Хромосомные изменения |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Опухоли |
из |
жировой |
ткани |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Липома |
|
|
|
|
|
|
Транслокации с участием |
12ql3-15, транслокации |
|||||||||
|
|
|
|
|
|
|
с участием 6р, структурные аномалии 13q |
|
|||||||||
Атипичная |
липома |
|
|
|
+ι(12) |
|
|
|
|
|
|
|
|
|
|
||
Липобластома |
|
|
|
|
der(8)(q11-13) |
|
|
|
|
|
|
|
|
||||
Веретеноклеточная |
липома |
|
|
Делеций |
16ql3-qter |
|
|
|
|
|
|
|
|||||
Гибернома |
|
|
|
|
|
Структурные изменения |
11ql3-21 |
|
|
|
|||||||
Липосаркома |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Миксоидная и круглоклеточная |
|
t(12;16)(q13;p11) |
|
|
|
|
|
|
|
||||||||
Плеоморфная |
|
|
|
|
Комплексные перестройки |
|
|
|
|
|
|
||||||
Опухоли из клеток мышечной ткани |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Лейомиома |
(матки) |
|
|
|
Транслокации |
12q 13-15 |
|
|
|
|
|
|
|
||||
Лейомиосаркома |
|
|
|
|
Комплексные перестройки |
|
|
|
|
|
|
||||||
|
|
|
|
|
|||||||||||||
Т а б л и ц а |
12.11. Гены, вовлеченные в транслокации, характерные для различных солид |
||||||||||||||||
ных опухолей |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
Тип опухоли |
|
|
|
|
Транслокация |
|
|
|
Гены |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Злокачественные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Примитивные |
|
|
|
|
|
|
t(11;22)(q24;ql2) |
|
FLI, EWS |
|
|||||||
Нейроэктодермальные |
|
|
|
|
t(21;22)(q22;ql2) |
|
ERG, EWS |
|
|||||||||
Меланома мягких тканей |
|
|
|
|
t(12;22)(ql3;ql2) |
|
ATF1, |
EWS |
|
||||||||
Миксоидная хондросаркома |
|
|
|
t(9;22)(q22-31;ql2) |
|
CHN, EWS |
|
||||||||||
Дермопластическая опухоль из круглых клеток |
t(11;22)(pl3;ql2) |
|
WT1, EWS |
|
|||||||||||||
Папиллярный рак щитовидной железы |
|
inv(10)(q11.2;q21) |
|
RET, |
D1OS170 |
||||||||||||
|
|
|
|
|
|
|
|
|
11 |
|
|
|
TRKA, |
TPM3 |
|||
|
|
|
|
|
|
|
|
|
11 |
|
|
|
TRKA, |
TPR |
|
||
Рак толстой кишки |
|
|
|
|
|
11 |
|
|
|
TRKA, |
TPM3 |
||||||
Синовиальная саркома |
|
|
|
|
t (X;18)(p11.2;q11.2) |
|
SSX1/SSX2, |
SYT |
|||||||||
Альвеолярные |
|
|
|
|
|
|
t(2;13)(q37;ql4) |
|
|
PAX3, |
FKHR |
||||||
Рабдомиосаркома |
|
|
|
|
|
|
t(l;13)(q36;ql4) |
|
|
PAX7, |
PKHR |
||||||
Миксоидная липосаркома |
|
|
|
|
t(12;16)(ql3;p11) |
|
CHOP, |
TLS/FUS |
|||||||||
Менингиома |
|
|
|
|
|
|
t(4;22)(pl6;q11) |
|
|
MN1, 11 |
|
|
|||||
Рак желудка |
|
|
|
|
|
|
?? |
|
|
|
ALL1 |
|
|
|
|||
Папиллярный рак почек |
|
|
|
|
t(X;l) |
|
|
?? |
|
|
|
||||||
Доброка |
чественные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Липомы |
|
|
|
|
|
|
|
|
t(var;12)(ql3-15) |
|
HVG1-C |
|
|
||||
Лейомиомы |
матки |
|
|
|
|
|
t(12;14)(ql3-15) |
|
|
HVG1-C, |
11 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
козом с |
эозинофилией |
(M4Eo) |
(рис. |
t(9;22)(q34;qll) |
(см. |
табл. |
12.7, |
12.8). |
|||||||||
12.7). Сведения об остальных много |
Укороченная в |
результате этой |
пере |
||||||||||||||
численных специфических нарушени |
стройки хромосома |
22 |
известна как |
||||||||||||||
ях кариотипа читатели могут найти в |
Ph или филадельфийская — по назва |
||||||||||||||||
табл. 12.7-12.11. |
|
|
|
|
нию города, где она впервые была от |
||||||||||||
У 90—95 % больных хроническим |
крыта |
Ноуэллом и |
Хангерфордом в |
||||||||||||||
миелолейкозом |
(ХМЛ) |
наблюдается |
1960 г. (рис. 12.8). В |
1973 |
г. |
Дженет |
|||||||||||
специфическая |
|
транслокация |
|
— |
Роули показала, что Ph-хромосома об- |
||||||||||||
32-7908 Д. Г. Заридзе
разуется в результате сбалансирован ного обмена между 9q34 и 22q11.
Поскольку окраска обмениваю щихся фрагментов одинакова, а вели чина сильно различается (на хромосо му 9 переносится значительно боль ший участок, чем на хромосому 22), при G-окраске увеличение хромосомы 9 видно всегда очень четко, а перенос маленького фрагмента на делетированную хромосому 22 при стандарт ной окраске на G-полосы увидеть нельзя. Это определяется молекуляр- но-генетическими методами, в част ности FISH . Примерно в 10 % случаев происходит перенос участка хромосо мы 22 не на 9-ю, а на другую хромо сому. Такие транслокации называются атипичными. Кроме того, иногда при ХМЛ обнаруживают сложные Phтранслокации с участием не двух (хро мосомы 9 и 22), а трех или более хро мосом. Установлено, что практически при всех Ph-транслокациях (не только простых, но и сложных или атипич ных) участвуют хромосомы 9 и 22, од нако это не всегда видно при обыч ном цитогенетическом исследовании. Тип Ph-транслокации (стандартная, атипичная или сложная) не имеет клинического значения.
Изучение разрывов в генах ABL и ВСЯ показало, что у разных пациен тов их локализация неодинакова. Так, в гене ABL протяженность участка, на котором могут происходить разрывы, велика — до 200 кб, а в гене BCR раз рывы локализуются обычно на ма леньком участке — 8,5 кб (breakpoint cluster region), отсюда и название гена. В подавляющем большинстве случаев ХМЛ разрывы гена ВСR локализуются на участке, обозначаемом M-BCR. При этом в химерный ген входит длинный фрагмент гена ВСR, в ре зультате чего возникает характерный для ХМЛ белок-Р210 BCR-ABL. (Сравнить с так называемым хрониче ским нейтрофильным лейкозом и ост рым лимфобластным лейкозом — см. ниже.) В типичных случаях гематолог легко ставит диагноз ХМЛ без хромо сомного и/или молекулярно-генети-
ческого анализа. Изредка клинико-ге- матологическая картина не совсем ти пична: у таких пациентов диагноз мо жет быть подтвержден цитогенетически. Отсутствие Ph не исключает, од нако, диагноз ХМЛ, поскольку транс локация BCR-ABL может быть суб микроскопической, и только приме нение молекулярных методик (в част ности, FISH, PCR) дает возможность уточнить диагноз. И н ы м и словами, в спорных случаях именно обнаружение слияния BCR-ABL позволяет поста вить диагноз, а его отсутствие в клет ках костного мозга дает возможность окончательно отвергнуть предположе ние о ХМЛ.
Картина крови, напоминающая та ковую при ХМЛ, наблюдается при ря де заболеваний: ювенильном ХМЛ, хроническом миеломоноцитарном лейкозе (ХММЛ) и некоторых других миелопролиферативных процессах. Образование химерного гена BCRABL для них нехарактерно. Эти забо левания требуют своеобразных тера певтических подходов, отличающихся от лечения ХМЛ. Следовательно, при неясном диагнозе проведение иссле дований, направленных на обнаруже ние специфической транслокации (хромосомный анализ, FISH и/или PCR), абсолютно необходимо.
Следует добавить, что, кроме ти пичного ХМЛ, существует еще один вариант хронического лейкоза, в ос нове которого лежит формирование химерного гена BCR-ABL. Речь идет о так называемом хроническом нейтрофильном лейкозе. При этой форме лейкоза точки разрыва в гене BCR ло кализуются ближе к 3' концу, чем при типичном ХМЛ, т. е. химерный ген содержит более протяженный фраг мент гена BCR, чем классический ген BCR-ABL, продуцирующий химерный белок Р210 BCR-ABL. При хрониче ском нейтрофильном лейкозе экспрессируется химерный белок Р230 BCR-ABL. Обычно течение этой фор мы лейкоза длительное и более добро качественное; бластные кризы разви ваются очень редко.
498
Отметим, что Ph-позитивный ХМЛ, ассоциированный не с класси-
ческим |
геном |
BCR-ABL и белком |
Р210, ас |
другими |
BCR-ABL белками, |
может иметь атипичные клинико-ге-
матологические |
черты |
[Deininger et |
al, 2000]. Так, |
редкие |
случаи ХМЛ, |
где экспрессируется белок Р190, ха рактеризуются значительным повы шением уровня моноцитов в крови, а ХМЛ с белком Р230 BCR-ABL обычно имеет более "зрелую" формулу крови и относительно доброкачественное те чение, правда, этот вариант может оказаться резистентным к препарату глевек.
Транслокация t(9;22)(q34;q11), идентичная таковой при ХМЛ, зако номерно обнаруживается у 20—30 % взрослых и у 5—10 % детей, страдаю щих острым лимфобластным лейко зом (ОЛЛ). На молекулярном уровне примерно в половине случаев у взрос лых и у 20 % детей с Ph-позитивным ОЛЛ изменения такие же, как при ХМЛ; у остальных пациентов разрыв в хромосоме 22 (ген BCR) отличается по локализации от разрыва, характер ного для ХМЛ, он расположен ближе к центромере. Образующийся химер ный белок Р190 BCR-ABL обладает более высокой протеинкиназной ак тивностью, чем Р210 BCR-ABL.
Различные химерные белки BCRABL не строго ассоциированы с фено типом лейкоза: так, Р210 BCR-ABL ассоциирован не только с ХМЛ, но и обнаруживается у 40 % больных с Phпозитивным ОЛЛ, а Р190 BCR-ABL продуцируется у 2—3 % больных с ти пичным ХМЛ; продукция Р230 BCRABL иногда наблюдается при класси ческом варианте ХМЛ, который за канчивается бластным кризом [Quakenbush et al., 2000].
Сочетание различных молекуляр- но-генетических методик (исследова ние Д Н К , Р Н К , белка, применение методов FISH и PCR) позволяет вы явить комплекс BCR—ABL чаще, чем хромосомный анализ выявляет Phтранслокацию. Это важно для диагно стики, дифференциальной диагности
32*
ки между ОЛЛ и лимфоидным бласт ным кризом ХМЛ и для мониторинга ОЛЛ и ХМЛ.
Другой наглядный пример клини ческого значения специфической хро мосомной перестройки — транслока ция t(15;17)(q22;q21), характерная для острого промиелоцитарного лейкоза (ОПЛ, МЗ), при котором она наблю дается в подавляющем большинстве случаев. Эта аномалия не обнаружена ни при одном гемобластозе, кроме ОПЛ и промиелоцитарного бластного криза ХМЛ, что чрезвычайно важно при проведении дифференциального диагноза между острым промиелоцитарным лейкозом и другими варианта ми острых миелобластных лейкозов (ОМЛ).
Транслокация t(15;17) приводит к образованию химерного гена за счет слияния фрагмента гена PML из хро мосомы 15 с фрагментом гена, коди рующего рецептор α-ретиноевой ки слоты (RARальфа), из хромосомы 17. В результате этого слияния у большин ства больных с транслокацией t(15;17) образуется и экспрессируется два химерных гена: PML-RARальфа и RARальфаPML.
С помощью молекулярно-генети- ческих методов можно обнаружить химерные гены и их продукты не только в случаях ОПЛ, где t(15;17) видна при обычном цитогенетическом исследовании, но и у больных, у кото рых она при хромосомном анализе не выявляется, в частности при субмик роскопических слияниях PML-RARальфа даже в редких случаях с нормальным кариотипом.
Необходимо сказать еще одну важ ную вещь: транслокацию t(15;17) не всегда удается обнаружить на хромо сомных препаратах, поскольку содер жащие ее лейкозные клетки могут иметь низкий митотический индекс. В таких ситуациях необходимо приме нять FISH или PCR для выявления характерного химерного гена PMLRARальфа.
Примерно в 5—10 % случаев при ОПЛ обнаруживают не транслокацию
499
t(15;17), а другие характерные транс локации, при которых происходят об мены генетическим материалом меж ду хромосомой 15 или 17 не друг с другом, а с другими хромосомами. Лучше всего изучены транслокации t(ll;17)(q23:q21), t(5;17)(q 35;ql2-21) и t(ll;17)(ql3;q21). В результате этих транслокаций образуются химерные гены: PLZF-RARa, NPM-RARa и Nu- MA-RARa. Описаны единичные слу чаи ОПЛ, где химерный ген возникал в результате слияния фрагментов двух генов из хромосомы 17: STAT5b-RA- Rальфа, а на цитогенетических препаратах виден маркер der(17). Атипичные хро мосомные перестройки при ОПЛ мо гут быть скрытыми, не видимыми при обычном хромосомном анализе и вы являются только при использовании молекулярно-генетических методик.
Кроме того, в отдельных случаях выявлены транслокации t(3;15)(q21; q22), t(X;15)(p11;q22), где под микро скопом хромосома 17 кажется неизме ненной, однако при молекулярном исследовании было обнаружено уча стие в транслокации гена RARальфа.
В связи с тем что в подавляющем большинстве случаев ОПЛ, исследо ванных молекулярно-генетическими методами, обнаружены перестройки гена RARальфа, сделан вывод о том, что изменения этого гена играют решаю щую роль в развитии данного вариан та лейкоза. Имеются также убедитель ные экспериментальные данные, сви детельствующие о том, что изменения гена PML имеют большое значение для развития острого промиелоцитар ного лейкоза.
субмикроскопической (не видимой под микроскопом вставки, если не ис пользована FISH) инсерции хромо сомного материала было обнаружено в 3,6 % случаев. С помощью FISH и PCR было установлено, что инсерции гена RARaльфа с хромосомы 17 в область гена PML на хромосоме 15 представ ляют самый частый тип субмикроско пических инсерции. При этом экс прессируется только ген PML-RARa, но не экспрессируется ген RARa-PML. Изредка наблюдаются и инсерции субмикроскопического фрагмента ге на RARa в область гена PML; в таких случаях экспрессируется только ген RARa-PML. Кариотип при этом вы глядит, как правило, неизмененным.
Анализ материала, представленно го на этой конференции, показал так же, что атипичные транслокации, ха рактерные для ОПЛ, встречаются весьма редко: так, t(11;17) и/или слит ный ген PLZF-RARa обнаружен менее чем у 1 % больных (0,8 % ) , а другие атипичные слитные гены — еще реже (0,4—0,2 % ) . Огромный интерес пред ставляют данные этой же конферен ции, свидетельствующие о том, что изредка встречаются случаи типично го по морфологии ОПЛ, когда приме нение современного арсенала молеку лярно-генетических методик не по зволяет обнаружить перестройки гена RARa. Этот факт позволил выдвинуть предположение о том, что возможны альтернативные пути возникновения ОПЛ без участия гена RARa.
ОПЛ и ХМЛ — примеры злокаче ственных новообразований, при кото рых удалось разработать и с успехом
В1999 г. в Италии проводилась применить патогенетическую тера
Европейская |
конференция, |
посвя |
пию. При ОПЛ полная ремиссия мо |
||
щенная цитогенетической и молеку- |
жет быть достигнута в подавляющем |
||||
лярно-генетической |
характеристике |
большинстве случаев (90—98 %) вве |
|||
острого |
промиелоцитарного |
лейкоза. |
дением производных ретиноевой ки |
||
Всего было представлено 611 случаев, |
слоты. Последние снимают блок диф |
||||
среди |
них |
типичная |
транслокация |
ференцировки лейкозных клеток, вы |
|
t(15;17) и/ или ее молекулярные экви |
званный действием химерного белка — |
||||
валенты — химерные гены PML-RARa |
продукта гена PML/RARa. При этом |
||||
и/или RARa-PML были обнаружены у |
положительный эффект лечебных про |
||||
559 человек (91,5 % ) . Образование хи |
токолов, включающих препараты ре |
||||
мерного гена PML-RARальфа в результате |
тиноевой кислоты в сочетании с цито- |
||||
500
статиками, не зависит от того, возник |
мальные метафазы. Кроме того, если |
||||||||||||||||||||
ли химерный ген PML/RARa как ре |
величина |
|
перестроенных |
хромосом |
|||||||||||||||||
зультат транслокации |
t(15;17), |
види |
ных участков очень мала, как это бы |
||||||||||||||||||
мой |
при |
стандартном |
хромосомном |
вает |
при |
|
мелких |
(субмикроскопиче |
|||||||||||||
анализе, или |
визуально |
транслокация |
ских) |
инсерциях, |
образовавшиеся |
хи |
|||||||||||||||
не определяется, но химерный ген |
мерные гены или их продукты можно |
||||||||||||||||||||
экспрессируется и может быть обна |
обнаружить только с помощью моле- |
||||||||||||||||||||
ружен молекулярно-генетическими ме |
кулярно-генетических методик, среди |
||||||||||||||||||||
тодами. |
|
|
|
|
|
|
|
|
|
|
которых для диагностических целей в |
||||||||||
Ремиссии у больных ОПЛ, индуци |
клинике лучше всего подходят FISH и |
||||||||||||||||||||
рованные |
препаратами |
ретиноевой |
RT-PCR. В последние годы все боль |
||||||||||||||||||
кислоты, непродолжительны. Их час |
шее распространение получает так на |
||||||||||||||||||||
тоту и длительность удается значи |
зываемая multiplex PCR. Этот метод |
||||||||||||||||||||
тельно увеличить за счет применения |
позволяет |
|
проверить материал |
(на |
|||||||||||||||||
комплексных схем, сочетающих ан- |
пример, кровь, костный мозг) с целью |
||||||||||||||||||||
трациклиновые |
|
производные |
|
(чаще |
обнаружения сразу нескольких основ |
||||||||||||||||
всего |
даунорубицин) |
и |
цитостатики |
ных |
характерных |
транслокаций. |
|||||||||||||||
типа Аrа-С. При современных тера |
Обычно используют набор для PCR, |
||||||||||||||||||||
певтических |
протоколах |
пятилетняя |
позволяющий диагностировать |
до 30 |
|||||||||||||||||
выживаемость достигает 70 |
%. |
|
|
химерных |
|
генов, |
специфичных |
для |
|||||||||||||
Важно, что ремиссии при ОПЛ, |
разных морфологических типов ОМЛ. |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
вызванные |
препаратами |
ретиноевой |
|
|
|
|
|
|
|
|
|
|
|||||||||
кислоты, |
обусловлены |
созреванием |
12.1.3.3. Прогностическое |
|
|||||||||||||||||
лейкемических клеток, а не их унич |
значение хромосомного |
|
|
||||||||||||||||||
тожением; |
нормальный |
росток |
при |
анализа |
|
|
|
|
|
|
|||||||||||
этом не страдает. Ремиссии наступают |
|
|
|
|
|
|
|
|
|
|
|||||||||||
обычно без |
предшествующего |
периода |
В онкологической и онкогематоло- |
||||||||||||||||||
аплазии костного мозга и связанных с |
гической |
клинике |
накоплен большой |
||||||||||||||||||
нею |
тяжелых |
|
клинических |
проявле |
опыт |
применения |
хромосомного |
ана |
|||||||||||||
ний. Вместе с тем нельзя не отметить, |
лиза с прогностическими целями. |
||||||||||||||||||||
что |
препараты |
|
ретиноевой |
кислоты |
Особенно |
|
убедительные данные полу |
||||||||||||||
могут вызывать очень серьезные ос |
чены при острых лейкозах, когда ка- |
||||||||||||||||||||
ложнения, |
поэтому |
|
их |
применение |
риотип принято считать независимым |
||||||||||||||||
должно быть тщательно продумано с |
прогностическим |
критерием. Очевид |
|||||||||||||||||||
учетом результатов цитогенетического |
но, что в ряде ситуаций трудно про |
||||||||||||||||||||
исследования, |
поскольку |
острые |
лей |
вести четкую границу между диагно |
|||||||||||||||||
козы, протекающие без перестроек ге |
стическим |
и прогностическим |
значе |
||||||||||||||||||
на RARa, могут быть резистентными к |
нием |
результатов |
|
цитогенетического |
|||||||||||||||||
препаратам |
ретиноевой |
кислоты или |
исследования, |
поскольку |
отдельные |
||||||||||||||||
ремиссии удается |
достигнуть добавле |
специфические |
хромосомные |
анома |
|||||||||||||||||
нием |
колониестимулирующих |
факто |
лии тесно ассоциированы с морфоло |
||||||||||||||||||
ров к стандартным протоколам лече |
гическими |
типами |
лейкозов, |
имею |
|||||||||||||||||
ния ОПЛ. Клиническое значение это |
щими определенный прогноз. |
|
|
||||||||||||||||||
го вывода невозможно переоценить. |
В |
качестве |
иллюстрации |
можно |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Выше мы уже говорили, что диаг |
привести |
|
одну |
из |
прогностических |
||||||||||||||||
ностически |
|
важные |
|
специфические |
классификаций |
хромосомных |
анома |
||||||||||||||
хромосомные |
|
транслокации |
|
могут |
лий при остром миелобластном лей |
||||||||||||||||
быть |
скрытыми |
и |
не |
определяются |
козе (табл. |
12.12). |
|
|
|
|
|
||||||||||
при |
стандартном |
цитогенетическом |
Эти |
данные |
|
опубликованы |
в |
||||||||||||||
исследовании. Причиной может быть |
1998 г. как результат многоцентрового |
||||||||||||||||||||
низкая митотическая активность лей- |
Европейского |
исследования |
более |
||||||||||||||||||
козных клеток, и тогда под микроско |
1,5 тыс. больных острым миелобласт- |
||||||||||||||||||||
пом |
цитогенетик |
видит |
только |
нор |
ным |
лейкозом. |
На |
основании |
обще- |
||||||||||||
501
Т а б л и ц а |
12.12. Прогностическое значение хромосомного анализа при ОНЛЛ |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Благоприятный |
|
Промежуточный прогноз |
|
|
Неблагоприятный** прогноз |
|
|||||||||||||||||||
|
|
прогноз* |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
t(8;21) |
|
|
Нормальный |
кариотип |
|
|
|
|
Inv(3), |
t(3;3) |
|
|
|
||||||||||
|
|
t(15;17) |
|
|
|
|
|
7q- |
|
|
|
|
|
|
-5/5q- |
|
|
|
|||||||
inv(16)/t(l6;l6) |
|
|
|
|
+8 |
|
|
|
|
|
|
|
-7 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
9q- |
|
|
Множественные |
нарушения кариотипа |
||||||||||
|
|
|
|
|
|
|
|
Перестройки |
11q23 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
+21 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
+22 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||||||||||||||||||
*Пятилетнее безрецидивное течение наблюдалось у 60—70 % больных. |
|
|
|
|
|||||||||||||||||||||
**Пятилетнее безрецидивное течение наблюдалось у 5—10 % больных. |
|
|
|
|
|||||||||||||||||||||
принятых |
|
критериев |
|
(частота |
полных |
ных с t(9;11) в 3 раза выше, чем у па |
|||||||||||||||||||
гематологических |
ремиссий, |
безреци |
циентов с t(10;11). |
|
|
|
|
|
|||||||||||||||||
дивная 5-летняя выживаемость и др.) |
|
Остановимся |
несколько |
более |
|||||||||||||||||||||
сделан вывод о том, что относительно |
подробно |
на прогностическом |
значе |
||||||||||||||||||||||
благоприятными |
|
являются |
|
t(15;17), |
нии перестроек длинного плеча хро |
||||||||||||||||||||
t(8;21) и аномалии длинного плеча |
мосомы |
11, |
затрагивающих |
район |
|||||||||||||||||||||
хромосомы |
16 (инверсии, |
транслока |
11q23. |
|
|
|
|
|
|
|
|
|
|||||||||||||
ции). |
|
Подтверждено |
неблагоприятное |
|
Молекулярно-генетические |
мето |
|||||||||||||||||||
прогностическое |
|
значение |
множест |
дики, как правило, обнаруживают из |
|||||||||||||||||||||
венных |
нарушений |
кариотипа, |
пере |
менения гена MLL (myeloid lymphoid |
|||||||||||||||||||||
строек длинного плеча хромосомы 3, |
leukemia). Различные изменения этого |
||||||||||||||||||||||||
моносомий 5 и 7, а также делеций |
гена наблюдаются при острых лейко |
||||||||||||||||||||||||
длинного плеча хромосомы 5. В груп |
зах как миелоидной, так и лимфоид- |
||||||||||||||||||||||||
пу |
нарушений, |
|
имеющих |
|
промежу |
ной природы, что и отразилось в его |
|||||||||||||||||||
точное |
|
прогностическое |
значение, |
названии. Ген является транскрипци |
|||||||||||||||||||||
были включены трисомия 8, пере |
онным фактором. |
|
|
|
|
|
|||||||||||||||||||
стройки 11q23 и некоторые другие |
|
Сейчас известно около 70 хромо |
|||||||||||||||||||||||
аномалии. |
|
|
|
|
|
|
|
|
|
сомных |
участков, |
вовлеченных |
в |
||||||||||||
Следует обратить внимание на то, |
транслокации с 11q23 (с геном MLL). |
||||||||||||||||||||||||
что каждая из прогностических групп |
Лейкозы, при которых происходят пе |
||||||||||||||||||||||||
весьма гетерогенна по цитогенетиче- |
рестройки этого гена, обладают рядом |
||||||||||||||||||||||||
ской характеристике. Особенно это |
общих признаков: они характерны для |
||||||||||||||||||||||||
касается групп с промежуточным и |
молодых людей и детей, особенно для |
||||||||||||||||||||||||
плохим прогнозом. Очень важно, что |
младенцев в возрасте до 1 года. Не |
||||||||||||||||||||||||
различия между группами по показа |
редко бластные клетки имеют моно- |
||||||||||||||||||||||||
телям |
эффективности |
лечения |
весьма |
цитарные |
черты, |
лейкоцитоз |
значи |
||||||||||||||||||
значительны. |
Эта |
|
классификация |
тельно |
|
повышен, |
прогноз |
обычно |
|||||||||||||||||
вполне |
оправдана, |
поскольку |
позво |
крайне неблагоприятен, однако следу |
|||||||||||||||||||||
ляет |
оценивать |
эффективность |
новых |
ет учитывать, что прогноз определяет |
|||||||||||||||||||||
терапевтических |
|
протоколов. |
|
|
|
ся не только геном MLL, но и вторым |
|||||||||||||||||||
В |
этом |
же |
исследовании, |
прове |
участником транслокации. Так, транс |
||||||||||||||||||||
локация |
(9;11) |
имеет |
более |
благопри |
|||||||||||||||||||||
денном |
на |
больших |
группах одинако |
||||||||||||||||||||||
ятное |
прогностическое значение, |
чем |
|||||||||||||||||||||||
во леченных больных, удалось |
|
срав |
|||||||||||||||||||||||
|
другие |
транслокации |
гена |
MLL. Час |
|||||||||||||||||||||
нить две подгруппы |
с разными транс |
||||||||||||||||||||||||
тота полных ремиссий при |
t(9;11) |
со |
|||||||||||||||||||||||
локациями |
одного и |
того |
же |
хромо |
|||||||||||||||||||||
ставляет |
90 %, |
а при |
других трансло |
||||||||||||||||||||||
сомного |
участка |
11q23: |
t(9;11)(p22; |
||||||||||||||||||||||
кациях с участием |
MLL — всего 56 |
%. |
|||||||||||||||||||||||
q23) |
|
и |
|
t(10;11)(pl2;q23). |
Оказалось, |
||||||||||||||||||||
|
|
Трехлетнее |
безрецидивное течение |
со- |
|||||||||||||||||||||
что |
пятилетняя |
выживаемость у боль |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
502
ставляет |
соответственно |
|
67 |
и |
15 |
% |
Т а б л и ц а |
12.13. |
Прогностическое |
значе |
||||||||||||||||
[Martintz-Clement |
et |
|
al., |
|
1995; |
Grim- |
ние специфических |
хромосомных |
трансло |
|||||||||||||||||
wade et |
al., 1998]. |
|
|
|
|
|
|
|
|
каций при ОЛЛ |
|
|
|
|
|
|
|
|
||||||||
Еще |
один |
пример |
— |
специфиче |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
Доля больных с длитель |
|||||||||||||||||||||
ская |
|
хромосомная |
|
транслокация |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
ным безрецидивным те |
|||||||||||||||||||
t(4;11)(q21;q23). |
|
Ее |
|
удается |
обнару |
|
|
|
|
|
||||||||||||||||
|
|
Аномалии |
|
|
|
чением, % |
|
|
||||||||||||||||||
жить |
при различных |
вариантах ост |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
3 года |
|
|
5 лет |
|||||||||||||||||
рого лейкоза, |
чаще |
всего |
при |
ОЛЛ |
и |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
(дети) |
|
(взрослые) |
||||||||||||||||||
бифенотипических ОЛ. Эта трансло |
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
кация |
наиболее |
характерна для детей |
t(12;21)(pl3;q22) |
|
8 5 - 9 0 |
|
|
8 5 - 9 0 |
|
|||||||||||||||||
младше 1 года. Лейкозы с транслока |
|
|
|
|
||||||||||||||||||||||
t(9;22)(q34;q11) |
|
|
2 0 - 2 5 |
|
|
< 10 |
|
|||||||||||||||||||
цией |
t(4;11) |
характеризуются |
высо |
t(l;19)(q23;p13) |
|
7 0 - 8 0 |
|
|
2 0 - 4 0 |
|
||||||||||||||||
ким лейкоцитозом и крайне неблаго |
t(4;ll)(q21;q23) |
|
10 - 30 |
|
|
10 - 20 |
|
|||||||||||||||||||
приятны |
в прогностическом |
отноше |
t(8;14)(q24;q32) |
|
|
7 0 - 8 5 |
|
|
5 0 - 6 0 |
|
||||||||||||||||
нии, |
поскольку |
полученные |
терапев |
t(2;8)(ql2;q24) |
|
|
7 0 - 8 5 |
|
|
5 0 - 6 0 |
|
|||||||||||||||
тические |
ремиссии |
|
очень |
коротки. |
t(8;22)(q24;q11) |
|
|
7 0 - 8 5 |
|
|
5 0 - 6 0 |
|
||||||||||||||
|
t(l;14)(p34;q11) |
|
|
6 0 - 7 0 |
|
|
? |
|
||||||||||||||||||
Наихудший прогноз отмечен у мла |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
денцев до полугода. Так, медиана |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
безрецидивного |
|
течения |
ОЛЛ |
с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
t(4;11) |
у детей |
до |
1 |
года |
составляет |
7 |
Эта |
аномалия |
имеет благоприятное |
|||||||||||||||||
мес, а у детей этого же возраста, но с |
прогностическое |
значение: доля |
пол |
|||||||||||||||||||||||
другими |
|
изменениями |
кариотипа |
— |
ных ремиссий приближается к 100 %, |
|||||||||||||||||||||
23 мес. Необходимо отметить также, |
большинство |
|
больных |
|
переживает |
|||||||||||||||||||||
что эффективность лечения ОЛЛ с |
5 лет. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
t(4;11) у детей от 1 |
года до 9 лет зна |
Прогностическое |
значение резуль |
|||||||||||||||||||||||
чительно выше, чем у взрослых лю |
татов |
цитогенетического |
анализа при |
|||||||||||||||||||||||
дей. |
|
|
|
|
|
|
|
|
|
|
|
|
|
ОЛЛ |
наглядно |
|
иллюстрирует |
табл. |
||||||||
Важным примером значения моле- |
12.13. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
кулярно-генетического анализа в кли |
Данные, |
представленные |
в |
табл. |
||||||||||||||||||||||
нике |
является |
транслокация |
t(12;21) |
12.13, как и сведения о прогностиче |
||||||||||||||||||||||
(pl3;q22). В последние годы было по |
ском |
значении |
хромосомного |
анализа |
||||||||||||||||||||||
казано, что она может быть выявлена |
при ОНЛЛ (см. табл. 12.9), показыва |
|||||||||||||||||||||||||
примерно в 25 % В-клеточных острых |
ют, что каждая группа лейкозов с |
|||||||||||||||||||||||||
лейкозов. |
|
|
|
|
|
|
|
|
|
|
идентичными |
изменениями кариоти |
||||||||||||||
Результатом |
|
транслокации |
являет |
па неоднородна. Не все больные, вхо |
||||||||||||||||||||||
ся образование химерного гена из |
дящие в ее состав, имеют одинаковую |
|||||||||||||||||||||||||
фрагментов |
генов |
|
TEL(12р13) |
и |
продолжительность |
жизни при |
одно |
|||||||||||||||||||
AMLl(21q22). |
TEL |
— |
сравнительно |
типном |
лечении. |
Например, |
около |
|||||||||||||||||||
недавно |
|
выявленный |
ген, |
который |
70 % пациентов с миелобластным |
|||||||||||||||||||||
сейчас интенсивно изучается [Tosi et |
лейкозом и транслокацией t(8;21) пе |
|||||||||||||||||||||||||
al., 1998]. Вероятно, |
белок TEL может |
реживают |
пятилетний рубеж, |
каждый |
||||||||||||||||||||||
работать и как онкоген, и как ген-су- |
же из оставшихся 30 % больных мо |
|||||||||||||||||||||||||
прессор. Изменения этого гена нахо |
жет прожить значительно меньше. |
|||||||||||||||||||||||||
дят примерно у половины пациентов с |
Многие исследователи |
подчеркива |
||||||||||||||||||||||||
самыми |
|
различными |
гемобластозами, |
ют, что так называемый комплексный |
||||||||||||||||||||||
у которых при стандартном цитогене- |
кариотип (сочетание трех или более |
|||||||||||||||||||||||||
тическом |
исследовании |
наблюдаются |
хромосомных |
|
аномалий |
|
в |
клетках |
||||||||||||||||||
перестройки короткого |
плеча |
хромо |
опухолевого клона) при любом типе |
|||||||||||||||||||||||
сомы |
12. |
|
|
|
|
|
|
|
|
|
|
|
гемобластоза является прогностически |
|||||||||||||
Транслокация |
t(12;21) |
неуловима |
неблагоприятным признаком. |
|
|
|
||||||||||||||||||||
при |
стандартном |
|
цитогенетическом |
В последние годы появились дан |
||||||||||||||||||||||
исследовании. Она четко определяет |
ные, свидетельствующие о том, что |
|||||||||||||||||||||||||
ся с помощью FISH и PCR. |
|
|
|
лейкемические |
клетки, несущие |
одну |
||||||||||||||||||||
503
из |
специфических хромосомных ано |
щественно хуже, чем у остальных |
||||||||||||||
малий, имеют еще целый ряд важных |
больных ХМЛ. Кроме того, отмечено, |
|||||||||||||||
особенностей, |
не |
связанных |
напря |
что длина теломеры в лейкозных клет |
||||||||||||
мую с хромосомной транслокацией. |
ках при ХМЛ в среднем ниже, чем в |
|||||||||||||||
Эти особенности лейкозных клеток в |
нормальных |
клетках. Степень укоро |
||||||||||||||
ряде случаев тесно ассоциированы с |
чения коррелирует со степенью уко |
|||||||||||||||
прогнозом. Например, миелобласты, |
рочения хронической фазы. |
|
||||||||||||||
маркированные |
|
|
транслокациями |
В последние годы получены фак |
||||||||||||
t(8;21) или t(15;17), могут нести на |
ты, |
свидетельствующие |
о |
большом |
||||||||||||
своей поверхности антигены, экспрес |
прогностическом значении хромосом |
|||||||||||||||
сия |
которых |
имеет |
прогностически |
ного анализа при хроническом лим- |
||||||||||||
неблагоприятное значение. Таким ан |
фолейкозе (ХЛЛ). Для этого заболева |
|||||||||||||||
тигеном является CD56. Показано, |
ния характерны клоны клеток со сле |
|||||||||||||||
что при СD56-позитивных лейкозах с |
дующими аномалиями: дополнитель |
|||||||||||||||
транслокациями |
t(8;21) |
или |
t(15;17) |
ная хромосома 12, делеция длинного |
||||||||||||
процент |
ранних |
|
рецидивов |
сущест |
плеча хромосом 6 и 13, различные пе |
|||||||||||
венно |
выше, |
а |
|
продолжительность |
рестройки длинного плеча хромосомы |
|||||||||||
жизни больных ниже, чем при лейко |
11. В ряде случаев наблюдаются |
|||||||||||||||
зах с теми же хромосомными анома |
транслокации с участием 14q32, столь |
|||||||||||||||
лиями, но без маркера CD56. Есть и |
характерные для В-клеточных новооб |
|||||||||||||||
другие |
независимые |
прогностические |
разований. Из них самыми частыми |
|||||||||||||
маркеры, |
например |
мутации гена |
являются t(ll;14)(ql3;q32), |
t(2;14)(pl3; |
||||||||||||
FLT3 (см. ниже). |
|
|
|
|
|
q32) и t(14;19)(q32;pl3). Иногда обна |
||||||||||
Все сказанное имеет целью под |
руживаются |
сочетанные |
(комплекс |
|||||||||||||
черкнуть |
мысль |
|
об |
относительном |
ные) изменения. Перечисленные ано |
|||||||||||
значении |
цитогенетического |
прогно |
малии кариотипа отличаются друг от |
|||||||||||||
за в каждом конкретном случае. Вме |
друга в прогностическом отношении. |
|||||||||||||||
сте с тем результаты хромосомного |
Так, |
наличие дополнительной хромо |
||||||||||||||
анализа очень важны при оценке эф |
сомы 12, перестройки 11q и делеций |
|||||||||||||||
фективности |
терапевтических |
прото |
17р |
предвещает неблагоприятное |
те |
|||||||||||
колов, |
поскольку |
цитогенетическая |
чение. Делеций длинного плеча хро |
|||||||||||||
характеристика группы дает представ |
мосомы 13 прогностически благопри |
|||||||||||||||
ление о доле случаев с относительно |
ятны. |
|
|
|
|
|
||||||||||
благоприятным |
и |
неблагоприятным |
Необходимо подчеркнуть, что три- |
|||||||||||||
прогнозом. |
|
|
|
|
|
|
сомию 12 не всегда удается обнару |
|||||||||
Применение молекулярно-генети- |
жить при стандартном цитогенетиче- |
|||||||||||||||
ческих методов исследования даже та |
ском исследовании, поскольку клетки |
|||||||||||||||
кого сравнительно хорошо изученного |
с этой аномалией часто имеют низкий |
|||||||||||||||
заболевания, |
как |
ХМЛ, |
позволило |
митотический индекс. Следовательно, |
||||||||||||
сделать выводы, важные для опреде |
заключение о прогнозе у больного |
|||||||||||||||
ления прогноза при этом лейкозе, |
ХЛЛ |
невозможно |
без |
применения |
||||||||||||
причем еще до начала лечения. Из |
FISH с зондами на хромосому 12. |
|
||||||||||||||
вестно, что при транслокации t(9;22), |
В течение длительного времени ве |
|||||||||||||||
типичной для ХМЛ, образуется два |
дутся |
поиски |
прогностических крите |
|||||||||||||
химерных гена — BCR-ABL, о кото |
риев для такой гетерогенной группы |
|||||||||||||||
ром говорилось выше, и второй ген |
заболеваний, |
как миелодиспластиче- |
||||||||||||||
ABL-BCR. Последний экспрессируется |
ские синдромы (МДС). Известно, что |
|||||||||||||||
у 70 % пациентов. В тех случаях, когда |
каждая из 5 форм, входящих в эту |
|||||||||||||||
он не экспрессируется, как правило, |
группу, сама по себе неоднородна. |
|||||||||||||||
имеют место делеций участков генов: |
Нередко возникают |
диагностические, |
||||||||||||||
выше точки разрыва в гене BCR и ни |
дифференциально-диагностические |
и |
||||||||||||||
же точки разрыва в гене ABL. У паци |
прогностические трудности. В 1997 г. |
|||||||||||||||
ентов с этими делециями прогноз су |
были |
опубликованы |
материалы меж- |
|||||||||||||
504
дународного совещания, посвященно го диагностике и прогнозированию МДС. На основании ретроспективной оценки длительности заболевания до перехода в острый лейкоз и общей продолжительности жизни больных результат цитогенетического анализа был расценен как важнейший прогно стический признак. К группе с благо приятным прогнозом отнесены случаи с единичными хромосомными анома лиями: -Υ, 5q- и 20q-. Неблагоприят ное течение наблюдалось в случаях с множественными нарушениями (3 или более перестроек кариотипа) и при изменениях хромосомы 7 (деле ций длинного плеча, моносомии). Другие аномалии определяли проме жуточный прогноз. Средняя длитель ность заболевания до перехода в ост рый лейкоз составила по группам: 9,4; 0,4 и 1,1—3,3 года соответственно. Эти данные теперь используются при оценке эффективности новых схем лечения миелодисплазий и зареко мендовали себя как одна из лучших прогностических систем при МДС .
В последние годы получена деталь ная хромосомная и молекулярно-ге- нетическая характеристика множест венной миеломы и выявлен ряд важ ных прогностических параметров. Ус тановлено, в частности, что делеций хромосомы длинного плеча 13 имеют крайне неблагоприятное прогностиче ское значение, причем речь идет не только о делециях, видимых при стан дартном цитогенетическом исследова нии, но и о субмикроскопических ут ратах материала хромосомы 13 (13ql4). Необходимо подчеркнуть, что метод FISH позволяет выявлять эти аномалии в 2 раза чаще, чем анализ метафазных хромосом при обычном исследовании, а именно — в половине исследованных случаев. Утрата 13ql4 предсказывает сравнительно низкий ответ на химиотерапию в стандартных дозах: 40,8 % по сравнению 78,6 % у пациентов без делеций. Общая выжи ваемость у больных с делецией со ставляет в среднем 24,2 мес, а у боль ных без делеций — более 60 мес [Zojer
et al., 2000]. Совсем недавно были опубликованы убедительные данные о неблагоприятном прогностическом значении числовых изменений карио типа при миеломной болезни: гиподиплоидный и гипотетраплоидный на бор хромосом нередко сочетается с делециями 13q, но и в отдельности ка ждый из этих признаков прогностиче ски неблагоприятен. В серьезных за рубежных клиниках лечение миелом ной болезни не проводят без предва рительного хромосомного анализа с обязательным включением FISH .
Что касается солидных опухолей, то данные литературы об особенностях изменений кариотипа в большинстве из них пока не дают возможности сделать четкие выводы, которые можно было бы использовать в кли нической практике. Это относится к наиболее распространенным злокаче ственным новообразованиям (рак желудка, рак молочной железы, рак легкого и др.).
Исключением является колоректальный рак: цитогенетически иссле довано несколько сот случаев. Пока зано, что практически все ненаслед ственные (спорадические) опухоли представляют собой клоны с много численными сложными хромосомны ми изменениями, как числовыми, так и структурными. Определен спектр характерных аномалий: это пере стройки короткого плеча хромосомы 1, делеция длинного плеча хромосо мы 5, трисомия 7, перестройки ко роткого плеча хромосомы 8, длинно го плеча хромосом 9 и 11, утрата все го или части короткого плеча хромо сомы 17, моносомия 18 (рис. 12.9). Для этих, так же как и для других, эпителиальных опухолей в отличие от гемобластозов более характерны делеций, чем хромосомные трансло кации. Изучение клинического зна чения отдельных конкретных нару шений кариотипа при раке толстой кишки показало, что аномалии 1-й и 17-й хромосом прогностически не благоприятны: они коррелируют с относительно ранним метастазирова-
505
нием и короткой продолжительно |
4. При нейробластоме наличие |
||||||||||||||||
стью жизни . Корреляция не является |
признаков |
амплификации |
гена |
||||||||||||||
очень строгой. Уместно также под |
MYCN(1p) говорит о поздней стадии |
||||||||||||||||
черкнуть, что утраты короткого плеча |
прогрессии и является плохим про |
||||||||||||||||
хромосомы 17 — плохой прогности |
гностическим признаком. |
|
|
|
|||||||||||||
ческий признак не только для коло- |
5. Обнаружение |
клеточных |
клонов |
||||||||||||||
ректального рака, но и для самых |
с перестройками |
l l q l 3 при |
сквамоз- |
||||||||||||||
разнообразных |
злокачественных опу |
ных карциномах головы и шеи — пло |
|||||||||||||||
холей, включая гемобластозы. Уста |
хой прогностический признак. Про |
||||||||||||||||
новлено, что неблагоприятное про |
должительность жизни больных с этой |
||||||||||||||||
гностическое |
значение |
имеют |
прак |
аномалией значительно ниже, чем без |
|||||||||||||
тически |
все |
утраты |
17р |
независимо |
нее. |
|
|
|
|
|
|
|
|
||||
от того, какие хромосомные пере |
Большое |
прогностическое |
значе |
||||||||||||||
стройки привели к этим утратам: |
ние имеют данные повторных хромо |
||||||||||||||||
простые делеций, транслокации с де |
сомных |
анализов: |
усложнение |
|
карио |
||||||||||||
лениями, утраты целой хромосомы 17 |
типа свидетельствует о неблагоприят |
||||||||||||||||
или образование маркера i(17q). Не |
ной динамике процесса. Это общая |
||||||||||||||||
благоприятное |
прогностическое зна |
закономерность. Лучше всего она |
|||||||||||||||
чение делеций короткого плеча хро |
прослежена |
при |
изучении |
хрониче |
|||||||||||||
мосомы 17 в большинстве случаев |
ского миелолейкоза: переход в тер |
||||||||||||||||
объясняется |
изменениями |
в |
р53, а |
минальную фазу у 70—80 % больных |
|||||||||||||
при делециях 1р агрессивное течение |
сопровождается |
появлением |
|
клонов |
|||||||||||||
связывают с изменениями гена р73. |
клеток |
с дополнительными |
(кроме |
||||||||||||||
Прогностическое |
значение |
хромо |
Ph-транслокации) аномалиями ка |
||||||||||||||
сомных аномалий для других солид |
риотипа. Из них наиболее характерно |
||||||||||||||||
ных опухолей можно найти в обзоре |
появление второй Ph-хромосомы, до |
||||||||||||||||
известного |
шведского |
цитогенетика |
полнительной |
хромосомы |
8 |
и/или |
|||||||||||
Ф. Мительмана (1997). Приводим его |
маркера i(17q). |
|
|
|
|
|
|
||||||||||
основные положения. |
|
|
|
Значительно |
|
реже |
наблюдаются |
||||||||||
1. Больные с метастазами злокаче |
другие |
изменения |
кариотипа |
(число |
|||||||||||||
ственной меланомы, в клетках кото |
вые и/или структурные). Важно, что |
||||||||||||||||
рых |
содержатся |
структурные |
анома |
клон клеток с дополнительными хро |
|||||||||||||
лии хромосом 7 или 11, имеют значи |
мосомными |
аномалиями |
нередко вы |
||||||||||||||
тельно |
меньшую продолжительность |
является за несколько месяцев до об |
|||||||||||||||
жизни, чем пациенты, у которых та |
наружения |
четких |
симптомов |
терми |
|||||||||||||
кие аномалии не обнаружены. |
|
нальной стадии болезни. |
|
|
|
||||||||||||
2. |
Исследование |
злокачественных |
Следовательно, |
|
цитогенетический |
||||||||||||
фиброзных |
гистиоцитом |
показало, |
анализ |
помогает диагностировать тер |
|||||||||||||
что местные рецидивы и метастазы |
минальную фазу ХМЛ раньше, чем |
||||||||||||||||
гораздо чаще наблюдаются у тех |
другие клинико-лабораторные показа |
||||||||||||||||
больных, у которых в опухолях обна |
тели. |
|
|
|
|
|
|
|
|
||||||||
ружены клоны клеток с дополнитель |
При |
идиопатическом |
миелофиб- |
||||||||||||||
ным материалом на коротком плече |
розе |
обнаружение |
анеуплоидного |
||||||||||||||
хромосомы 19. |
|
|
|
|
|
клона с маркером |
i(17q) |
или |
множе |
||||||||
3.Маркер i(12p) имеет большое ственными перестройками позволяет
прогностическое значение для боль ных с опухолями из недифференциро ванных зародышевых клеток. Наличие маркера благоприятно в прогностиче ском отношении, его отсутствие сви детельствует о том, что терапия с включением препаратов цис-платины вряд ли окажется эффективной.
предсказать неблагоприятное разви тие событий. Кроме того, отрица тельное прогностическое значение имеет обнаружение клонов аномаль ных клеток в ходе болезни, после то го как предыдущие анализы выявля ли только клетки с нормальным кариотипом.
506
|
При миелодиспластических про |
менее благоприятна, чем низкая, а от |
||||||||||||
цессах доля случаев, в которых удает |
сутствие |
нормальных |
элементов |
дела |
||||||||||
ся |
обнаружить |
клоны |
анеуплоидных |
ет прогноз еще более неблагоприят |
||||||||||
клеток, существенно различается в за |
ным. |
|
|
|
|
|
|
|
||||||
висимости от фазы болезни: на отно |
Сделать |
заключение |
о |
прогнозе |
||||||||||
сительно ранних этапах она составля |
опухолей с |
нормальным |
кариотипом |
|||||||||||
ет 20—30 %, при появлении призна |
можно только после тщательного мо- |
|||||||||||||
ков трансформации — 40—60 % и |
лекулярно-генетического анализа с |
|||||||||||||
достигает 80—90 % при трансформа |
использованием |
большого |
набора |
|||||||||||
ции в ОМЛ. |
|
|
|
|
методов и зондов. Ярким примером, |
|||||||||
|
Необходимо |
остановиться |
еще на |
свидетельствующим в |
пользу |
такого |
||||||||
одном вопросе, связанном с прогно |
заключения, служит острый миело- |
|||||||||||||
стическим |
значением |
|
хромосомного |
идный лейкоз. Установлено, что |
||||||||||
анализа в клинике опухолей и гемо |
группа больных, у которых во время |
|||||||||||||
бластозов. Речь пойдет о клетках с |
постановки |
диагноза |
(до |
лечения) |
||||||||||
нормальным кариотипом, причем ци- |
обнаружены только клетки с нор |
|||||||||||||
тогенетически |
нормальными |
могут |
мальным кариотипом, весьма гетеро- |
|||||||||||
оказаться все изученные клетки в ис |
генна. В нее входят, в частности, па |
|||||||||||||
следуемом |
материале |
или выявляется |
циенты, у которых лейкозные клетки |
|||||||||||
две |
популяции |
клеток |
с |
нормальным |
имеют |
химерные |
гены, |
образовав |
||||||
ианомальным кариотипом. Первой шиеся в результате субмикроскопи
ситуации мы уже касались, отметив, что даже высокозлокачественные опу холи иногда имеют нормальный кариотип.
Сейчас известно, что это может от ражать реальную действительность или быть следствием того, что, вопервых, малигнизированные клетки не делятся в момент взятия образца для исследования кариотипа (пункция или биопсия), и, во-вторых, метафазы, которые видит цитогенетик, пред ставляют не клетки опухоли, а нор мальные элементы, например стромальные.
Имеются неопровержимые доказа тельства того, что собственно опухо левые клетки могут иметь скрытые ге нетические изменения, как правило, клональные. При этом нет видимых изменений кариотипа.
Выше |
уже приводились |
примеры |
|
субмикроскопических |
специфиче |
||
ских изменений кариотипа |
(слияние |
||
BCR-ABL, |
перестройки |
генов TEL, |
|
MLL и др.). |
|
|
|
Вторая ситуация встречается чаще. Многолетний опыт изучения кариоти па разнообразных опухолей и лейко зов свидетельствует о том, что при клональных изменениях высокая доля аномальных метафаз прогностически
ческих инсерции. Такая ситуация на блюдается примерно в 10 % случаев ОПЛ .
Довольно большую группу состав ляют больные с номальным кариоти пом, в лейкозных клетках которых удается выявить прогностически не благоприятные перестройки гена
MLL.
Кроме того, в последние годы опубликовано много работ, свидетель ствующих о неблагоприятном прогно стическом значении гена FLT3. Белок, кодируемый этим геном, является тирозинкиназой. Частота его мутаций при ОМЛ составляет 15—35 %. Эти мутации обнаруживаются как при раз личных изменениях кариотипа, так и в случаях с нормальным кариотипом.
Установлено, что особенно небла гоприятен прогноз у пациентов, где отсутствует нормальный аллель FLT3. Описаны и другие мутации, характер ные для ОМЛ.
Сходные примеры можно привести и для других гемобластозов. Сказан ное диктует использование комплекса молекулярно-генетических исследова ний для уточнения прогноза больных, у которых, при хромосомном анализе обнаружены только клетки с нормаль ным кариотипом.
507
12.1.4.Хромосомный анализ
имониторинг опухолей
Выше подчеркивалось, что клетки опухолевых клонов нередко маркиро ваны характерными хромосомными аномалиями, а в ряде случаев имеют молекулярно-генетические маркеры — эквиваленты соответствующих хромо сомных перестроек. Этот факт широ ко используется для мониторинга опухолей в процессе лечения. Нали чие молекулярных зондов для FISH и/ или PCR делает задачу слежения за опухолью вполне разрешимой благо даря более высокой чувствительности этих методик по сравнению с хромо сомным анализом: аномальные клетки
могут быть обнаружены даже при их содержании 1 на 106.
Необходимо остановиться на поня тии минимальной резидуальной болезни
(МРБ). Это понятие подразумевает злокачественные клетки, не уничто женные успешной терапией, в резуль тате которой достигнута полная ре миссия. Резидуальные злокачествен ные клетки не выявляются при стан дартных клинических анализах крови
икостного мозга, но обнаруживаются
спомощью более чувствительных ме тодов, таких как полимеразная цепная реакция с обратной транскрипцией, проточная цитометрия, флюоресцент ная in situ гибридизация и некоторые другие методы, самым чувствитель ным из которых является полимераз ная цепная реакция с обратной транс крипцией (ОТ - ПЦР) .
Вчастности, для оценки эффек тивности различных методов лечения ХМЛ широко применяют стандарт ный цитогенетический метод, FISH и РТ - ПЦР . Поскольку известно, что до лечения у подавляющего большинства больных Ph-хромосома содержится практически во всех клетках костного мозга, появление нормальных клеток (без этого маркера) и нарастание их количества свидетельствуют о суже нии или исчезновении лейкозного клона.
Впоследние годы достигнуты
большие успехи в лечении ХМЛ: при менение интерферона или его анало гов для монотерапии или в сочетании с другими препаратами позволило ре гулярно получать длительные клини ческие и цитогенетические ремиссии, причем первые удается достигнуть бы стрее и значительно чаще вторых. Как уже было сказано выше, примерно 2 года назад в клиническую практику был введен новый эффективный пре парат для лечения ХМЛ — STI 571 (глевек).
Применение интерферона и STI 571 обусловило необходимость коли чественной оценки цитогенетического ответа на лечение. Между критериями разных авторов имеются определен ные различия, но они не имеют прин ципиального значения. Существенно, что все исследователи и клиницисты ориентированы на степень уменьше ния клона с Ph-хромосомой в кост ном мозге пациента. Различают пол ный ответ, когда после лечения не удается обнаружить клеток с фила дельфийской хромосомой, частичный большой ответ, при котором количе ство таких клеток снижается до 60— 70 %, и малый, когда количество нор
мальных метафаз |
(без |
Ph-хромосомы) |
в костном мозге |
не |
превышает 5— |
10 %. В ряде случаев количество Phпозитивных клеток не уменьшается.
Существует выраженный |
параллелизм |
|
между |
цитогенетическим и |
клиниче |
ским |
эффектами интерферона: при |
|
полном ответе пятилетняя |
выживае |
|
мость составляет 90 %, при малом — 76 %. К сожалению, при лечении ин терфероном цитогенетический ответ удается получить только в 20—30 % случаев, а полный — у 8—12 % боль ных. Применение глевека вызывает клинический и цитогенетический от вет значительно чаще. Конечно, боль шое значение имеют дозы препаратов и весь комплекс терапевтических средств. При лечении интерфероном полный ответ, если и достигается, то обычно не ранее чем через 8—12 мес (от 6 мес до 4 лет). Некоторого умень шения количества Ph-позитивных
508
клеток в костном мозге можно ждать уже через 3—6 мес от начала лечения.
Важно, что глевек позволяет полу чить клинический и гематологический ответ даже у пациентов в фазе акселе рации болезни. При мониторинге большой группы больных, леченных глевеком, было установлено, что су ществует корреляция между глубиной цитогенетического ответа и длитель ностью клинико-гематологической ремиссии.
В настоящее время трансплантация костного мозга (ТКМ) рассматривает ся как единственный метод возмож ного полного излечения ХМЛ, однако наблюдение за больными, перенесши ми Т К М , показывает, что у них по стоянно существует угроза рецидива, поэтому проблема мониторинга ми нимальной резидуальной болезни весьма актуальна. Для отслеживания лейкозных клеток чаще всего исполь зуют метод RT-PCR. Обнаружение хи мерного транскрипта BCR-ABL свиде тельствует о повышении риска реци дива: в сроки 6—12 мес после Т К М рецидивы развиваются более чем в 40 % случаев при обнаружении транс крипта и только в 3 % случаев при его отсутствии ("PCR-негативность"). Од нако простое выявление химерного транскрипта после Т К М без его коли чественной оценки в динамике долж но быть оценено с известной долей осторожности и не может служить ос нованием для назначения агрессивной терапии. У многих больных химерный транскрипт BCR-ABL персистирует по
истечении |
нескольких |
лет после |
Т К М , далеко не всегда |
предвещая |
|
скорый рецидив. Большинство иссле дователей обнаруживают BCR-ABL- транскрипт у 25—55 % больных через 3 года после Т К М , рецидивы же были зафиксированы не у всех, а у 8—10 % этих пациентов. Известный прогресс в изучении резидуальной болезни при ХМЛ, в частности после Т К М , был достигнут в результате количественно го определения уровня транскрипта в; крови и костном мозге пациентов в ходе клинической и цитогенетической
ремиссии: было четко показано, что стойкая ремиссия сопровождается стабильно низким уровнем транс крипта, а рецидиву предшествует по вышение этого уровня (молекулярный рецидив). Сейчас ведутся интенсив ные исследования по разработке ра циональных протоколов мониторирования ХМЛ при разных вариантах те рапии.
Мониторинг в процессе лечения ХМЛ можно проводить и с помощью FISH, поскольку это дает возмож ность быстро получать ответ, причем на клетках крови, а не костного мозга. Применение FISH оказывается един ственно возможным цитогенетическим способом слежения за Ph-пози тивным клоном в случаях, когда под влиянием лекарственных препаратов количество делящихся клеток в кост ном мозге резко снижается. Это за трудняет стандартный хромосомный анализ или исключает его. В то же время общепринятые FISH-зонды да ют довольно высокий процент клеток с ложнопозитивным сигналом (около 15 % ) , что затрудняет оценку эффек тивности лечения. Разработка досто верных методов мониторинга ХМЛ интенсивно проводится в течение по следних 5 лет, причем с активным участием российских ученых.
Современные программы химиоте рапии обеспечивают достижение пол ной ремиссии у большинства пациен тов с острыми миелоидными лейкоза ми (ОМЛ), однако у 60—70 % боль ных в течение первых 1,5—2 лет на блюдаются рецидивы вследствие не полного уничтожения опухолевого клона. В разгаре заболевания количе ство лейкемических клеток достигает 1012, что легко выявляется при морфо логическом исследовании пунктата костного мозга. После проведения ин дукционной терапии и получения морфологической ремиссии количест во лейкемических клеток существенно снижается — до 109—104. Такое коли чество клеток можно обнаружить только с помощью более чувствитель ных методик, в частности при исполь-
509
зовании полимеразной цепной реак ции с обратной транскрипцией, про точной цитометрии, флюоресцентной in situ гибридизации.
цией |
t(8;21)(q22;q22) |
более сложна, |
чем |
при ОПЛ. На |
протяжении не |
скольких лет для мониторинга М Р Б использовали модификацию RT-PCR,
Вкачестве маркеров лейкозных при которой можно было сделать за
клеток с успехом используют химер ные гены, возникшие в результате специфических хромосомных транс локаций, перестроенные гены Т-кле точных рецепторов, измененные гены тяжелых цепей иммуноглобулинов, а также комплекс иммунофенотипических особенностей. Получены важные данные, свидетельствующие о тесной связи М Р Б и прогноза заболевания. Показано, что частота рецидивов зна чительно выше в группе больных, где удается обнаружить минимальную резидуальную болезнь, по сравнению с группой пациентов, у которых М Р Б не выявляется. Кроме того, установле но, что чем больше количество остав шихся лейкозных клеток, тем меньше сроки от начала ремиссии до наступ ления рецидива.
Клиническое значение М Р Б до сих пор не совсем ясно. В литературе по стоянно обсуждается вопрос о том, следует ли лечить М Р Б , и если следу
ет, то как и на каком этапе. |
|
|
|
Наиболее ярким примером |
парал |
||
лелизма |
между показателями |
М Р Б и |
|
клиническим течением лейкоза |
явля |
||
ются результаты изучения экспрессии |
|||
химерного гена PML-RARa при |
ост |
||
ром |
промиелоцитарном |
лейкозе |
|
(ОПЛ): на огромном материале (сотни больных) было продемонстрировано, в частности, итальянскими и англий скими исследователями, что исчезно вение химерного транскрипта (т. е. наступление молекулярной ремис сии) и наступление гематологической ремиссии практически совпадают по времени. Кроме того, установлено, что если после периода ПЦР-негатив- ности химерный транскрипт обнару живался вновь (молекулярный реци див); это практически всегда является предвестником скорого гематологиче ского рецидива.
Ситуация с мониторингом М Р Б при ОМЛ с хромосомной транслока
ключение только о наличии или от сутствии химерного транскрипта, но не об его количестве. Применение этой методики показало, что химер ный транскрипт AML1-ETO присутст вует в крови и костном мозге подав ляющего большинства больных не только до лечения, но и на фоне дли тельной (в том числе многолетней) ремиссии. С помощью качественной RT-PCR в последнее время получены новые факты, важные для клиники. Особое внимание привлекает работа Morschhauser и соавт. (2000). При ис следовании в динамике 51 больного ОМЛ с t(8;21) авторы обнаружили достоверную корреляцию между ран ним исчезновением транскрипта и по следующей длительной ремиссией. У всех больных, получивших адекватное лечение и реально переживших пяти летний рубеж, была зафиксирована ПЦР-негативность.
Разработка количественных моди фикаций метода О Т - П Ц Р (таких как real-time и конкурентная) позволила установить важную закономерность: применение адекватной терапии со провождается существенным сниже нием уровня химерного транскрипта в крови и костном мозге, и этот сни женный уровень характерен для ре миссии. Повышение уровня транс крипта у больных, находящихся в ге матологической ремиссии, как прави ло, свидетельствует о наступлении мо лекулярного рецидива и позволяет прогнозировать приближение гемато логического рецидива. Было показа но, что гематологический рецидив обязательно следует за молекулярным с интервалом в 4—6 мес. Количест венная О Т - П Ц Р пока не получила широкого применения. Поскольку транскрипт химерного гена для лейко зов с t(8;21) может сохраняться доста точно долго во время ремиссии, не предвещая наступления рецидива, при
510
этом варианте ОМЛ необходимо оп |
|
ния |
|
возможностей цитогенети |
|||||||||||||||||||||||
ределять |
|
уровень |
сохраняющегося |
|
ческих |
исследований |
в диагно |
||||||||||||||||||||
транскрипта. |
|
|
Повышение |
|
уровня |
|
стике, |
прогнозировании |
и мо |
||||||||||||||||||
транскрипта, |
как известно, свидетель |
|
ниторинге |
|
как |
гемобластозов, |
|||||||||||||||||||||
ствует о начале молекулярного реци |
|
так и солидных опухолей. Ведь |
|||||||||||||||||||||||||
дива. |
Следовательно, |
необходимость |
|
даже |
при |
сравнительно |
хорошо |
||||||||||||||||||||
использования |
количественной |
моди |
|
изученных |
|
новообразованиях, |
|||||||||||||||||||||
фикации О Т - П Ц Р в мониторинге |
|
например |
|
острых |
лейкозах, |
||||||||||||||||||||||
МРД у больных ОМЛ с t(8;21) не вы |
|
практическое значение ясно не |
|||||||||||||||||||||||||
зывает сомнений. |
|
|
|
|
|
|
|
для |
|
всех |
|
характерных |
нару |
||||||||||||||
Современные |
|
протоколы |
монито |
|
шений. |
|
|
|
|
|
|
|
|
|
|||||||||||||
ринга |
М Р Б |
не |
|
позволяют |
избежать |
Следует |
подчеркнуть, |
что |
новые |
||||||||||||||||||
ошибок |
в |
|
предсказании |
рецидива: |
|||||||||||||||||||||||
|
терапевтические |
схемы |
переводят |
от |
|||||||||||||||||||||||
описаны |
гематологические рецидивы, |
||||||||||||||||||||||||||
дельные специфические хромосомные |
|||||||||||||||||||||||||||
возникшие |
как |
бы |
неожиданно, |
т. е. |
|||||||||||||||||||||||
аномалии |
из |
|
разряда прогностически |
||||||||||||||||||||||||
их не |
удалось предсказать с |
помощью |
|
||||||||||||||||||||||||
неблагоприятных в разряд |
прогности |
||||||||||||||||||||||||||
молекулярного |
|
количественного |
мо |
||||||||||||||||||||||||
|
чески |
благоприятных. |
|
|
|
|
|||||||||||||||||||||
ниторинга М Р Б . Правда, такие ситуа |
|
|
|
|
|||||||||||||||||||||||
Разработка |
новых |
молекулярных |
|||||||||||||||||||||||||
ции наблюдаются редко. |
|
|
|
||||||||||||||||||||||||
|
|
|
зондов |
на |
специфические |
хромосом |
|||||||||||||||||||||
Многократные |
исследования боль |
||||||||||||||||||||||||||
ные |
|
перестройки |
имеет |
большое |
|||||||||||||||||||||||
ших групп |
больных с различными ге- |
|
|||||||||||||||||||||||||
практическое |
|
значение, так как рас |
|||||||||||||||||||||||||
мобластозами |
|
|
позволят |
накопить |
|
||||||||||||||||||||||
|
|
ширяет |
возможности |
диагностики, |
|||||||||||||||||||||||
опыт, |
полезный для усовершенствова |
||||||||||||||||||||||||||
прогнозирования |
и |
мониторинга |
ге |
||||||||||||||||||||||||
ния протоколов мониторирования па |
|||||||||||||||||||||||||||
мобластозов. |
|
|
|
|
|
|
|
|
|
||||||||||||||||||
циентов, |
злокачественные клетки |
ко |
|
|
|
|
|
|
|
|
|
||||||||||||||||
В настоящее |
время |
можно условно |
|||||||||||||||||||||||||
торых |
несут |
химерные |
гены, образо |
||||||||||||||||||||||||
разделить клоновые изменения карио |
|||||||||||||||||||||||||||
вавшиеся |
в |
результате |
специфических |
||||||||||||||||||||||||
типа, |
обнаруженные |
в |
клетках самых |
||||||||||||||||||||||||
хромосомных |
транслокаций. |
|
|
|
|||||||||||||||||||||||
|
|
|
разнообразных |
опухолей, |
на |
повто |
|||||||||||||||||||||
Опубликовано |
несколько |
успеш |
|||||||||||||||||||||||||
ряющиеся |
|
(обнаруженные |
в несколь |
||||||||||||||||||||||||
ных попыток предотвратить истинный |
|
||||||||||||||||||||||||||
ких новообразованиях) и неповторяю |
|||||||||||||||||||||||||||
рецидив |
лейкоза, |
начав лечение |
во |
||||||||||||||||||||||||
щиеся, или неспецифические. |
|
|
|||||||||||||||||||||||||
время молекулярного рецидива. Так, в |
|
|
|||||||||||||||||||||||||
Увеличение общего |
количества ци- |
||||||||||||||||||||||||||
1998 г. итальянские |
гематологи полу |
||||||||||||||||||||||||||
тогенетически |
исследованных |
опухо |
|||||||||||||||||||||||||
чили |
весьма |
обнадеживающие |
резуль |
||||||||||||||||||||||||
лей |
позволяет |
переводить |
хромосом |
||||||||||||||||||||||||
таты: |
повторные |
молекулярные |
ре |
||||||||||||||||||||||||
ные |
перестройки |
из |
разряда неповто |
||||||||||||||||||||||||
миссии были |
|
достигнуты у |
12 |
из 14 |
|||||||||||||||||||||||
|
ряющихся |
|
в |
|
разряд |
повторяющихся. |
|||||||||||||||||||||
пациентов |
вследствие |
интенсифика |
|
|
|||||||||||||||||||||||
Более того, |
последние могут оказаться |
||||||||||||||||||||||||||
ции терапии |
во |
время |
молекулярного |
||||||||||||||||||||||||
специфичными |
для |
конкретных уни |
|||||||||||||||||||||||||
рецидива. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
кальных |
субвариантов |
неоплазий |
и |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
* * * |
|
|
|
|
важными |
|
для |
|
диагностики |
именно |
|||||||||||
|
|
|
|
|
|
|
|
|
|
этих редких форм. |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Изложенный |
выше |
материал |
дает |
Применение |
молекулярно-генети- |
||||||||||||||||||||||
ческих |
методик |
(FISH, PCR) |
в кли |
||||||||||||||||||||||||
возможность |
|
сделать |
два |
основных |
|||||||||||||||||||||||
|
нической |
практике существенно рас |
|||||||||||||||||||||||||
вывода: |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
ширяет |
возможности |
диагностики |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
• |
во-первых, |
уже |
сегодня |
хромо |
опухолей и лейкозов, а также их мо |
||||||||||||||||||||||
|
сомный |
анализ |
имеет |
большое |
ниторирования |
и |
способствует усо |
||||||||||||||||||||
|
практическое |
значение в |
онко |
вершенствованию |
|
терапевтических |
|||||||||||||||||||||
|
логической клинике, особенно в |
протоколов. |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
гематологической; |
|
|
|
Все сказанное выше относится к |
||||||||||||||||||||||
• |
во-вторых, |
очевидно, что требу |
практической цитогенетике, но и тео |
||||||||||||||||||||||||
|
ется большая работа для уточне |
ретическое значение современной ци- |
|||||||||||||||||||||||||
511
тогенетики опухолей трудно переоце нить: специфические хромосомные аномалии маркируют участки генома, играющие кардинальную роль в малигнизации и прогресии, и служат ориентиром при исследовании моле кулярных механизмов канцерогенеза.
Рекомендуемая литература
Avvisatti G., Lo Coco F, Mandelli F. Acute promyelocytic leukemia: Clinical and Morphologic features and prognostic fac tors // Seminars Heamatol. — 2001. — Vol. 38 (1). - P. 4 - 1 2 .
Caligiuri Μ. Α., Strout M., Lawrence D. et al.
Rearrangement of ALLl(MLL ) gene in acute myeloid leukemia with normal cy togenetics // Cancer Research. — 1998. —
Vol. 58. - |
P. 5 5 - 5 9 . |
|
|
|
|
||||
Clarkson B. D., Strife Α., |
Wisniewski D. |
et |
al. |
||||||
New understanding |
of the pathogenesis |
of |
|||||||
С ML: |
a prototype of early |
neoplasia |
// |
||||||
Leukemia. |
— |
1997. |
— |
Vol. 11. |
— |
||||
P. 1404-1428. |
|
|
|
|
|
|
|||
Cortes |
J., |
O'Brien |
S. |
Chronic |
myelogenous |
||||
leukemia // Current Opnion in Oncology. |
|||||||||
- |
1994. - |
Vol. |
6. |
- P. 2 3 - 3 1 . |
|
|
|||
Deininger |
M. |
W. N., |
Goldman |
J. M., |
Melo |
||||
J. |
V. |
The |
molecular |
biology of chronic |
|||||
myeloid leukemia // Blood. — 2000. — |
|||||||||
Vol. 96. - P. 3343-3356. |
|
|
|
||||||
Diverio |
D., |
Ross I. |
V., |
Avvisati G. |
et al. |
Early |
|||
detection of relapse by prospective reverse transcriptase-polymerase chain reaction analysis of the PML/RARa fusion gene in patients with acute promyelocytic leuke mia enrolled in the GIMEMA - AIEOP
multicenter "AIDA" trial // Blood. |
— |
|
1998. - Vol. 92. - P. 784 - 789 . |
|
|
Faderl S., Kantarjian Η. M., |
Talpaz M., Estrov |
|
L. Clinical significance |
of cytogenetic |
ab |
normalities in adult acute lymphoblastic leukemia // Blood. — 1998. — Vol. 91. — P. 3996-4019.
Faderl S., |
Kantarjian Η. M., |
Talpaz M., |
Estrov |
|||
L. |
Clinical significance |
of minimal |
residu |
|||
al disease in leukemia (rewiev) // Int. J. |
||||||
Oncol. - 2000. - Vol. 17. - P. |
1 2 7 7 - |
|||||
1287. |
|
|
|
|
|
|
Greenberg |
P., |
Cox C, LeBeau |
M. et al. |
Inter |
||
national scoring system for evaluating |
||||||
prognosis of myelodysplastic syndromes // |
||||||
Blood. - 1997. - Vol. 89. - P. |
2 0 7 9 - |
|||||
2088. |
|
|
|
|
|
|
Grimwade |
D., |
Biondi Α., |
Mocciaconacci |
M.-J. |
||
et |
al. |
Characterization |
of acute promyelo |
|||
cytic leukemia lacking the classic t(15;17):
results of the European Working Party // Blood. - 2000. - Vol. 96. - P. 1297— 1305.
Grimwade |
D., |
Walker H., Oliver F. |
et |
al. The |
|||||
importance of diagnostic cytogenetics on |
|||||||||
outcome in AML: analysis of 1,612 pa |
|||||||||
tients |
entered |
into |
the M R C A M L |
10 trial |
|||||
// |
Blood. - |
1998. |
- Vol. |
92. |
- |
P. |
2 3 2 2 - |
||
2333. |
|
|
|
|
|
|
|
|
|
Heim |
S., |
Mitelman F. |
Cancer |
Cytogenetics. |
|||||
Chromosomal and molecular genetic aber |
|||||||||
rations of |
tumor cells. — |
Second |
edition, |
||||||
Willey Liss, 1995. |
|
|
|
|
|
||||
Но C. Y., Otterud В., |
Legare |
R. D. |
et |
al. Lin- |
|||||
cage of familial platelet disorder with a |
|||||||||
propensity to develop myeloid malignan |
|||||||||
cies to human chromosome 21q22.1-22.2 |
|||||||||
// |
Blood. - 1996. |
- Vol. |
87. - |
P. 5 2 1 8 - |
|||||
5224. |
|
|
|
|
|
|
|
|
|
Honda H, Oda H., Suzuku T. |
et |
al. Develop |
|||||||
ment of acute lymphoblasic leukemia and |
|||||||||
myeloproliferative |
disorder |
in |
transgenic |
||||||
mice expressing p210 bcr-abl: a novel |
|||||||||
transgenic model for human Ph-positive |
|||||||||
leukemias |
// |
Blood. — 1998. |
— |
Vol. 91. |
|||||
-P. 2067.
Honda H., Ushijima Т., Wakazono K. et al.
Aquired loss of p53 induces blastic trans formation in p210bcr/abl -expressing he matopoietic cells: a transgenic study for
blast |
crisis |
of human |
C M L // |
Blood. — |
2000. - Vol. 95. - P. |
1144-1150. |
|||
Johansson |
В., |
Mertens F., |
Mitelman |
F. Cytoge |
netic deletions maps of hematologic neo plasms: circumstantial evidence for tumor suppressor loci // Genes, Chromosom,
Cancer. - 1993. - |
Vol. 8. - |
P. |
2 0 5 - |
218. |
|
|
|
Johansson В., Mertens F., |
Mitelman |
F. |
Geo |
graphic heterogeneity |
of neoplasia-associ- |
||
ated chromosome aberrations // Genes, Chromosom, Cancer. — 1991. — Vol. 3. - P. 1-7.
Kinzler K. W., Vogelstein B. Lessons from he reditary colorectal cancer // Cell. — 1996.
-Vol. 18. — P. 159-170.
Kondo M. et al. Real-toime quantitative re verse transcription-polymerase chain reac tion for the detection of AML1 - MTG8 fu sion transcripts in t(8;21)-positive acute myelogenous leukemia // Leuk. Res. — 2000, - Nov. - Vol. 24 (11). - P. 951.
Mauro M. J., Drucker B. J. STI571: targeting BCR-ABL as therapy for C M L // Oncol ogist. - 2001. - Vol. 6. - P. 233 - 238 .
Mertens F, Johansson В., Mitelman F. Ageand gender-related heterogeneity of cancer chromosome aberrations // Cancer Genet. - 1993. - Vol. 70. - P. 6 - 1 1 .
512
Meshinchi S., |
Woods |
W., Stirewalt D. |
L. et al. |
||||
Prevalence et prognostic significance of |
|||||||
FLT3 internal tandem duplication in pedi |
|||||||
atric acute myeloid leukemia // Blood. — |
|||||||
2001. - |
Vol. |
97. - |
P. 8 7 - 9 4 . |
|
|||
Michaud J., |
Wu |
F., |
Ostao M. et al. |
In vitro |
|||
analyses |
of |
known |
and |
novel |
R U N X 1 / |
||
AML1 Mutations in dominant familial |
|||||||
platelet disorder with predisposition to |
|||||||
acute myelogenous |
leukemia; implications |
||||||
for |
mechanisms |
of pathogenesis |
// Blood. |
||||
- |
2002. |
- Vol. |
99. |
- P. |
1364-1372. |
||
Mitelman F. Catalog of chromosome aberra tions in cancer. — Fifth edition. — Willey-
Liss, 1995. |
|
|
|
Mitelman |
F, |
Johansson В., |
Mandahl N., |
Mertens |
F. |
Clinical significance of cytoge |
|
netic findings in solid tumors // Cancer Genet. Cytogenet. — 1997. — Vol. 95. — P. 1-8.
Mrozek K., Heinonen K., de la Chapelle Α., Bloomfield C. Clinical significance of cy togenetics in acute myeloid leukemia // Seminars in Oncol. — 1997. — Vol. 24. — P. 1 7 - 3 1 .
Ong S., Le Beau Μ. M. Chromosomal abnor malities and molecular genetics of nonHodgkin's lymphomas // Seminars in On col. - 1998. - Vol. 25. - P. 447 - 460 .
Pui Ch.H., Crist |
W. M., Look |
T. |
A. Biology |
and clinical |
significance |
of |
childhood |
acute lymphoblastic leukemia // Blood. — 1990. - Vol. 76. - P. 1449-1463.
Quakenbush R. C, |
Reuther G. W., Miller J. P. |
et al. Analysis |
of the biologic properties of |
p230 Bcr-Abl reveals unique and overlap ping properties with the oncogenic pl85 and p210 Bcr-Abl tyrosyne kinases // Blood. - 2000. - Vol. 95. - P. 2913— 2921.
Radich J. P. Clinical applicability of the eval uation of minimal residual disease in acute leukemia // Curr. Opin. Oncol. — 2000.
- |
Vol. 12. |
- P. 3 6 - 4 0 . |
Rhoades K. L. |
et al. Analysis of the role of |
|
AML1 - ETO in leukemogenesis // Blood. |
||
- |
2000. - |
Vol. 96. - P. 2108-2115. |
Rowley J. D. The critic role of chromosome translocations in human leukemias // Ann.
Rev. |
Genet. |
- |
1998. |
- |
Vol. |
32. - |
P. 495 - 519 . |
|
|
|
|
|
|
Sole F, |
Espinet В., Sanz G. E. |
et al. |
Inci |
|||
dence, characterization and prognostic sig |
||||||
nificance of chromosome abnormalities in |
||||||
640 |
patients |
with |
primary |
myelodysplastic |
||
syndromes // |
Brit. |
J. Haematol. — 2000. |
||||
-Vol. 108. - P. 346 - 356 .
Strehl S., KonigM., Mann G., Haas O. Multi plex reverse transcriptase-polymerase
chain |
reaction |
screening |
in |
childhood |
||||
acute myeloblastic leukemia // Blood. — |
||||||||
2001. - Vol. 97. - P. 805 - 808 . |
|
|
||||||
Veldman Т., Vignon CH., Schrock |
E. et |
al. |
||||||
Hidden |
chromosome |
abnormalities |
in |
|||||
haematological |
malignancies |
detected |
by |
|||||
multicolor spectral karyotyping // Nature |
||||||||
Genet. |
- |
1997. - Vol. |
15. |
- |
P. 4 0 6 - |
|||
410. |
|
|
|
|
|
|
|
|
Yuan Y, Zhou |
L., |
Miyamoto |
T. et |
al. AML1 - |
||||
eto expression is directly involved in the development of acute myeloid leukemia in
the presence of additi |
// Proc. Natl. Acad |
|||
Sci USA. - 2001. - |
Vol. 98, |
N |
18. |
- |
P. 10 398 - 10 403. |
|
|
|
|
Zojer N., Konrigsberg R., |
Ackerman |
J. |
et |
al. |
Deletion of 13ql4 remains an independent adverse prognostic variable in multiple myeloma despite its frequent detection by interfase in situ hybridization // Blood. — 2000. - Vol. 95. - P. 1925-1930.
12.2. Молeкулярнобиологические исследования онкогенов
и генов-супрессоров опухолевого роста в клинической практике
И. Б. Зборовская
Фундаментальные исследования в области молекулярной онкобиологии направлены на определение структур ных и функциональных изменений, вызывающих необратимую опухоле вую трансформацию клеток, и имеют конечной целью решение проблем предупреждения, возникновения или эффективного лечения злокачествен ных новообразований у человека. Идентификация генетических факто ров, ассоциированных с канцерогене зом, является одной из наиболее ост рых проблем современной молекуляр ной онкологии. Риск возникновения, гистогенез, темпы роста опухоли и ее прогрессия в немалой степени опреде ляются структурными особенностями и/или аберрациями клеточного генома.
С возникновением и прогрессией опухоли могут быть связаны как де терминированные в геноме параметры (например, нормальный аллельный полиморфизм генов или герминаль-
33-7908 Д. Г. Заридзе |
513 |
ные, т. е. наследуемые в поколениях, мутации), так и изменения, появляю щиеся de novo при злокачественной трансформации и развитии опухоле вого процесса. Малигнизация нор мальных клеток является следствием каскадного накопления в их геноме различных нарушений. Предполагает ся, что для развития рака у человека необходимы изменения не менее 6— 10 генетических факторов.
Генетическая нестабильность, яв ляющаяся неотъемлемой чертой опу холевой прогрессии, может быть обу словлена в первую очередь наруше ниями в системе генов, контролирую щих целостность генома, что резко увеличивает вероятность появления и накопления мутаций.
Значительный вклад в малигнизацию клетки вносят повреждения ге нов, участвующих в процессах регуля ции клеточного роста и дифференци ровки, в частности онкогенов и геновсупрессоров опухолевого роста — ан тионкогенов (см. разделы 3.1, 3.2). В настоящее время известно более 100 различных онкогенов и около 20 ге- нов-супрессоров. Большое значение придается исследованиям генов, ко дирующих нормальные регуляторы клеточного цикла — циклинзависимые киназы и их ингибиторы (послед ние также относятся к классу геновсупрессоров опухолевого роста) и оп ределяющих скорость клеточного де ления, т. е. уровень пролиферации опухолевых клеток. Кроме того, суще ствует большая группа генов-модуля торов, не отвечающих за злокачест венную трансформацию клеток, но способствующих распространению опухоли в организме. К ним относят ся гены главного комплекса гистосовместимости, иммунного ответа, гены, контролирующие функционирование протеолитических ферментов, неоангиогенез и т. п.
Опухоли человека являются объек том пристального внимания при изу чении факторов генетической неста бильности, и в настоящее время нако пился достаточно большой объем дан
ных, касающихся отдельных молеку- лярно-генетических характеристик различных гистологических типов ра ка. Хотя спектр как наследуемых, так и соматических изменений генов в случае каждой конкретной опухоли носит индивидуальный характер, тем не менее наблюдаются определенные закономерности генных модифика ций, дающие основания связывать их с развитием или характером прогрес сии той или иной патологии. В ряде случаев структурные и функциональ ные изменения онкогенов, генов-су- прессоров и модуляторов могут слу жить специфическими маркерами, имеющими важное значение в прак тике клинической онкологии.
К молекулярно-генетическим мар керам опухолевого роста и профессии следует отнести точечные мутации в кодирующих и регуляторных областях генов, амплификацию онкогенов, ут рату отдельных аллелей и генных локусов вследствие делеций и хромо сомных перестроек, модуляцию экс прессии генов на уровне транскрип ции и трансляции. Особенности структуры протоонкогенов (наследст венный полиморфизм аллелей) и аль терации антионкогенов и генов систе мы репарации генома (терминальные рецессивные мутации одного из двух аллелей) могут определять наследст венную предрасположенность к забо леванию раком. В экспериментальных исследованиях показано, что инакти вация антионкогена в результате од новременных нарушений в соответст вующих локусах парных хромосом — мутации в одном и делеций во вто ром — может быть устранена внесе нием аллеля дикого типа (т. е. струк турно не измененного, интактного ал леля), что является основой для науч ных разработок в области генной те рапии опухолей.
Внимание практической онкогенетики сосредоточено на тех известных изменениях, детекция которых может служить характеристикой тех или иных клинических параметров в груп пах онкологических больных или от-
дельных индивидуумов. Такие марке |
наследственностью. |
Методы |
молеку |
|||||||||||||||||||||
ры уже используются: а) для форми |
лярной генетики открывают принци |
|||||||||||||||||||||||
рования групп риска развития тех или |
пиально новые |
возможности |
диагно |
|||||||||||||||||||||
иных опухолевых заболеваний как в |
стики |
наследственных |
заболеваний, |
|||||||||||||||||||||
семьях |
с |
отягощенной |
онкологиче |
основанные на исследовании мутант- |
||||||||||||||||||||
ской наследственностью, так и при |
ных аллелей у предполагаемых носи |
|||||||||||||||||||||||
спорадических формах; б) в качестве |
телей патологических мутаций. |
|
||||||||||||||||||||||
тестов |
для |
досимптоматической |
диаг |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
ностики; |
в) |
при |
дифференциальной |
12.2.1.1. Мутации генов |
|
|||||||||||||||||||
диагностике тех или иных гистологи |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
ческих форм; г) с целью выявления |
Известно, что потеря функций ан |
|||||||||||||||||||||||
метастазов |
и |
рецидивов |
первичного |
тионкогенов |
|
в |
опухолевых |
клетках |
||||||||||||||||
очага; д) для прогнозирования тече |
происходит, как правило, в результате |
|||||||||||||||||||||||
ния |
опухолевого |
процесса |
(скорости |
инактивации |
|
обоих аллелей. |
Предпо |
|||||||||||||||||
прогрессирования |
|
заболевания |
и |
лагается, что утрата в результате деле |
||||||||||||||||||||
уровня |
выживаемости |
больных); |
е) |
ций одного аллеля дает возможность |
||||||||||||||||||||
эффективности и коррекции проводи |
проявления |
фатальных |
рецессивных |
|||||||||||||||||||||
мых лечебных мероприятий, в частно |
мутаций в оставшемся (теория Кнад- |
|||||||||||||||||||||||
сти |
воздействия |
химиотерапевтиче- |
сена). Особое место в плане медико- |
|||||||||||||||||||||
ских агентов; ж) в разработке новых |
генетического |
тестирования |
занимает |
|||||||||||||||||||||
подходов |
к |
лечению |
онкологических |
детекция |
терминальных мутаций этой |
|||||||||||||||||||
больных методами гено- и сигналоте- |
группы генов, с большой частотой |
|||||||||||||||||||||||
рапии. |
|
|
|
|
|
|
|
|
|
|
(иногда |
более |
90 %) |
обнаруживаемых |
||||||||||
На |
сегодняшний |
день |
очевидно, |
у пациентов, членов их семей или в |
||||||||||||||||||||
что для совершенствования критериев |
популяциях |
с |
|
повышеной |
частотой |
|||||||||||||||||||
оценки течения болезни и эффектив |
встречаемости |
|
опухолевых |
заболева |
||||||||||||||||||||
ности |
проводимых |
лечебных |
меро |
ний (табл. 12.14) (см. также табл. 3.5). |
||||||||||||||||||||
приятий |
в |
онкологии |
необходимо |
Существующая в таких семьях высо |
||||||||||||||||||||
объединение в рамках единых про |
кая фоновая частота мутаций опреде |
|||||||||||||||||||||||
грамм |
традиционных |
способов |
диаг |
ляет более ранние сроки возникнове |
||||||||||||||||||||
ностики и лечения с современными |
ния наследуемых опухолей по сравне |
|||||||||||||||||||||||
методами |
молекулярно-генетического |
нию |
со |
спорадическими, |
имеющими |
|||||||||||||||||||
тестирования. |
|
|
|
|
|
|
сходные локализации и тип гистоло |
|||||||||||||||||
Ниже |
рассматриваются |
наиболее |
гической |
структуры. |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
яркие примеры молекулярно-биоло- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
гических |
исследований, |
результаты |
12.2.1.2. Полиморфизм |
|
|
|||||||||||||||||||
которых |
используются |
в |
практике |
|
|
|||||||||||||||||||
онкогенов |
|
|
|
|
|
|
|
|
||||||||||||||||
клинической онкологии. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
В |
последнее |
десятилетие |
большое |
|||||||||
12.2.1. |
|
Наследуемые |
|
|
внимание |
исследователей |
в |
области |
||||||||||||||||
особенности |
структуры |
|
молекулярной |
биологии |
рака |
привле |
||||||||||||||||||
онкогенов |
|
|
|
|
|
|
кает |
наследственный |
полиморфизм |
|||||||||||||||
и |
генов-супрессоров |
|
|
некоторых онкогенов, т. е. наличие |
в |
|||||||||||||||||||
|
|
геноме |
различных |
вариантов |
аллелей |
|||||||||||||||||||
как |
факторы |
риска |
|
|
|
|||||||||||||||||||
|
|
|
одного и |
того |
же |
гена, |
определяемых |
|||||||||||||||||
развития |
онкопатологии |
|
||||||||||||||||||||||
|
внутривидовой |
|
изменчивостью Д Н К . |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Огромное значение в изучении па |
Природа |
возникновения вариантных |
||||||||||||||||||||||
тогенеза |
различных |
опухолей |
имеют |
аллелей может быть различной. Поли |
||||||||||||||||||||
исследования |
наследственых |
онко- |
морфные маркеры обладают менде- |
|||||||||||||||||||||
синдромов, в основе которых лежат |
левским |
характером |
расщепления |
и, |
||||||||||||||||||||
строго |
|
определенные |
структурные |
по |
сложившемуся |
|
на |
сегодняшний |
||||||||||||||||
особенности |
генома, |
характерные для |
день мнению, могут влиять как на |
|||||||||||||||||||||
семей с отягощенной онкологической |
риск возникновения |
некоторых форм |
||||||||||||||||||||||
зз* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
515 |
|

Т а б л и ц а 12.14. Некоторые наследственные онкосиндромы, ассоциированные с терми
нальными мутациями мутаторных генов или генов-супрессоров опухолевого роста
Заболевание |
Клиническое проявление |
Ген |
участия |
Локус |
Ювенильный на |
Множественные аденомы толстой киш |
АРС, |
М С С |
5q21 22 |
следственный |
ки с высоким риском малигнизации |
|
|
|
аденоматоз тол |
|
|
|
|
стой кишки (син |
|
|
|
|
дром Линча I) |
|
|
|
|
Синдром Линча II |
Неполипозный рак толстой кишки с по |
Гены |
системы |
2pl6 |
|
вышенной частотой возникновения в |
репарации Д Н К |
2q32 |
|
|
семье муцинозных опухолей яичника |
(MSH2, |
MLH1, |
3p21 |
|
|
PMS1, |
PMS2) |
9p |
Синдром Пейт- |
Ювенильные гамартомы Ж К Т , рак яич |
STK11 |
Serine/ |
19pl3.3 |
ца—Егерса |
ников и яичка, опухоли поджелудочной |
treonin kinase 11 |
|
|
|
железы |
gene |
|
|
Болезнь Л и — |
Остеосаркомы, рак молочной железы в |
p53 |
|
17pl2 |
Фраумени |
молодом возрасте, лимфопролифератив- |
|
|
|
|
ные заболевания, опухоли мозга и аде- |
|
|
|
|
нокортикальный рак у детей и т. д. |
|
|
|
Наследственные |
Опухоли молочной железы и/или яич |
BRCA1, |
BRCA2 |
17q213 |
формы рака мо |
ников не менее чем у 3 членов семьи в |
|
|
13ql2 |
лочной железы и |
двух генерациях |
|
|
|
яичников |
|
|
|
|
Болезнь Каудена |
Гамартоидный полипоз с высоким рис |
PTEN |
|
10q23.3 |
|
ком возникновения нейрогенных опухо |
|
|
|
|
лей, рака кожи, молочной железы, щи |
|
|
|
|
товидной железы и т. д. |
|
|
|
Болезнь Банья |
Множественные гамартомы, возникаю |
PTEN |
|
10q23.3 |
на—Зонана |
щие в детском возрасте |
|
|
|
Ювенильный хро |
Миелоидные лейкозы, развивающиеся у |
NF1 |
|
17qll . l2 |
нический миело- |
детей с высоким риском развития ней- |
|
|
|
лейкоз |
рофиброматоза I типа |
|
|
|
Синдром Реклин- |
Множественный нейрофиброматоз, отя |
NF1 |
|
17ql 1.12 |
гаузена |
гощенный риском возникновения рака |
|
|
|
|
желудка. Сопутствующие менингиомы |
|
|
|
Синдром ф о н |
Развитие множественных гемангиом с |
VHL |
|
3p25 |
Хиппеля—Линдау |
частым возникновением рака почек |
|
|
|
Синдром Бекви- |
Опухоль Вильмса часто в сочетании с |
WT1 |
|
l l p l 3 |
рабдомиосаркомой, гепатобластомой, |
|
|||
та—Видемана |
|
|
|
|
адренальными карциномами |
|
|
|
|
|
|
|
|
|
Наследственные |
Опухоль Вильмса (у детей), неоплазии |
WT1 |
|
H p l 3 |
урогенитального ряда |
|
|||
нефробластомы |
|
|
|
|
|
|
|
|
|
рака, так и на характер прогрессии за болевания.
Особого внимания в связи с этим заслуживает полиморфизм аллелей ге на c-Ha-ras, обусловленный числом тандемно-повторяющихся последова тельностей в 28 нуклеотидов, так на зываемой областью VNTR, находя щейся "правее" З'кодирующей области
гена. В 1985 г. Krontiris и соавт. иден тифицировали 20 полиморфных алле лей c-Ha-ras, из которых 4 определи ли как "общие" (95 % всех аллелей в популяции, частота встречаемости от 5 % для а4 до 65 % для al), а осталь ные отнесли к классу "редких". Впо следствии было открыто еще несколь ко редких аллелей. Частота встречае-
516
мости всех редких аллелей в кон |
развитие опухолей молочной железы у |
||||||||||||||||||||||
трольных группах из различных попу |
курящих женщин. |
|
|
|
|
|
|
|
|
|
|||||||||||||
ляций изменяется от 0,1 до 15 % (на |
Большое |
значение |
при |
исследова |
|||||||||||||||||||
территории |
России |
— |
в |
среднем |
нии полиморфизма генов и его ассо |
||||||||||||||||||
2,7 % ) . Было продемонстрировано 2— |
циации с развитием той или иной па |
||||||||||||||||||||||
5-кратное увеличение частоты редких |
тологии |
имеет |
популяционный |
|
фак |
||||||||||||||||||
аллелей в группах больных раком мо |
тор. Опубликованы данные, позво |
||||||||||||||||||||||
лочной железы, легкого, толстой киш |
ляющие объяснить повышенный риск |
||||||||||||||||||||||
ки, мозга, щитовидной железы, моче |
развития |
аденокарцином |
легкого |
у |
|||||||||||||||||||
вого пузыря и т. д. При более деталь |
чернокожего |
населения |
Америки |
на |
|||||||||||||||||||
ных исследованиях с учетом гистоло |
личием |
|
частого |
полиморфизма |
гена |
||||||||||||||||||
гической картины было показано, что |
CYP1A1 |
(Р4501А1), |
ответственного |
за |
|||||||||||||||||||
наличие редких аллелей скорее всего |
первый этап метаболизма полицикли |
||||||||||||||||||||||
является |
наследственным |
фактором |
ческих |
ароматических |
углеводородов, |
||||||||||||||||||
риска развития |
аденокарцином раз |
канцерогенных |
агентов табачного ды |
||||||||||||||||||||
личных локализаций. |
|
|
|
|
ма (см. раздел 4.1). Обнаружена ассо |
||||||||||||||||||
Важную |
роль |
при |
возникновении |
циация |
|
между |
наличием |
терминаль |
|||||||||||||||
некоторых |
|
гистологических |
|
типов |
ной мутации внутри данного гена и |
||||||||||||||||||
опухолей |
играют |
факторы |
внешней |
увеличением |
риска |
|
возникновения |
||||||||||||||||
среды, и их доминирующее влияние |
аденокарцином легкого даже при ми |
||||||||||||||||||||||
может маскировать участие в этом |
нимальном |
воздействии |
ПАУ. |
Кроме |
|||||||||||||||||||
процессе редких аллелей как наслед |
того, |
выявлено |
пятикратное |
увеличе |
|||||||||||||||||||
ственных факторов непрямого |
дейст |
ние частоты мутаций гена р53 у куря |
|||||||||||||||||||||
вия. Так, при сопоставлении поли |
щих больных раком легкого, имею |
||||||||||||||||||||||
морфизма c-Ha-ras в группах с раз |
щих |
такой |
|
полиморфный |
вариант |
||||||||||||||||||
личными |
гистологическими |
типами |
CYP1A1. |
|
Некоторые |
аллельные |
вари |
||||||||||||||||
рака легкого с учетом воздействия |
анты гена GSTM1 и Р1 при прочих |
||||||||||||||||||||||
канцерогенов |
табачного |
дыма |
было |
равных |
условиях также |
обеспечивают |
|||||||||||||||||
выявлено резкое (до 35 %) увеличение |
высокий риск развития рака легкого |
||||||||||||||||||||||
частоты встречаемости |
редких аллелей |
при |
высокой |
экспозиции |
канцероге |
||||||||||||||||||
у некурящих больных с аденокарци- |
нов в окружающей среде. |
|
|
|
|
|
|||||||||||||||||
номами легкого, что прямо указывает |
Известно, |
что |
специфические |
му |
|||||||||||||||||||
на важную роль данной генетической |
тации гена АРС (Adenomatous Polyposis |
||||||||||||||||||||||
детерминанты в возникновении имен |
Coli) (см. табл. 12.14) ассоциированы с |
||||||||||||||||||||||
но железистых опухолей. |
|
|
|
развитием |
наследственного |
аденома- |
|||||||||||||||||
Полиморфизм |
гена |
NAT2, |
гомолога |
тоза толстой кишки . Однако не толь |
|||||||||||||||||||
Ν-ацетилтрансферазы, участвующей в |
ко мутации' играют роль в развитии |
||||||||||||||||||||||
утилизации некоторых |
канцерогенов, |
онкопатологии. |
Ген |
АРС также |
поли |
||||||||||||||||||
также связан с риском развития опу |
морфен, и наличие в геноме одного из |
||||||||||||||||||||||
холей, спровоцированных |
канцероге |
вариантов, |
аллеля |
113 074, |
связывают |
||||||||||||||||||
нами табачного дыма и некоторыми |
с развитием колоректального рака у |
||||||||||||||||||||||
вариантами диеты. Некоторые редкие |
пациентов из семей евреев ашкенази. |
||||||||||||||||||||||
аллели ΝΑ Т2 кодируют |
полиморфный |
|
|
|
|
|
|
* * * |
|
|
|
|
|
|
|
|
|||||||
вариант Ν-ацетилтранеферазы, стиму |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
лирующий |
активность |
гетероцикличе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ских аминов. Предполагается, что ге |
Таким |
образом, |
определение |
таких |
|||||||||||||||||||
нотип NAT2, ассоциированный с вы |
особенностей |
структуры |
генома, |
как |
|||||||||||||||||||
сокой ацетилтрансферазной |
активно |
терминальные мутации генов-супрес |
|||||||||||||||||||||
стью, вдвое увеличивает риск возник |
соров |
и |
генов |
системы |
репарации |
||||||||||||||||||
новения Р М Ж (в постменопаузе — в 4 |
Д Н К и наследственный полиморфизм |
||||||||||||||||||||||
раза). Сочетание данного генотипа с |
некоторых |
онкогенов, |
|
имеет |
непо |
||||||||||||||||||
мутациями |
генов-супрессоров |
BRCA1 |
средственное отношение к формиро |
||||||||||||||||||||
и BRCA2 в |
30 |
% |
случаев провоцирует |
ванию |
групп |
онкологического |
риска |
||||||||||||||||
517
как в семьях с отягощенной наследст венностью, так и в популяциях здоро вых индивидуумов.
Выявление патогенных терминаль ных мутаций позволяет не только пре дупреждать рождение больных детей, но и проводить досимптоматическую диагностику, что особенно важно при онкологических заболеваниях, успех борьбы с которыми зависит от сроков начала лечения или внедрения профи лактических мероприятий. Следует отметить, что опухолевые заболевания пациентов из групп с отягощенной онкологической наследственностью отличаются меньшей агрессивностью и более благоприятным прогнозом, что имеет значение при выборе лечеб ной тактики.
12.2.2.Досимптоматическая
диагностика опухолей с использованием
молекулярно-генетического тестирования онкогенов
иантионкогенов
Одной из характерных особенно стей опухолевых клеток является так называемая нестабильность генома. Это понятие определяет появление многочисленных соматических изме нений генов, число которых прогрес сивно нарастает в процессе роста опу холи. К ним относятся точковые мута ции, микро- и макроделеции и пере стройки различных хромосомных локусов, появление химерных генов (и как следствие аномальных белков) и т. д. Некоторые изменения, скорее всего ассоциированные с трансформа цией клеток или приобретением ими злокачественного потенциала, появ ляются на самых ранних этапах опу холевого роста и могут служить осно вой для создания диагностических тестов. Не только структурные повре ждения генов, но и изменения в эпи генетической регуляции их экспрес сии, в частности гиперметилирование CpG островков промоторов или экзонов, могут служить маркерами ранних стадий опухолевого роста (см. раздел
3.6). Метилирование классических и
потенциальных генов-супрессоров [р16INK4А, O6метилгуанин-ДНК-метил-
трансфераза (MGMT), RARbeta, DAPK, p194RF, FHIT и глутатион-трансфераза PI (GSTP1)], а также генов-модулято ров опухолевого роста (TIMP3 или кадхерин Е) является ранним и час тым событием при опухолевой транс формации. Молекулярно-биологиче- ские исследования являются весьма перспективными, так как открывают новую стратегию скрининга всех диспластических поражений или добро качественных новообразований с це лью выделения групп с высоким рис ком малигнизации.
12.2.2.1. Мутации генов
При различных видах неоплазий идентифицируются точечные мута ции генов. Среди них доминируют мутации генов семейства ras, р53, erbB2-neu и Rb. В большинстве форм спорадических опухолей на различ ных стадиях их развития, включая гиперпластические и пренеопластические, часто обнаруживаются сома тические альтерации р53, а также ге нов системы репарации Д Н К (MSH2, MLH1, PMS1, ΡMS2), однако резуль таты использования таких данных в целях досимптоматической диагно стики конкретных опухолей довольно противоречивы. Тем не менее сома тические точечные мутации этих ге нов, в первую очередь р53, свидетель ствуют о нестабильности генома и высоком риске трансформации кле ток в целом, что свидетельствует в пользу обоснованности скрининга мутаций для целей ранней диагно стики.
Мутации генов семейства ras. Ак тивность наиболее известных генов семейства ras (Ha-ras, K-ras и N-ras)
подробно исследована как на первич ном опухолевом материале, так и в соответствующих культурах клеток. Наряду с генами туc гены ras отно сятся к наиболее часто экспрессируемым протоонкогенам, однако уровень
518
экспрессии этой группы генов в про цессах трансформации не является определяющим. Истинное значение данных генов в канцерогенезе выяви лось после обнаружения специфиче ских точковых мутаций в их структу ре, которые превращают нормальные клеточные гены в активированные онкогены.
В Д Н К из опухолей различных ло кализаций точковые мутации генов семейства ras обнаруживаются пре имущественно в аденокарциномах (30—67 % ) , причем более 30 % всех мутаций — в кодоне 12 гена K-ras. Вероятными индукторами мутаций ras-генов являются мутагенные ком поненты табачного дыма. Продемон стрирована определенная связь меж ду наличием мутантного K-ras в клет ках опухоли и привычкой к курению табака у пациентов с аденокарциномами легкого. Высокая частота то чечных мутаций с-K-ras обнаружена в железистых опухолях других лока лизаций: экзокринной части подже лудочной железы (более 90 % опухо лей), толстой к и ш к и (преимущест венно ободочной), щитовидной же лезы (до 50 % случаев), а также при миелодиспластическом синдроме. В опухолях, позитивных в отношении данной мутации, в большинстве слу чаев наблюдаются также мутации ге- на-супрессора р53, что, с одной сто роны, может служить индикатором недостаточной эффективности фер ментов, нейтрализующих действие канцерогенов, с другой — отражать дефицитность системы репарации
Д Н К .
Возможно, активированный K-ras эффективно влияет на трансформа цию в клетках, которые дифференци ровались в секреторный тип. В то же время мутация K-ras в эпителиальных клетках может, вероятно, сама являть ся одним из факторов дифференци ровки в секреторные клетки, более уязвимые по отношению к трансфор мирующим агентам. Кроме того, ак тивированный K-ras вовлечен в регу ляцию экспрессии некоторых интег-
ринов, контролирующих клеточную пролиферацию и миграцию. Мутантный K-ras снижает экспрессию рецеп торов альфа-1 -бета-1 -коллагена/лами- нина и альфа-5-бета-1-фибронектина, принимающих участие в поддержании нетрансформированного фенотипа клеток.
Создание современных методик детекции мутаций в гене K-ras было в значительной степени облегчено тем фактом, что подавляющее большин ство их локализуется в 12-м кодоне данного гена. Использование этих методов позволяет выявлять 1 мутантный аллель данного гена в при сутствии 10 000 аллелей дикого типа (чувствительность метода 10-4). Это делает возможным выявление мута ций в гене K-ras в гистологически нормальной ткани и биологических образцах обследованных пациентов. Восьмилетний мониторинг пациен тов с различной патологией органов дыхания показал, что наличие мута
ции |
K-ras в образцах Д Н К из мокро |
ты, |
бронхоальвеолярного лаважа или |
браш-биопсий свидетельствует о на чале развития неопластического по ражения в легких. Подобные иссле дования Д Н К из кишечного секрета или стула пациентов с язвенными и воспалительными заболеваниями нижних отделов желудочно-кишеч ного тракта обнаружили сходную картину. Таким образом, существует возможность очень раннего выявле ния опухолевого процесса на первич ных и профилактических этапах об следования населения.
Мутации гена RET. Онкоген RET
(Re-arranged during Transfection), лока лизованный на длинном плече хромо сомы 10 (10q11.2), является онкоге ном, специфически ассоциированным с развитием опухолевой патологии щитовидной железы. Миссенс-мута- ции в одном из 5 цистеиновых кодонов экзонов 10 и 11 гена RET иденти фицированы более чем в 95 % семей, отягощенных наследственным син дромом множественных опухолей эн докринного происхождения типа 2
519
( M EN 2), и в 75 % семей с наследст |
12.2.2.2. Специфические |
|
||||||||||||||||
венным |
медуллярным |
раком |
|
щито |
делеций |
|
|
|
|
|
|
|||||||
видной железы (FMTC). Существует |
|
|
|
|
|
|
|
|
||||||||||
довольно |
строгая |
корреляция |
между |
Хромосомные |
аномалии на |
корот |
||||||||||||
различными мутациями гена RET и |
ком плече хромосомы 3 (Зр). Впервые |
|||||||||||||||||
фенотипическими |
|
проявлениями |
утрата в этой области была зафикси |
|||||||||||||||
M E N 2, а также возникновением спо |
рована при кариотипическом |
анализе |
||||||||||||||||
радических |
медуллярных |
карцином |
как клинического |
материала опухолей |
||||||||||||||
щитовидной железы. Мутации в кодо- |
легких, так и в клетках, культивируе |
|||||||||||||||||
нах 768 и 804 |
обнаруживаются |
только |
мых in vitro. Разработка более точных |
|||||||||||||||
у пациентов |
с |
F M T C , |
тогда |
как |
для |
молекулярно-биологических |
подхо |
|||||||||||
индивидуумов с синдромом M E N 2В |
дов позволила установить, что деле |
|||||||||||||||||
характерны |
мутации |
кодона |
|
918, |
ций на Зр наблюдаются в 100 % слу |
|||||||||||||
встречающиеся также в случаях спо |
чаев |
мелкоклеточного |
рака легкого и |
|||||||||||||||
радических |
медуллярных |
карцином. |
в 60—65 % случаев немелкоклеточно- |
|||||||||||||||
Наличие |
феохромоцитом и |
гиперпла |
го рака. Потеря гетерозиготности в |
|||||||||||||||
зии паращитовидных желез у пациен |
зоне Зр была обнаружена и у ряда па |
|||||||||||||||||
тов из |
группы |
M E N 2А ассоциирова |
циентов с преинвазивными поврежде |
|||||||||||||||
но с мутациями кодона 634 (экзон |
11), |
ниями бронхов. |
|
|
|
|
|
|||||||||||
ни разу не выявленными в семьях с |
В настоящее время идентифициро |
|||||||||||||||||
FMTC . Ассоциация определенных му |
ваны участки, |
специфично утрачивае |
||||||||||||||||
таций |
с |
различными биохимическими |
мые при раке легкого и ряде других |
|||||||||||||||
изменениями |
белкового продукта гена |
онкозаболеваний — 3р14, 3р21 и 3р25. |
||||||||||||||||
(повышением |
тирозинкиназной |
ак |
На коротком плече хромосомы 3 |
|||||||||||||||
тивности, способности к аутофосфо- |
идентифицировано более 45 генов, 25 |
|||||||||||||||||
рилированию, |
изменением |
субстрат |
из которых локализовано в области |
|||||||||||||||
ной специфичности и т. п.), по-види |
3р21.3. Данная область размером 630- |
|||||||||||||||||
мому, |
влияет |
на |
развитие |
|
разных |
kb является одним из самых генона- |
||||||||||||
форм |
патологии. |
|
|
|
|
|
|
сыщенных участков генома и интен |
||||||||||
При ДНК-диагностике членов се |
сивно исследуется. |
|
|
|
|
|||||||||||||
мей с родословной, отягощенной в |
О значении делеций в этой области |
|||||||||||||||||
отношении |
множественных |
|
эндок |
генома на ранних стадиях канцероге |
||||||||||||||
ринных неоплазий, показано, что на |
неза свидетельствуют данные об ано |
|||||||||||||||||
личие |
специфической |
точковой мута |
малиях Зр, выявленных в клетках из |
|||||||||||||||
ции в гене RET у 2 индивидуумов без |
зон |
пренеопластических |
поражений |
|||||||||||||||
клинических |
|
проявлений |
патологии |
легких. Какой-либо из локусов корот |
||||||||||||||
было ассоциировано с началом разви |
кого плеча поврежден в 57 % гипер |
|||||||||||||||||
тия опухолевого процесса в превен |
плазии эпителия бронхов, в 53 % дис- |
|||||||||||||||||
тивно |
удаленной щитовидной |
железе. |
плазий и в 90 % карцином in situ. Дру |
|||||||||||||||
Факт |
досимптоматического |
выявле |
гими |
словами, |
потеря |
генетического |
||||||||||||
ния неопластического поражения щи |
материала на коротком плече хромо |
|||||||||||||||||
товидной железы у пациентов из груп |
сомы 3 может быть фиксирована до |
|||||||||||||||||
пы риска является ярким примером |
проявления |
клинически |
диагности |
|||||||||||||||
использования |
фундаментальных |
ге |
руемого рака легкого, и в цитологиче |
|||||||||||||||
нетических |
исследований |
в |
|
повсе |
ски |
верифицированных |
диспластиче- |
|||||||||||
дневной |
онкологической практике и |
ских клетках ее можно расценивать |
||||||||||||||||
указанием на организацию эффектив |
как |
неблагоприятный |
фактор |
разви |
||||||||||||||
ной помощи, необходимой при син |
тия рака у данного пациента. |
|
||||||||||||||||
дроме |
M E N 2А. |
|
|
|
|
|
|
Таким образом, |
исследования де |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
Подобные |
|
исследования |
служат и |
леций 3р очень перспективны в плане |
||||||||||||||
для разработки терапевтических |
под |
обследования |
больных |
с |
хронически |
|||||||||||||
ходов по отношению к пациентам — |
ми или обструктивными заболевания |
|||||||||||||||||
носителям мутаций |
в гене RET. |
|
|
ми легких. |
|
|
|
|
|
|
||||||||
520
Делеций хромосомы 5. На длинном |
тест может иметь скрининговое значе |
||||||||||||||
плече хромосомы 5 в зоне 21q локали |
ние при оценке риска малигнизации |
||||||||||||||
зован кластер генов, включающий ге- |
аденом толстой кишки при синдроме |
||||||||||||||
ны-супрессоры АРС и МСС. Оба этих |
Линча I типа. |
|
|
|
|
|
|||||||||
гена участвуют в индукции различных |
|
|
|
|
|
|
|
||||||||
типов колоректального рака, так как |
12.2.2.3. Экспрессия генов |
||||||||||||||
инактивируются на самых ранних ста |
|
|
|
|
|
|
|
||||||||
диях заболевания. У подавляющего |
В качестве примера использования |
||||||||||||||
большинства |
пациентов |
с |
наследст |
определения экспрессии генов для це |
|||||||||||
венным |
аденоматозом толстой |
кишки |
лей ранней диагностики следует упо |
||||||||||||
и их прямых родственников обнару |
мянуть ген-супрессор WT1. |
|
|
||||||||||||
живается |
наследственно |
закреплен |
WT1 был клонирован в 1990 г. при |
||||||||||||
ный дефект |
в проксимальной |
части |
изучении |
дифференцировки |
клеток |
||||||||||
15-го экзона гена АРС в виде корот |
урогенитальных |
органов |
и |
является |
|||||||||||
кой делеций или вставки. Данное тер |
классическим примером гена-супрес- |
||||||||||||||
минальное |
нарушение может служить |
сора при развитии нефробластом у де |
|||||||||||||
прямым указанием на скорое развитие |
тей (опухоль Вильмса). Ген |
WT1 (так |
|||||||||||||
болезни у клинически здоровых чле |
же как EGR1) принадлежит к группе |
||||||||||||||
нов семьи, что позволяет принять ряд |
так называемых |
генов раннего |
ответа |
||||||||||||
превентивных мер. Показано, что и в |
и активируется в ответ на стимулы, |
||||||||||||||
35 % спорадических аденом толстой |
индуцирующие |
клеточную |
|
пролифе |
|||||||||||
кишки |
обнаруживаются |
|
соматиче |
рацию. |
|
|
|
|
|
|
|||||
ские делеций данного локуса, и имен |
При исследованиях различных ви |
||||||||||||||
но эти аденомы имеют тенденцию к |
дов неоплазий была обнаружена высо |
||||||||||||||
малигнизации. С клинической точки |
кая экспрессия |
WT1 дикого типа в не |
|||||||||||||
зрения |
идентификацию |
генетических |
которых |
активно |
пролиферирующих |
||||||||||
нарушений в зоне 5q21 в клетках, по |
линиях клеток мезотелия и при лей |
||||||||||||||
лученных при биопсии |
доброкачест |
козах, хотя механизм действия |
WT1 в |
||||||||||||
венных |
полипов, следует |
расценивать |
провокации роста клеток миелоидно- |
||||||||||||
как показание к их срочному удале |
го ряда не до конца ясен, однако не |
||||||||||||||
нию. |
|
|
|
|
|
|
|
|
которые |
особенности |
экспрессии |
||||
TGF-бетаRII — |
рецептор |
II |
типа |
м Р Н К и |
белка |
WT1 дают |
|
основания |
|||||||
трансформирующего |
фактора |
роста β |
использовать его в целях диагностики. |
||||||||||||
(TGF-β). Через него |
T G F - β |
активиру |
Продукт данного гена |
экспресси |
|||||||||||
ет внутриклеточный |
каскад, |
останав |
руется в нормальных клетках костного |
||||||||||||
ливающий |
пролиферацию во |
многих |
мозга, преимущественно в CD34+- |
||||||||||||
типах эпителия. В гене рецептора на |
предшественниках. |
Наибольший уро |
|||||||||||||
ходится несколько кодирующих поли |
вень WT1 обнаруживается в CD43+ / |
||||||||||||||
(А)10 последовательностей, |
|
частота |
CD33-/lin |
-, которые скорее всего от |
|||||||||||
микроделеций которых при раках тол |
носятся к группе очень ранних пред |
||||||||||||||
стой кишки, |
характеризующихся по |
шественников. |
В |
предшественниках |
|||||||||||
вышенным |
|
уровнем |
микросателлит- |
CD33+, представляющих собой более |
|||||||||||
ной нестабильности (RER+ фенотип), |
позднюю |
стадию |
дифференцировки, |
||||||||||||
составляет |
-70 %. |
|
Делеций |
поли-А |
наблюдается 100-кратное снижение |
||||||||||
трактов приводят к синтезу аберрант |
экспрессии этого белка. |
|
|
|
|||||||||||
ного пептида, не способного к пере |
В то время как в норме WT1-белок |
||||||||||||||
даче сигнала внутрь клетки. Предпо |
обнаруживается |
в |
клетках |
костного |
|||||||||||
лагается, что микроделеций гена TGF- |
мозга, его присутствие в плазме пери |
||||||||||||||
бетаRII происходят на ранних этапах |
ферической крови |
считается отчетли |
|||||||||||||
канцерогенеза и могут влиять на сни |
вым фактором патологии и свидетель |
||||||||||||||
жение |
дифференцировки |
клеток ки |
ствует о присутствии бластных клеток. |
||||||||||||
шечных аденокарцином. Подобно оп |
Экспрессия WT1 м Р Н К определяется |
||||||||||||||
ределению |
|
мутаций |
K-ras, |
данный |
более чем в 80 % случаев острого мие- |
||||||||||
521
лоидного лейкоза. Исследования WT1 при помощи обратной П Ц Р (см. раз дел 12.6) обнаруживают минимальное количество бластных клеток у пациен тов с острым лейкозом, что может служить более чувствительным тес том, чем диагностическое определе ние продукта слитных генов, таких как PML-RARальфа, наблюдаемого при остром промиелоцитарном лейкозе.
12.2.3.Молекулярно-
генетические исследования в дифференциальной диагностике
С целью идентификации специфи ческих аномалий анализировалось ог ромное число различных опухолей, и, несмотря на то что ни для одного за болевания не было найдено гена, од нозначно ответственного за инициа цию или супрессию злокачественного роста, при некоторых опухолевых за болеваниях обозначились уязвимые участки генома, нарушения которых носят тканеспецифический характер и могут быть использованы в качестве тестов для подтверждения клиниче ского диагноза. Основой для создания молекулярно-генетических маркеров дифференциального диагноза в онко логии служат данные о превалирова нии тех или иных путей передачи сиг нала и изменении активности опреде ленных генов при морфологической дифференцировке клеток и тканей. Как правило, это связано с домини рующим в определенных опухолевых тканях изменением экспрессии неко торых онкогенов и утратой активно сти конкретных генов-супрессоров. Специфические точковые мутации также могут являться маркерами для диагностических тестов.
12.2.3.1. Гены регуляции клеточного цикла
Одним из наиболее интересных примеров нарушений на определен ных этапах регуляции клеточной про лиферации в опухолях различной гис
тологической структуры являются из менения генов, участвующих в кон троле клеточного цикла. Такие изме нения, опосредованные одним из ге нов-супрессоров (р53, Rb и т. п.), мо гут быть ассоциированы с развитием определенного типа онкопатологии и не влиять на развитие сходных про цессов, связанных с нарушением ра боты других генов, также контроли рующих клеточное деление.
Основным "двигателем" клеточного цикла являются циклинзависимые киназы (cyclin dependent kinases — CDK), для проявления активности ко торых требуется образование ком плекса с молекулой одного из циклинов (А, В, Е, С или D). Прохождение точки рестрикции и вхождение в S- фазу контролируется CDK, которые последовательно регулируются циклинами и непосредственно определяют функцию белка гена ретинобластомы (RB) путем его фосфорилирования. Существует группа генов CDKI (сус- lin-dependent kinase inhibitor) или INK (inhibitor of kinase), в свою очередь ингибирующих действие таких киназ и влияющих, таким образом, на ско рость и порядок прохождения фаз де ления клеток. Правильность прохож дения клеточного цикла в ряде кон трольных точек контролирует белок р53 (см. раздел 3.2).
Состояние основных участников регуляции клеточного цикла подробно исследовано при различных типах ра ка легкого. Было показано, что отсут ствие Rb или наличие его мутантной формы более типично для опухолей и опухолевых клеточных линий, полу ченных от пациентов с МРЛ, чем от пациентов с НМРЛ . В 20 % случаев обнаруживаются делеций или пере стройки в локусе гена Rb, в 55 % слу чаев наблюдается отсутствие или уменьшение экспрессии м - РНК; в 80 % изученных случаев МРЛ и опу холевых клеточных линий, получен ных от пациентов с МРЛ, наблюдает ся полное отсутствие белка Rb. Сход ные изменения при Н М Р Л наблюда ются значительно реже (в 3, 10 и 24 %
522
случаев соответственно). В 1995 г. тре мя независимыми группами авторов было показано, что делеций и потеря экспрессии генов р15ΙΝΚ4 и р16ІΝΚ4 — ингибиторов CDK - 4 — ассоциирова ны только с прогрессией немелкоклеточного рака легкого и крайне редко наблюдаются в клетках МРЛ. Потеря
гетерозиготности |
(LOH) |
участка |
|
12р13, |
содержащего |
еще |
один ген |
INK, |
ρ27Кір1, является характерной |
||
чертой при крупноклеточном РЛ, вхо дящем в группу НМРЛ .
Различия в генетических характе ристиках МРЛ и Н М Р Л нашли под тверждение в работе по исследованию pl6INK4 в различных типах эпителиаль ных клеток; было показано, что фосфорилирование белка Rb посредством инактивации ингибиторов C D K — яв ление, характерное для клеток плос кого эпителия, а именно плоскокле точный рак и составляет большинство в исследованных группах НМРЛ .
Становится ясно, что изменения регуляции клеточного цикла при раз витии различных типов рака легкого происходят на разных этапах. В случае мелкоклеточного рака наблюдаются непосредственные структурные нару шения гена Rb, тогда как при немелкоклеточном раке происходит угнете ние его функции, опосредованное по терей ингибиторов циклинзависимых киназ.
Изменения структуры и функции генов, контролирующих клеточный цикл, с большой частотой фиксиру ются также и при первичных лейкозах и лимфомах. В 30 % случаев острого миелоидного лейкоза, главным обра зом М4 или М5, обнаружено значи тельное уменьшение или полное от сутствие экспрессии белка RB. Частые делеций области 9р21, содержащей
кодирующие последовательности ге нов p16ІNK4 и ARF (еще один ген-су-
прессор, контролирующий клеточ ный цикл), характерны для Т- и В- клеточных острых лимфобластных
лейкозов. Недавно получены данные, что гиперметилирование p15ІNK4B явля
ется характерной чертой только у па
циентов с острым миелолейкозом, развившимся на фоне paroxysmal noc turnal hemoglobinuria. Все эти измене ния очень редко наблюдаются при миелодиспластическом синдроме или хроническом миеломоноцитарном лейкозе и могут служить фактором дифференциальной диагностики.
Таким образом, становится ясно, что изменение регуляции клеточного цикла при развитии различных типов солидных опухолей или гемобластозов происходит на разных этапах, и, зна чит, способы снижения пролиферативной активности данных опухолей должны иметь различные мишени.
12.2.3.2.Экспрессия онкогенов
игенов-супрессоров
как фактор дифференцировки клеток
В качестве морфогенетических маркеров различной степени диффе ренцировки опухолевой ткани наибо лее перспективным представляется использование результатов определе ния уровня экспрессии некоторых ге нов.
Ген WAF1, кодирующий белок р21, является еще одним представителем класса ингибиторов циклинзависимых киназ. р53 индуцирует р21, обеспечи вая его дальнейшее связывание с CDK-комплексами, что приводит к уменьшению их активности. Актива ция р21 может быть вызвана как су перэкспрессией р53, так и митогенами, агентами, индуцирующими диф - ференцировку или ведущими к угне тению роста клеток путем нарушения структуры Д Н К .
В опухолевых клетках уровень экс прессии р21 достаточно низок. Супер экспрессия р21 наблюдается, как пра вило, только в высокодифференцированных опухолях или в фокусах кле ток с ярко выраженной дифференцировкой в случае умеренно дифферен цированных опухолей. Таким обра зом, уровень экспрессии данного бел ка может быть использован при морфометрических исследованиях.
523
Онкоген c-fos. Исследования белка гена c-fos, одного из ядерных онкоге нов, кодирующих факторы транс крипции Д Н К , при хронических не специфических заболеваниях, предра ковых изменениях и некоторых гистотипах рака показали, что повышение его активности коррелирует с высо ким уровнем дифференцировки опу холевых клеток, а также ранними эта пами опухолевой прогрессии. Данный белок активируется на ранних этапах канцерогенеза, усиливая пролифера цию клеток и воздействуя на опреде ленные этапы их дифференцировки.
Онкоген src. Было установлено, что белок src, редко определяемый в боль шинстве человеческих опухолей, ак тивно экспрессируется в культурах кле ток мелкоклеточного рака легкого и в меньшей степени — в клетках других морфологических типов РЛ. По-види мому, тирозинспецифичная киназная активность этого гена связана с нейроэндокринной природой клеток МРЛ, о чем свидетельствует факт специфич ной экспрессии c-src в дифференци рующихся нервных клетках. Экспрес сия c-src, по-видимому, связана с низ кой дифференцировкой опухолей и может служить показателем плохого прогноза (см. раздел 11.2.4).
Ген EGR1. Было отмечено, что в бипотенциальных культурах клетокпредшественников миелоидного ряда этот ген напрямую регулирует дифференцировку моноцитов, но не гранулоцитов. Исследования суперэкспрессии и эксперименты по введению антисмысловых последовательностей EGR1 окончательно определили его роль как индуктора дифференцировки моноци тов. Данные по нокауту данного гена (knock-out — прямое выключение) по казали возможность компенсации его функций другими генами семейства EGR или частично геном WT1.
12.2.3.3. Мутации генов
Ген р53. Репертуар точечных мута ций и их положение внутри гена варь ируют в опухолях различной локали-
зации. При колоректальных раках, опухолях мозга и лимфобластозах преобладают транзиции, для опухолей легкого и печени более характерны трансверсии G - C -» Т-А. Трансверсии G -> С часто наблюдаются в клетках опухолей молочной железы, легкого и пищевода, причем в последних обна руживаются также и замены А -» Т, очень редко встречающиеся в других опухолях. Интересно, что спектр нуклеотидных замен в гене р53, обнару живаемых при различных гистологи ческих типах рака легкого, также раз личается. В 75 % случаев плоскокле точного РЛ были обнаружены замены G -> Т. Этот тип точечных мутаций нехарактерен для всех других опухо лей человека, где чаще встречаются трансверсии G -» А. Предполагается, что замены G-T ассоциированы с му тагенным воздействием бенз(а)пирена, содержащегося в табачном дыме, тогда как для других агентов типичны другие варианты точечных мутаций. Принято считать, что в опухолях че ловека наиболее часто мутируют кодоны 247-249.
В инвазивных опухолях молочной железы наличие мутаций р53 коррели рует с низким уровнем дифференци ровки и высоким пролиферативным индексом клеток. Эти показатели час то сопровождаются делециями в зоне локализации гена c-met — тирозинкиназного рецептора клеточной поверх ности для фактора роста гепатоцитов.
12.2.4. Генетичесиие альтерации как факторы прогнозирования течения опухолевого процесса
Практически все механизмы каче ственного и количественного измене ния онкогенов и генов-супрессоров, описанные для различных опухолей человека, имеют отношение к пробле ме прогрессирования опухоли. Роли онкогенов и опухолевых супрессоров в контроле скорости роста первичного опухолевого узла, приобретении спо собности к метастазированию, неоан-
524

гиогенезе и возникновении резидуаль |
отдельных |
прогностических |
маркеров |
|||||||||||||||
ной болезни посвящено огромное ко |
не всегда отличаются высокой досто |
|||||||||||||||||
личество |
работ. |
|
|
|
|
|
верностью. Для усиления достовер |
|||||||||||
Наиболее |
значимым |
фактором |
ности прогноза молекулярно-биоло- |
|||||||||||||||
прогрессии |
опухолевого |
роста |
явля |
гические исследования в этой облас |
||||||||||||||
ется |
усиление |
|
общей |
генетической |
ти в настоящий момент выходят на |
|||||||||||||
нестабильности, |
облегчающей |
появ |
уровень |
определения |
комплекса |
неза |
||||||||||||
ление |
дополнительных |
признаков, |
висимых параметров. |
Одновременное |
||||||||||||||
необходимых |
для |
метастазирования |
определение |
группы |
|
генетических |
||||||||||||
и, в частности, аберрации тех генов, |
маркеров, характеризующих |
различ |
||||||||||||||||
изменение |
активности |
которых |
при |
ные уровни нестабильности генома и |
||||||||||||||
водит к возникновению сразу не |
связанных с клинико-патоморфоло- |
|||||||||||||||||
скольких |
компонентов |
метастатиче |
гическими |
параметрами |
быстрой |
|||||||||||||
ского фенотипа, например р53, ras и |
опухолевой |
прогрессии, |
вплотную |
|||||||||||||||
src. Генетические характеристики, ас |
приближают возможность прогности |
|||||||||||||||||
социированные с различиями в гис |
ческого |
тестирования |
|
каждого |
кон |
|||||||||||||
тологии, |
степени |
дифференцировки |
кретного пациента. Выявление ком |
|||||||||||||||
и анаплазии клеток, |
инвазивностью |
плекса детерминант, |
|
определяющих |
||||||||||||||
опухоли, |
|
уровнем |
метастатического |
достоверный |
индивидуальный |
про |
||||||||||||
поражения организма, риском ранне |
гноз, особенно важно для наиболее |
|||||||||||||||||
го рецидива, могут считаться марке |
распространенных |
и |
неблагоприятно |
|||||||||||||||
рами |
прогрессии |
опухолевого |
роста. |
текущих форм рака. |
|
|
|
|
||||||||||
К ним относятся плоидность хромо |
Ниже приводятся данные о про |
|||||||||||||||||
сом, |
аллельный |
полиморфизм |
генов, |
гностическом |
значении |
отдельных ге |
||||||||||||
структурные |
нарушения |
отдельных |
нетических маркеров и их комбина |
|||||||||||||||
хромосомных и генных локусов, то |
ций |
для |
некоторых |
онкологических |
||||||||||||||
чечные мутации, усиление или поте |
заболеваний (табл. 12.15) и примеры |
|||||||||||||||||
ря продукции белков. Следует под |
их |
использования |
в |
клинической |
||||||||||||||
черкнуть, |
|
что |
|
результаты изучения |
практике. |
|
|
|
|
|
|
|||||||
Т а б л и ц а 12.15. Молекулярные характеристики как возможные факторы прогноза при
некоторых онкологических заболеваниях
|
|
Ассоции |
|
|
|
|
|
|
Тип опухоли |
рованный |
Обнаруживаемые |
из |
Прогностическое значение |
||||
ген или |
||||||||
менения |
|
|||||||
|
|
хромосом |
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
ный локус |
|
|
|
|
|
|
|
|
|
|
|
||||
Немелкокле- |
WAF1 |
Суперэкспрессия |
|
Наблюдается в в/д опухолях, тест хо |
||||
точный |
рак |
|
|
|
|
рошего |
прогноза |
|
легкого |
|
р27Kip1 |
Низкий |
уровень |
бел |
Коррелирует с плохим прогнозом |
||
|
|
|
ка |
|
|
Коррелирует с риском развития ме |
||
|
|
L-myc |
Наличие |
аллеля |
S |
|||
|
|
|
|
|
|
тастазов |
|
|
Плоскокле |
c-src |
Высокая |
экспрессия |
Коррелирует с развитием метастати |
||||
точный |
рак |
|
|
|
|
ческих поражений и низкой диффе - |
||
легкого |
|
|
|
|
|
ренцировкой опухолей. Показатель |
||
|
|
|
|
|
|
плохого |
прогноза |
|
Острый |
мие- |
WT1 |
Повышенная экс |
Фактор |
плохого прогноза |
|||
лоидный лей |
|
прессия |
|
|
Возникновение дисплазий и плохой |
|||
коз |
|
EVI1 |
Реаранжировки локу- |
|||||
|
|
(3q21-26) |
са |
|
|
прогноз |
|
|
|
|
|
|
|
|
|
|
|
525

Тип опухоли
Диффузная В-клеточная лимфома Рак молоч ной железы
Рак молоч ной железы
Ассоции
рованный ген или хромосом ный локус
BCL6 и c-MYC BCL2 ERBB2/
с-туc
c-Ha-ras
р53
L-myc
17q и 18q
Длинное плечо 17 хромосо мы
Обнаруживаемые из менения
Реаранжировки он когенов
Амплификация гена. Суперэкспрессия м Р Н К и белка
Амплификация гена. Суперэкспрессия Структурные пере стройки (амплифика ция гена, реаранжи ровки и делеций) Мутации
наличие аллеля S в гомозиготном состоя нии (генотип SS) Одновременная поте ря генетического ма териала Делеций
BRCA1 Мутации (17ql2-21)
Уменьшение экс прессии
Рак яичников Кластер Делеций генов в зоне 11р15
Рак толстой |
BRCA1 |
Делеций |
|
кишки |
|
|
|
|
5q21 |
Делеций |
|
|
bс12н |
Делеций |
|
|
DCC |
|
|
Рак поджелу |
INK4a |
Уменьшение или от |
|
дочной желе |
(9p21) |
сутствие |
экспрессии, |
зы |
|
делеций |
локуса |
Солидные |
WAF1 |
Повышение экспрес |
|
опухоли |
|
сии |
|
Гемобластозы |
MYB |
30—60-кратная ам |
|
|
|
плификация |
|
Продолжение
Прогностическое значение
Признак прогрессии заболевания. Отрицательная динамика при химио терапии Строго коррелирует с рецидивами
болезни, низкими показателями вы живаемости, неэффективностью ра дио- и гормонотерапии, уровнем от вета на химиопрепараты Ухудшение краткосрочного прогноза. Фактор плохого прогноза
Связаны со стадийностью и коррели руют с негативной гормональной ре гуляцией роста опухоли и развитием отдаленных метастазов Коррелируют со снижением количе ства рецепторов эстрогенов и поте рей гормо.нозависимости
Строго коррелирует с риском разви тия легочных метастазов
Отмечается при более агрессивных формах, при этом повышается риск развития рака толстой кишки В сочетании с определенным функ
циональным статусом гормональных рецепторов могут быть индикатором потери чувствительности к гормоно терапии Ограничения в применении химиоп-
репаратов, в частности тамоксифена Отмечается при прогрессии
Ассоциированы с развитием низкодифференцированных опухолей и плохим прогнозом Наблюдаются в более злокачествен
ных опухолях. Коррелируют с позд ними стадиями заболевания Коррелируют с агрессивностью опу холи
Фактор плохого прогноза
Связано с инициацией прогрессии
Уменьшение сроков ремиссии
Генерализация процесса
526
12.2.4.1. Полиморфизм онкогенов
Полиморфизм Ha-ras уже упоми нался выше в связи с ассоциацией ме жду наличием редких аллелей и рис ком возникновения аденокарцином. При исследовании частоты распреде ления общих аллелей c-Ha-ras у онко логических больных были получены данные, свидетельствующие о связи аллеля а4 с повышенным риском бы строго прогрессирования некоторых форм рака, в частности немелкоклеточного рака легкого. Было показано, что в группах больных с низкодифференцированными формами рака и/ или с метастазами в регионарные лимфатические узлы наблюдается достоверное двух-четырехкратное уве личение частоты встречаемости алле ля а4 гена c-Ha-ras (14 % в группе плоскоклеточных раков, 22 % в груп пе аденокарцином против 5 % в здо ровой популяции).
Ассоциация развития низкодифференцированных и/или активно метастазирующих опухолей с наличием в геноме больных НМРЛ аллеля а4 гена c-Ha-ras может определяться тем, что а4 имеет самую большую область ва риабельных нуклеотидных тандемных повторов (VNTR). Эксперименталь ные исследования позволяют предпо лагать, что увеличение числа таких повторов может играть регуляторную роль в функционировании гена c-Ha- ras, которому отводится важное место в процессе канцерогенеза.
Другим онкогеном, наследствен ный полиморфизм которого имеет значение при профессии рака легко го, является ген L-myc — представи тель семейства ядерных генов — фак торов транскрипции. Существование двух аллелей гена L (long) и S (short) обусловлено точечной терминальной мутацией, и три вида генотипа по гену L-myc LL, LS и SS. Наличие в геноме S-аллеля ассоциировано с быстрой прогрессией и процессами диссеминации опухоли. Кроме того, для некото рых других локализаций рака, харак
теризующихся частым метастазированием в легкие (остеосаркома, рак мо лочной железы, гипернефрома), нали чие аллеля S в гомозиготном состоя нии (генотип SS) строго коррелирует с риском развития легочных метастазов.
Сочетание в геноме больного не благоприятных наследуемых аллелей генов L-myc и Ha-ras определяет уси ление риска метастазирования у таких пациентов.
12.2.4.2. Мутации генов
Гены семейства ras. По мнению большинства исследователей, наличие мутаций генов ras скорее всего связа но с процессом трансформации кле ток, но не влияет на пролиферацию и способность клеток к метастазированию. Гистологически и биохимически аденокарциномы, характеризующие ся наличием мутаций ras, не отлича ются от остальных, однако нельзя от рицать прогностического значения то чечных мутаций в генах семейства, особенно гена K-ras.
Существуют данные о влиянии на личия K-ras мутаций на сроки жизни пациентов, имеющих поздние стадии развития рака толстой кишки, причем в отличие от других онкопатологий немаловажное значение могут иметь возраст и пол больных. Изучение дан ных анализа 1413 пациентов с колоректальными раками показало, что в возрастных группах моложе 50 лет на личие мутаций K-ras достоверно кор релирует со снижением уровня выжи ваемости на 40 %.
Характер мутаций также имеет зна чение в определении метастатическо го потенциала опухоли, хотя единого мнения на этот счет не сложилось. Показано, что в клетках, диссеминирующих РТК, обнаруживаются нару шения именно второй пары основа ний 12-го кодона (транзиции G-A и трансверсии G —» С), тогда как в неметастазирующих опухолях они редки. Трансверсии G - C достоверно корре лируют также и с низкими сроками выживаемости пациентов. В метаста-
527
тических узлах и рецидивах РТК часто обнаруживаются мутации не только в 12-м, но и в 13-м кодоне гена. Приме
нение |
современных |
молекулярных |
|
высокочувствительных |
методик |
по |
|
зволяет |
обнаруживать |
мутации |
генов, |
в частности K-ras, не только в опухо левой ткани, но в сыворотке крови и кале пациентов с РТК. При использо вании технологии экстракции опухо левых клеток из кровяного русла на рушения в 12-м кодоне K-ras и/или мутации р53 обнаруживаются в опухо левых образцах 9 из 10 больных с инвазивными К Р Р и в крови у 45 % па циентов, имеющих данные наруше ния. Появление аберрантных генов в 80 % случаев совпадает с наличием метастатического поражения печени на момент хирургического вмешательства и в 60 % — с развитием печеночных метастазов в период послеоперацион ного наблюдения. Данный тест успеш но используется в японских клиниках для мониторинга больных с колоректальными раками с целью установле ния прогрессирования болезни.
В случае выявления мутации K-ras у больных с аденокарциномами легко го без метастатических поражений ре гионарных лимфатических узлов на момент хирургического вмешательства показатели трехлетней выживаемости значительно ниже, чем у больных с такими же, но ras-негативными опу холями.
Влияние нарушений в K-ras на аг рессивное поведение опухолей можно объяснить тем, что активированный ген усиливает продукцию группы ре цепторов клеточной поверхности, оп ределяющих адгезивные свойства кле ток (альфа-З-бета-1 ламинин/коллаген/фибронектинового и альфа-З-бе та-1 витронектинового), а значит, мо жет влиять на метастатическое пове дение опухоли. Кроме того, в опухо лях с активированным K-ras наблюда ется значительное снижение апоптотического индекса вне зависимости от экспрессии р53 и bcl-2.
Учитывая данные о дефектах сис темы репарации Д Н К , наблюдаемых в
528
подавляющем большинстве трансфор мированных клеток, мутации ras-re- нов могут служить показателем общей генетической нестабильности генома клеток опухоли.
Р53. В ходе прогрессии резко воз растает число мутаций гена р53, влияющих на его функции. Данные о конкретных точечных мутациях р53 как факторе прогноза довольно про тиворечивы, однако несомненно, что этот ген оказывает опосредованное влияние на скорость роста и форми рование опухоли. Так, например, в инвазивных опухолях молочной желе зы наличие мутаций р53 коррелирует с низким уровнем дифференцировки, снижением количества рецепторов эс трогенов и высоким пролиферативным индексом клеток. Эти показатели часто сопровождаются усилением экс прессии с-erbВ2 и делециями в зоне локализации гена c-met, тирозинкиназного рецептора клеточной поверх ности для фактора роста гепатоцитов. Возрастание числа мутаций р53 часто наблюдается наряду с потерей одной из аллелей и ассоциируется со стадий ностью карцином молочной железы.
Накопленный материал позволяет сделать вывод о необходимости стро гого сопоставления локализации и ха рактера таких мутаций с каждым из клинических и морфологических па раметров отдельно и путем мультивариантного анализа. Применение таких
статистических |
программ |
для Р М Ж |
|
позволило установить, |
что |
большин |
|
ство мутаций в |
6-м и |
7-м экзонах р53, |
|
а также в "горячих точках" (кодоны 175, 245, 248 и 273) на самом деле не ассоциированы с показателями выжи ваемости. Статистически достоверная корреляция наблюдалась между уменьшением сроков ремиссии и му тациями внутри 4-го экзона.
12.2.4.3. Специфические делеций
Открытие высокополиморфных микросателлитных маркеров, с высо кой частотой распределенных в гено-
с
ме человека, позволило существен ным образом интенсифицировать ис следования генов-супрессоров. Мик росателлиты — ди-, три-, тетрануклеотидные последовательности, повто ряющиеся в геноме от нескольких де сятков до нескольких сотен раз и представленные большим количест вом различных аллелей. Высокая полиморфность обусловливает тот факт, что большинство индивидов имеет два аллельных фрагмента в анализируе мом микросателлитном локусе (с го мологичных хромосом). Делеция од ного аллеля в опухолевой Д Н К обо значается термином "потеря гетерози готности", или LOH (Loss of Heterozigosity). Кроме того, микросателлитные последовательности склонны к мутациям небольшого размера — из менению длины вследствие делеций или вставки нескольких нуклеотидов. Это явление часто связано с дефекта ми генов репарации Д Н К и приводит к формированию так называемого R E R + (Replication Error) фенотипа.
Идентификация делеций, предпо ложительно связанных с онкогенами, генами-супрессорами опухолевого роста или ингибиторами циклинзави симых киназ, и анализ их распределе ния в различных опухолях показали, что они часто ассоциируются с метастастазированием, рецидивированием и другими составляющими плохого прогноза. Показано, что LOH в генахсупрессорах опухолевого роста и ин гибиторов циклинзависимых киназ может служить признаком агрессив ного поведения опухоли при раке мо лочной железы и яичников, ретинобластомах, раке легкого, колоректальных раках и т. д. При некоторых он кологических заболеваниях были вы явлены наиболее подверженные LOH участки хромосом (lp, 7q, 9р, l i p , 13q, 17р, 17q, 18q), утрата которых мо жет служить показателем высокой скорости прогрессии заболевания и уровня выживаемости пациентов.
Делеций генетического материала короткого плеча хромосомы 1 обнару жены в ряде опухолей, включая ней-
робластомы, феохромоцитомы, менингиомы, меланомы, карциномы мо лочной железы, печени, почки, же лудка, поджелудочной железы, легко го и некоторые другие. Предполагает ся, что в этом районе локализован кластер генов, предположительно ан тионкогенов, утрата которых коррели рует с низкими прогностическими по казателями.
Делеций на коротком плече хромо сомы 1 являются характерной чертой нейробластом и нейробластомных клеточных линий. Потеря гетерози готности различными участками 1р, по данным разных авторов, имеет ме сто в 30—89 % случаев первичных нейробластом и с большей частотой наблюдается на поздних стадиях опу холевой прогрессии. Нейробластомы, несущие делеций на 1р, могут быть подразделены на два класса. Опухоли, относящиеся к первому классу, харак теризуются делециями небольшого размера (5—10 сМ) в пределах участка 1р36.2-3. Опухоли второго класса не сут делеций большего размера, кото рые захватывают районы 1р35-36 и ха рактеризуются амплификацией протоонкогена N-MYC. Опухоли этого клас са клинически более агрессивны и ха рактеризуются плохим прогнозом. Эти данные свидетельствуют о том, что нейробластома прогрессирует, во влекая различные механизмы инакти вации аллелей предполагаемого анти онкогена, находящегося на 1р36.2-3, и дополнительных генов, находящихся на 1р35 и в других локусах субтеломерного района 1р, которые, вероят но, тоже играют определенную роль в прогрессии нейробластом.
Наличие частых делеций в локусах 1р32—1р36 и 1р13.1 характерно для многих злокачественных опухолей, однако важное прогностическое зна чение имеет именно участок 1р36, ут рату которого уже сегодня можно рас ценивать как маркер быстрого прогрессирования опухолевого процесса и более короткого периода выживае мости. Делеций в субтеломерном рай оне 1р характерны для поздних стадий
3 4 - 7 9 0 8 Д. Г. Заридзе |
529 |
опухолевой |
прогрессии |
и |
коррелиру |
эмбриогенеза и в опухолях. Делеций |
|||||||||||||||||||
ют с плохим прогнозом при многих |
этого участка коррелируют с агрессив |
||||||||||||||||||||||
видах онкопатологии. Было иденти |
ным течением Р М Ж и рака |
толстой |
|||||||||||||||||||||
фицировано |
3 |
консенсусных |
района |
кишки. В этой зоне хромосомы 17 на |
|||||||||||||||||||
перекрывания делеций: 1р36.3 |
(10сМ), |
ходится |
ряд |
других |
важных |
генов: |
|||||||||||||||||
1р35.1—1р36.3 (2сМ) и 1р34.2-1р35 |
MDC |
(металлопротеаза); |
RAR |
(рецеп |
|||||||||||||||||||
(1сМ). Хотя делеций в этих районах |
тор ретиноидной кислоты), один из |
||||||||||||||||||||||
обнаруживаются |
|
на |
поздних |
стадиях |
генов, ответственных за контроль кле |
||||||||||||||||||
опухолевой |
|
прогрессии |
|
с |
большей |
точной дифференциации, а также с- |
|||||||||||||||||
частотой, их присутствие показано и |
erbВ2, значение которого в индивиду |
||||||||||||||||||||||
для |
пренеопластических |
поражений, |
альном прогнозе обсуждается ниже. |
||||||||||||||||||||
что свидетельствует о важной роли |
Делеций на хромосоме 17 часто ас |
||||||||||||||||||||||
инактивации |
предполагаемого |
|
анти |
социированы |
с |
таковыми |
на |
11p и |
|||||||||||||||
онкогена, |
локализованного |
в |
|
одном |
18q. Одновременная |
|
потеря |
генетиче |
|||||||||||||||
из этих районов, для индукции карци |
ского |
материала |
на 17q и 18q отмеча |
||||||||||||||||||||
ном. |
|
|
|
|
|
|
|
|
|
|
|
лась при более агрессивных формах |
|||||||||||
Делеций генов длинного плеча 17-й |
рака яичников и молочной железы, |
||||||||||||||||||||||
хромосомы. |
Известно, |
что |
синдром |
причем у таких пациентов повышался |
|||||||||||||||||||
наследуемого рака молочной железы и |
риск развития рака толстой кишки. |
||||||||||||||||||||||
яичников хотя бы отчасти является |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
результатом |
доминантного |
аутосомно- |
12.2.4.4. Амплификация генов |
||||||||||||||||||||
го |
наследования |
мутантного |
гена-су- |
и увеличение их экспрессии |
|||||||||||||||||||
прессора BRCA1 |
(Breast |
Cancer |
|
Associ |
|||||||||||||||||||
|
как факторы прогноза |
|
|
|
|||||||||||||||||||
ated), |
локализованного |
|
на |
|
участке |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
17q21.1-21.2. |
|
|
|
|
|
|
|
|
|
Амплификация ряда известных он |
|||||||||||||
|
Первоначально |
предполагалось, |
когенов |
идентифицирована |
в |
различ |
|||||||||||||||||
что ген BRCA1 является геном-супрес- |
ных опухолях человека. Как правило, |
||||||||||||||||||||||
сором, |
специфичным |
в |
отношении |
процесс увеличения числа копий оп |
|||||||||||||||||||
Р М Ж в семьях с отягощенной наслед |
ределенных |
протоонкогенов |
|
имеет |
|||||||||||||||||||
ственностью. Оказалось, что измене |
вторичную природу и отражает селек |
||||||||||||||||||||||
ния этого гена более специфичны для |
тивные |
преимущества |
одних |
клеток |
|||||||||||||||||||
спорадических форм рака яичников и |
перед |
другими. |
Основным |
результа |
|||||||||||||||||||
молочной железы и в большой степе |
том амплификации гена является ано |
||||||||||||||||||||||
ни обусловлены микро- и мини-деле- |
мально высокая |
продукция |
кодируе |
||||||||||||||||||||
циями. Так, частота встречаемости |
мого им белка. В ряде случаев ампли |
||||||||||||||||||||||
LOH гена BRCA1 для спорадических |
фикация того или иного онкогена или |
||||||||||||||||||||||
случаев рака яичников 70 %, для спо |
сопряженная |
с |
ней |
суперэкспрессия |
|||||||||||||||||||
радических |
|
случаев |
Р М Ж |
— |
|
около |
коррелируют с определенным |
новооб |
|||||||||||||||
50 %. Как правило, эти случаи харак |
разованием и могут служить в качест |
||||||||||||||||||||||
теризуются |
более |
агрессивным |
тече |
ве молекулярного маркера при диаг |
|||||||||||||||||||
нием. |
|
|
|
|
|
|
|
|
|
|
|
ностике и определении прогноза забо |
|||||||||||
|
Кроме BRCA1, из окружающей его |
левания. |
|
|
|
|
|
|
|
|
|
||||||||||||
области |
генома |
на |
17q |
клонированы |
Гены |
семейства |
туc. Накоплено |
||||||||||||||||
26 генов, часть из которых ассоцииро |
большое количество данных о корре |
||||||||||||||||||||||
вана с процессами опухолевой про |
ляции между амплификацией и экс |
||||||||||||||||||||||
грессии. В районе 17q21.3 картирова |
прессией генов семейства myc и пока |
||||||||||||||||||||||
ны |
супрессоры |
|
метастазирования |
зателями |
прогрессии |
при |
различных |
||||||||||||||||
пт23Ш (NME1) и пт23H2 (NME2). |
типах опухолевой патологии. Сущест |
||||||||||||||||||||||
Отмечена |
значительная |
роль |
гена |
вует прямая зависимость между высо |
|||||||||||||||||||
пт23Н1 |
в контроле |
клеточной диффе |
ким пролиферативным статусом, |
низ |
|||||||||||||||||||
ренцировки, |
пролиферации |
и |
|
транс |
ким |
уровнем |
дифференцировки |
кле |
|||||||||||||||
крипции. |
Наблюдаются |
колебания |
ток и суперэкспрессией myc-генов. |
||||||||||||||||||||
экспрессии |
|
пт23 |
на разных |
стадиях |
Установлено, |
что |
повышение |
экс- |
|||||||||||||||
530
прессии c-myc и амплификация L-myc ассоциируются с агрессивным поведе нием и быстрой диссеминацией опу холи при раке желудка и легкого, а также низкими показателями трехлет ней выживаемости больных. Ампли фикация с-тус в злокачественных опухолях молочной железы коррели рует с делениями на 1р32-36, в зоне локализации L-myc и соседнего с ним гена р73. Возможно, инактивация р73 приводит к усилению общей неста бильности генома, включая и ампли фикацию.
Увеличение числа копий гена с- тус наблюдается во многих солидных опухолях (рак легкого, аденокарцинома желудка, рак тела матки, саркома Юинга и др.). Степень амплификации этого онкогена при различных типах опухолей варьирует от 5 до 70 копий на клетку. Существенное увеличение числа копий с-тус было зарегистри ровано и в 40 % случаев злокачествен ных неходжкинских лимфом. Макси мальное число копий демонстрирует онкоген N-myc в случае нейробластом и ретинобластом — до 200 копий на гаплоидный геном клетки.
Суперэкспрессия белка с-тус в опухолевых клетках, обусловленная как амплификацией протоонкогена, так и другими причинами, характери зует наиболее агрессивно текущие, ак тивно метастазирующие опухоли и яв ляется маркером низкого показателя выживаемости даже у радикально опе рированных больных с ранними ста диями рака желудка и легкого.
Ген c-ERBB-2(NEU). Ген HER-2/ NEU/c-ERBB-2 обладает тирозинки назной активностью и структурно го мологичен другому представителю се мейства — рецептору эпидермального фактора роста (EGFR) или C-ERBB.
Амплификация ERBB-2, ведущая к гиперэкспрессии продукта, от 2 до 40 раз превышающей норму, была найде на примерно в 30 % карцином молоч ной железы и ассоциировалась с пло хим прогнозом. Обнаружена значи тельная статистически достоверная корреляция между увеличением коли
34*
чества копий гена, рецидивами болез ни (р < 0,001) и низкими показателя ми выживаемости (р < 0,0011). Неко торые исследователи отрицают связь амплификации этого гена с пораже нием регионарных лимфатических уз лов и возникновением рецидивов опу холи, однако указывают на значитель ное увеличение процента опухолей с амплифицированным NEU на III—IV стадии заболевания. Эти данные под тверждаются результатами иммуногистохимического определения C-ERBB- 2 в большом архивном материале, по лученном от пациенток с трехлетним и более сроком послеоперационного наблюдения. Показано, что достовер ная корреляция между гипериммунореактивностью ткани по этому киназному рецептору наблюдается главным образом в опухолях молочной железы большого размера (более 5 см в диа метре) (р — 0,006) или опухолях, про растающих окружающие ткани. 35— 47 % внутрипротоковых Р М Ж демон стрируют трех-восьмикратную ампли фикацию NEU преимущественно в низкодифференцированных и активно пролиферирующих опухолях типа comedo. Увеличение экспрессии гена сопровождается потерей рецепторов к эстрогенам и прогестерону. Предпола гают, что амплификация гена ERBB-2 и усиление экспрессии его белка в со четании с потерей функции генов-су- прессоров р53 и BRCA1 ассоциирова ны с переходом длительно растущих высокодифференцированных внутри протоковых карцином в более агрес сивные формы. В свете этого предпо ложения становятся понятными пре имущественная амплификация гена на поздних стадиях болезни и ее связь с низкими показателями выживаемо сти. Следует отметить, что гиперэкс прессия белка ERBB-2 может быть необходимым условием инвазии опу холевых клеток и часто регистрирует ся задолго до появления метастатиче ских очагов роста.
Уровень экспрессии ERBB-2 кор релирует с плохим прогнозом и при некоторых других злокачественных
531
новообразованиях, |
в |
частности |
при |
ется |
неоангиогенез — |
формирование |
|||||||||||||||||||
аденокарциномах |
легкого |
и толстой |
дополнительной |
капиллярной |
сети, |
||||||||||||||||||||
кишки. |
|
Сопоставление |
|
клинических |
обеспечивающей |
рост опухолевого |
уз |
||||||||||||||||||
показателей |
с |
данными |
исследования |
ла. Очевидно, что именно изменения |
|||||||||||||||||||||
генов семейства erbВ-2 дает все осно |
активности |
|
определенных |
|
опухоле |
||||||||||||||||||||
вания |
для |
широкого |
практического |
вых супрессоров и онкогенов играют |
|||||||||||||||||||||
внедрения в качестве прогностическо |
решающую роль в стимуляции роста |
||||||||||||||||||||||||
го фактора. |
|
|
|
|
|
|
|
|
|
сосудов, так как активируют факторы, |
|||||||||||||||
Экспрессия c-SRC, видимо, не свя |
выполняющие ключевую роль в ан- |
||||||||||||||||||||||||
зана |
с |
|
морфологической |
злокачест |
гиогенезе. |
|
При |
анализе механизмов |
|||||||||||||||||
венностью, |
однако исследование |
рака |
возникновения ангиогенного феноти |
||||||||||||||||||||||
легкого показало, что высокая экс |
па в человеческих фибробластах обна |
||||||||||||||||||||||||
прессия этого белка коррелирует с |
ружено, что в большинстве случаев |
||||||||||||||||||||||||
развитием |
метастатических |
пораже |
именно инактивация р53 влияет на |
||||||||||||||||||||||
ний |
и |
низкой |
дифференцировкой |
экспрессию некоторых ингибиторов и |
|||||||||||||||||||||
опухолей |
при П К Р Л и может служить |
стимуляторов |
ангиогенеза, |
|
например |
||||||||||||||||||||
показателем плохого прогноза. Влия |
тромбоспондинов 1 и 2 и рецептора |
||||||||||||||||||||||||
ние экспрессии c-SRC на процессы |
фактора роста эндотелия сосудов (ген |
||||||||||||||||||||||||
метастазирования |
и |
дифференциров |
VEGF-A). Инактивация и снижение |
||||||||||||||||||||||
ки обусловлено тем, что продукт гена |
экспрессии р53 могут являться важ |
||||||||||||||||||||||||
может |
фосфорилировать |
белки, |
фор |
ным этапом стимуляции неоангиоге- |
|||||||||||||||||||||
мирующие |
цитоскелет |
(актин, |
фиб |
неза и, исходя из этого, негативным |
|||||||||||||||||||||
рин, винкулин, тубулин). Этот про |
фактором |
прогрессии. |
|
|
|
|
|
||||||||||||||||||
цесс усиливает морфологическую ати- |
|
|
|
|
|
|
* * * |
|
|
|
|
|
|||||||||||||
пию клеток, изменяет параметры кле |
|
|
|
|
|
. |
|
|
|
|
|
||||||||||||||
точной адгезии в эпителиальных клет |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
ках и облегчает образование метаста |
Таким |
образом, применение |
мето |
||||||||||||||||||||||
зов. |
|
|
|
|
|
|
|
|
|
|
|
|
дов молекулярной генетики уже сего |
||||||||||||
Р53. Модельные эксперименты in |
дня позволяет надеяться на появление |
||||||||||||||||||||||||
vivo показали, что существенное уве |
точных |
критериев оценки |
возможно |
||||||||||||||||||||||
личение |
метастатической |
способности |
сти |
метастазирования |
или |
|
рецидива |
||||||||||||||||||
клеток ассоциировано с функцио |
заболевания за несколько месяцев до |
||||||||||||||||||||||||
нальными нарушениями р53. В част |
клинического |
проявления. Очевидно, |
|||||||||||||||||||||||
ности, снижение экспрессии или пол |
что |
своевременное |
распознавание |
||||||||||||||||||||||
ная инактивация р53 приводят к поте |
прогрессирования заболевания |
позво |
|||||||||||||||||||||||
ре экспрессии белка недавно открыто |
лит |
увеличить эффективность |
проти |
||||||||||||||||||||||
го гена |
|
КАИ. |
Продукт |
КАП |
активиру |
воопухолевой |
терапии. |
|
|
|
|
|
|||||||||||||
ет |
транскрипцию |
трансмембранных |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
белков, |
|
образующих |
комплексы |
с Е- |
12.2.5. |
|
Генетические |
|
|
|
|||||||||||||||
кадхерином. |
В |
различных |
опухолях |
|
|
|
|
||||||||||||||||||
маркеры |
и |
тактика |
лечения |
||||||||||||||||||||||
человека на поздних стадиях заболева |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
ния |
наблюдается |
потеря |
экспрессии |
Наличие |
|
определенного |
спектра |
||||||||||||||||||
белка ΚΑΙ1, обусловленная в том чис |
генетических |
нарушений |
может |
яв |
|||||||||||||||||||||
ле и инактивацией р53 (60—90 % рака |
ляться базой для индивидуализации и |
||||||||||||||||||||||||
предстательной, |
поджелудочной и мо |
терапевтических |
вмешательств. |
В |
по |
||||||||||||||||||||
лочной |
|
желез, |
|
мелкоклеточного |
рака |
следние |
годы |
получены |
доказательст |
||||||||||||||||
легкого, |
гепатоцеллюлярного |
рака |
ва, что резистентность к проводимому |
||||||||||||||||||||||
и др.). Восстановление его экспрессии |
химио- и радиотерапевтическому ле |
||||||||||||||||||||||||
вызывает ингибирование |
метастатиче |
чению |
онкопатологии |
может |
быть |
||||||||||||||||||||
ского процесса, что может быть ис |
обусловлена |
молекулярными |
наруше |
||||||||||||||||||||||
пользовано в целях генотерапии. |
|
ниями, часто ассоциированными и с |
|||||||||||||||||||||||
Важным |
условием |
формирования |
агрессивным |
поведением |
|
опухоли. |
|||||||||||||||||||
первичной опухоли и метастазов явля |
Выявление |
таких генетических |
изме- |
||||||||||||||||||||||
532
нений является очень важной, но при |
чивость |
трансформированных |
клеток |
||||||||||||||||||||
современном |
состоянии |
|
медицины |
к доксорубицину. Ген топоII-альфа, |
|||||||||||||||||||
довольно сложной задачей при назна |
кодирующий ключевой |
фермент |
про |
||||||||||||||||||||
чении адекватных схем лечения. |
|
цесса репликации Д Н К и являющий |
|||||||||||||||||||||
Суперпродукция ERBB-2 (HER-2, |
ся |
молекулярной |
мишенью действия |
||||||||||||||||||||
NEU). |
Химиорезистентность, |
несо |
ингибиторов топоизомеразы И-аль |
||||||||||||||||||||
мненно, развивается в результате мно |
фа, расположен в хромосомном локу- |
||||||||||||||||||||||
гофакторного |
процесса, |
однако |
важ |
ce l7ql2-q21, в |
непосредственной |
бли |
|||||||||||||||||
ную роль в индукции этого фенотипа, |
зости от erbB-2/neu. Оказалось, что |
||||||||||||||||||||||
по всей видимости, играет активность |
амплификация |
neu |
всегда |
сопровож |
|||||||||||||||||||
гена erbВ-2. В настоящее время опре |
дает |
(или |
определяет) амплификацию |
||||||||||||||||||||
деление |
амплификации |
и |
гиперэкс |
или делеций соседнего с ним monoll- |
|||||||||||||||||||
прессии erbВ-2 используется не толь |
альфа и, таким образом, ассоциирова |
||||||||||||||||||||||
ко в качестве фактора плохого про |
на с увеличением или уменьшением |
||||||||||||||||||||||
гноза, но и для выбора терапевтиче |
чувствительности клеток к |
ингибито |
|||||||||||||||||||||
ской тактики при развитии опухолей |
рам топоизомеразы II. Эти результаты |
||||||||||||||||||||||
женской репродуктивной сферы. Су |
проливают |
свет |
на |
противоречивые |
|||||||||||||||||||
ществуют |
работы, |
указывающие |
на |
факты |
изменения |
чувствительности к |
|||||||||||||||||
использование данного теста и при |
доксорубицину в опухолях с ампли |
||||||||||||||||||||||
лечении аденокарцином легкого. |
|
фикацией гена erbВ-2. |
|
|
|
|
|||||||||||||||||
Оказалось, |
что |
гиперэкспрессия |
Последние |
данные |
показывают, |
||||||||||||||||||
белка р185erbB-2 коррелирует |
с устойчи |
что регуляторы клеточного цикла так |
|||||||||||||||||||||
востью клеток к химиотерапии. Разра |
же |
связаны |
с |
химиорезистентностью |
|||||||||||||||||||
батываемые |
методы |
|
иммунодиагно |
erbВ-2 зависимых карцином. Гиперак |
|||||||||||||||||||
стики |
позволяют |
определять повыше |
тивация сигналов с участием erbВ-2 |
||||||||||||||||||||
ние продукции данного белка в образ |
приводит |
к |
дисрегуляции |
клеточного |
|||||||||||||||||||
цах, полученных из плазмы крови, что |
цикла, |
что |
сопровождается |
активаци |
|||||||||||||||||||
несомненно |
облегчает |
лечебный |
мо |
ей комплексов циклинзависимые ки- |
|||||||||||||||||||
ниторинг |
и терапевтическую |
коррек |
назы/циклин. |
|
|
|
|
|
|
|
|||||||||||||
цию. |
|
|
|
|
|
|
|
|
|
|
|
Одним из очевидных подходов к |
|||||||||||
Уровень синтеза p185 является в |
контролю |
|
клеточной |
пролиферации |
|||||||||||||||||||
настоящее |
время |
основным |
достовер |
является вмешательство в паракрин- |
|||||||||||||||||||
ным параметром, |
позволяющим пред |
но/аутокринную |
стимуляцию |
|
роста |
||||||||||||||||||
сказывать |
химиорезистентность |
кле |
клеток с помощью агентов, ингиби- |
||||||||||||||||||||
ток |
к |
воздействию |
доксорубицида, |
рующих |
|
действие |
|
факторов |
роста, |
||||||||||||||
этопозида, |
и, |
возможно, |
цисплатина. |
усиливающих |
пролиферативную |
ак |
|||||||||||||||||
У пациенток с повышенным содержа |
тивность опухолевых клеток. В на |
||||||||||||||||||||||
нием белка p185 также отсутствует по |
стоящее время ведется разработка те |
||||||||||||||||||||||
ложительная динамика при |
использо |
рапевтических |
методов |
блокирования |
|||||||||||||||||||
вании радио- и гормонотерапии. |
|
рецепторов |
эпидермального |
фактора |
|||||||||||||||||||
Показано, |
что |
|
суперпродукция |
роста с использованием антител. В |
|||||||||||||||||||
erbВ-2 |
ассоциирована |
с |
устойчиво |
сентябре |
1998 |
г. |
в |
С Ш А |
впервые в |
||||||||||||||
стью опухоли и к широко используе |
клинической |
практике |
для |
лечения |
|||||||||||||||||||
мому в настоящее время таксолу. До |
солидных |
опухолей |
были применены |
||||||||||||||||||||
недавнего времени считалось, что ре |
моноклональные |
антитела. |
Эти |
хи |
|||||||||||||||||||
зистентность к этому препарату, отно |
мерные |
антитела, |
блокирующие |
ре |
|||||||||||||||||||
сящемуся к группе ингибиторов то- |
цептор HER2-neu, были успешно ис |
||||||||||||||||||||||
поизомеразы |
II-альфа, |
не коррелирует |
пользованы |
для |
усиления |
действия |
|||||||||||||||||
сгенетическими нарушениями гена химиотерапии при лечении рака мо
erbВ-2, однако в 2000 г. опубликованы |
лочной железы и яичников. Препарат |
|
данные, свидетельствующие о непо- |
получил название Trastuzumab, или |
|
средственном влиянии увеличения ко- |
Herceptin. Комплексные |
клинические |
пийности данного онкогена на устой |
испытания установили |
пригодность |
533
данного препарата для лечения неко торых форм опухолей, гиперэкспрессирующих HER2. Лиганд-управляе- мые процессы, ведущие к усилению инвазивности клеток опухоли, могут полностью супрессироваться херцептином, который также блокирует взаимодействие между HER2 - и НЕRЗ-рецепторами и ингибирует сиг нальный путь, обусловленный фосфа- тидилинозитол-3'-киназой, оставляя интактной митогенную активацию протеинкиназ. Этот факт может слу жить точкой приложения в разработке потенциального химиотерапевтического эффекта херцептина в ингибировании метастазирования в опухолях с низкой экспрессией ERBB-2.
Становится очевидным, что даль нейшие исследования механизмов химиорезистентности в опухолях, пози тивных в отношении усиленной экс прессии этого гена и генов множест венной лекарственной устойчивости, могут привести к разработке новой эффективной стратегии в лечении опухолей репродуктивной сферы, ос нованной на молекулярно-биологиче- ских тестах.
Микросателлитная нестабильность.
Особый интерес в плане исследова ний терапевтической тактики пред ставляют опухоли, имеющие различ ный статус микросателлитной неста бильности, обусловленной поврежде ниями генов репарации Д Н К (MSI). Если в исследуемой опухоли опреде ляется высокий уровень микросател литной нестабильности (MSI+), т. е. повреждено больше 30 % исследуемых микросателлитов, то опухоль имеет фенотип R E R + (replication error-posi tive phenotype) и, значит, в Д Н К ее клеток накопились сотни и тысячи мутаций. Фенотип R E R + встречается при раке молочной железы, яичников, желудка и т. д., но ни один тип онкопатологии не характеризуется более частым возникновением MSI+, чем колоректальные опухоли. Значитель ная часть колоректальных раков у па циентов с наследственными синдро мами и группа спорадических опухо
лей толстой кишки демонстрируют фенотип R E R + . Несмотря на неодно значность результатов, у исследовате лей, занимающихся этой проблемой, складывается впечатление, что про цессы MSI+ текут более благоприятно и отличаются большей химиочувствительностью, в частности, к 5-фторура- цилу. Кроме того, уровень микроса теллитной нестабильности может яв ляться хорошим маркером при оценке эффективности действия терапевтиче ских агентов.
В когорте RER-негативных опухо лей большее значение приобретает тестирование мутаций р53, K-ras, оп ределение экспрессии HER-2, ком плекса bcl2—bax, V E G F и т. д. Так, при оценке эффективности препарата миримастат в лечении пациентов с диссеминированным рефракторным РТК выявлено, что наличие в опухоли K-ras мутаций вдвое снижает медиану выживаемости с момента начала лече ния. Этот показатель еще ниже у па циентов, в опухоли которых одновре менно регистрировали и мутации р53. Использование р53 в качестве единст венного маркера химиорезистенции при использовании таких препаратов, как 5-фторурацил и паклитаксел, при лечении опухолей желудочно-кишеч ного тракта не столь успешно.
Другие маркеры лекарственной ре зистентности. В индукции устойчиво сти к действию химиотерапевтических агентов играет важную роль и семей ство генов bcl, демонстрирующих про- и антиапоптотическую активность. Функциональная утрата ΒΑΧ частич но снижает апоптотический эффект от воздействия 5-фторурацила и пол ностью его аннулирует при использо вании пироксикама, сулиндага и дру гих нестероидных противовоспали тельных препаратов. Эти препараты действуют как ингибиторы изоферментов циклооксигеназы (простагланДин эндопероксидазсинтетазы), акти вированных при большинстве воспа лительных, процессов. Поскольку многие цитокины, факторы роста и факторы клеточной адгезии индуци-
534
руют активность данного фермента, оценка корреляции противоопухоле вого эффекта препаратов этой группы и нарушений в онкогенах и модулято рах представляется весьма перспек тивной. В первую очередь это касает ся генов, участвующих в регуляции синтеза простагландинов, в частности АРС и бета-катенина.
Индикатором потери чувствитель ности к гормонотерапии могут быть в сочетании с определенным функцио нальным статусом гормональных ре цепторов делеций на 17-й хромосоме. Изменения некоторых генов на 17-й хромосоме строго коррелируют с по терей рецепторов к эстрогенам, осо бенно к прогестерону, и, возможно, ассоциированы с гормональной дерегуляцией при раке молочной железы и яичников. С этой точки зрения боль шой интерес представляют данные об исследовании мутаций гена ESR, ко дирующего эстрогеновые рецепторы.
Эффективное использование про тивоопухолевых препаратов или ус пешное радиотерапевтическое лече ние сопровождаются повышением экспрессии p21(WAF1). Есть все дан ные полагать, что уровень экспрессии данного белка может быть использо ван при оценке действия химиотера пии в качестве хорошего прогностиче ского теста.
12.2.6. Основные методы экспериментального анализа структурных и функциональных изменений генов
В рамках данной главы невозмож но дать полную характеристику суще ствующих и разрабатываемых методов молекулярной биологии, используе мых в целях практической онкологии. Однако представляется необходимым упомянуть некоторые методические подходы и подчеркнуть особенности их применения в области создания широкого спектра маркеров опухоле вого роста и возможных терапевтиче ских агентов. Для исследования хро
мосомных и генных нарушений суще ствует целый арсенал методов, неко торые из них описаны ниже. Данные о первичной структуре всех известных генов и обнаруженных изменениях, ассоциированных с патологическими процессами, хранятся в международ ных-компьютерных банках.
При детекции многих структурных или функциональных изменений ге нома проводят анализ Д Н К с помо щью коротких секвенированных по следовательностей Д Н К с известной хромосомной локализацией или полу ченных из к Д Н К библиотек экспрессирующихся генов — STS (sequence tagget sites) или EST (expressed se quence tag) тестирование.
В последние годы наблюдается ог ромный прогресс в диагностике раз личных патологических процессов у человека в связи с повсеместным вне дрением в практику молекулярнобиологических исследований такого высокочувствительного, специфично го и экономичного метода, как полимеразная цепная реакция (ПЦР) . Она
незаменима при |
изучении состояния |
микросателлитов. |
Микросателлитный |
анализ широко |
используется для |
скрининга микро- и макроделеций, а также мультимутаций, возникающих при дефектах генов системы репара ции Д Н К . Как показали недавно швейцарские и американские иссле дователи, высокую диагностическую ценность имеет анализ мутантных микросателлитов, попадающих в плаз му крови с обрывками Д Н К единич ных разрушенных опухолевых клеток. В качестве теста для выявления со стояния генетической нестабильно сти при онкопатологии и лучевых по ражениях недавно, также в образцах плазмы крови, предложена П Ц Р LINE-элементов, рассеянных по гено му длинных повторяющихся последо вательностей, так называемых пры гающих генов. В опухолевых клетках некоторые LINE-элементы могут пу
тем |
ретранспозиции встраиваться в |
||
Д Н К |
хромосом, |
повреждая |
сущест |
вующие там гены |
и создавая |
мутации. |
|
535
Наконец, с помощью П Ц Р или П Ц Р с дополнительной ДНК-гибридизацией могут быть выявлены характерные для ряда гемобластозов специфические хромосомные транслокации (см. главу 1). Для этого может быть достаточно 1 опухолевой клетки на 100 000 нор мальных клеток крови, что очень важ но для ранней диагностики заболева ния. Кроме того, в биологических жидкостях с помощью ПЦР-тестов, чувствительность которых во много раз превосходит таковую цитохимиче ских и иммунохимических методов, можно следить за эффективностью лечения онкологических больных и фиксировать появление рецидивов.
Помимо исследования уже извест ных онкогенов и генов-супрессоров, представляющих весьма небольшую часть активных генов клетки, ведется поиск новых опухолеспецифических генетических детерминант, участвую щих в возникновении и развитии раз личных типов опухолей. Одним из ин тенсивно развивающихся подходов в настоящее время является выделение генов, дифференциально экспрессирующихся в опухолевых клетках по сравнению с нормальными. Для обна ружения м Р Н К таких генов использу ется спектр новых методов, в частно сти электронное вычитание (electronic substruction), разностная гибридиза ция (substructive hybridization), диффе ренциальный дисплей м Р Н К на осно ве П Ц Р (differantial display) и биочипы (см. ниже). Эти методы могут служить основой для идентификации генов, не подверженных мутационному процес су. Полученные методами так назы ваемой экспрессионной генетики к Д Н К могут быть использованы при создании конструкций для диагности ки, производства рекомбинантных белков, получения антител, создания антисмысловых последовательностей. Этот подход может иметь важное зна чение в создании новых терапевтиче ских агентов, нормализующих генную экспрессию и уровень пролиферации.
Существование высокоспецифич ных антител позволяет идентифици-
ровать белки как продукты индивиду альных генов в любой сложной мно гокомпонентной смеси, например в лизатах клеточных культур или тка ней, а также на гистологических тка невых срезах и в цитологических об разцах. Вопросы тканевой специфич ности и клеточной локализации про дуктов индивидуальных генов реша ются применением иммуногистохимических подходов. Широкий спектр поли- и моноклональных антител к различным антигенным детерминан там позволяет различать патологиче ские белки как в тканевых образцах, так и в биологических жидкостях, что имеет важное диагностическое значе ние. Для того чтобы оценить количе ственные (уровень экспрессии) и ка чественные (наличие структурных или конформационных особенностей) из менения белков в опухолевых клетках, в настоящее время эффективно ис пользуют сочетания различных вари антов иммунохимических, иммуногистохимических и биохимических ана лизов. Такой подход увеличивает на дежность молекулярной онкодиагностики и расширяет ее возможности.
При молекулярно-генетических исследованиях обязательно должны строго учитываться морфологические параметры, такие как гистологиче ский тип новообразования, уровень дифференцировки и анаплазии кле ток, степень инвазии опухоли в окру жающие ткани, тонкая структура опу холевого образца (наличие стромальных элементов, участков другой гис тологической структуры, степень васкуляризации, некротические измене ния), а также классические клиниче ские характеристики для всех пациен тов.
Ниже следует далеко не полный перечень молекулярно-биологиче- ских методов экспериментального анализа структурных и функциональ ных изменений генов, которые с успе хом используются в целях онкодиагностики.
Рестрикционное картирование —
метод исследования с помощью фер-
536
ментов эндонуклеаз (рестриктаз), спе цифично расщепляющих строго опре деленные последовательности нуклеотидов (сайты) Д Н К . Широко приме няется для детекции точечных мута ций и определения аллельного поли морфизма.
Анализ полиморфных аллелей
[ПДРФ-анализ (RFLP — restriction fragment lenght polymorfism)] — электрофоретическое разделение и после дующая блот-гибридизация со специ фическими пробами полиморфных по длине аллельных фрагментов Д Н К , полученных при помощи рестриктного анализа.
Полимеразная цепная |
реакция |
[ П Ц Р (PCR — polymerase |
chain reac |
tion)] — получение in vitro большого количества копий какого-либо фраг мента Д Н К с использованием специ альной полимеразы и олигонуклеотидов уникального строения, ограничи вающих исследуемый фрагмент. В на стоящее время один из наиболее ши роко используемых методов в молеку
лярных |
исследованиях. |
|
|
Модификации: |
обратная |
П Ц Р [RT- |
|
PCR] — реакция, при которой в каче |
|||
стве матричной |
Д Н К используется |
||
кДНК, |
полученная при |
обратной |
|
транскрипции исследуемой информа ционной Р Н К ; П Ц Р in situ [PRINS] - П Ц Р in situ на хромосомных препара тах и т. д.
Метод аллель-специфичных олигонуклеотидов [ASO] — амплификация фрагментов Д Н К с последующей гиб ридизацией с мечеными нормальны ми или мутантными олигонуклеотидами, соответствующими исследуемым аллелям.
Высокоразрешающая жидкостная хроматография [(HPLC — high per formance liquid chromatography)] — скрининг Д Н К с целью определения единичных нуклеотидных замен. Ис пользуется также как метод детекции терминальных и соматических мута ций.
CMC (Chemical Mismatch Cleav age)] — расщепление неспаренных нуклеотидов в месте локализации не
комплементарных сайтов в Д Н К с по мощью специальных химических агентов.
Прямое секвенирование — последо вательное определение нуклеотидных последовательностей Д Н К .
Анализ конформационного полимор физма однонитевой ДНК [(SSCP — single strand conformation polymor phism)] — применяется для детекции мутаций, вызывающих изменение пространственной организации однонитевых фрагментов Д Н К и как след ствие различную подвижность амплифицированных аллелей при электрофоретическом разделении в ПААГ.
Микросателлитный анализ — ме тод, применяемый для детекции деле ций (в случае потери гетерозиготности) и обнаружения ошибок реплика ции (в случае появления аллелей ано мальной длины). Проводят путем электрофоретического разделения в ПААГ продуктов П Ц Р коротких по вторяющихся диили тетрануклеотидных последовательностей (микроса теллитов) с известной хромосомной локализацией.
Анализ биочипов (chip-analysis) — дифференциальная гибридизация кло нов из библиотеки кДНК, в опреде ленном порядке фиксированных на твердых фазах.
Саузерн- и Нозерн-блот-гибридиза- ция — идентификация с помощью комплементарных зондов рестриктных фрагментов Д Н К или молекул Р Н К , фиксированных на нейлоновых или нитроцеллюлозных фильтрах по сле электрофоретического разделения в различных гелях.
Радиоактивная и FISH-гибридиза- ция [fluorescein in situ hybridisation] — гибридизация Д Н К на цитогенетических или м Р Н К на гистологических препаратах с помощью меченных изо топами или флюорохромами Д Н К - зондов.
Вестерн-блот-гибридизация — гиб ридизация белков, разделенных при электрофорезе в ПААГ и иммобили зованных на нитроцеллюлозных фильтрах, с различными антителами.
537
Иммуногистохимический анализ —
метод визуализации специфических белков на цитологических и гистоло гических препаратах с использовани ем соответствующих антител.
Трансфекция — перенос образцов Д Н К опухолевых клеток в реципиентные клетки in vitro с последующим анализом трансдуцированных генов и их экспрессии, ассоциированных с фенотипическими изменениями кле точной культуры.
* * *
Клиническая онкология остро ну ждается в достоверных диагностиче ских и прогностических тестах. Соче тание данных клинических реестров с исследованиями в области молекуляр ной онкобиологии является необык новенно продуктивным как в опреде лении фундаментальных основ опухо левого роста, так и в плане диагности ки и лечения опухолевых заболева ний.
Молекулярная биология начинает создавать инструменты, с помощью которых можно точно узнать, какие гены подверглись мутациям в опухо левых клетках любого конкретного больного. Не меньшее значение имеет изучение специфических маркеров наследственной предрасположенности к возникновению различных типов рака человека. С учетом системного характера онкопатологий и мультифакторных механизмов возникнове ния и прогрессии рака при их иссле довании наиболее целесообразен ком плексный подход. Он подразумевает одновременное исследование консти тутивной (наследственной) предрас положенности и соматических дефек тов генотипа, учет популяционно-ге- нетических и эпидемиологических факторов, которые обусловливают формирование конкретной опухоли и характер ее прогрессии.
В заключение необходимо под черкнуть, что молекулярно-генетиче- ские тесты, в частности анализ онко генов и антионкогенов, расширяющие
возможности ранней и дифференци альной диагностики рака, позволяю щие выявить группы людей с повы шенным риском развития злокачест венных опухолей, разработать высоко чувствительные и точные прогности ческие критерии, создать новые под ходы в противоопухолевом лечении и т. д., могут значительно повысить эф фективность онкологической помощи и снизить затраты на обследование и лечение онкологических больных.
Рекомендуемая литература
Горбунова В., Баранов В. Введение в моле
кулярную |
диагностику |
и |
генотерапию |
||
наследственных заболеваний. — СПб.: |
|||||
Специальная литература, |
1997. |
||||
Зборовская |
И. |
Молекулярно-биологиче- |
|||
ские маркеры при раке толстой кишки |
|||||
// Новое в терапии колоректального |
|||||
рака. - М., 2001. - С. 17 - 28 . |
|||||
Зборовская |
И., |
Татосян А. |
|
Молекулярно- |
|
генетические маркеры при раке легко |
|||||
го: онкогены и гены-супрессоры // Но |
|||||
вое в терапии рака легкого. — М., 1997. |
|||||
- С. 5 - 17 . |
|
|
|
||
Зборовская |
И. |
Б., |
Ельчева |
И. Α., Татосян |
|
А. Г. Молекулярно-генетические иссле |
|||||
дования рака |
молочной |
железы: онко |
|||
гены и гены-супрессоры // Новое в те рапии рака молочной железы. — М., 1998. - С. 5 - 17 .
Карпшценко |
А. |
И., Антонов |
В. |
Г., Бутенко |
А. Б. и |
др. |
Онкомаркеры |
и |
их диагно |
стическое значение. — СПб.: Изд-во Воен.-мед. акад., 1999.
Копнин Б. П. Мишени действия онкогенов и опухолевых супрессоров: ключ к по ниманию базовых механизмов канце рогенеза // Биохимия. — 2000. — № 65, т. 1. - С. 5 - 3 3 .
Новик Α. Α., Белохвостое А. С. Молекуляр но-генетические исследования в онкогематологии // Диагностика и лечение злокачественных лимфом. — СПб.: Изд-во Воен.-мед. акад., 1997. — С. 64.
Сипу М., Kramar Α., Courjal F. et al. Relating genotype and phenotype in breast cancer: an analysis of the prognostic significance of amplification at eight different genes or loci and of p53 // Cancer Res. — 2000. — Vol. 60. - P. 1077-1083.
Ellisen L, Haber D. Hereditary breast cancer // Ann. Rev. Med. - 1998. - Vol. 49. - P. 425 - 436 .
538
Eng С, |
Clayton D., |
Schuffenecker |
I. |
et |
al. The |
лекулярной биологии и вирусологии. |
|||||||||||||||||||||||||
relationship between specific RET proto- |
Следует ожидать, |
что |
совершенствова |
||||||||||||||||||||||||||||
oncogen |
mutation and |
disease |
phenotype |
ние |
методов |
генной |
|
терапии |
весьма |
||||||||||||||||||||||
in |
multiple endocrine |
neoplasia |
type 2 |
|
// |
|
|||||||||||||||||||||||||
|
скоро |
приведет |
к конкретным |
резуль |
|||||||||||||||||||||||||||
J. A. M. A. |
- |
1996. |
- |
|
Vol. |
276. |
|
- |
|||||||||||||||||||||||
|
|
татам |
в борьбе |
с |
некоторыми |
генети |
|||||||||||||||||||||||||
P. 1575-1580. |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
ческими, |
иммунологическими, |
онко |
|||||||||||||||||||
Harris |
C, |
|
Hollstein |
M. Clinical |
implication |
|
of |
||||||||||||||||||||||||
|
|
логическими |
и даже |
инфекционными |
|||||||||||||||||||||||||||
the p53 tumor suppressor gene // New |
|||||||||||||||||||||||||||||||
заболеваниями |
|
человека. |
|
|
|
|
|
||||||||||||||||||||||||
Engl. |
|
J. |
Med. |
- |
1993. |
- |
Vol. |
329. |
- |
|
|
|
|
|
|
||||||||||||||||
P. 1318-1327. |
|
|
|
|
|
|
|
|
|
|
В целом генную терапию следует |
||||||||||||||||||||
Lebovitz R. M., Albrecht S. |
Use |
of |
oncogene |
рассматривать |
как клиническую стра |
||||||||||||||||||||||||||
markers in diagnosis // Cancer Invest. — |
тегию, при которой |
генетический |
ре |
||||||||||||||||||||||||||||
1992. |
|
- Vol. |
10. |
- |
P. |
399-416. |
|
|
|
|
пертуар соматических клеток модифи |
||||||||||||||||||||
Leichman |
|
C. |
G. |
Molecular assistant |
of |
re |
|||||||||||||||||||||||||
|
цируется |
или |
|
корректируется |
путем |
||||||||||||||||||||||||||
sponse |
in |
coloreatal |
cance: A fork |
in |
the |
|
|||||||||||||||||||||||||
введения новых генов с целью получе |
|||||||||||||||||||||||||||||||
road |
|
// |
ASCO |
Educatinal |
book |
/ |
Ed. |
||||||||||||||||||||||||
|
ния терапевтического эффекта. С |
мо |
|||||||||||||||||||||||||||||
M. C. |
Perry. - |
2001. |
- P. |
317-324. |
|
|
|||||||||||||||||||||||||
|
|
мента |
использования |
первых |
генети |
||||||||||||||||||||||||||
Loeb L. A mutator phenotype in cancer // |
|||||||||||||||||||||||||||||||
ческих конструкций для терапии про |
|||||||||||||||||||||||||||||||
Cancer Res. — 2001. — Vol.61. — |
|||||||||||||||||||||||||||||||
P. 3230-3239. |
|
|
|
|
|
|
|
|
|
|
шло более 10 лет. Несмотря на отно |
||||||||||||||||||||
Molecular |
|
diagnostic |
of |
cancer: |
Methods |
|
in |
сительную |
молодость |
|
этого |
|
направле |
||||||||||||||||||
molecular medicine / Ed. F. A. Cotter. — |
ния, |
к 1998 |
г. в |
мире |
утверждено |
бо |
|||||||||||||||||||||||||
Human Press. Totova N. J. (USA), |
1996. |
лее |
300 клинических протоколов лече |
||||||||||||||||||||||||||||
Molecular |
diagnosis |
of genetic diseases: |
|
Meth |
|||||||||||||||||||||||||||
|
ния, а генетические конструкции при |
||||||||||||||||||||||||||||||
ods in molecular medicine / Ed. R. Elles. — |
|||||||||||||||||||||||||||||||
менены для |
лечения |
более |
3000 боль |
||||||||||||||||||||||||||||
Human Press. Totova N . J . (USA), |
1996. |
||||||||||||||||||||||||||||||
ных с наследственными |
и |
опухолевы |
|||||||||||||||||||||||||||||
Ronai |
Z. |
|
Ras |
oncogen |
detection in |
preneo |
|||||||||||||||||||||||||
|
ми заболеваниями. |
|
|
|
|
|
|
|
|||||||||||||||||||||||
plastic lesions: Possible applications for di |
|
|
|
|
|
|
|
||||||||||||||||||||||||
Помимо |
создания |
конструкций, |
|||||||||||||||||||||||||||||
agnosis and prevention // Oncology Re |
|||||||||||||||||||||||||||||||
search. - |
1992. |
- Vol. |
4. |
- |
P. 4 5 - 4 8 . |
|
долговременно |
|
экспрессирующих |
"те |
|||||||||||||||||||||
Sinicrope F. A. New approaches for early de |
рапевтический" |
ген, |
важнейшей про |
||||||||||||||||||||||||||||
tection, chemoprevention |
and |
prognosti |
блемой генетической |
терапии остается |
|||||||||||||||||||||||||||
cation |
of coloreatal cancer // ASCO |
Edu |
эффективная |
и |
специфическая |
дос |
|||||||||||||||||||||||||
catinal book / Ed. M. C. Perry. — |
2001. |
- |
|||||||||||||||||||||||||||||
тавка |
этих |
конструкций |
в |
клетки |
па |
||||||||||||||||||||||||||
P. 332-340. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
циента. Существует два принципиаль |
||||||||||||||||||||
Srivastava |
|
S., |
Lippman |
S., |
Hong |
W. et |
al. Ear |
||||||||||||||||||||||||
|
ных |
|
способа |
|
доставки |
терапевтиче |
|||||||||||||||||||||||||
ly detection of Cancer // Molecular |
|
|
|||||||||||||||||||||||||||||
Markers. — New York: Futura Publishing |
ских генов — вирусные и невирусные, |
||||||||||||||||||||||||||||||
Company Inc, 1994. |
|
|
|
|
|
|
|
|
|
причем каждый из них может быть |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
использован как in vivo, так и ex vivo. |
|||||||||||||||
12.3. |
Генная терапия |
|
|
|
|
|
|
Напомним, |
что доставка |
in |
vivo пред |
||||||||||||||||||||
|
|
|
|
|
|
полагает |
непосредственное |
введение |
|||||||||||||||||||||||
на основе вирусных |
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
генетических |
|
конструкций |
|
в |
клетки |
||||||||||||||||||||
векторов |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
опухоли, лимфоциты или лимфоид- |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
В. А. |
Морозов |
|
|
|
|
|
|
|
|
|
|
ные органы, тогда как доставка ex vivo |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
предполагает |
исходно |
|
введение |
конст |
|||||||||||
Прогресс фундаментальных |
иссле |
рукций в клетки донора in vitro с по |
|||||||||||||||||||||||||||||
дований неизменно приводит к появ |
следующим их |
|
возвращением |
донору. |
|||||||||||||||||||||||||||
лению и развитию новых прикладных |
Первоначальные |
протоколы |
лечения |
||||||||||||||||||||||||||||
направлений, что в конечном счете |
строились большей частью на подходе |
||||||||||||||||||||||||||||||
оправдывает с избытком все предыду |
ex vivo. Позднее и вплоть до настоя |
||||||||||||||||||||||||||||||
щие затраты на развитие фундамен |
щего времени все больше используют |
||||||||||||||||||||||||||||||
тальных наук. Прекрасным тому при |
подходы in vivo. Именно для доставки |
||||||||||||||||||||||||||||||
мером |
|
служит |
бурно |
прогрессирую |
in vivo наиболее перспективным пред |
||||||||||||||||||||||||||
щая генная терапия, поскольку успехи |
ставляется |
|
использование |
|
вирусных |
||||||||||||||||||||||||||
этого |
прикладного |
направления |
на |
векторов. |
Поскольку |
|
применяемые в |
||||||||||||||||||||||||
прямую |
|
связаны |
с достижениями |
мо |
генетической |
терапии |
вирусы |
отно- |
|||||||||||||||||||||||
539
Т а б л и ц а |
12.16. |
Свойства |
вирусов, ис |
роткими (100 п.н.) инвертированными |
|||||||||||||||||||||||
пользуемых для создания векторов |
|
|
концевыми |
повторами, |
позволяющи |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ми |
образовывать |
кольцевые |
|
структу |
||||||||||
|
|
|
|
Разме |
|
|
|
|
|
|
|
||||||||||||||||
|
Ге |
|
Инте |
|
|
|
ры. |
|
Структура |
генома |
аденовирусов |
||||||||||||||||
|
|
ры ин |
|
гра |
|
|
|
позволяет теоретически |
ввести до |
30 |
|||||||||||||||||
Вирус |
ном, |
|
|
сер |
|
|
Титр |
||||||||||||||||||||
|
|
ция в |
|
т. п.н. чужеродной |
генетической |
ин |
|||||||||||||||||||||
|
т.п.н. |
|
|
ции, |
|
|
|
||||||||||||||||||||
|
|
|
геном |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
т.п.н. |
|
|
|
формации. Хотя аденовирусы облада |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ют низкой патогенностью, они тем не |
||||||||||||||
Ретрови- |
8 - 1 2 |
|
|
Око |
|
Да |
|
106-107 |
|
||||||||||||||||||
|
|
|
|
|
менее способны легко заражать разно |
||||||||||||||||||||||
русы |
|
|
|
|
ло 7 |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
образные делящиеся |
и |
неделящиеся |
|||||||||||||||
Аденови |
|
36 |
|
|
8 |
|
|
Нет |
|
1011-1012 |
|
||||||||||||||||
русы |
|
|
|
|
|
|
|
|
|
|
|
|
клетки, |
поскольку |
рецепторами |
|
для |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
вируса |
являются |
интегрины |
α ω β 3 |
и |
|||||||||||
Аденоас- |
4,7 |
|
|
4,5 |
|
Да |
|
106-108 |
|
||||||||||||||||||
социиро- |
|
|
|
|
|
|
|
|
|
|
|
|
αω β5 . |
|
В среднем на одну клетку прихо |
||||||||||||
ванные |
|
|
|
|
|
|
|
|
|
|
|
|
дится около 104—105 |
таких молекул. |
|||||||||||||
вирусы |
|
|
|
|
|
|
|
|
|
|
|
|
Для |
аденовирусов |
характерна |
высокая |
|||||||||||
Вирус |
150 |
|
|
25 |
|
|
Нет |
|
109-1010 |
|
продуктивность (титр около 1012 |
час |
|||||||||||||||
герпеса |
|
|
|
|
|
|
|
|
|
|
|
|
тиц в 1 мл), что делает возможным |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
использовать конструкции на |
основе |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
аденовирусов in |
vivo. |
|
|
|
|
|
|
|
||||||
сятся к разным семействам и по-раз |
Репликация |
аденовирусов |
проис |
||||||||||||||||||||||||
ному реплицируются в клетке, их цен |
ходит в клеточном ядре и сопровож |
||||||||||||||||||||||||||
ность как векторов для генетической |
дается почти полным угнетением син |
||||||||||||||||||||||||||
терапии неодинакова. |
|
|
|
|
|
|
теза клеточной Д Н К и белков. Репли- |
||||||||||||||||||||
При |
создании |
генноинженерных |
кативный |
цикл |
аденовирусов |
доста |
|||||||||||||||||||||
конструкций используют |
как |
Д Н К - , |
точно сложен и разделен на раннюю и |
||||||||||||||||||||||||
так и РНК-содержащие вирусы (табл. |
позднюю фазы. В ранней фазе проис |
||||||||||||||||||||||||||
12.16). Среди ДНК-содержащих ви |
ходит |
|
образование |
|
серии |
|
ранних |
||||||||||||||||||||
русов чаще |
используют |
аденовирусы, |
транскриптов, |
синтезирующихся |
|
на |
|||||||||||||||||||||
а среди РНК-содержащих вирусов |
вирусной Д Н К до |
начала ее реплика |
|||||||||||||||||||||||||
ретровирусы чаще всего служат "ос |
ции. В частности, область Е1 является |
||||||||||||||||||||||||||
новами" |
для |
создания |
|
терапевтиче |
критической |
для |
|
|
аденовирусной |
||||||||||||||||||
ских конструкций. Чтобы оценить |
трансформации. Ранние транскрипты |
||||||||||||||||||||||||||
преимущества |
|
и |
недостатки |
каждой |
имеют собственные промоторы. Часть |
||||||||||||||||||||||
из используемых |
вирусных |
систем, |
из этих генов без особого ущерба для |
||||||||||||||||||||||||
ниже представлены |
их |
характеристи |
репликации вируса может быть заме |
||||||||||||||||||||||||
ки, важные с точки зрения генной |
нена терапевтическими генами. Оче |
||||||||||||||||||||||||||
терапии. |
|
|
|
|
|
|
|
|
|
|
|
|
видно, что такая относительно про |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
стая замена делает аденовирусы при |
||||||||||||||
12.3.1. |
ДНК-содержащие |
влекательным объектом для использо |
|||||||||||||||||||||||||
вания в |
генетической |
терапии. Обра |
|||||||||||||||||||||||||
вирусы |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
зование |
структурных |
|
белков |
аденови |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
12.3.1.1. Аденовирусы |
|
|
русов |
происходит |
(за |
небольшим |
ис |
||||||||||||||||||||
|
|
ключением) в поздней фазе при уча |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Аденовирусы |
широко |
распростра |
стии |
|
поздних транскриптов |
и |
сопро |
||||||||||||||||||||
вождается |
одновременным |
подавле |
|||||||||||||||||||||||||
нены у животных и |
человека. У чело |
||||||||||||||||||||||||||
нием |
синтеза клеточных белков. |
|
|
||||||||||||||||||||||||
века вирусы ассоциируются в основ |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
ном с острыми респираторными забо |
Наиболее часто при создании век |
||||||||||||||||||||||||||
леваниями, а их связь с онкологиче |
торов |
|
используют |
|
слабоонкогенные |
||||||||||||||||||||||
скими заболеваниями человека не ус |
аденовирусы из подгруппы С, сероти- |
||||||||||||||||||||||||||
тановлена. |
|
|
|
|
|
|
|
|
|
|
|
пов 2 и 5. Эффективность трансфек- |
|||||||||||||||
Геном |
аденовирусов |
|
представляет |
ции аденовирусных конструкций in vi |
|||||||||||||||||||||||
собой |
линейную |
|
двухцепочечную |
vo в клетки человека может составлять |
|||||||||||||||||||||||
Д Н К размером |
|
около |
36 |
т. п.н. с ко |
чуть |
|
более |
10 %, |
|
что |
обеспечивает |
||||||||||||||||
540
достижение заметного терапевтиче ского результата. Наиболее совершен ные аденовирусные конструкции (векторы второго поколения) имеют одновременную делецию двух генов — Е1 и Е4, при этом иммунологическая реакция на такие конструкции у па циентов значительно снижена. Адено вирусные конструкции, в частности, были использованы для лечения муковисцидоза и некоторых опухолевых заболеваний, в том числе опухолей мозга.
Слабой стороной аденовирусов яв ляется выраженный иммунный ответ хозяина против вирусов и кратковре менная (несколько недель) экспрес сия вирусных генов. Поэтому боль ным требуется многократное введение аденовирусных конструкций, что зна чительно осложняет сам процесс ле чения. Поскольку экспрессия адено вирусов требует сложной системы контроля, а сами вирусы обладают выраженной цитотоксичностью, весь ма проблематичным остается вопрос создания клеток для упаковки на ос нове аденовирусов.
12.3.1.2. Аденоассоциированные вирусы
ААВ относительно недавно стали использоваться в качестве основы для создания векторов. ААВ относятся к парвовирусам и для продуктивной ин фекции нуждаются в присутствии ви руса-помощника. Роль вирусов-по мощников могут выполнять либо аде новирусы, либо вирус простого герпе са. Без вируса-помощника ААВ нахо дятся в латентном состоянии. ААВ широко распространены у человека, и антитела к этим вирусам обнаружива ются приблизительно у 80 % населе ния.
Геном ААВ представляет собой одноцепочечную Д Н К (около 4,7 т. п.н.), имеющую две открытые рам ки считывания — Rep и Сар. Продук ты трансляции гена rep необходимы
для |
репликации Д Н К , а гена cap — |
для |
образования капсида вириона. Ре |
цептором для вируса служит мембран ный гликопротеин с мол. массой 150 кДа, названный Erythrocyte Ρ globoside антиген. Некоторые свойства ААВ де лают их перспективным для использо вания в качестве векторов. В частно сти, они способны заражать разнооб разные клетки человека и не ассоции руются с какой-либо патологией. По тенциальным преимуществом ААВ яв ляется их сайт-специфическая инте грация в хромосому 19 человека. К со жалению, все генетические конструк ции на основе ААВ интегрировались случайным образом, что скорее всего свидетельствует о несовершенстве ди зайна векторов. В то же время ААВвекторы, несущие трансген, способны экспрессироваться до 6 мес, что зна чительно превосходит по этому пока зателю аденовирусные конструкции и является серьезным аргументом, сви детельствующим об их стабильной ин теграции в геном клетки. Более того, недавно на модельных системах была продемонстрирована высокая эффек тивность перорального введения ААВвекторов, несущих ген β-галактозида- зы, а также были получены перспек тивные клетки для упаковки (см. раз дел 11.3.3.4), основанные на ААВ. ААВ-векторы, кроме применения для лечения циститного фиброза, были использованы как средства доставки в клетки мозга и гематопоэтические клетки. Однако геном ААВ невелик, потенциально можно манипулиро вать областью, не превышающей 4,5 т. п.н., и получаемый титр вируса от носительно невысок, что существенно сокращает возможности его клиниче ского использования.
12.3.1.3. Вирус простого герпеса 1 человека
Недавно было предложено исполь зовать ВПГ-1 в качестве генетическо го вектора, но эти работы находятся пока в начальной стадии разработки. Напомним, что вирусы герпеса очень широко распространены в природе и способны длительное время оставать-
541
ся у носителя в латентном состоянии. Персистенция вируса происходит без интеграции в геном клетки. Рецепто ром для вируса служит рецептор для протеогликанов.
Генетический материал ВПГ-1 представлен двухцепочечной Д Н К размером около 150 т. п.н. Большой геном позволяет ввести до 25 т. п.н. чужеродного генетического материа ла, что позволяет одновременно при менять несколько терапевтических ге нов. В частности, в опытах на живот ных показана эффективность конст рукций, содержащих гены ТК и фак тора некроза опухолей-α, при лечении глиобластомы, однако большой геном заметно усложняет анализ функцио нирования рекомбинантных конст рукций и самих терапевтических ге нов. Предполагается, в частности, что векторы на основе ВПГ-1 будут иметь преимущества при лечении опухолей мозга и заболеваний периферической нервной системы.
12.3.2. Невирусные способы доставки
Кроме вирусных векторов, сущест вуют и невирусные способы доставки генетического материала в клетки, в частности с помощью синтетических катионовых липосом. Процедура при готовления таких синтетических кон струкций достаточно проста. Положи тельно заряженная липосома погло щает отрицательно заряженный трансген с набором регуляторных по следовательностей, и затем при кон такте происходит слияние этого ком плекса с клеткой. Использование ли посом позволяет избежать формиро вания рекомбинантных ретровирусов, а сама процедура введения липосом в клетку напоминает классические про цедуры трансфекции эукариотических клеток. Теоретически в липосомы можно вводить не ограниченные по размерам конструкции, и они не будут вызывать воспалительных реакций, так как не содержат в своем составе белков. В то же время опыт показыва-
Т а б л и ц а |
12.17. |
Векторы, используемые |
||
для лечения |
|
|||
|
|
|
|
|
|
|
Про |
|
|
Векторы |
|
токо |
|
Страны |
|
|
лы |
|
|
|
|
|
|
|
Ретрови- |
|
93 |
|
США, Франция, Гол |
русные |
|
|
|
ландия, Великобрита |
|
|
|
|
ния, Италия, Китай |
Аденови |
|
18 |
|
США, Франция |
русные |
|
|
|
|
Липо- |
|
16 |
|
США, Великобрита |
фекция |
|
|
|
ния, Германия, Австрия |
ААВ |
|
1 |
|
С Ш А |
|
|
|
|
|
ет, что такие конструкции не обеспе чивают высокой эффективности транс фекции. Одна из причин этого — не возможность доставки трансгена не посредственно в ядро. Хотя эти кон струкции используют в клинике, но не так широко, как вирусные методы доставки, поэтому более подробно мы их рассматривать не будем.
Чистая Д Н К трансгена сама по се бе без каких-либо носителей может быть доставлена в клетки с использо ванием трансфекции, однако такая Д Н К может быть иммунногенной, она чувствительна к действию клеточных нуклеаз, а эффективность трансфек ции обычно низка.
Частота использования тех или иных конструкций для генетической терапии приведена в табл. 12.17.
12.3.3. РНК-содержащие вирусы
Самой популярной основой среди вирусных векторов являются ретровирусы (включая и лентивирусы). На та ких векторах мы остановимся более подробно. Анализ их структур и осо бенностей функционирования будет изложен ниже. Кратко же их преиму щества сводятся к стабильной инте грации в геном клетки, возможности создавать лабораторные псевдотипы (например, с вирусом везикулярного стоматита), а также способности лентивирусных векторов заражать покоя-
542

щиеся клетки. Поскольку геном ретровирусов относительно невелик, то чаще всего в ретровирусные конструк ции вводят один (редко два) терапев тический ген. Ретровирусные конст рукции с LTR способны интегриро ваться в геном, а в дальнейшем пере даются по наследству как классиче ские "менделевские" гены. Таким об разом, они могут стабильно реплици роваться на протяжении всей жизни хозяина, обеспечивая при этом посто янную экспрессию трансгена.
12.3.3.1. Принципы создания ретровирусного вектора на основе вируса лейкоза мышей Mo-MuLV
Начиная с 1989 г., когда ретровирусы впервые были применены для генетической терапии, и по настоящее время подавляющее большинство конструкций основано на Mo-MuLV. Кроме того, этот вирус широко ис пользуется при создании клеток для упаковки, поэтому остановимся на ха рактеристике Mo-MuLV чуть подроб нее. Напомним, что Mo-MuLV — это ретровирус с простым геномом и мор фологией частиц типа С. Геном виру са состоит из трех генов. Это ген gag, кодирующий структурные внутрен ние белки вириона, ген pol, кодирую щий обратную транскриптазу, и ген env, кодирующий белки оболочки ви риона (схема 12.1).
Морфогенез ретровирусов типа С происходит на внутренней стороне
плазматической мембраны клетки. Участниками начальных этапов этого процесса являются белки-предшест венники структурных внутренних бел ков (кодируемые геном gag) и полно размерная вирусная Р Н К . Поскольку в цитоплазме клеток, помимо вирус ных Р Н К , присутствуют разнообраз ные клеточные Р Н К , то очевидно, что вирусный белок-предшественник дол жен иметь возможность отобрать именно вирусную Р Н К для упаковки ее в частицу. Действительно, при фор мировании вирусной частицы отбор и упаковка вирусной Р Н К происходят при активном участии мотивов типа "цинковый палец", находящихся в со ставе NC части белка-предшественни ка. В свою очередь вирусная геномная Р Н К имеет область ψ между LTR и ге ном gag, и эта область распознается "цинковым пальцем" N C . Таким обра зом, взаимодействие белка NC и ψ об ласти Р Н К является начальным и принципиальным этапом при форми ровании полноценной ретровирусной частицы. Размер ψ варьирует от виру са к вирусу. У вируса мышей Молони
ψ |
область |
составляет |
примерно |
300 п.н., а |
наименьшая из |
известных |
|
ψ областей (примерно 40 п.н.) выявле на у вируса иммунодефицита челове ка. Напомним, что полноценная ви русная частица содержит две цепи плюс - РНК .
Рецептором для амфотропного ви руса служит транспортер фосфата Pit- 2, широко представленный в различ ных типах клеток. Структура этого
С х е м а 12.1. Структура генома вируса лейкоза мышей Молони
SD — донор сплайсинга; SA — акцептор сплайсинга; ppt — полипуриновый тракт; fs — сайт проскока стоп-кодона; AAA — Поли-А; Ψ — область, отвечающая за упаковку РНК
543
белка включает 10 трансмембранных доменов и 5 внеклеточных петель. Связывание вируса с клеточным ре цептором является начальным этапом заражения вирусом клетки. Для ус пешного проникновения вируса в клетку требуется, чтобы Pit-2 был свя зан с актиновыми интрацитоплазматическими филаментами. Следую щим этапом после попадания вирус ной частицы в клетку является обрат ная транскрипция — синтез к Д Н К на матрице Р Н К с последующей инте грацией этой Д Н К в геном клетки-хо зяина. С большой долей уверенности можно считать, что интеграция провируса в клеточный геном носит слу чайный характер. В результате геном вируса начинает существовать в фор ме провируса, подчиняясь всем зако нам классической генетики.
Очевидно, что наиболее простой вариант ретровирусного вектора — это репликативно-полноценный вектор, содержащий, помимо основных ви русных генов, еще и терапевтический ген. Такие конструкции были созданы и по своей организации напоминали хорошо известный вирус саркомы Рауса птиц, имеющий, кроме генов gag, pol, env, еще и ген src. Однако почти сразу стало очевидно, что ис пользование этих конструкций in vivo может принести больше вреда, чем пользы, поскольку образующиеся полноценные вирусные частицы мог ли заражать не только "больные", но . многочисленные "здоровые" клетки, активно интегрировать в геном клетки
ции, у которых один или несколько вирусных генов были заменены одним или двумя терапевтическими (маркер ными) генами. Были созданы конст рукции, сохранившие от ретровирусов только LTR, которые выполняли роль промоторов для трансгена и обеспечи вали этим конструкциям эффектив ную экспрессию и интеграцию в ге ном клетки. Помимо Mo-MuLV, практически все известные ретровирусы были в той или иной степени ап робированы в качестве основы для те рапевтических конструкций. В их чис ле — вирусы лейкоза птиц, ретровирусы обезьян, эндогенные вирусы обезь ян и кошек, вирус лейкоза крупного рогатого скота, пенящий вирус чело века и вирус иммунодефицита чело века.
Несмотря на впечатляющее разно образие ретровирусных векторов, есть ряд общих элементов, которые пред ставлены в подавляющем большинст ве конструкций и присутствие кото рых необходимо для их эффективной работы. Ниже приведена их краткая характеристика.
12.3.3.2. Необходимые элементы ретровирусных векторов
В этом разделе мы кратко остано вимся на характеристике отдельных элементов, используемых при созда нии ретровирусного вектора.
1. Длинные концевые повторы. LTR являются принципиальными элемента
ииндуцировать экспрессию самых ми, обеспечивающими транскрипцию
разных нежелательных генов клеткихозяина. Более того, в результате ре комбинации с эндогенными провирусами могли быть образованы новые ретровирусные частицы с непредска зуемыми свойствами. По этим причи нам от простого введения терапевти ческого гена в геном ретровируса ско ро отказались.
Следующий вариант, а точнее — многочисленные варианты ретровирусных векторов, представляли собой репликативно-дефектные конструк
и интеграцию вируса в геном клетки. Ретровирусные конструкции могут иметь в своем составе оба или один 5'-концевой LTR. Напомним, что LTR имеют сложную структуру и состоят из набора регуляторных (транскрипцион ных) и функционально важных участ ков, в том числе энхансера, промотора, сигнала полиаденилирования, области связывания РНК-затравки, части об ласти ψ и, наконец, полипуринового тракта. Кратко остановимся на харак теристике LTR.
544
LTR делится на три области — U5, R и U3. Наиболее сложной является область U3 . В ней, в частности, рас положены энхансер и промотор, по следний в своем составе имеет ТАТАобласть. В каждой клетке находится большое количество разнообразных активаторов транскрипции, но энхан сер взаимодействует лишь с относи тельно небольшим их числом. Многие из сайтов взаимодействия с энхансером взаимно перекрываются, позво ляя, вероятно, осуществлять конку рентное взаимодействие клеточных факторов в определенных условиях клеточного микроокружения. Таким образом, эти области непосредственно взаимодействуют с определенными клеточными факторами и с их помо щью осуществляют регуляцию экс прессии провируса. В составе U3 (5'-конец) находятся и локусы, осуще ствляющие негативную регуляцию, в частности с помощью ELP. Другая об ласть негативной регуляции располо жена за пределами LTR и находится в районе связывания РНК-затравки.
Для экспрессии ретровирусных белков в ряде конструкций прибегают к использованию единственного про мотора, расположенного на 5'-конце- вом LTR. Другим важным элементом в составе LTR являются короткие ин вертированные повторы, расположен ные на концах LTR, которые служат, в частности, для интеграции прови руса.
2. Область ψ. Особенности и роль области ψ были рассмотрены выше. Напомним, что она является маркер ной и необходима для выборочного захвата "цинковым пальцем" нуклеокапсидной области (белка-предшест венника) ψ+ Р Н К из всей массы кле точных Р Н К . У большинства ретровирусов ψ включает 3'-концевую область 5'-LTR и несколько десятков нуклеотидов, входящих в состав гена gag. Размеры ψ у ретровирусов неодинако вы. Важно подчеркнуть, что область ψ ретровируса одного рода слабо или вообще не распознается нуклеокапсидным белком ретровируса другого
рода. Очевидно, что наличие ψ в лю бой конструкции обеспечивает успеш ную упаковку транскрипта в вирусную частицу, что принципиально важно при работе с клетками, предназначен ными для упаковки. Удаление области ψ (или ее модификация) из состава провируса обычно приводит к форми рованию "пустых" вирионов.
3. Дополнительные промоторы.
Строго говоря, дополнительные (внут ренние) промоторы не являются необ ходимым элементом ретровирусных векторов, однако они часто использу ются для более эффективной экспрес сии терапевтического гена. Уже давно и широко в таком качестве использу ют промоторы вируса обезьян SV 40, CMV человека, β-актина человека и некоторые другие. Отдельные конст рукции могут содержать до трех до полнительных промоторов, однако в таких конструкциях после селекции по одному из генов может наблюдать ся ослабление экспрессии других ге нов. Это явление известно как "су прессия промотора". В последнее вре мя в конструкциях векторов часто ис пользуют так называемые IRES, пред ставляющие собой дополнительные области посадки рибосом, позволяю щие осуществлять независимую трансляцию в направлении 3' от IRES. Открытые в 1990 г. в составе пикорнавирусов IRES-элементы затем были обнаружены в составе вируса энцефаломиелокардита и вируса везикуляр ной болезни свиней.
4. Селективные и маркерные гены.
Как правило, эффективность транс фекции или инфекции генетическими конструкциями недостаточно велика, поэтому для успешного отбора трансфицированных или зараженных кле ток ex vivo в эти конструкции необхо димо вводить дополнительно селек тивные гены. Пожалуй, на первом месте по частоте использования стоят гены устойчивости к неомицину и ам пициллину, которые позволяют про водить селекцию клеток на устойчи вость к этим антибиотикам. Часто ис пользуют мутантный ген гидрофолат-
3 5 - 7 9 08 Д. Г. Заридзе |
545 |
редуктазы мышей, обеспечивающий трансфицированным клеткам устой чивость к метотрексату.
Маркерные гены начали использо вать раньше терапевтических генов, и сами по себе они не несут терапевти ческой нагрузки. Задача маркерных генов состоит в демонстрации эффек тивности работы конструкции, что особенно важно при проведении как первой, так и второй фаз испытания генетических конструкций in vivo (на безопасность и на эффективность со ответственно). Среди маркерных ге нов удобен ген β-галактозидазы, экс прессия которого на мембране клетки позволяет проводить отбор, используя для этого клеточные сортеры. В целом же маркерным геном может служить любой нетоксичный ген, который в норме не экспрессируется клеткой. Конструкции с такими генами тести руют не только in vitro, но и in vivo (на добровольцах). В качестве маркерных генов часто используют гены, экс прессию которых можно выявить с помощью гистохимических реакций. Маркерные гены необходимы и при использовании генетических конст рукций ex vivo. При использовании некоторых конструкций экспрессия генетических маркеров в клетках мо жет свидетельствовать не только об успешной трансфекции (инфекции), но также об экспрессии терапевтиче ского гена.
5. Терапевтические гены и принци пы их действия. Ключевым элемен том, обеспечивающим терапевтиче ский эффект всей конструкции, явля ются так называемые терапевтические гены. Строго говоря, терапевтические гены могут не только вылечить клет ку, но и вызвать ее гибель, если, на пример, это опухолевая клетка. Набор имеющихся сейчас терапевтических генов достаточно велик. Среди них есть "ветераны" генной терапии (такие как ген Ил-2), использование которых продолжается до настоящего времени; другие цитокины, такие как Ил-4, Ил-7, Ил-10, Ил-12, а также совсем новые гены — такие как фактор IX,
анти-k-ras и некоторые гены, участ вующие в регуляции клеточного деле ния. Всего в настоящее время исполь зуется более 40 терапевтических ге нов. Ниже представлены некоторые из них.
Интерлейкин-2. Ген Ил-2 исполь зовался в ряде ретровирусных генети ческих конструкций, примененных ех vivo для лечения некоторых онкологи ческих и иммунологических заболева ний. Продукт трансляции гена Ил-2 представляет собой гликопротеин с мол. массой около 15 кДа. Ил-2 явля ется цитокином, обладающим выра женным стимулирующим действием на иммунный ответ. Ил-2, в частно сти, стимулирует пролиферацию NK - клеток и увеличивает цитолитическую активность лимфокин-активирован- ных киллеров. В свою очередь эти клетки, обладающие выраженной противоопухолевой активностью, спо собствуют частичной регрессии опу холей. Ил-2 используют при лечении меланом и карцином кожи.
Интерлейкины-4, -10. Для лечения аутоиммунных заболеваний в качестве трансгенов (помимо инсулина) при меняют цитокины, обладающие анти воспалительным действием (Ил-4 и Ил-10), а также гены антагонистов некоторых цитокинов, ассоциирован ных с воспалением. Эффективность их использования была показана на животных и отдельных, правда, не многочисленных, терапевтических ис следованиях на больных. У мышей, в частности, Ил-10 (доставленный в липосоме) был успешно применен для лечения аутоиммунного тироидита.
Р53. Клеточный белок с мол. мас сой 53 кДа (р53) является одним из наиболее полно изученных опухоле вых супрессоров. Он кодируется ге ном ТР53 и регулирует прохождение клетками фазы G1-S. В случае обна
ружения |
значительного повреждения |
Д Н К р53 |
прекращает деление клеток |
и включает механизм апоптоза, поэто му р53 получил название "молекуляр ный полицейский". р53 фосфорилирован, локализован в клеточном ядре и
546
является трансактиватором широкого действия, взаимодействуя с разнооб разными промоторами, в том числе промоторами циклинов и факторов репарации. Мутации р53 выявляются при многих онкологических заболева ниях, поэтому разнообразные генети ческие конструкции с геном р53 ши роко используют для терапии злокаче ственных новообразований человека.
Мутации еще одного опухолевого супрессора — RIZ1, относящегося к семейству ацетилтрансфераз, часто наблюдаются в опухолях. RIZ1 участ вует в апоптозе и регулирует прохож дение клетками фазы G2/M . Созданы и успешно проходят испытания на животных аденовирусные векторы, несущие этот ген.
Аденозиндезаминаза. Отсутствие АДА представляет собой редкое (встречается у 1 из 100 000) генетиче ское заболевание, приводящее к силь ному иммунному дефициту у детей, связанному с нарушением формиро вания нормальной иммунной систе мы. Без лечения смерть больных обычно наступает в первые годы жиз ни. Мутация гена АДА приводит к ак кумуляции аденозина и 2-деоксиаде- нозина, которые токсичны для лим фоцитов. Регулярное внутривенное введение фермента совместно с полиэтиленгликолем несколько улучшает клиническое состояние больных, но полного излечения не наступает. Та кие больные продолжают страдать от оппортунистических инфекций и име ют крайне низкий уровень иммуног лобулинов.
Bcl-2. Роль и механизмы апоптоза при неоплазиях постепенно начинают определяться. В частности, выявлены белки, принимающие непосредствен ное участие в апоптозе. Это, в частно сти, клеточные белки bcl-2, р53 и бел ки аденовирусов Е1А и Е1В. Такие белки, как р53 и Е1А, активируют апоптоз, a bcl-2 и El В его угнетают. В этой связи использование в генетиче ских конструкциях генов р53 и Е1А обеспечивает гибель трансфицированной клетки, тогда как использование
35*
генов bcl-2 и Е1В, наоборот, защища ет их от естественной гибели. Ген bcl- 2 является протоонкогеном и кодиру ет белок с мол. массой 26 кДа, кото рый преимущественно локализован в митохондриях, эндоплазматическом ретикулуме и ядерных мембранах. В норме bcl-2 и его гомологи осуществ ляют контроль за апоптозом Т- и В- клеток в процессе развития лимфоидной системы.
Тимидинкиназа (ТК) вируса просто го герпеса. Ген ТК широко использу ют в конструкциях, применяемых для терапии опухолей мозга. ТК относит ся к группе так называемых генов-от равителей, или "самоубийц". Продукт трансляции гена ТК является фосфопротеином с мол. массой около 40 кДа. Принцип действия ТК в трансфицированных опухолевых клетках сводится к следующему. После начала экспрессии ТК в клетках больному внутривенно вводят ганцикловир (нуклеозидный аналог 2'-деоксигуани- дина). В клетках с помощью ТК про исходит фосфорилирование этого со единения с образованием его моно фосфата. При участии уже клеточных фосфатаз монофосфат фосфорилируется до токсичного трифосфата, кото рый во время репликации встраивает ся в Д Н К и ингибирует ее, вызывая гибель ("самоубийство") активно деля щихся опухолевых клеток.
12.3.3.3. Структура некоторых ретровирусных конструкций
В настоящее время используют не сколько десятков видов ретровирус ных конструкций. Структурная орга низация некоторых из них представ лена на схеме 12.2.
А. Векторы с одним промотором в LTR. Этот вариант векторов наиболее простой. Его усовершенствованный вариант может иметь измененную об ласть энхансера или самого промотора LTR с целью обеспечения тканеспецифической экспрессии конструкции.
Б. Векторы с несколькими промо торами. Использование внутренних
547
или дополнительных промоторов по зволяет, кроме экспрессии трансгена, одновременно проводить селекцию трансфицированных клеток в случае, если под одним из промоторов нахо дится селективный или маркерный ген.
В. Векторы, использующие меха низм альтернативного сплайсинга. Для одновременной экспрессии двух или более терапевтических белков прибе гают к созданию конструкций, ис пользующих механизм сплайсинга. Это позволяет, применяя один промо тор, получать полноразмерную и сплайсированную Р Н К и в результате иметь различные белки. Близкий по принципу вариант строится на введе нии в конструкцию области дополни тельной посадки рибосом (IRES).
щихся векторов был сконструирован таким образом, что прямые повторы фланкируют ψ так, чтобы эта область удалялась во время обратной транс крипции, в результате чего в дальней шем образуются пустые частицы. Та кие конструкции могут быть особенно полезны, когда требуется остановить дальнейшее распространение вектора.
12.3.3.4. Клетки для упаковки
Клетки для упаковки создаются с целью экспрессии репликативно-пол- ноценного вируса, получаемого в ре зультате рекомбинации между дефект ным вирусом-помощником, экспрессируемым клеткой, и искусственно введенной в клетку Р Н К , имеющей сигнал для упаковки (ψ). Другими
Г.Векторы со встроенными IRES. словами, клетки для упаковки произ
Такие конструкции с одним промото ром могут экспрессировать и как два различных белка, и как разные облас ти одного и того же белка.
Д. Векторы, кодирующие слитые белки. Такие векторы, имеющие один промотор, создаются по аналогии с некоторыми онкогенными вирусами, имеющими слитые вирусную и кле точную части. Теоретически создание слитых белков может быть полезно с точки зрения получения нового тера певтического эффекта. Однако опыт показывает, что такие гибриды обыч но функционируют хуже, чем каждая из их частей в отдельности.
Чуть подробнее остановимся на самоинактивирующихся векторах, кото рые стали широко использовать в по следнее время. Первые самоинактивирующиеся векторы были сконструи рованы путем делеций транскрипци онного энхансера или энхансера и промотора в Ш-области З'-LTR. По сле одного раунда репликации вируса эти изменения копируются в обеих 5'- и З'-LTR, образуя при этом неактив ный провирус, однако все внутренние промоторы при этом не инактивируются, что может быть опасным для использования в генетической тера пии. Другой тип самоинактивирую-
водят все необходимые элементы для
создания вирусной частицы, |
но они |
||
не способны |
упаковать |
в |
частицу |
свою собственную Р Н К , |
так |
как их |
|
Р Н К лишена ψ. |
После трансфекции в |
||
такие клетки вектора, имеющего, кро ме трансгена, область ψ, синтезируе мые векторные ψ+ Р Н К будут упако вываться в вирусные частицы. В ре зультате этого образуется популяция инфекционных вирусных частиц, не сущих вместо полноразмерной Р Н К вируса ψ+ Р Н К трансгена. Заражение клеток такими вирусами обеспечивает доставку трансгена в эти клетки, од нако новая популяция вирусных час тиц в этих клетках уже не может обра зоваться (схема 12.2).
Основой создания клеток для упа ковки часто служат либо мышиные клетки, либо клетки человека, проду цирующие амфотропный ретровирус мышей. Напомним, что амфотропные ретровирусы способны заражать не только клетки данного вида, но и клетки других видов, включая клетки человека. В первых вариантах клеток для упаковки были использованы реп- ликативно-компетентные ретровиру сы, у которых была удалена область ψ, однако в таких клетках сохранялась высокая вероятность рекомбинации с
548

С х е м а 12.2. Ретровирусные конструкции, используемые в
генетической терапии (по Coffin и др., 1997)
Χ, Υ — гены, кодирующие белки; стрелка — промотор; SD и SA — акцептор и донор сплайсинга; Ψ — область, отвечающая за упаков ку РНК; LTR — длинные концевые повторы
образованием |
репликативно-полно- |
ния вирусной частицы, но они не |
|||||||||||||
ценного вируса. В связи с этим для |
способны упаковать в частицу свою |
||||||||||||||
уменьшения вероятности |
гомологич |
собственную |
Р Н К , |
так как |
эта |
Р Н К |
|||||||||
ной |
рекомбинации |
с |
эндогенными |
лишена сигнала для упаковки — ψ. |
|||||||||||
ретровирусами |
(или |
терапевтическим |
После трансфекции в такие клетки |
||||||||||||
вектором) |
современные |
|
клетки |
для |
вектора, |
имеющего, |
кроме |
трансгена |
|||||||
упаковки |
трансфицируют |
двумя |
или |
область |
ψ, |
синтезируемые |
векторные |
||||||||
тремя |
взаимодополняющими |
конст |
ψ+ Р Н К , будут упаковываться в вирус |
||||||||||||
рукциями. Очевидно, что ни одна из |
ные частицы. В результате этого обра |
||||||||||||||
этих конструкций не должна иметь |
зуется популяция инфекционных ви |
||||||||||||||
области ψ. В настоящее время получе |
русных частиц, несущих вместо пол |
||||||||||||||
но более 30 вариантов клеток для упа |
норазмерной |
Р Н К |
вируса |
ψ + |
Р Н К |
||||||||||
ковки. В некоторых из них можно по |
трансгена. Заражение клеток такими |
||||||||||||||
лучить титр частиц до |
107 |
в |
1 |
мл куль- |
вирусами |
обеспечивает |
доставку |
||||||||
туральной |
среды. |
|
|
|
|
|
трансгена в эти клетки. Однако новая |
||||||||
Клетки |
для |
упаковки |
производят |
популяция вирусных частиц в этих |
|||||||||||
всё необходимые элементы для созда |
клетках уже |
не |
может образоваться. |
||||||||||||
549
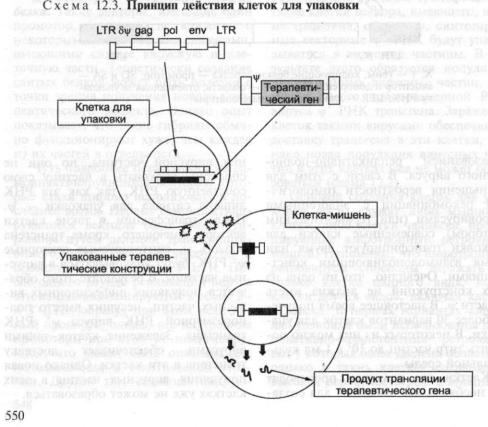
12.3.4.Использование ным. Такую процедуру повторяли
методов |
|
генетической |
|
ежемесячно. Фермент экспрессиро- |
||||||||
терапии |
в |
клинике |
|
|
вался в 50 % лимфоцитов у одного па |
|||||||
|
|
|
|
|
|
|
циента и примерно в 1 % лимфоци |
|||||
12.3.4.1. Генетические болезни |
тов — у другого. Курс внутривенного |
|||||||||||
|
|
|
|
|
|
|
введения АДА продолжается. Похо |
|||||
Дефицит АДА. В 1990 г. было нача |
жие конструкции и подходы были ис |
|||||||||||
то лечение 2 больных детей с исполь |
пользованы для лечения в Японии, |
|||||||||||
зованием |
клинических |
протоколов, |
причем |
полученные результаты соот |
||||||||
основанных на введении аутологич- |
ветствовали описанным выше. Другая |
|||||||||||
ных Т-лимфоцитов. Оба пациента до |
группа |
исследователей |
использовала |
|||||||||
настоящего |
|
времени чувствуют |
себя |
сходные подходы, но одному из двух |
||||||||
хорошо, продолжают получать поли- |
пациентов |
конструкции |
вводили |
не |
||||||||
этиленгликоль с АДА. Уровень Т-лим |
посредственно в костный мозг. Не |
|||||||||||
фоцитов у них остается стабильным. |
смотря |
на |
определенное улучшение |
|||||||||
В 1990 г. был начат курс лечения с |
состояния, полной ремиссии у боль |
|||||||||||
использованием |
ретровирусного |
век |
ных не наблюдалось (схема 12.3). |
|
||||||||
тора с геном АДА под контролем про |
Наследственно-семейная гиперхо- |
|||||||||||
мотора Mo-MuLV. Использовали под |
лестеринемия |
(синдром |
Харбитца— |
|||||||||
ход ex |
vivo. |
Взятые у больных лимфо |
Мюллера). |
Гиперхолестеринемия |
— |
|||||||
циты |
трансфицировали |
ретровирус- |
крайне |
опасное заболевание, связан |
||||||||
ными векторами, и после 9 дней куль |
ное с мутацией |
гена рецептора Л Η П . |
||||||||||
тивирования |
in |
vitro возвращали |
боль |
В результате такой мутации у больных |
||||||||
наблюдается высокий уровень холе стерина в сыворотке и как результат — ранний атеросклероз и инфаркт мио карда. Для лечения больных были ис
пользованы ретровирусные |
векторы, |
||
несущие |
нормальный |
ген |
рецептора |
Л Н П . В |
гепатоциты |
пациента, полу |
|
ченные |
после резекции |
примерно |
|
20 % печени, ex vivo вводили ретрови русные векторы. Затем модифициро ванные клетки возвращали больному через портальную вену. Уровень холе стерина у больных был снижен на 10—15 % и оставался на относительно низком уровне более 18 мес.
Муковисцидоз — наиболее распро страненное генетическое заболевание в Северной Америке. Частота муковис-
цидоза |
в популяции |
колеблется |
от |
1:600 до |
1:3000. Это заболевание с |
ау- |
|
тосомно-рецессивным |
наследованием, |
||
связанное с мутацией гена, кодирую щего 3,5-монофосфат регулируемого КТП апикального эпителия. В резуль тате этой мутации в эпителии легких не экспрессируется ген КТП, что при водит к хроническим инфекциям дыха тельных путей. У больных наблюдается повышение вязкости панкреатического и бронхиального секрета, а также жел чи, что приводит к нарушению прохо димости выводных протоков. Первые попытки лечения муковисцидоза были предприняты в 1993 г. с использовани ем для этого аденовирусных векторов, несущих ген КТП. Генетические кон струкции вводили либо непосредствен но в эпителий бронхов, либо впрыски вали в нос. Через неделю была обнару жена экспрессия Р Н К КТП и кодируе мого белка приблизительно в 14 % клеток, что сопровождалось опреде ленным улучшением состояния боль ных, однако спустя уже десять дней обнаружить экспрессию Р Н К и белка КТП не удалось. Кратковременное улучшение состояния больных наблю далось и в ряде других клиник, где были использованы похожие конст рукции и протоколы. Следует отме тить, что имеются значительные тех нические сложности при введении ге на К Т П в легочный эпителий in vivo.
12.3.4.2.Инфекционные
заболевания
СП И Д . Несколько подходов было предложено для лечения С П И Д а с по мощью методов генетической тера пии. В этих экспериментальных ис следованиях (фаза I/II) были исполь зованы ретровирусные векторы, спо
собные специфически связываться с клетками-мишенями (CD4+) ВИЧ - 1 . Для подавления репликации вируса были использованы анти-ВИЧ-рибо- зимы (антисмысловые Р Н К ) , подав ляющие обратную транскрипцию и интеграцию, мутанты гена rev и ряд других конструкций, однако наиболее перспективным представляется непо средственная защита клеток-мише ней от ВИЧ-1 инфекции. В частности, такая защита может быть обеспечена пептидами, которые будут предотвра щать связывание вируса с клеточными рецепторами.
12.3.4.3.Онкологические
заболевания
Для борьбы с онкологическими за болеваниями к 1998 г. было предложе но уже более 140 протоколов с ис пользованием разнообразных терапев тических конструкций. По этому по казателю онкологические заболевания существенно опережают генетические и иммунологические заболевания, при лечении которых также применяют методы генетической терапии.
Несмотря на широту подходов к лечению опухолей с помощью мето дов генной терапии, не следует забы вать, что наши представления о тон ких механизмах канцерогенеза, в ча стности генных перестройках, пред шествующих возникновению злокаче ственной опухоли, все еще поверхно стны. Более того, трансформация не является по большей части нарушени ем функции одного гена, поэтому, да же зная о нарушениях экспрессии от дельных генов, трудно перейти к лече нию опухолей методами генной тера пии и ожидать быстрых успехов. Важ-
551
но и то, что часто для многих опухо лей не существует пока методов ран ней диагностики и генная терапия проводится уже на поздних стадиях развития заболевания.
Несмотря на обнадеживающие ре зультаты, полученные in vitro и на жи вотных, современные подходы генной терапии не принесли в полной мере желаемых результатов. Ниже мы оста новимся на некоторых формах онко логических заболеваний, при лечении которых были применены или будут применяться методы генной терапии.
Первые попытки генетической те рапии, предпринятые в 1990—1991 гг., были направлены на усиление проти воопухолевого действия лимфоцитов. Для этого был использован ген Ил-2, который вводили в лимфоциты ex vi vo. Этот ген был использован потому, что Ил-2 участвует в активации лим фоцитов и NК-клеток, усиливая тем самым неспецифическую иммунную реакцию против опухолевых клеток. Подходы с использованием неспеци фических активаторов иммунного от вета при терапии опухолей применя ются и сейчас.
Рак предстательной железы являет ся самым распространенным новооб разованием у мужчин и вторым по частоте смертельных исходов. Хирур гические операции и радиотерапия эффективны лишь при отсутствии ме тастазов, тогда как химиотерапия не оказывает существенного влияния на эти новообразования. Стратегии, ис пользуемые при лечении рака пред стательной железы, основываются в первую очередь на знании биологии опухоли, иммунном ответе опухоли на иммуномодуляторы, выборе терапев тического гена и, наконец, степени прогрессии опухоли.
В отличие от других солидных опу холей опухоль предстательной железы возникает в виде диффузного ин фильтрата, часто захватывающего всю железу. Это значительно осложняет направленную терапию, так как при ходится иметь дело со значительной клеточной массой. В целом клетки
опухоли представляют собой гетеро генную популяцию, имеющую много численные генетические аберрации. Кроме того, клетки опухоли растут медленно как in vivo, так и in vitro. Медленный рост клеток затрудняет использование подходов ex vivo, а так же использование ретровирусных век торов, требующих интенсивного деле ния клеток для интеграции в геном. Клетки опухоли экспрессируют два маркера: ПСА и ПСМА.
Генная терапия опухолей предста тельной железы делает лишь первые шаги. Модуляция антиопухолевого иммунитета представляется одной из наиболее эффективных стратегий, предлагаемых для борьбы с этой зло качественной опухолью, и достигается путем введения в клетки генетических конструкций, несущих гены иммуно стимуляторов. Ранее, в частности, бы ло показано, что введение Ил-2 и ин терферона-α приводит к частичной или полной регрессии ряда солидных опухолей. Предлагаемые сейчас кли нические протоколы основаны как на подходах ex vivo, так и на подходах in vivo путем прямого введения векторов, несущих трансген непосредственно в опухоль. При подходе ex vivo опухоле вые клетки, взятые от больного, трансфицируют одним из терапевти ческих генов, доставляемых ретровирусными или же липосомными векто рами. Затем для подавления малигни зации трансфицированные клетки об лучают и вводят обратно пациенту. Цитокины, синтезируемые этими клетками, позволяют стимулировать неспецифический иммунный ответ. Теоретически может происходить сти мулирование цитотоксических Т-лим- фоцитов, направленных против опу холевых клеток. Обнадеживающие ре зультаты были получены на живот ных, однако существенным ограниче нием использования этих подходов для лечение больных являются техни ческие сложности, связанные с выра щиванием клеток опухоли предста тельной железы in vitro. Кроме того, пока не обнаружен специфический
552
антиген, экспрессируемый только в клетках опухоли.
Подходы, использующие прямую инъекцию векторов в опухоль, нахо дятся пока в стадии разработки.
Меланома кожи. Меланома кожи — одна из опухолей, для лечения кото рой уже несколько лет используют ме тоды генной терапии с применением стратегии in vivo. Основания для ис пользования методов генетической те рапии при лечении меланомы были получены после успешных экспери ментов ex vivo с геном устойчивости к неомицину. Экспрессия трансгена в опухоли наблюдалась более трех меся цев. Для доставки трансгена применя ли ретровирусные векторы, а в качест ве самих трансгенов использовали ге ны, кодирующие фактор некроза опу холей, р53, Ил-2 или фактор стимуля ции колоний гранулоцитов-макрофа- гов. Несмотря на то что трансгены экспрессировались у больных доста точно долго, получить заметного тера певтического эффекта не удалось.
Другой подход был предпринят в конце 1992 г. Были использованы липосомы, несущие гены HLA-B2 глав ного комплекса гистосовместимости и бета2-микроглобулина человека. Эти конструкции вводили в метастатиче ские узлы меланомы в молочной же лезе. Через 3—7 дней в биопсийном материале были обнаружены HLA-B2 и трансфицированная Д Н К . У всех больных были выявлены, правда, в небольшом количестве, антиопухоле вые ЦТЛ. С тех пор неоднократно предпринимались похожие клиниче ские попытки лечения и, помимо по явления ЦТЛ, были отмечены случаи уменьшения размера опухоли.
12.3.4.4.Заболевания ЦНС
иопухоли мозга
Известно, что в клетках мозга больше транскриптов и экспрессиру ется больше белков, чем в любом дру гом органе человека, и уже поэтому мозг — наиболее сложный для лече ния орган. Не исключено, что генная
терапия станет со временем основным методом лечения заболеваний Ц Н С , однако ей на этом пути предстоит ре шить ряд принципиальных задач. Преградами для генетической терапии являются доставка генетического ма териала в мозг, отсутствие непосред ственного доступа к клеткам, а также трудность проведения трансфекции постмитотических нейронов. Имеет значение и наше слабое представле ние о специфических клеточных про моторах, которые следовало бы ингибировать при той или иной патоло гии, и, наконец, чисто техническая сложность — широкомасштабное вве дение терапевтических генов, необхо димое при некоторых диффузных па тологиях (в частности, при болезни Альцгеймера).
Методы доставки генетических конструкций в мозг традиционны (т. е. доставка вектора в клетки в дан ном случае осуществляется после про ведения операции) и могут быть про ведены как ex vivo, так и in vivo. В ча стности, иммортализованные клеткипредшественники нейронов являются удобными клеточными векторами при введении ex vivo, поскольку они поте ряли свой митотический потенциал, но сохраняют свою способность ин тегрироваться в клеточную архитекту ру Ц Н С и дифференцироваться либо
внейроны, либо в глиальные клетки.
Вкачестве вирусных векторов для доставки трансгенов при опухолях мозга чаще других используют ретровирусы и аденовирусы, которые отно сительно легко переносятся пациен тами.
Глиобластома. Наиболее частой формой опухоли мозга является гли областома, причем эта опухоль приво дит к самой высокой летальности. Пока не существует эффективного способа лечения глиобластом, и смерть человека наступает менее чем через год после диагностирования за болевания. Было показано, что мута ция гена ТР53 (кодирующего р53) час то наблюдается у больных с глиобластомами, поэтому генная терапия та-
553
ких опухолей при помощи гена ТР53 представляется перспективной. Кон струкции с геном ТР53 для лечения глиобластом используют сейчас на животных, однако до широкого при менения таких конструкций в клини ке еще далеко. Попытки лечения опу холей мозга (в частности, глиобластом и метастазирующих в мозг меланом) с помощью ретровирусных конструкций с геном ТК были впервые предприня ты в 1994 г. В опухоль вводили мыши ные фибробласты, экспрессирующие ретровирусные частицы, которые не сли ген ТК вируса простого герпеса. Через неделю в некоторых клетках опухоли методом гибридизации in situ была обнаружена экспрессия ТК. Этот момент стал началом терапии с ис пользованием ганцикловира, кото рый вводили внутривенно. Напом ним, что в зараженных клетках вирус ный ТК превращает ганцикловир в монофосфат, который затем с помо щью эндогенных киназ переходит в токсичный трифосфат, способный эффективно подавлять полимериза цию Д Н К .
У больных не было выявлено ника ких отрицательных побочных эффек тов, связанных с терапией или с вве дением мышиных клеток. У некото рых больных наблюдалось заметное уменьшение размеров опухоли, одна ко полного ее исчезновения добиться не удалось.
Злокачественная глиома мозга — тяжелое онкологическое заболевание с плохим прогнозом. Химио- и имму нотерапия неэффективны при лече нии этого заболевания. Попытки ген ной терапии злокачественной глиомы предпринимались неоднократно, при этом лечение применяли как дополне ние к хирургической операции. Тера певтический протокол, использующий ген ТК в качестве трансгена, выглядит следующим образом. Мышиные клет ки для упаковки, трансфицированные геном ТК вируса простого герпеса, вводили больным в каверну, образо вавшуюся после хирургического уда ления опухоли. Продуцируемые этими
клетками вирусные частицы несли ген ТК и заражали делящиеся клетки опу холи, если они случайно оставались после операции. Затем больным в те чение 7—14 дней давали антивирус ный препарат ганцикловир, обеспечи вающий гибель делящихся (в этом случае опухолевых) клеток. Есть опре деленные основания считать, что у части больных, подвергшихся генети ческой терапии, по сравнению с кон трольной группой была заметно уве личена продолжительность жизни. К сожалению, экспрессия ТК оказалась непродолжительной и полного подав ления опухолевых клеток у больных не наблюдалось.
Предпринимаются попытки для лечения глиомы использовать конст рукции на основе аденовирусов, несу щие ген р53. В частности, в первой фазе клинических испытаний отмече ны отсутствие токсичности и некото рый противоопухолевый эффект.
12.3.5. Перспективы генетической терапии
Современная генная терапия стоит перед рядом проблем, среди которых наиболее существенными представля ются такие, как доставка, уровень и продолжительность экспрессии транс гена. Очевидно, что появится целая серия способов доставки, подбор ко торых будет производиться индивиду ально в зависимости от характера за болевания.
12.3.5.1. Векторы, находящиеся в разработке
В этом разделе мы перечислим соз даваемые (или уже созданные, но про ходящие тестирование) перспектив ные конструкции, использования ко торых можно ожидать в ближайшее время.
Векторы на основе ААВ. Проходят тестирование на собаках с природной мутацией по гену фактора IX ААВвекторы, несущие этот ген. Для де монстрации возможной терапии гемо-
554
филии В животным вводили конст рукции в портальную вену и мышцы. При введении в портальную вену уда лось поднять уровень экспрессии фактора IX до 1 % от нормы, что уже влияло на свертываемость крови, и этот уровень экспрессии сохранялся 8 мес. Экспрессия же фактора IX у жи вотных, которым конструкцию вводи ли в мышцы, составляла 16 мес.
На основе ААВ был создан вектор, несущий ген β-галактозидазы, и он успешно экспрессировался у крыс по сле введения через рот. Предполагает ся использовать эти конструкции для лечения больных с наследственной непереносимостью лактозы.
Плазмавирусы представляют собой новое поколение векторов, которые можно использовать in vivo, не прибе гая к помощи клеток для упаковки. Существующие плазмавирусы по строены на основе вируса лейкоза мышей Молони (хотя разрабатывают ся и другие основы) и по своей орга низации напоминают инфекционный клон, имеющий оба LTR, гены gag, pol, и трансген, который помещен на место гена env, расположенного под дополнительным CMV-промотором. Предполагается использовать плазма вирусы как in vivo, так и in vitro. Плазмавирусом, как обычной плазмидой, трансфицируют клетки, в которых об разуется популяция вирусных частиц, несущих трансген. Эти частицы могут заражать соседние клетки, однако лишь однократно, поскольку конст рукция создана таким образом, что второе поколение частиц уже не фор мируется; таким образом, исключает ся опасность долговременного и бес контрольного инфицирования нор мальных клеток. Несмотря на относи тельно короткое время экспрессии ге на env, что пока является слабой сто роной таких конструкций, использо вание плазмавирусов в клинике для лечения опухолей мозга уже началось во Франции.
Векторы на основе ВИЧ. Генетиче ские конструкции на основе ВИЧ бы ли созданы в нескольких лаборатори
ях, и многие из них прошли успешное тестирование на животных. Главное достоинство таких векторов состоит в том, что они способны заражать неделящиеся клетки, т. е. клетки, остано вившиеся в фазе G1/G2 . Кроме того, обычно высок титр частиц (до 109 в 1 мл), экспрессируемых зараженны ми клетками. Однако представляется маловероятным использование ВИЧ в качестве полноценного вектора. Дей ствительно, для уменьшения потенци ального риска, связанного с возмож ностью формирования инфекционных вирусных частиц, большую часть та ких векторов вводят в клетку в виде двух-трех отдельных плазмид. Обычно эти плазм иды несут область ψ и ген оболочки вириона, а также трансген. Другая возможность сводится к созда нию самоинактивирующихся векторов (см. выше), не имеющих энхансеров и промоторов. Надо иметь в виду также, что отдельные элементы этого вируса могут быть с успехом использованы при создании химерных генетических конструкций и псевдотипов с другими ретровирусами в качестве основы.
Векторы на основе вирусов фоами.
Недавно было опубликовано несколь ко работ, касающихся использования вирусов фоами в качестве векторов. Напомним, что вирусы фоами пред ставляют собой ретровирусы со слож ным геномом. Они широко распро странены среди позвоночных, в том числе и разнообразных видов прима тов. При этом вирусная инфекция у животных носит латентный характер. Вирусы заражают широкий спектр клеток (включая клетки человека) in vitro, и инфицирование этими вируса ми клеточных культур сопровождается быстрой их гибелью. Без достаточных оснований считается, что вирусы фоа ми отсутствуют у человека, поэтому их использование для терапии абсо лютно безопасно. С этим утверждени ем нельзя полностью согласиться, учитывая, с одной стороны, недоста точный поиск вирусов фоами в чело веческой популяции, а с другой — "аг рессивность" вирусов in vitro. Более
555
того, особенности репликативного цикла вирусов фоами изучены пока недостаточно. В то же время работать с фоами-векторами относительно просто, так как без ущерба для репли кации вируса можно заменить З'-кон- цевую область генома, где располага ются трансактиваторы. Был разрабо тан, в частности, ряд конструкций, у которых, были удалены трансактива торы — гены bel2 и bel3. Эти гены не принимают непосредственного уча стия в репликации вируса, более того, их роль в жизненном цикле вируса до конца не установлена. Еще одним достоинством фоами-векторов являет ся их способность заражать неделящиеся клетки, что делает их близкими к векторам на основе ВИЧ. Были сконструированы фоами-векторы, не сущие гены люцеферазы, хлорамфениколацетилтрансферазы и поверхно стного белка вируса гепатита мышей. Такие конструкции, имеющие вставки до 1,3 т. п.н., продуцировали пример но то же число вирусных частиц, что и дикий тип. Проводится работа по созданию клеток для упаковки на ос нове вирусов фоами. В ближайшее время следует ожидать первых клини ческих испытаний фоами-векторов.
* * *
Первый и наиболее существенный вывод, который можно сделать, за ключается в том, что у генной тера пии есть будущее. В опытах ex vivo с использованием ретровирусных генов удалось успешно осуществить перенос маркерных генов в различные клетки человека, в том числе Т-клетки раз личных классов, стволовые клетки, лимфоциты, инфильтрирующие опу холь, трансформированные крове творные клетки и клетки солидных опухолей. Ретровирусные конструк ции с терапевтическими генами при использовании ex vivo в отдельных случаях экспрессировались до 36 мес. Определенным успехом можно счи тать генную терапию детей с АДА, больных с дефицитом по гену рецеп
тора Л Н П , больных с муковисцидозом и отдельные случаи терапии опу холей мозга. Однако во всех перечис ленных выше случаях была достигнута лишь частичная коррекция заболева ний. До сих пор ни одно из заболева ний человека не было полностью вы лечено с помощью методов генной те рапии. Во многом поэтому отношение к генной терапии неоднозначно. Регу лярно на страницах журналов появля ются статьи о непредсказуемости ге нетических воздействий на человека, потенциальной опасности генной те рапии для будущих поколений и низ кой терапевтической эффективности. С перечисленными аргументами "про тив" трудно не согласиться. Действи тельно, наше понимание взаимоотно шений между вирусом и клеткой и многих тонких механизмов регуляции репликации вирусов еще далеко не полное. Мы плохо представляем себе характер биохимических перестроек, вызванных действием вируса или его отдельных компонентов. Мы не спо собны предугадывать места интегра ции конструкций на основе ретровирусов в геном клетки со всеми выте кающими из этого последствиями. Более того, не до конца ясны возмож ные побочные действия многих ис пользуемых в генной терапии трансге нов. Однако при всей непредсказуе мости генной терапии не следует за бывать, что для ряда онкологических, а также тяжелых форм вирусологиче ских и иммунологических заболева ний пока вообще не существует сколько-нибудь эффективного лече ния. Поэтому часто лечение с помо щью методов генной терапии прово дят как раз на тех больных, для кото рых генная терапия — единственный шанс на спасение. Не следует забы вать и того, что генная терапия нахо дится на начальном этапе своего раз вития и ожидать от нее уже сейчас ка ких-то "революционных" результатов еще рано. Можно предположить, что завершение работы по проекту "Геном человека" будет способствовать значи тельному прогрессу генной терапии.
556
Основываясь на полученных ре зультатах, можно сделать вывод, что наиболее перспективными для лече ния с помощью методов генной тера пии являются "болезни одного гена", в частности отдельные редкие наследст венные заболевания. Несмотря на всю очевидность такого вывода, именно такие проекты, связанные с генной терапией генетических заболеваний, хуже всего финансируются, а приори тетными являются несравненно более сложные работы в области генной те рапии опухолевых и сердечно-сосуди стых заболеваний.
Уже сейчас ясно, что генная тера пия обладает мощным арсеналом средств, таких как терапевтические гены, и использует разнообразные средства доставки. Отдать предпочте ние какому-либо из используемых в генной терапии способов доставки трансгена трудно. Каждый из них имеет свой набор достоинств и недос татков. Однако вирусные, особенно ретровирусные, конструкции на об щем фоне выглядят предпочтительнее. Складывается впечатление, что имен но вирусные векторы ближе к "иде альному" вектору для генной терапии и обладают набором свойств, позво ляющих надеяться на эффективное и долговременное их функционирова ние у реципиента.
Без всякого сомнения, новые фун даментальные разработки в таких об ластях, как молекулярная вирусоло гия, молекулярная биология и моле кулярная генетика, будут способство вать развитию генной терапии на ос нове вирусных и, в частности, ретро вирусных векторов.
Рекомендуемая литература
Anderson F. W. Human gene therapy // Na ture. - 1998. - Vol. 392 (suppl.).
P. 2 5 - 3 0 .
Crystal |
R. G. |
Transfer of genes to |
Humans: |
|
Early lessons and obstacles to success // |
||||
Science. - |
1995. - |
Vol. 270. |
- P. 4 0 4 - |
|
410. |
|
|
|
|
During |
M. J., |
Ashenden |
L.-M. A. |
Towards |
gene therapy for the central nervous sys tem // Molecular Medicine Today. — 1998, November. - P. 485 - 493 .
Ficazzola Μ. Α., Taneja S. S. Prospects for gene therapy in human prostate cancer // Molecular Medicine Today. — 1998, N o vember. — P. 494—503.
Linden R. M., Woo S. L. C. AAVant-garde gene therapy // Nature Medicine. — 1999.
-Vol. 5. - P. 2 1 - 2 2 .
Miyoshi |
H., |
Blomer |
U., |
Takahashi M. |
et |
al. |
|
Development of a self-inactivating lentivi- |
|||||||
rus vector // J. Virol. — 1998. — Vol. 72, |
|||||||
N 10. - P. 8150-8157. |
|
|
|
||||
Molecular |
virology / |
Ed. |
D. R. |
Harper. |
— |
||
Second Edition. Bios Scientific Publishers, |
|||||||
1996. |
|
|
|
|
|
|
|
Morozov |
V. Α., Noguiez-Hellin P., |
Laune |
S. |
et |
|||
al. Plasmavirus: Replication cycle of |
a |
||||||
novel nonviral/viral vector for gene trans |
|||||||
fer // Cancer Gene |
Therapy. — 1997. |
— |
|||||
Vol. |
4. |
- P. 2 8 6 - 2 9 3 . |
|
|
|
||
Nabel G. |
J., |
Mabel E. G., |
Yang Ζ. |
Y. et al. Di |
|||
rect gene transfer with DNA-liposome complex in melanoma: expression, biolog ic activity, and lack of toxicity // Proc. Natl. Acad. Sci. - 1993. - Vol. 90. - P. 11 307 - 1 1 311.
Oldfield Ε. H., Ram Z., Chiang Y, Blaese R. M. Intrathecal gene therapy for the treatment of leptomeningeal carcinomas. A phase I/I I study // Human gene thera py. - 1995. - Vol. 6. - P. 5 5 - 8 5 .
Retroviruses. Ed. J. M. Coffin, |
S. H. Hughes, |
|
Η. E. Varmus. — Cold |
Spring |
Harbor |
Laboratory Press, 1997. |
|
|
Rosenberg S. Α., Aebersold P., |
Cornrtta |
C. et |
al. Gene transfer into hurnans-immuno- therapy of patients with advanced melano ma, using TIL modified by retroviral gene transduction // N. Engl. J. Med. — 1990.
-Vol. 323. - P. 570 - 578 .
Trobridge G. D., Russell D. W. Helper-free foamy virus vectors // Human gene thera py. - 1998. - Vol. 9. - P. 2517 - 2525 .
Valere T. Therapie genique: le point sur les es-
-sais cliniques // Medicine Science. —
1996. - Vol. 10. - P. 7 3 - 8 3 .

Г л а в а 13
МЕХАНИЗМЫ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ ОПУХОЛЕВЫХ КЛЕТОК
А. А. Ставровская
Устойчивость опухолевых клеток к химиотерапевтическим препаратам — одна из важных причин неэффектив ности терапии злокачественных ново образований. В данном разделе мы рассмотрим основные механизмы, обусловливающие резистентность малигнизированных клеток к лекарст венным препаратам, не останавлива ясь на проблемах, связанных с фармакокинетикой лекарств, т. е. на причи нах, по которым препарат может не дойти до клетки в адекватной и актив ной форме. Механизмы устойчивости клеток к цитостатикам представляют существенный интерес не только с позиций лечения опухолей, но и с по зиций исследования защитных систем живой клетки, ограждающих ее от по вреждений.
В табл. 13.1 представлены основ ные этапы реализации в клетке повре ждающего действия лекарственного препарата, где завершающими собы тиями в большинстве случаев являют ся программируемая гибель или апоптоз, либо длительная задержка клеточ ного цикла. Общий перечень измене ний, приводящих к лекарственной ус тойчивости, показывает, что клетки млекопитающих обладают возможно стью прерывать путь реализации по вреждения на любом этапе и что ме ханизмы лекарственной резистентно сти опухолей разнообразны.
Лекарственную устойчивость (ЛУ) опухолевых клеток можно разделить на предсуществующую (наблюдаю щуюся до применения лечения) и приобретенную (схема 13.1). При
Т а б л и ц а 13.1. Основные этапы реализации цитотоксического действия лекарственных
препаратов и основные механизмы лекарственной устойчивости опухолевых клеток
558

С х е ма 13.1. Основные типы лекарственной устойчивости опухолевых клеток
предсуществующей |
(intrinsic) |
|
ЛУ |
знаки клетки, такие как характер раз |
|||||||||||||
обычно |
все клетки новообразования |
множения, |
изменение чувствительно |
||||||||||||||
устойчивы |
к терапии. Резистентность |
сти к факторам роста и т. д. Сущест |
|||||||||||||||
клеток |
к |
лекарственному |
препарату |
вуют также так называемые адаптаци |
|||||||||||||
может, в частности, определяться раз |
онные изменения, в условиях которых |
||||||||||||||||
ной тканевой принадлежностью |
кле |
большинство клеток популяции |
ока |
||||||||||||||
ток. Так, известно, что опухоли мозга |
зывается устойчивым к лечению за |
||||||||||||||||
резистентны к химиотерапии из-за ге- |
счет |
временной |
активации |
защитных |
|||||||||||||
матоэнцефального |
барьера. Клетки |
механизмов клеток. |
|
|
|
|
|
||||||||||
системы |
кроветворения |
разной |
диф |
ЛУ может возникнуть к одному и |
|||||||||||||
ференцировки различаются |
по степе |
нескольким |
(многим) |
|
препаратам. |
||||||||||||
ни чувствительности к химиопрепара- |
Примером первого типа ЛУ может |
||||||||||||||||
там, следовательно, происходящие |
из |
служить |
большинство |
случаев |
рези |
||||||||||||
них новообразования могут иметь раз |
стентности |
к антиметаболитам. Так, |
|||||||||||||||
ную степень ЛУ. |
Предсуществующая |
например, 6-меркаптопурин и б-тио- |
|||||||||||||||
ЛУ может определяться также генети |
гуанин |
активируются |
гипоксантин- |
||||||||||||||
ческим изменением, вызвавшим дан |
фосфорибозилтрансферазой |
(ГФРТ), |
|||||||||||||||
ное новообразование. Показано, на |
и снижение или полное исчезнове |
||||||||||||||||
пример, |
что хромосомная |
транслока |
ние активности этого фермента в му- |
||||||||||||||
ция 9;22 и появление сливного белка |
тантных |
клетках приводит |
к |
тому, |
|||||||||||||
BCR/ABL, лежащие в основе хрони |
что препарат не активируется и клет |
||||||||||||||||
ческого миелолейкоза, приводят к от |
ки от него не погибают. Множест |
||||||||||||||||
мене апоптоза и могут определять ЛУ. |
венной |
лекарственной |
устойчиво |
||||||||||||||
Приобретенная |
ЛУ |
возникает |
в |
стью |
(МЛУ) |
называют |
резистент |
||||||||||
связи с химиотерапией. В популяциях |
ность клеток к нескольким (многим) |
||||||||||||||||
опухолевых клеток в результате воз |
лекарственным |
препаратам, |
разли |
||||||||||||||
действия цитостатика могут появиться |
чающимся |
по |
химической |
структуре |
|||||||||||||
редкие |
генетические варианты |
рези |
и механизму действия. Было показа |
||||||||||||||
стентных |
клеток, |
которые |
впоследст |
но, что воздействие на культуры кле |
|||||||||||||
вии размножаются, в том случае если |
ток одного препарата круга МЛУ мо |
||||||||||||||||
получают |
селективное |
преимущество. |
жет |
определить |
устойчивость |
клетки |
|||||||||||
Селективное преимущество обеспечи |
(перекрестную |
резистентность) |
к |
||||||||||||||
вает клеткам не только устойчивость к |
другим препаратам, с которыми клет |
||||||||||||||||
действию лекарства, но и другие при |
ка не встречалась. |
|
|
|
|
|
|||||||||||
559
13.1. |
Лекарственная |
|
|
Выброс веществ |
из |
клеток связан |
||||||||
устойчивость, |
|
|
|
с функционированием |
транспортных |
|||||||||
обусловленная снижением |
|
белков, к которым принадлежат Р-гли- |
||||||||||||
накопления препарата |
|
|
копротеин |
(Pgp), |
транспортеры |
се |
||||||||
внутри клетки |
|
|
|
|
мейства MRP, а также некоторые дру |
|||||||||
|
|
|
|
|
|
|
|
гие белки (табл. 13.2). Исследования |
||||||
Снижение накопления лекарства в |
Pgp проводятся более 25 лет, и в этой |
|||||||||||||
клетке a priori может быть результатом |
области накоплено значительное коли |
|||||||||||||
как снижения поступления в клетку |
чество фактов, |
позволяющих рассмот |
||||||||||||
лекарственных препаратов, так и уве |
реть на примере МЛУ, обусловленной |
|||||||||||||
личения их выведения из клетки. По |
Pgp, проблемы, которые еще ждут сво |
|||||||||||||
скольку |
подавляющее |
большинство |
его решения при исследовании других |
|||||||||||
химиотерапевтических |
препаратов |
механизмов ЛУ. В связи с этим мы ос |
||||||||||||
проникает в клетку путем простой |
тановимся на Pgp подробнее. |
|
||||||||||||
диффузии |
через |
плазматическую |
мем |
|
|
|
|
|
|
|
||||
брану, поступление вещества в клетку |
13.1.1. |
Множественная |
|
|||||||||||
может снизиться в том случае, если |
лекарственная |
|
|
|
||||||||||
изменяется структура клеточной |
мем |
устойчивость, |
|
|
||||||||||
браны. |
Действительно, |
электронно- |
|
|
||||||||||
обусловленная |
|
|
||||||||||||
микроскопические |
исследования |
и |
|
|
||||||||||
Р-гликопротеином |
|
|
||||||||||||
анализ |
липидов |
мембран клеток |
с |
|
|
|||||||||
(Рgр — МЛУ) |
|
|
|
|||||||||||
МЛУ выявил отличия некоторых ре |
|
|
|
|||||||||||
|
|
|
|
|
|
|
||||||||
зистентных клеток |
от чувствительных. |
Pgp — общие сведения, функцио |
||||||||||||
Обнаруженные |
модификации |
могли |
нальная активность. Pgp — крупный |
|||||||||||
изменять |
прохождение |
некоторых |
трансмембранный белок с молекуляр |
|||||||||||
препаратов через мембрану, а также |
ной массой около 170 кДа, состоящий |
|||||||||||||
оказывать влияние на передачу сигна |
из 2 одинаковых частей, каждая из ко |
|||||||||||||
лов, определяющих апоптоз. Однако |
торых включает 6 гидрофобных транс |
|||||||||||||
сведений |
об изменениях |
поступления |
мембранных |
участков |
(схема |
13.2). |
||||||||
лекарств в клетку немного, и на пер |
Это позволяет считать, что молекула |
|||||||||||||
вый план уже давно выступил другой |
Pgp двенадцать раз пересекает плазма |
|||||||||||||
механизм — выброс (откачка) токсич |
тическую мембрану клетки. Молекула |
|||||||||||||
ных веществ из резистентных клеток. |
Pgp имеет два сайта связывания с |
|||||||||||||
|
|
|
|
|
|
|
|
АТФ, что свидетельствует об энерго |
||||||
|
|
|
|
|
|
|
|
зависимости |
функционирования |
бел |
||||
Т а б л и ц а |
13.2. Некоторые транспортные |
ка. С Pgp связана резистентность опу |
||||||||||||
белки, |
определяющие |
множественную |
ле |
холевых |
клеток |
к |
антрациклиновым |
|||||||
карственную устойчивость опухолевых кле |
антибиотикам, |
актиномицину, |
алка |
|||||||||||
ток и кодирующие их гены |
|
|
|
лоидам |
растительного |
происхожде |
||||||||
|
|
|
|
|
|
|
|
|||||||
|
Белок |
|
Хромо |
|
Белок |
(число |
Ген че |
сомная |
|
амино |
ловека |
локали |
||
|
||||
|
кислот) |
|
зация |
|
|
|
|
|
|
Р-гликопро- |
1280 |
MDR1 |
7q21.1 |
|
теин (Pgp) |
|
|
|
|
MRP1 |
1531 |
MRP1 |
16р13.1 |
|
MRP2 |
1545 |
MRP2 |
10q24 |
|
(СМОАТ) |
|
|
|
|
MRP3 |
1527 |
MRP3 |
17q21.3 |
|
(MOAT-D) |
|
|
|
|
ABCG2 |
655 |
ABCG2 |
4q22 |
|
(MXR/BCRP) |
|
|
|
|
LRP/Mvp. |
893 |
LRP |
16pl 1.2 |
|
|
|
|
|
ния (например, винка-алкалоидам), подофиллотоксинам, таксанам. Одна из наиболее популярных в настоящее время гипотез предполагает, что моле кула цитостатика связывается с соот ветствующим сайтом Pgp внутри липидного бислоя плазматической мем браны и благодаря энергии, получен ной в результате гидролиза АТФ, вы брасывается наружу. Показано, что на специфическое связывание веществ с Pgp влияют мутации в 5, 6, 11 и 12-м трансмембранных доменах белка. По казано также, что интактные АТФ-
560

С х е м а 13.2. Схема строения белка множественной лекарственной устойчиво
сти Р-гликопротеина (Pgp)
I — домены, содержащие трансмембранные участки (обозначены прямоугольниками); I I — АТФ-связывающие домены (обведены овалом); 1—12 — домены
связывающие домены, а также их |
123) клетками. При этом применяют |
|||||||||||||
взаимодействие с сайтами связывания |
также |
модуляторы |
активности |
Pgp, |
||||||||||
препаратов необходимы для осуществ |
желательно |
в |
наибольшей |
степени |
||||||||||
ления |
транспортной |
функции |
Pgp. |
специфичные |
для |
него |
(например, |
|||||||
Субстратами Pgp |
(веществами, |
кото |
PSC833 или верапамил). О функцио |
|||||||||||
рые он связывает) являются многие |
нальной |
активности |
Pgp |
свидетельст |
||||||||||
химиотерапевтические |
препараты, |
вует следующее: а) количество накоп |
||||||||||||
иные |
лекарственные |
препараты |
(на |
ленного вещества снижено в опытных |
||||||||||
пример, некоторые лекарства, исполь |
клетках |
по |
сравнению |
с |
контрольны |
|||||||||
зуемые в кардиологии и неврологии), |
ми; б) |
это |
вещество |
быстрее выходит |
||||||||||
многие флюоресцентные красители, а |
из клеток; в) ингибитор функции Pgp |
|||||||||||||
также другие вещества, например бро |
тормозит |
процесс |
выброса |
препарата |
||||||||||
мистый этидий. Эти вещества объеди |
из клеток. |
|
|
|
|
|
|
|
||||||
няет то, что все они растворимы в ли- |
Р-гликопротеин принадлежит к су |
|||||||||||||
пидах мембраны. Полагают, что сайты |
персемейству |
транспортеров |
ABC |
(от |
||||||||||
связывания разных препаратов на мо |
"ATP-Binding Cassette"). К семейству |
|||||||||||||
лекуле |
белка различаются. |
|
|
ABC относят более сотни транспорт |
||||||||||
Существуют разные методы, позво |
ных белков, обнаруженных у разных |
|||||||||||||
ляющие тестировать функциональную |
организмов — от Е. coli до человека. В |
|||||||||||||
активность Pgp как насоса, выбрасы |
это семейство входят белки, транспор |
|||||||||||||
вающего вещества из клетки. Актив |
тирующие весьма разные субстраты — |
|||||||||||||
ность Pgp может быть оценена по сте |
от неорганических ионов до полисаха |
|||||||||||||
пени |
накопления |
меченого |
(напри |
ридов и белков. Такие разнообразные |
||||||||||
мер, 3Н винбластина) или флюоресци |
транспортеры |
объединяет общая |
до |
|||||||||||
рующего препарата (например, дауно- |
менная |
организация |
— |
наличие |
||||||||||
рубицина) клетками, а также по сте |
трансмембранных и АТФ-связываю- |
|||||||||||||
пени накопления или по скорости вы |
щих доменов, которые также называ |
|||||||||||||
броса |
флюоресцентных красителей, |
ют доменами ABC (см. домены II на |
||||||||||||
субстратов Pgp (например, |
родамина |
схеме 13.2). Домены ABC прокариоти- |
||||||||||||
3 6 - 7 9 08 Д. Г. Заридзе |
561 |
ческих и эукариотических белков дан ного семейства весьма сходны: они имеют 30—40 % гомологии (независи мо от их субстратной специфично сти). О древнем происхождении и вы сокой консервативности белков этого семейства свидетельствуют опыты с введением в клетки человека гена, ко дирующего бактериальный транспор тер LmrA, который определяет рези стентность бактерии Lactococcus lactis к антибиотикам. В клетках легкого че ловека с введенным геном LmrA ко дируемый им белок обнаруживался в клеточной мембране. Трансфицированные клетки приобрели устойчи вость к препаратам круга Pgp-МЛУ: антрациклинам, винка-алкалоидам, бромистому этидию, родамину. Рези стентность снималась теми же инги биторами, которые блокируют актив ность Pgp. Эти опыты показали, та ким образом, что бактериальный транспортер ABC может выполнять в клетках человека роль, присущую Р- гликопротеину.
До последнего времени загадочной оставались химическая природа ши рокой субстратной специфичности Pgp. Его способность связывать со единения разной химической приро ды и механизма действия разительно отличается от строгой специфичности большинства известных белков. Не давно получены данные, показываю щие, что бактериальный белок, обла дающий также широкой субстратной специфичностью, связывает вещества следующим образом: под действием субстрата происходит расплетание спирали белка, открывается внутрен ний карман, в котором содержится отрицательно заряженная аминокис лота глутамин, с высокой афинностью связывающая положительно заряжен ные лиганды. По-видимому, функ ционирование Pgp осуществляется по тому же принципу.
Ген MDR1, кодирующий Р-глико-
протеин, генетические механизмы PgpМЛУ. Pgp человека кодируется геном MDR1, принадлежащим к семейству MDR, локализованным в хромосоме 7
(7q21.1) человека. Семейство M D R включает два гена человека (MDR1 и MDR2) и три гена грызунов (mdr1, 2, 3). С помощью метода трансфекции показано, что лишь один ген человека (MDRT) и два гена грызунов имеют отношение к МЛУ. Введение в клетки гена MDR2 к лекарственной устойчи вости не приводило. Показано, что продукт гена MDR2 (у мышей mdr2)
присутствует в |
больших |
количествах |
на поверхности |
клеток, |
выстилающих |
желчные канальцы, и транспортирует в желчь фосфолипиды.
К МЛУ может приводить как по |
|
вышение экспрессии гена |
MDR1, так |
и увеличение дозы гена — |
амплифи |
кация |
участка |
генома, содержащего |
ген MDR1. Амплификация обнаружи |
||
вается |
обычно |
в экспериментальных |
клеточных линиях с высокими уров нями Pgp-МЛУ, а не в материале, по лучаемом от больных. Механизмами МЛУ могут быть также стабилизация мРНК , регуляция на уровне синтеза и процессинга белка. Высказывались предположения и о возможности не посредственной регуляции активности Pgp его субстратами.
Активность гена MDR1 возрастает
вответ на самые разные воздействия.
Кэтим воздействиям принадлежат разные химиотерапевтические препа раты, в том числе и вещества, не яв ляющиеся субстратами Pgp (напри мер, Ара-Ц). Облучение культивируе мых клеток китайского хомячка при водило к возникновению резистент ности к винкристину, связанной с из менениями Pgp. Химические канцеро генные вещества индуцируют актив ность гена MDR1 в клетках крысиной печени, после частичной гепатэктомии в регенерирующей печени крыс возрастает активность MDR1. Некото рые факторы роста могут оказывать влияние на Pgp-МЛУ в некоторых ти пах культивируемых клеток. Было найдено, что тепловой шок, агенты,
индуцирующие |
дифференцировку, |
и др., влияют |
на активность MDR1/ |
Pgp. Важно заметить, однако, что эти эффекты наблюдаются лишь в культи-
562
вируемых клетках некоторых линий и определяются видовой и тканевой принадлежностью клеток.
Очевидно, таким образом, что при определенных условиях (по-видимому, в зависимости от активации в клетках тех или иных путей передачи сигнала) активность гена MDR1 или белка Pgp повышается в ответ на самые разно образные стимулы, т. е. что эта сис тема легко активируется в разных, не только в стрессорных ситуациях.
Исследования генов и путей сиг нальной трансдукции, вовлеченных в регуляцию активности Pgp, свидетель ствуют о том, что этих путей (генов) много или по крайней мере несколь ко. Было показано, что на активность регуляторного района (промотора) MDR1 или эндогенного гена клеток могут влиять гены р53, ras, raf, RARальфа и RARбета (гены рецепторов ретиноевой кислоты). На активность гена MDR1 влияли также гены трансфакторов с- fos и c-jun, участки связывания кото рых имеются в промоторной области гена MDR1. Судя по результатам опы тов с применением ингибиторов неко торых протеинкиназ, в регуляции ак тивности Pgp принимают, очевидно, участие протеинкиназа С, протеинкиназа А и, возможно, еще некоторые протеинкиназы. Данные относительно
множественности элементов, регули рующих активность MDRl/Pgp, свиде тельствуют о том, что эта защит ная система клетки жизненно важна, и поэтому ее регуляция неоднократно продублирована.
Экспрессия Pgp в нормальных тка нях и клетках. Выше мы говорили о предсуществующей и индуцированной ЛУ. Яркий пример этих типов ЛУ — Pgp-опосредованная МЛУ. Pgp экспрессирован в разных тканях организ ма по-разному — от очень низкого, неопределимого уровня (например, клетки эпидермиса, пневмоциты) до высокого (например, клетки коры надпочечника, слизистая оболочка кишечника). Степень экспрессии гена MDR1 в этих тканях различается в де сятки раз (табл. 13.3). Иммунохимиче-
ские исследования выявили в экспрессирующих Pgp тканях выражен ную и относительно гомогенную ок раску. Это относится к коре надпо чечников, эпителиальным клеткам, выстилающим полости (слизистая ки шечника, клетки почечных канальцев, трофобласты плаценты), а также к клеткам эндотелия сосудов мозга и яичек. Разная степень экспрессии Pgp относится и к клеткам системы крове творения. В нормальном костном мозге стволовые клетки и ранние предшественники, несущие антиген C D 3 4 , экспрессируют функционально активный Pgp. Затем по мере созрева ния клеток миелоидного ряда посте пенно снижается как экспрессия это го белка, так и его функциональная активность. Ясно, что новообразова ния, происходящие из экспрессирующих Pgp клеток, будут обладать пред существующей МЛУ, а те, которые произошли из не экспрессирующих Pgp клеток, изначально МЛУ обладать не должны.
Тканевая специфичность экспрес сии Pgp ставит вопрос о его физиоло гической роли в организме. Полагают, что Pgp несет "барьерные" функции, защищая нижележащие клетки от вредных веществ, содержащихся, на пример, в полости кишок, либо под держивает необходимый уровень сте роидных гормонов в надпочечниках. Экспрессия Pgp и белка M R P в эпите лии хороидного сплетения свидетель ствует о существенной роли этих бел-
Т а б л и ц а 13.3. Экспрессия гена MDR1 в
различных тканях человека (по М. Gottesman и соавт.)
Ткань |
Степень экспрессии |
|
гена MDR1 |
||
|
||
|
|
|
Кожа, мышцы |
1 |
|
Толстая кишка |
20 |
|
Легкое |
20 |
|
Печень |
25 |
|
Ободочная кишка |
31 |
|
Почка |
51 |
|
Кора надпочечника |
160 |
|
|
|
36* |
563 |
ков в гематоэнцефалическом барьере. Не исключено, что высокая индуцибельность MDR1/Pgp и тканевая спе цифичность степени их индуцибельности связаны с физиологическими функциями Pgp в организме.
Генетический полиморфизм гена
MDR1. В самое последнее время серь езное внимание уделяется проблеме полиморфизма гена MDR1. Простей шая форма полиморфизма — поли морфизм по одному нуклеотиду (SNP — single nucleotide polymorphism) — об наружена в нескольких сайтах гена. Некоторые из SNP определяют изме нения степени экспрессии Pgp. Оказа лось, что в этих случаях меняется как абсорбция лекарств клетками кишеч ника, так и их проникновение через гематоэнцефалический барьер. Найде ны как индивидуумы, гомозиготные по аллелю, определяющему низкую экспрессию Pgp соответствующими клетками организма, так и "высокоэкспрессирующие" этот белок люди.
Роль МЛУ, опосредованной Pgp (Pgp-МЛУ), при злокачественных но вообразованиях. При некоторых ново образованиях экспрессию активного Pgp (или гиперэкспрессию кодирую щего его гена MDR1) нередко обнару живают при постановке диагноза за болевания: обычно это связано с тем типом клеток, из которых происходят данные новообразования, т. е. здесь речь идет о предсуществующей ЛУ. Это относится в первую очередь к карциномам надпочечников, ракам почки и толстой кишки, феохромоцитомам, ракам поджелудочной железы. При некоторых гемобластозах (AML и при Т-клеточных лимфомах взрослых) нередко МЛУ определяется тем типом клеток, из которых возникло новооб разование. Типирование клеток неко торых гемобластозов, например, кле ток больных в бластном кризе CML, свидетельствует о том, что часть слу чаев лекарственной устойчивости свя зана с тем, что при прогрессии забо левания размножаются клетки опре деленного типа дифференцировки, исходно экспрессирующие Pgp. Таким
образом, в ряде случаев злокачествен ных новообразований Pgp можно рас сматривать как маркер определенного типа дифференцировки опухолевых клеток.
В качестве доводов в пользу роли приобретенной МЛУ в терапии при водят обычно данные, свидетельст вующие о том, что число случаев с ги перэкспрессией Pgp возрастает после курсов лечения, и показывающие, что экспрессия MDR1/Pgp клетками боль ных коррелирует с неэффективностью терапии. Результаты, свидетельствую щие в пользу значимости Pgp-МЛУ в исходе лечения, получены с помощью подобных исследований для аденокар цином легкого и яичников, рака мо лочной железы, сарком (включая остеосаркомы), нейробластом. Наиболее исследована роль Pgp-МЛУ при гемо бластозах. При AML Pgp-положитель- ными считают (по данным разных ис следований) от 30 до 50 % случаев, Pgp чаще обнаруживают у больных, не отвечающих на лечение, а также после проведения курсов химиотерапии. При AML повышенная экспрессия ге на MDR1 обычно коррелирует с фено типом незрелых клеток — экспресси ей антигена CD34. При миелодиспластическом синдроме (MDS) также найдена корреляция Pgp и CD34. Это свидетельствует в пользу того, что в большей части случаев AML и M D S Pgp-МЛУ связана с размножением ранних предшественников кроветво рения. Очевидно, еще при одном мие-
лопролиферативном нарушении |
си |
|
туация та же: в бластном |
кризе |
C M L |
мы обнаружили четкую |
корреляцию |
|
экспрессии функционально активного Pgp с экспрессией антигенов, харак терных для предшественников и кле ток ранней миелоидной дифференци ровки — CD34 и CD13.
Множественную миелому (ММ) принято рассматривать как яркий при мер заболевания, при котором PgpМЛУ возникает в результате лечения. В то время, как при постановке диаг ноза не более 6 % пациентов оказыва ются Pgp-положительными, после те-
564
рапии, особенно по схеме VAD (вин- |
по поискам путей ингибирования его |
||||||||||||||||||||
кристин, доксорубицин, дексаметазон), |
активности привлекли внимание мно |
||||||||||||||||||||
до 85 % резистентных к лечению боль |
гих исследователей |
и |
фармацевтиче |
||||||||||||||||||
ных оказываются Pgp-положительны- |
ских компаний. Было найдено немало |
||||||||||||||||||||
ми. Обнаружение экспрессии Pgp при |
разнообразных соединений, |
преодоле |
|||||||||||||||||||
ряде |
новообразований |
|
считают плохим |
вающих в эксперименте Pgp-МЛУ: |
|||||||||||||||||
прогностическим |
признаком. |
Неясно, |
блокаторы кальциевых каналов (вера- |
||||||||||||||||||
однако, во всех ли случаях прогресси- |
памил, нифедипин и др.), гипотензив |
||||||||||||||||||||
рование заболевания |
следует |
относить |
ные средства (резерпин), антибиотики |
||||||||||||||||||
за счет размножения клеток с актив |
(цефалоспорины, грамицидин, |
пуро- |
|||||||||||||||||||
ным Pgp. Для того чтобы настаивать на |
мицин), иммуносупрессоры |
(в первую |
|||||||||||||||||||
этом, |
необходимо |
проведение |
повтор |
очередь циклоспорин и его производ |
|||||||||||||||||
ных исследований больных по мере |
ные) и многие другие гидрофоб ные |
||||||||||||||||||||
эволюции |
заболевания. Таких данных |
препараты. Их объединяет лишь низ |
|||||||||||||||||||
немного. Наши результаты относитель |
кий молекулярный вес, гидрофоб- |
||||||||||||||||||||
но C M L показывают, что часто у боль |
ность и наличие ароматического коль |
||||||||||||||||||||
ных клетки, экспрессирущие Pgp, не |
ца в молекуле. Для некоторых из них |
||||||||||||||||||||
только не накапливаются при терапии |
(например, |
для |
верапамила) |
показано |
|||||||||||||||||
лекарствами, |
субстратами этого |
белка, |
связывание с молекулой Pgp и конку |
||||||||||||||||||
но и исчезают. Это означает, что в этих |
ренция за связывание с лекарствами, |
||||||||||||||||||||
случаях Pgp не способствует выжива |
субстратами |
Pgp. Клинические иссле |
|||||||||||||||||||
нию клеток в условиях терапии. Кроме |
дования |
показали, |
что |
концентрации |
|||||||||||||||||
того, мы нашли, что экспрессия Pgp |
большинства |
модификаторов |
|
Pgp- |
|||||||||||||||||
клетками периферической крови боль |
МЛУ, которые удается получить в |
||||||||||||||||||||
ного при постановке диагноза властно |
крови |
больных, |
недостаточны |
|
для |
||||||||||||||||
го криза |
БК |
C M L прогнозирует более |
преодоления лекарственной |
устойчи |
|||||||||||||||||
быстрое течение БК. Эти данные сви |
вости, а повышение дозы дает тяже |
||||||||||||||||||||
детельствуют о том, что связи экспрес |
лые осложнения. Популярными в на |
||||||||||||||||||||
сии белков ЛУ с исходом терапии ге |
стоящее |
время |
являются производное |
||||||||||||||||||
мобластозов не так просты, как кажет |
циклоспорина PSC-833 и производное |
||||||||||||||||||||
ся на первый взгляд. Мы объясняем |
верапамила R-верапамил. Основной |
||||||||||||||||||||
наши |
результаты |
сочетанием |
|
разных |
интерес |
вызывает |
применение |
моди |
|||||||||||||
механизмов ЛУ в одних и тех же клет |
фикаторов при гемобластозах, в пер |
||||||||||||||||||||
ках, а также тем, что экспрессия Pgp |
вую очередь ММ и лимфомах, в ком |
||||||||||||||||||||
является маркером активации в клет |
бинации с антрациклинами и винка- |
||||||||||||||||||||
ках сразу нескольких механизмов за |
алкалоидами. Большие рандомизиро |
||||||||||||||||||||
щиты от цитостатиков. |
|
|
|
|
|
ванные |
исследования |
|
модификаторов |
||||||||||||
Можно |
сказать, что, несмотря |
на |
Pgp-МЛУ проходят |
в |
С Ш А |
и странах |
|||||||||||||||
Западной Европы. В последние годы в |
|||||||||||||||||||||
необходимую |
осторожность |
в |
|
оценке |
|||||||||||||||||
|
качестве |
модификаторов |
Pgp-МЛУ |
||||||||||||||||||
результатов |
исследования роли |
|
Pgp |
в |
|||||||||||||||||
|
начали |
применять |
моноклональные |
||||||||||||||||||
исходе терапии злокачественных |
ново |
||||||||||||||||||||
антитела к |
Pgp, |
однако пока они |
на |
||||||||||||||||||
образований, |
при |
ряде |
опухолей |
Pgp- |
|||||||||||||||||
ходятся |
в стадии проверки. |
|
|
|
|||||||||||||||||
МЛУ играет роль в ответе больных на |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
терапию. |
Экспрессия |
этого |
белка ма- |
|
|
|
|
|
|
|
|
|
|
||||||||
лигнизированными |
клетками |
является |
13.1.2. |
Множественная |
|
|
|||||||||||||||
плохим |
прогностическим |
признаком |
|
|
|||||||||||||||||
лекарственная |
|
|
|
|
|
||||||||||||||||
даже |
в условиях, когда |
Pgp |
не |
опреде |
|
|
|
|
|
||||||||||||
устойчивость, |
|
|
|
|
|
||||||||||||||||
ляет |
резистентность |
больных |
к |
лече |
|
|
|
|
|
||||||||||||
определяемая |
|
белками |
|
|
|||||||||||||||||
нию. |
Нередко экспрессия Pgp |
обуслов |
|
|
|
||||||||||||||||
семейства |
MRP |
|
|
|
|
||||||||||||||||
лена |
типом |
дифференцировки |
опухоле |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
вых клеток. |
|
|
|
|
|
|
|
|
По сравнению с Pgp белок MRP1 |
||||||||||||
Преодоление Pgp-МЛУ. В связи с |
был открыт гораздо позже, в 1992 г., |
||||||||||||||||||||
клинической значимостью |
Pgp работы |
поэтому |
сведений |
относительно |
его |
||||||||||||||||
565
роли в эволюции злокачественных но вообразований меньше. Этот белок с молекулярной массой около 190 кДа, так же как и Pgp, является энергоза висимым (требующим АТФ) насосом, выкачивающим из клетки токсиче ские соединения, и тоже принадлежит к суперсемейству АВС-транспортеров. Сейчас известно уже шесть генов и белков M R P (MRP1 — MRP6), входя щих в подсемейство MRP/CFTR . Роль MRP1 в определении лекарственной устойчивости доказана с помощью опытов с введением в клетки гена MRP1. Гомология гена MRP1 и гена MDR1, кодирующего Pgp, очень неве лика (15 % ) . Гиперэкспрессия MRP1 вызывает устойчивость клеток при мерно к тем же препаратам, что и по вышенная экспрессия Pgp, однако спектр кросс-резистентности несколь ко иной. Например, клетки, экспрессирующие M R P 1 , обычно проявляют гораздо меньшую кросс-резистент ность к таксанам, чем клетки с PgpМЛУ. Механизм функционирования MRP1 иной, чем у Pgp: для активно сти MRP1 необходим глутатион, что позволило полагать, что в нормальных клетках этот белок является транспор тером конъюгатов лекарств с глутататионом. Такие конъюгаты могут со- д е р ж а т ь и физиологические субстраты (например, гормон 17бета-эстрадиол, простагландин А), афлатоксин В1. По вышенные количества MRP1 найдены в клетках нормальной печени, почек, эпителии бронхов, скелетных мыш цах, лимфоцитах периферической крови. Очевидно, в нормальных клет ках некоторые белки семейства M R P (MRP1, 2, 3) транспортируют конъюгаты глутатиона (а также некоторые другие конъюгаты), которые играют роль как в нормальной жизнедеятель ности клетки, так и в воспалительных процессах. Обнаружено, например, что MRP4 является высокоафинным транспортером сАМФ .
Имеются данные, что экспрессия наиболее изученного белка MRP1 клетками больных ассоциирована с лекарственной устойчивостью ряда
злокачественных новообразований: карцином молочной железы, легких, желудка, нейробластом, ретинобластом. Найдено, что у большинства больных AML, обследованных при постановке диагноза, бласты перифе рической крови сохраняют базальный уровень экспрессии белка, характер ный для нормальных клеток крови, однако появились сведения о том, что в случаях AML, резистентных к лече нию, экспрессия MRP1 выше, чем у пациентов с полной ремиссией. В от личие от M R P 1 — M R P 3 белки MRP4 и MRP5 в экспериментах сообщали клеткам устойчивость к препаратам иных классов — к аналогам пуриновых оснований и метотрексату (MRP4).
Несмотря на то что клиническая значимость белков M R P еще не со всем ясна, проводятся интенсивные поиски ингибиторов активности этих белков МЛУ. Пока ясно, что эффек тивные ингибиторы для MRP1 и Pgp разные, хотя ингбиторы активности Pgp в некоторой степени могут подав лять и функциональную активность MRP1 . Было найдено, что генистеин подавляет накопление даунорубицина
в клетках, |
гиперэкспрессирующих |
|
M R P 1 , но не |
в клетках с |
гиперэкс |
прессией Pgp. |
Генистеин |
высокоток |
сичен и не может применяться у боль ных, однако он используется в тестах на функциональную активность MRP1 . Применяются также ингибито ры синтеза глутатиона и ингибиторы протеинкиназы С.
13.1.3. Множественная лекарственная устойчивость и белок ABCG2 (MXR/BCRP)
Среди транспортных белков, с экс прессией которых связывают МЛУ, большое внимание в самые последние годы уделяется белку ABCG2 (MXR/ BCRP) (см. табл. 13.2), впервые опи санному в конце 90-х годов XX в. не сколькими независимыми группами исследователей, с чем и связано оби-
566
лие названий этого белка. ABCG2, принадлежащий к суперсемейству ABC, называют полутранспортером (half-transporter), поскольку он в отли чие от Pgp имеет 6 (а не 12) трансмем бранных доменов и 1 АТФ-связываю- щий (ABC) домен. Он обнаружен в клетках различных культур опухолей, впервые — в резистентных к антрациклинам клетках рака молочной же лезы MCF - 7, в связи с чем он и был назван BCRP (breast cancer resistance protein). Селекция культивируемых клеток митоксантроном нередко при водит к отбору клеток, гиперэкспрессирующих этот белок. Клетки, трансфицированные к Д Н К гена ABCG2, приобретали устойчивость к митоксантрону, даунорубицину, адриабластину. Накопление даунорубицина в этих клетках было снижено, и в них наблюдался ускоренный выброс флюоресцентного красителя Родами на 123. Показано, что белок ABCG2 гиперэкспрессирован в плаценте и, очевидно, защищает плод от токсиче ских веществ.
13.1.4. Множественная лекарственная устойчивость, определяемая белком LRP/Mvp
В отличие от белков Pgp и M R P открытый в 1993 г. белок МЛУ LRP (мол. масса 110 кДа) с помощью анти тел обнаруживается не на клеточной мембране, а по преимуществу в цито плазме. LRP оказался уже известным белком, Mvp, мажорным белком крупных рибонуклеопротеиновых час тиц, называемых vaults ("своды") — major vault protein. Vaults (мол. масса 13 кДа) обнаруживаются в цитоплазме всех эукариотических клеток. Эти час тицы имеют структуру, напоминаю щую бочку с закругленными линия ми — арками, отсюда и слово "своды". Функция этих частиц пока неясна, однако считают, что они участвуют в ядерно-цитоплазматическом транс порте. Имеются отдельные сообщения
о том, что vaults ассоциированы с ядерной мембраной. Есть данные, свидетельствующие о том, что LRP/ Mvp вовлечен в транспорт рецепторов стероидных гормонов внутри клетки. В клетке белок LRP нередко ассоции рован с везикулами и лизосомами, что позволяет связывать его функцию с транспортом лекарств и их изоляцией внутри везикул. Полагают, что в даль нейшем препарат может выводиться из клетки путем экзоцитоза. Строгие доказательства того, что LRP/Mvp оп ределяет МЛУ, пока отсутствуют, по скольку трансфекция этого гена в клетки не сообщала им лекарствен ную устойчивость. Показано, однако, что использование рибозима, специ фичного для LRP/Mvp, снижало ле карственную устойчивость клеток. Су ществуют данные, свидетельствующие о том, что экспрессия LRP может быть причиной МЛУ при раке яични ка и AML и определяет устойчивость опухолевых клеток к адриамицину, винкристину, этопозиду и таксолу.
13.2. Лекарственная устойчивость, обусловленная обезвреживанием препарата в клетке
Одной из важнейших систем клет ки, позволяющей ей обезвреживать цитостатики, является система глута тиона. Глутатион (GSH) — небелко вый тиол, взаимодействие сульфгидрильной группы которого с реактив ной группой лекарственного препа рата определяет образование конъ югатов препарата с глутамином. Эти конъюгаты менее активны, более во дорастворимы, выбрасываются из клетки с помощью белков MRP . По вышенное количество глутатиона об наруживается в клеточных линиях, резистентных к алкилирующим со единениям (эмбихину, хлорбутину, мелфалану, циклофосфамиду, B C N U и др.). Химические взаимодействия между глутатионом и алкилирующими соединениями катализируются
567

группой |
ферментов |
глутатион-S- |
гидрильная |
(SH) группа глутатиона |
|
трансфераз, разные изоформы кото |
связывается |
с реактивной |
группой |
||
рых, очевидно, взаимодействуют с |
хлорамбуцила. GSTалфьа и GSΤβ |
— глу- |
|||
разными |
препаратами, |
повышая сте |
татион-S-трансферазы, катализирую |
||
пень детоксикации лекарств. Сульф- |
щие реакцию. |
|
|||
Реакция связывания алкилирующего соединения (хлорамбуцил) с молекулой глутатиона и образования конъюгата (моноаддукта)
Сульфгидрильная (SH) группа глутатиона связывается с реактивной группой хлорамбуцила; GSTальфа и GSTбета — глутатион-5-трансферазы, катализирующие реакцию
Таким |
образом, |
активация |
этих |
ны, циклофосфану, хлорамбуцилу, не |
|||||||
ферментов |
может |
определять |
рези |
которым |
антрациклинам. |
Включение |
|||||
стентность клеток к лекарствам. Фер |
в систему GSH транспортных белков |
||||||||||
менты, катализирующие синтез |
глута |
M R P делает |
круг препаратов, устой |
||||||||
тиона в клетке, также могут иметь |
чивость к которым может обусловли |
||||||||||
отношение |
к лекарственной |
устойчи |
вать данная система, еще более широ |
||||||||
вости. |
|
|
|
|
|
ким. |
|
|
|
|
|
Полагают, что |
изменения |
различ |
Существенным фактором, который |
||||||||
ных ступеней системы G S H могут оп |
может |
влиять |
на чувствительность |
||||||||
ределять невосприимчивость |
к |
лече |
больных |
к |
химиотерапевтическим |
||||||
нию таких новообразований человека, |
препаратам, |
является |
генетический |
||||||||
как опухоли яичника, мозга, желудка, |
полиморфизм |
|
ферментов |
системы |
|||||||
некоторые |
лейкозы, |
обеспечивая ре |
GSH . Обнаружен полиморфизм по |
||||||||
зистентность опухолевых клеток к со |
нескольким генным локусам глутати- |
||||||||||
единениям |
платины, |
нитрозмочеви- |
он-S-трансфераз, |
однако |
роль разных |
||||||
568
генетических вариантов этих фермен тов в лекарственной устойчивости опухолевых больных пока неясна.
Ингибиторы |
активности глутати- |
он-S-трансфераз |
рассматриваются как |
наиболее перспективные модификато ры данного типа лекарственной ус тойчивости. К ним принадлежит, в частности, этакриновая кислота. BSO (бутионин сульфоксамин) снижает внутриклеточный уровень глутатиона и преодолевает устойчивость клеток к алкилирующим соединениям. BSO применяют также в экспериментах в качестве препарата, влияющего на MRP-МЛУ. Значение GSH-ЛУ отме чено при лечении лимфом. Повыше ние активности глутатион-S-трансфе- раз наблюдается в устойчивых к хлорбутину случаях ХЛЛ.
13.3. Лекарственная устойчивость, связанная с изменением
или повышенной репарацией мишени препаратов
Ряд препаратов, применяемых при лечении злокачественных новообразо ваний, является ингибиторами топоизомераз (топоизомеразы I, чаще то поизомеразы II). В их круг входят препараты, стабилизирующие ком плекс топоизомераза-ДНК, который в нормальных условиях быстро распада ется. В культивируемых клетках, рези стентных за счет изменений топоизо меразы II, обнаруживают либо сниже ние активности этого фермента, либо снижение его количества. Найдены мутации гена топоизомеразы II, с ко торыми связывают ЛУ. Препаратами, к которым возникает этот тип рези стентности, являются ингибиторы то поизомеразы II — этопозид (VP-16) и тенипозид (VP-26), адриамицин, рубомицин, митоксантрон, амсакрин, а также бифункциональные агенты (со единения платины и нитрозметилмочевины). Клиническая значимость этого типа МЛУ пока неясна. Боль шинство веществ, взаимодействую щих с молекулой топоизомеразы II,
являются также субстратами Pgp или MRP . Существуют эксперименталь ные данные о том, что применение лекарства в комбинации с модифика торами активности Pgp приводит к возникновению МЛУ, определяемой топоизомеразой II. Нельзя исключить также, что разные механизмы МЛУ могут оперировать в одной клетке.
Еще одним возможным путем из менения мишени препарата является увеличение количества белка-мише ни в клетке. Например, в целом ряде культивируемых клеточных линий, резистентных к метотрексату, обнару живалось увеличение количества бел ка-мишени этого препарата, дигидрофолатредуктазы (ДГФР), связанное с амплификацией гена ДГФР .
Повышенная эффективность репа рации повреждений Д Н К , по-видимо му, играет роль в резистентности к препаратам нитрозметилмочевины или платины, механизмом действия
которых |
является взаимодействие |
с |
|
молекулой Д Н К . Так, |
устойчивость |
к |
|
BCNU |
(кармустину) |
коррелирует |
с |
экспрессией Ο-6-алкилгуанин-ДНК- алкилтрансферазы. Изменения коли чества белков, распознающих и репарирующих повреждения Д Н К , таких как ERCC1, ERCC2 и ERCC3/XPB, были найдены при изменениях чувст вительности культивируемых клеток к препаратам платины.
13.4.Роль ключевых генов, контролирующих апоптоз,
влекарственной устойчивости опухолевых клеток
13.4.1.Ген р53
и лекарственная устойчивость опухолевых клеток
Важнейшим элементом ответа клетки на стрессорные воздействия, в том числе на воздействие химиотерапевтических препаратов, является бе лок р53 и регулируемые им гены (см. раздел 3.1). Нормальный р53 активи-
569
руется в ответ на различные повреж |
шие р53 дикого типа. Эти данные сви |
|||||||||||||||||||||||||||||||
дающие клетку воздействия, что при |
детельствуют |
о |
существенной |
роли |
||||||||||||||||||||||||||||
водит к остановке пролиферации кле |
р53 |
в |
|
|
определении |
чувствительности |
||||||||||||||||||||||||||
ток или к апоптозу. Таким образом |
злокачественных |
новообразований |
к |
|||||||||||||||||||||||||||||
поврежденные клетки либо |
удаляются |
химиотерапии. |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
из популяции, либо у клеток появля |
Очевидно, однако, что и эта про |
|||||||||||||||||||||||||||||||
ется |
возможность |
|
репарировать |
по |
блема не так проста. Исследования |
|||||||||||||||||||||||||||
врежденную |
Д Н К . |
|
Изменения |
р53, |
регуляции р53 показывают, что харак |
|||||||||||||||||||||||||||
весьма частые в опухолях (см. раздел |
тер модификаций, |
активирующих этот |
||||||||||||||||||||||||||||||
3.1), |
обусловливают |
|
нарушения |
нор |
белок |
|
в |
ответ |
|
на |
стимулы, |
зависит: |
||||||||||||||||||||
мальной |
функции |
|
кодируемого |
|
им |
а) от стрессорного воздействия, б) тка |
||||||||||||||||||||||||||
белка и нарушение способности кле |
невой и в) видовой принадлежности |
|||||||||||||||||||||||||||||||
ток вступать в апоптоз или останавли |
клеток, г) типа аминокислотной заме |
|||||||||||||||||||||||||||||||
ваться в некоторых сверочных точках |
ны в мутантном р53. Разные повреж |
|||||||||||||||||||||||||||||||
клеточного цикла в ответ на повреж |
дающие воздействия не только разны |
|||||||||||||||||||||||||||||||
дение. |
Химиотерапевтические |
препа |
ми способами активируют р53, но и |
|||||||||||||||||||||||||||||
раты вызывают чаще всего апоптоз |
эта |
активация |
|
осуществляется |
через |
|||||||||||||||||||||||||||
опухолевых |
клеток |
|
или |
длительную |
разные сигнальные пути. Эти, а воз |
|||||||||||||||||||||||||||
остановку их движения по циклу. Та |
можно, и другие особенности регуля |
|||||||||||||||||||||||||||||||
ким образом, нарушения функции р53 |
ции |
р53 |
определяют |
существенные |
||||||||||||||||||||||||||||
a priori могут вызвать изменения чув |
различия |
ответа |
разных |
опухолевых |
||||||||||||||||||||||||||||
ствительности |
опухолевых |
|
клеток |
к |
клеток на одни и те же воздействия и |
|||||||||||||||||||||||||||
воздействию |
|
химиотерапевтических |
различия в результатах влияния на р53 |
|||||||||||||||||||||||||||||
препаратов, в частности приводить к |
одних и тех же клеток разных повреж |
|||||||||||||||||||||||||||||||
множественной |
лекарственной |
устой |
дающих |
агентов. |
Приведем |
примеры |
||||||||||||||||||||||||||
чивости. |
|
|
|
|
|
|
|
|
|
|
|
|
таких |
|
разных |
|
эффектов: |
активация |
||||||||||||||
В |
число |
индукторов, |
активирую |
р53 в ответ на повреждение Д Н К при |
||||||||||||||||||||||||||||
водила к гибели |
(апоптозу) фибробла- |
|||||||||||||||||||||||||||||||
щих нормальный |
р53, |
входят |
агенты, |
|||||||||||||||||||||||||||||
стов человека, |
в то время как размно |
|||||||||||||||||||||||||||||||
разными |
способами |
повреждающие |
||||||||||||||||||||||||||||||
жение |
|
фибробластов |
|
грызунов |
лишь |
|||||||||||||||||||||||||||
Д Н К , |
|
вызывающие |
|
изменения |
пула |
|
|
|||||||||||||||||||||||||
|
|
временно |
задерживалось. |
В |
одной |
из |
||||||||||||||||||||||||||
рибонуклеотидов, |
изменения |
редокс- |
||||||||||||||||||||||||||||||
работ было обнаружено, что гиперэкс |
||||||||||||||||||||||||||||||||
потенциала |
(например, |
накопление |
||||||||||||||||||||||||||||||
прессия р53 в |
культивируемых клетках |
|||||||||||||||||||||||||||||||
атомов |
активного |
кислорода |
в клет |
|||||||||||||||||||||||||||||
легкого |
человека линии |
Η1299 потен |
||||||||||||||||||||||||||||||
ке), |
разрушение |
веретена |
деления, |
|||||||||||||||||||||||||||||
цирует, |
как |
и |
следовало |
ожидать, ци- |
||||||||||||||||||||||||||||
и др. |
(см. раздел |
3.1). Поскольку |
ме |
|||||||||||||||||||||||||||||
тотоксический |
|
эффект |
цисплатины, |
|||||||||||||||||||||||||||||
ханизмы действия |
ряда |
противоопухо |
|
|||||||||||||||||||||||||||||
но |
защищает эти |
клетки |
от |
токсиче |
||||||||||||||||||||||||||||
левых |
|
препаратов |
|
связаны |
с |
этими |
||||||||||||||||||||||||||
|
|
ского |
|
действия |
випезида. |
|
Известно, |
|||||||||||||||||||||||||
воздействиями |
на |
|
клетку, |
|
очевидно, |
|
|
|||||||||||||||||||||||||
|
|
однако, |
что |
в других клетках (в тимо- |
||||||||||||||||||||||||||||
что многие |
из |
цитостатиков |
должны |
|||||||||||||||||||||||||||||
цитах |
|
мыши) |
р53 |
определяет индук |
||||||||||||||||||||||||||||
являться |
активаторами |
р53. Действи |
|
|||||||||||||||||||||||||||||
цию апоптоза именно випезидом. Ан- |
||||||||||||||||||||||||||||||||
тельно, большое исследование Нацио |
||||||||||||||||||||||||||||||||
тиапоптотический |
(вместо |
ожидаемо |
||||||||||||||||||||||||||||||
нального |
Ракового |
|
Института |
США, |
||||||||||||||||||||||||||||
|
го |
апототического) эффект |
р53 |
отме |
||||||||||||||||||||||||||||
включившее |
60 |
линий |
культивируе |
|||||||||||||||||||||||||||||
чен |
и |
|
в |
нескольких других работах. |
|
|||||||||||||||||||||||||||
мых опухолевых клеток и более 100 |
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
противоопухолевых |
|
препаратов, |
вы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
явило прямую корреляцию между ста |
|
Таким |
образом, |
р53, |
|
несомненно, |
||||||||||||||||||||||||||
тусом |
р53 |
в |
клетках |
|
и их чувствитель |
|
|
|||||||||||||||||||||||||
|
играет |
важную |
роль |
в |
определении |
|||||||||||||||||||||||||||
ностью |
к |
цитотоксическому действию |
||||||||||||||||||||||||||||||
|
чувствительности |
|
опухолевых |
кле |
||||||||||||||||||||||||||||
лекарств. Клетки с мутантным р53 ча |
|
|
||||||||||||||||||||||||||||||
ток |
|
к |
цитостатикам, |
однако |
ха |
|||||||||||||||||||||||||||
ще всего были более резистентными к |
|
|||||||||||||||||||||||||||||||
рактер |
влияния |
р53 |
на |
лекарствен |
||||||||||||||||||||||||||||
препаратам |
с |
разным |
механизмом |
|||||||||||||||||||||||||||||
ную |
|
устойчивость |
|
опухолевых |
кле |
|||||||||||||||||||||||||||
действия |
(например, |
к |
цисплатину |
и |
|
|
||||||||||||||||||||||||||
ток |
|
может |
|
существенно |
меняться |
|||||||||||||||||||||||||||
5-фторурацилу), |
чем |
клетки, |
обладав |
|
|
|||||||||||||||||||||||||||
в |
зависимости |
от |
механизма |
дей- |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
570
спиши лекарственного препарата, видовой, тканевой принадлежности клеток, а также, очевидно, от тех генетических изменений, которые возникли в опухолевой клетке в ходе канцерогенеза и опухолевой прогрес сии, в том числе и от различий в изменениях самого гена ρ53 в клет ках.
Белки, синтез которых контроли рует транскрипционный фактор р53 (p21Waf-1, M D M ) , также могут влиять на чувствительность клеток к цитостатикам. Недавно показано, что р53 влияет и на экспрессию некоторых ге нов, продукты которых локализованы в митохондриях и имеют непосредст венное отношение к программам апоптоза (NOXA, p53AIP, PUMA).
Факты, полученные в пользу значения всех этих генов для лекарственной ус тойчивости опухолевых клеток, либо скудны, либо сходны с полученными для р53. Иногда в экспериментах эф фекты р53 и контролируемых им бел ков на чувствительность клеток к ле карствам могут не совпадать.
13.4.2.Антионкоген PTEN
илекарственная устойчивость опухолевых клеток
Еще одной системой, имеющей от ношение к лекарственной устойчиво сти опухолевых клеток, является сис тема передачи сигнала, вовлекающая ген PTEN. PTEN — опухолевый супрессор, имеющий гомологию с тирозинфосфтазами и тензином, белком, ассоциированным с актиновым цитоскелетом в фокальных контактах клет ки (см. раздел 3.1). Белок PTEN обла дает способностью дефосфорилировать субстраты как по тирозину, так и по треонину. PTEN выполняет роль опухолевого супрессора, являясь нега тивным регулятором фосфатидилинозитол З'-киназного (Р13К/РКВ/ Akt) сигнального пути. Известно, что протеинкиназа B/Akt является важ нейшим регулятором выживания
клетки. PTEN негативно влияет на выживаемость клеток в неблагоприят ных условиях, его активация может повысить чувствительность опухоле вых клеток к химиотерапии, а его инактивация определит лекарствен ную резистентность.
Действительно, показано, что клет ки, дефектные по PTEN, обладают оп ределенной степенью резистентности к целому ряду повреждающих (инду цирующих апоптоз) воздействий: ультрафиолетовым лучам, T N F a , циклогексимиду, анизомицину, сорбитолу, тепловому шоку. В таких устойчи вых клетках были конститутивно по вышены активность и фосфорилирование протеинкиназы B/Akt.
На примере системы, включающей белок PTEN, хорошо видна роль на рушения нормального баланса между проапоптотическими и антиапоптотическими (обеспечивающими размно жение и выживание клеток) сигнала ми в чувствительности популяций опухолевых клеток к лекарственным препаратам. Не только инактивация PTEN, но и различные способы ингибирования активности PI3K или РКВ/ Akt могут приводить к резистентности клеток к лекарствам.
13.4.3. Влияние онкогена BCL-2 и других генов семейства BCL-2
на лекарственную устойчивость опухолевых клеток
BCL-2 — онкоген, участвующий в процессе возникновения злокачест венного новообразования в связи с тем, что он подавляет апоптоз. Он принадлежит к большому семейству генов, продукты которых обладают как антиапоптотическим (например, BCL-2, BCL-XL), так и проапоптотическим действием (Βαx, Bad Bic и др.) Кодируемые этими генами полипеп тиды могут образовывать гомо- и гетеродимеры, сочетания членов которых определяют их влияние на апоптоз. Белок BCL-2 способен тормозить
571
апоптоз, вызываемый р53 в ответ на |
гут приводить к лекарственной устой |
|||||||||||||||||||||||
генотоксические воздействия. Показа |
чивости. Показано, что лимфоциты |
|||||||||||||||||||||||
но, что гиперэкспрессия BCL-2 сооб |
мышей, мутантных по гену рецептора |
|||||||||||||||||||||||
щает |
клеткам лекарственную |
устойчи |
CD95, а также линии клеток, рези |
|||||||||||||||||||||
вость к различным химиотерапевтаче- |
стентные к CD95-L, устойчивы к ряду |
|||||||||||||||||||||||
ским препаратам. Существуют дан |
химиотерапевтических |
|
препаратов. |
|||||||||||||||||||||
ные, |
показывающие, |
что экспрессия |
Было обнаружено также, что воздей |
|||||||||||||||||||||
гена |
BCL-2 может рассматриваться |
ствия, |
блокирующие данный |
сигналь |
||||||||||||||||||||
как |
плохой прогностический признак |
ный путь, препятствуют апоптозу, вы |
||||||||||||||||||||||
при |
ряде |
новообразований, |
например |
званному |
химиопрепаратами. |
|
Однако |
|||||||||||||||||
при раке мочевого пузыря, новообра |
при |
использовании |
некоторых |
линий |
||||||||||||||||||||
зованиях системы кроветворения лим- |
клеток |
были |
получены |
результаты, |
||||||||||||||||||||
фоидного и миелоидного ряда. В по |
свидетельствующие, |
|
что |
|
система |
|||||||||||||||||||
следнее время появились работы, сви |
CD95-L/CD95 не играет роли в апоп |
|||||||||||||||||||||||
детельствующие о том, что при неко |
тозе, |
вызываемом |
|
лекарственными |
||||||||||||||||||||
торых |
новообразованиях |
(например, |
препаратами. Таким образом, так же, |
|||||||||||||||||||||
при опухолях мозга) особое место в |
как и в случаях других генов, описан |
|||||||||||||||||||||||
определении |
восприимчивости |
боль |
ных выше, характер влияния данной |
|||||||||||||||||||||
ных |
|
к |
химиотерапии |
принадлежит |
системы |
на |
лекарственную |
чувстви |
||||||||||||||||
белку |
ΒΑΧ. |
|
|
|
|
|
|
|
|
тельность опухолевых клеток не все |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
гда |
однозначен |
и, |
очевидно, |
зависит |
||||||||
73.4.4. Система CD95-L/CD95 |
от целого ряда параметров. |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
(FasL/Fas) |
и лекарственная |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
устойчивость |
|
|
|
|
|
|
13.4.5. |
Фактор |
транскрипции |
|||||||||||||||
Система лиганд/рецептор CD95-L/ |
NF-kB |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
CD95 (FasL/Fas или APOl) играет |
N F - k B |
— |
фактор |
транскрипции, |
||||||||||||||||||||
важную роль в апоптозе некоторых |
контролирующий экспрессию |
многих |
||||||||||||||||||||||
типов клеток. Лиганд CD95-L (ли- |
генов, вовлеченных в контроль раз |
|||||||||||||||||||||||
ганд, т. е. связывающее рецептор ве |
множения, дифференцировки |
и |
про |
|||||||||||||||||||||
щество) — интегральный белок мем |
граммируемой гибели клеток. Он ак |
|||||||||||||||||||||||
браны, который может выходить во |
тивируется в ответ на ионизирующее |
|||||||||||||||||||||||
внеклеточную |
среду |
и |
действовать, |
излучение |
и |
такие |
химиопрепараты, |
|||||||||||||||||
как растворимый цитокин (по прин |
как ингбиторы топоизомераз, антиме |
|||||||||||||||||||||||
ципу находящихся в среде факторов |
таболиты, таксаны, винка-алкалоиды. |
|||||||||||||||||||||||
роста). Существуют и другие, сходные |
Конститутивная активация этого фак |
|||||||||||||||||||||||
с CD95-L, цитокины — индукторы |
тора в клетках поджелудочной железы |
|||||||||||||||||||||||
апоптоза: |
фактор |
некроза |
опухолей |
рассматривается |
как причина лекарст |
|||||||||||||||||||
(TNFальфа), TRAIL |
и др. |
Связываясь |
со |
венной |
устойчивости |
новообразова |
||||||||||||||||||
своим рецептором, CD95-L (или дру |
ний этого органа. Ингибирование ак |
|||||||||||||||||||||||
гой сходный цитокин) включает цепь |
тивности |
N F - k B приводило |
к |
повы |
||||||||||||||||||||
передачи |
сигнала, |
|
приводящего |
к |
шению |
чувствительности |
клеток |
кар |
||||||||||||||||
апоптозу. Данная сигнальная |
система, |
циномы поджелудочной железы к ле |
||||||||||||||||||||||
по-видимому, независима от пути ре |
карственным препаратам. Однако в |
|||||||||||||||||||||||
гуляции апоптоза, в которой участву |
отношении |
новообразований |
других |
|||||||||||||||||||||
ют |
р53, |
BCL-2 и другие упомянутые |
локализаций |
данные |
весьма |
противо |
||||||||||||||||||
выше |
гены. |
|
|
|
|
|
|
|
|
речивы. Так, например, на несколь |
||||||||||||||
Есть данные, |
показывающие, |
что |
ких |
линиях |
культивируемых |
опухоле |
||||||||||||||||||
вых |
клеток |
показано, что, |
несмотря |
|||||||||||||||||||||
система |
CD95-L/CD95 |
может |
иметь |
|||||||||||||||||||||
на |
торможение |
активности |
N F - k B , |
|||||||||||||||||||||
отношение к |
гибели |
опухолевых |
кле |
|||||||||||||||||||||
выживаемость клеток |
в |
среде |
с |
раз |
||||||||||||||||||||
ток |
под |
влиянием |
химиотерапевтиче- |
|||||||||||||||||||||
личными |
химиопрепаратами |
не |
отли |
|||||||||||||||||||||
ских |
препаратов, |
а |
нарушения |
в |
||||||||||||||||||||
чалась |
от контрольной. Тем |
не |
менее |
|||||||||||||||||||||
функционировании этой системы мо |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
572
идея использовать ингибиторы N F - K B для повышения эффективности лече ния злокачественных новообразова ний остается весьма популярной.
Суммируя сведения, приведенные в разделах 13.4.2—13.4.5, можно ска зать, что различные нарушения ре гуляции апоптоза и выживаемости опухолевых клеток, несомненно, су щественно сказываются на чувст вительности популяций опухолевых клеток к химиотерапии, однако данные о роли каждого из молеку лярных изменений пока остаются противоречивыми.
* * *
Изложенные выше результаты изу чения механизмов ЛУ опухолевых клеток показывают, что эти механиз мы множественны, в работе освещены лишь основные. Так, например, не описано влияние изменений проли ферации опухолевых клеток на их чувствительность к лекарствам. От крытия новых генов и белков, обу словливающих защиту клетки от по вреждений, продолжаются. Множест венность и разнообразие механизмов ЛУ значительно затрудняют как диаг ностику причин устойчивости боль ных к терапии, так и выработку ра зумных протоколов по преодолению ЛУ опухолевых клеток.
Обсуждение каждого отдельного механизма ЛУ показывает, что чувст вительность опухолевых клеток к те рапии в высокой степени зависит от того, что сейчас принято называть "клеточным контекстом", — от сочета ния особенностей регуляции жизнен но важных процессов клетки, связан ных с ее видовой, тканевой принад лежностью, а также с теми генетиче скими изменениями, которые про изошли в клетке в ходе ее малигниза ции и профессии новообразования. Этот феномен осложняет диагностику причин ЛУ опухолей. Существенный вклад в представления о ЛУ вносит и изучение наследственного полимор
физма генов, определяющих этот фе номен (см. раздел 13.1.1).
Естественно, на первый план вы ходит исследование множественной лекарственной устойчивости и неко торых ключевых и наиболее часто встречающихся ее механизмов. Важ нейшее значение, несомненно, имеют изменения генов и белков, контроли рующих апоптоз и выживаемость опу холевых клеток, в первую очередь из менения р53 и белков семейства BCL- 2 (см. раздел 13.4), а также такие за щитные механизмы, как повышение активности белка-транспортера Pgp и функционирование системы глутатио на (см. разделы 13.1.1 и 13.1.3). Хотя исследования клинической значимо сти каждого из этих ключевых меха низмов МЛУ, как следует из изложен ного выше, свидетельствуют об их важной роли в исходе терапии при не которых новообразованиях, нередки и отрицательные результаты. Это связа но с многообразием причин МЛУ при одних и тех же типах новообразова ний, в одной и той же опухоли и, не редко, в одной и той же опухолевой клетке. Полученные данные тем не менее свидетельствуют о необходимо сти исследования конкретных меха низмов для диагностики причин МЛУ большинства опухолей. Очевидно, в зависимости от изменений в клетках данного новообразования генов, опре деляющих малигнизацию (см. главу 3), а также от характера экспрессии белков (например, Pgp) в данной тка ни и у данного пациента набор иссле дуемых для диагностики МЛУ генов или белков должен быть разным для разных неоплазий.
При планировании набора мето дов, выявляющих ЛУ, нельзя забы вать, что, хотя и существуют опреде ленные механизмы лекарственной ус тойчивости, наиболее характерные для резистентности клеток к данному препарату, чаще всего устойчивость клеток к конкретному веществу может определяться несколькими разными причинами. Так, например, устойчи вость к цисплатину может быть связа-
573
на с активацией системы глутатиона, повышенным выбросом препарата из клетки, изменениями регуляции апоп тоза, повышением эффективности ре парации Д Н К .
Важно понимать, что в одной и той же клетке (не говоря о гетерогенной популяции опухолевых клеток) могут сосуществовать разные механизмы ЛУ, которые могут быть связаны между со бой. Эти связи исследованы мало, од нако примеры таких связей можно привести. Например, было найдено, что если подавить в клетках активность белка р53 дикого типа (это отменяло апоптоз, вызванный лекарствами), то активируется белок Pgp. Таким обра зом, в данном случае имело место со существование и взаимосвязь двух ти пов МЛУ — обусловленной нарушени ем функции нормального белка р53 и обусловленной активностью Pgp. Не давно в промоторной области гена MDRI человека, кодирующего Pgp, был обнаружен сайт связывания для р53. Транскрипционный фактор р53 при нимает, таким образом, участие в регу ляции Pgp. О связи белка-транспортера MR P и системы глутатиона мы писали выше (см. раздел 13.1.2).
Для повышения эффективности химиотерапии опухолей неоднократно предлагались различные методы опре деления индивидуальной чувствитель ности клеток данной опухоли к ряду химиопрепаратов. В настоящее время применяется набор методик с исполь зованием краткосрочных культур кле ток больного, позволяющих судить о чувствительности клеток пациента к различным препаратам. В круг этих методов входят тесты, оценивающие влияние препаратов на размножение клеток (определение эффективности клонирования клеток, тест МТТ, включение в клетки меченого тимидина и др.), оценка целостности клеточ ной мембраны (DiSC-метод), оценка экспрессии отдельных белков или ге нов, определяющих МЛУ опухолевых клеток (в частности, Pgp, BCL-2, фер ментов системы глутатиона и др.), а также некоторые другие тесты. При
гемобластозах детей такие тесты, при меняемые комплексно, уже дают све дения, позволяющие выбрать необхо димую терапию. Несомненно, опреде ление экспрессии набора генов мето дом микрочипов найдет свое место при исследовании чувствительности больных к химиотерапии.
С точки зрения изучения защит ных систем клетки, наиболее интерес ным представляется исследование сигнальных путей, участвующих в ре гуляции различных защитных белков/ генов, а также связей между разными сигнальными системами. Учитывая множественность причин ЛУ, наибо лее перспективным подходом к поис кам веществ, преодолевающих лекар ственную устойчивость опухолевых клеток, является детальное исследова ние путей сигнальной трансдукции, регулирующих активность генов, оп ределяющих ЛУ.
Рекомендуемая литература |
|
|
|
|
|
|
||||
Ambudakar S. |
V., |
Dey |
S., |
Hrycyna |
С. A. |
et |
al. |
|||
Biochemical, |
cellular, |
and |
pharmacologi |
|||||||
cal aspects of the multidrug |
transporter // |
|||||||||
Ann. Rev. Pharmacol. Toxicol. — 1999. — |
||||||||||
Vol. 39. - P. 361 - 398 . |
|
|
|
|
|
|
||||
Borst P., Evers R., Kool |
M., |
Wijnholds |
J. |
A |
||||||
family of drug transporters: the |
multidru- |
|||||||||
gresistance-associated |
proteins |
// |
J. |
Natl. |
||||||
Cancer . Inst. — 2000. — |
Vol. 92. |
— |
||||||||
P. 1295-1302. |
|
|
|
|
|
|
|
|
||
Brinkmann U., Roots I., Eichelbaum |
M. |
Phar |
||||||||
macogenetics of the human drug-transport |
||||||||||
er gene |
M D R I : |
impact |
of |
polymorphism |
||||||
on pharmacotherapy // Drug Discovery |
||||||||||
Today. - |
2001. - |
Vol. 6. |
- |
P. |
835-839. |
|||||
Chu G. Cellular responses to cisplatin // J. Bi
ol. |
Chem. |
- |
1994. - Vol. 269. |
- |
|
P. 787-790. |
|
|
|
|
|
Robert J. |
Resistance |
to cytotoxic |
agents |
// |
|
Curr. |
Opinion |
in |
Pharmacology. |
— 2001. |
|
-Vol. 1. - P. 353 - 357 .
Shen H., Kauvar L., Tew K. D. Importance of glutathione and associated enzymes in drug response // Oncology Res. — 1997.
-Vol. 9. - P. 295 - 302 .
Zheleznova |
Ε. E., |
Markham, |
P. N., Neyfakh, |
|
Α. Α., |
Brennen, R. G. Structural basis of |
|||
multidrug recognition by BmrR, a transcrip |
||||
tion activator of multidrug transporter |
// |
|||
Cell. - |
1999. |
- Vol. 96. |
- P. 353-362. |
|
574

Руководство для врачей
КАНЦЕРОГЕНЕЗ
Зав. редакцией Т. П. Осокина Научный редактор Т. Л. Эрайзер
Редакторы издательства Л. В. Левушкина, Г. А. Рыжова
Художественный редактор С. М. Лымина
Технический редактор |
В. Г. |
Александрова |
|
|
|||||
Корректор |
М. |
П. |
Молокова |
|
|
|
|
||
ЛР № 010215 от 29.04.97. Сдано в набор |
17.07.2003. Подписано к |
||||||||
печати |
13.11.2003. |
Формат |
бумаги |
70 х 1001/16. Бумага офсетная |
|||||
№ 1. |
Гарнитура |
Тайме. |
Печать |
офсетная. Усл. |
печ. |
л. 47,12. |
|||
Усл. кр.-отт. 48,73. |
Уч.-изд. л. |
49,83. |
Тираж |
3000 |
экз. За |
||||
каз № |
7908 |
(л-л). |
|
|
|
|
|
|
|
ГП ордена Трудового Красного Знамени издательство "Медицина". 101990, Москва, Петроверигский пер., 6/8.
Отпечатано с готовых диапозитивов на Федеральном государствен ном унитарном предприятии Смоленский полиграфический ком бинат Министерства Российской Федерации по делам печати, те лерадиовещания и средств массовых коммуникаций. 214020, Смо ленск, ул. Смольянинова, 1.
