
2 курс / Нормальная физиология / Физиология_дыхания_Частоедова_И_А_,_Еликов_А_В_
.pdf
51
1.Протекает при температуре человеческого тела;
2.Протекает в водной среде;
3.Отсутствует пламя.
Другой вопрос, который долгое время занимал ученых, был о происхождении энергии активации необходимой для взаимодействия водорода и кислорода. Дело в том, что в молекулярной форме кислород относительно малоактивен, поэтому «гремучую смесь» (смесь кислорода с водородом)
необходимо нагреть, а водород выходящий из трубки генератора - поджечь. В
условиях организма это невозможно, поэтому дискуссия о происхождении энергии активации в процессах биологического окисления получила дальнейшее развитие. В 1897 году была обоснована первая гипотеза тканевого дыхания, названная гипотезой перекисного (пероксидного) окисления. Ее разрабатывали независимо А.Н. Бах в России и Энглер в Германии. Суть данной гипотезы состоит в том, что при дыхании, как считали авторы,
происходит активирование молекул О2 за счет энергии самоокисляющихся веществ, образование пероксидов и разложение их с участием другого вещества:
1. О = О  – О – О – (активный кислород)
– О – О – (активный кислород)
О
Оксигеназа
2. – О – О – + А (субстрат) |
А |
(пероксид) |
О
О
Пероксидаза
3. А + В (второй субстрат)  АО + ВО
АО + ВО
О
Для указанных целей необходимо последовательное действие двух ферментов - оксигеназы и пероксидазы. Впоследствии оказалось, что это не главный, а частный случай окисления веществ при дыхании. В настоящее время известно, что это тип медленного окисления органических веществ имеет место в микросомах печени, а не в митохондриях.

52
Идея активирования кислорода как основного механизма тканевого дыхания разрабатывалась известным немецким ученым Варбургом, создавшим первые аппараты для изучения тканевого дыхания. Он считал, что активирование кислорода есть ключевой процесс в тканевом дыхании, в результате чего кислород соединяется с водородом и образуется вода.
В 1912 г. Варбург открыл гемосодержащий протеид, названный в последствии цитохромоксидазой, которая активирует кислород. Однако, после открытия в том же году Бателли и Штерном дегидрогеназ ученых захватила идея активирования не кислорода, а водорода субстрата как основного звена тканевого дыхания. В.И. Палладин (1912) предложил схему дыхания, по
которой дегидрирование является важнейшим звеном дыхания:
Дегидрогеназы
А · Н2 (субстрат) ½ О2 Н2О Вскоре Виланд и Тунберг доказали, что возможно активирование водорода
субстрата с помощью дегидрогеназы. Гипотеза Палладина получила подтверждение. Примерить дегидрогеназную концепцию Палладина и оксидазную Варбурга в тканевом дыхании удалось после открытия в 1933 г.
Кейлином цитохромов, являющихся промежуточными переносчиками электронов от водорода к кислороду. На самом деле Кейлин переоткрыл цитохромы, которые были впервые описаны Мак-Мунном в 1886 г. и названные им гистогематинами.
По современным представлениям, в реально работающей дыхательной цепи присутствуют как элементы активации водорода, так и активации кислорода.
Активация водорода достигается взаимодействием его с коферментами дегидрогеназ. Так редокс-потенциал (о природе и величине редокс-потенциала будет сказано ниже) газообразного водорода равен 0 (нулю), а когда водород в составе кофермента НАДН·Н+ редокс-потенциал снижается до величины -0,32
В, что говорит об резком увеличении восстанавливающих свойств водорода.
Активация кислорода достигается путем взаимодействия на уровне цитохромоксидазы двух электронов, идущих по дыхательной цепи с молекулой
53
О2. В результате неполного восстановления молекулы О2 (для полного восстановления молекулы О2 необходимо 4 электрона) образуется активная форма кислорода - пероксидный свободный радикал. Таким образом, теория активации кислорода также нашла свое подтверждение.
Контрольные вопросы
1.Что такое тканевое дыхание ?
2.В чем сходство и отличие между процессами горения и биологического окисления в организме ?
3.В чем суть гипотез А.Н. Баха и В.И. Палладина ?
5.2. Современные представления о структуре элементов
дыхательной цепи
В переносе электронов от субстрата к молекулярному кислороду принимают участие:
1. Коферменты на основе витамина В5 (РР) - пиридинзависимые дегидрогеназы,
для которых коферментами служат либо НАД, либо НАДФ; 2. Коферменты на основе витамина В2 - флавиновые дегидрогеназы
(флавиновые ферменты), у которых роль простетической группы играют ФАД или ФМН;
3.Убихинон (коэнзим Q);
4.Цитохромы, содержащие в качестве простетической группы железопорфириновую кольцевую систему. Среди компонентов дыхательной цепи обнаружены также и железосерные белки (FeS), содержащие негеминовое железо.

54
5.2.1. Характеристика коферментов на основе витамина В5 (РР)
Витамин B5 является компонентом коферментов. Функции витамина в организме человека выполняют никотиновая кислота и ее амид. Ниацин в организме используется для образования никотинамидных коферментов. Их представителями являются никотинамид-аденин-динуклеотид (НАД+, NAD+) и
никотинамид-аденин-динуклеотид-фосфат (НАДФ+, NADP+). Эти коферменты образуют специфические, каталитически активные комплексы с многочисленными (более 200) дегидрогеназами. Холоферменты участвуют в осуществлении окислительно-восстановительных реакций метаболизма.
Вчастности, эти комплексы:
1.Облегчают реакции окисления одного субстрата за счет восстановления другого. Эти реакции особенно важны для осуществления окислительных процессов в отсутствии кислорода. Примером подобных реакций может служить обратимое окисление молочной кислоты до пировиноградной,
которую катализирует фермент лактатдегидрогеназа (ЛДГ):
НООC-CН(ОН)-CH3 |
|
НООC-C(О)-CH3 |
|
2H 2e |
|
молочная к-та |
НАД+ |
НАДН∙Н+ ПВК |
Схема 1. Участие кофермента НАД+ в обратимом окислении молочной кислоты в
составе фермента лактатдегидрогеназы
2. Обеспечивают функцию компонентов дыхательной цепи, транспортируя
электроны (водород) от субстрата на кислород.
Схема 2. Химическое строение |
Схема |
3. |
Химическое |
строение |
никотинамида |
никотиновой кислоты |
|
||

Помимо окислительно-восстановительных реакций, лежащих в основе энергетического обмена, ниацин участвует в ряде других, не окислительно-
восстановительных реакций. В частности доказано, что эти реакции сопровождают передачу информации от клетки к клетке, транскрипцию ДНК,
синтез хроматина, дифференциацию клеток и многие другие жизненные процессы. Поступает с пищей, синтезируется в организме из триптофана.
Участвует в процессах тканевого дыхания, углеводном, белковом и липидном обмене, оказывает нормализующее влияние на уровень холестерина. Обладает
выраженным свойством расширять периферические сосуды
Схема 4. Химическая структура кофермента НАД+ В рамке показана восстановленная форма активного центра кофермента (НАДН·Н+).
Стрелкой показано расположение фосфатной группы в молекуле НАДФ.
Суточная потребность в витамине В5 (РР) – 15-25 мг. Повышается при физической нагрузке, лактации, низкой температуре, в высокогорье, а также при инфекционных заболеваниях, поражениях желудочно-кишечного тракта и нарушении всасывания. В организме возможен синтез никотиновой кислоты из аминокислоты триптофана. При этом из одной из 50 молекул триптофана образуется одна молекула никотиновой кислоты. Недостаток триптофана в
56
пище резко усугубляет симптомы гиповитаминоза никотиновой кислоты при его наличии.
Контрольные вопросы
1.В какие реакциях в организме принимает участие ниацин ?
2.Сколько составляет суточная потребность в витамине В5?
5.2.2. Характеристика коферментов на основе витамина В2
Относится к группе животных пигментов – флавонов. Рибофлавин хорошо растворим в воде, устойчив в кислых растворах, но легко разрушается в нейтральных и щелочных растворах. Весьма чувствителен к УФ-излучению и сравнительно легко подвергается обратимому восстановлению, присоединяя водород по месту двойных связей и превращается в бесцветную лейкоформу.
Это свойство рибофлавина легко окисляться и восстанавливаться лежит в основе его биологического действия в клеточном метаболизме. Участвует в окислительно-восстановительных реакциях, влияя на обмен веществ всего организма.
Витамин B2 интенсифицирует процессы обмена веществ в организме,
участвуя в метаболизме белков, жиров и углеводов. Рибофлавин необходим для образования красных кровяных телец и антител, для дыхания клеток и роста.
Он облегчает поглощение кислорода клетками кожи, ногтей и волос. Он улучшает состояние органа зрения, принимая, наряду с витамином A, участие в процессах темновой адаптации, снижает усталость глаз и играет большую роль в предотвращении катаракты. Витамин B2 оказывает положительное воздействие на слизистые оболочки пищеварительного тракта. Рибофлавин входит в состав флавиновых коферментов, в частности ФМН
(флавиномононуклеотид) и ФАД (флавиноадениндинуклеотид).

57
6,7-Диметил-9-(D-1-рибитил)-изоаллоксазин Схема 5. Химическое строение рибофлавина
Различают 2 типа реакций с участием этих коферментов:
1. Фермент осуществляет прямое окисление с участием кислорода, т.е.
дегидрирование (отщепление электронов и протонов) исходного субстрата или промежуточного метаболита. К ферментам этой группы относятся оксидазы L-
и D-аминокислот, ацил-КоА-дегидрогеназа, глициноксидаза и др.
ФМН
Схема 6. Химическое строение окисленной формы кофермента ФАД (ФМН). (цифрами 1
и 5 показаны места присоединения водорода в окислительно-восстановительных реакциях с образованием восстановленной формы кофермента ФАДН2)
58
В качестве примера можно привести следующую схему окисления с участием ФАД:
(суб. восс.ф.) (суб. окис.ф.)
R-CH2-CH2-COOH 2H 2e R-CH=CH-COOH
ФАД ФАДН2
Схема 7. Участие кофермента ФАД в окислении карбоновых кислот
2. Характеризуется переносом электронов и протонов в системе биологического окисления.
ФМН и ФАД прочно связываются с белковым компонентом молекулы фермента, иногда ковалентно, как в молекуле сукцинатдегидрогеназы. В
составе дыхательной цепи ФМН в качестве кофермента входит в состав НАД·Н-дегидрогеназы, которая акцептирует водород, отщепляемый от НАДН·Н+. Молекулярная масса НАД·Н-дегидрогеназы около 106. Этот флавиновый фермент тесно связан с железосерным белком, участвующим передаче электронов на коэнзим Q. НАД·Н-дегидрогеназа пересекает поперек внутреннюю мембрану митохондрий, находясь в окружении липидов.
Активный центр ее обращен к внутренней поверхности этой мембраны, т.е. к
матриксу.
Суточная потребность в витамине В2 – 2-3 мг. Возрастает при физической нагрузке, лактации, высокой калорийности пищи с большим содержанием белка, при употреблении больших количеств никотиновой кислоты.
Контрольные вопросы
1.Какие функции в организме выполняет рибофлавин ?
2.В состав каких коферментов входит рибофлавин ?
3.Какие реакции в организме протекают с участием этих коферментов?
4.Сколько составляет суточная потребность в витамине В2?

59
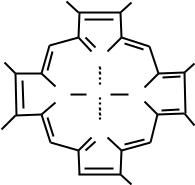
5.2.3.Строение и характеристика убихинона (кофермент Q)
Кофермент Q (КоQ) был впервые описан Мортоном, который показал, что данное соединение имеет повсеместное распространение в клетках и назвал его убихиноном. Позже было установлено, что убихинон, подобно НАД и ФАД,
может играть роль промежуточного переносчика водородных атомов, т.е.
электронов и протонов.
|
|
O |
|
|
|
OH |
|||||||||
CH3O |
|
|
|
|
|
CH3 |
CH3O |
|
|
|
|
CH3 |
|||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3O |
|
|
|
|
|
(CH2–CH=C–CH2)10H |
CH3O |
|
|
|
|
(CH2–CH=C–CH2)10H |
|||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
O |
|
|
|
OH |
|||||||||
Хиноидная форма |
|
Гидрохинонная форма |
|||||||||||||
Схема 8. Строение и участие убихинона (кофермента Q) в окислительно-
восстановительных реакциях
КоQ является производным бензохинона с длинной боковой цепью,
включающей у различных организмов от 6 до 10 изопреновых звеньев.
Человеческий убихинон содержит 10 изопреновых единиц (КоQ10). Наличие изопренового «хвоста» придает молекуле КоQ хорошую растворимость в липидах, поэтому относительно небольшая молекула убихинона легко перемещается от наружного к внутреннему краю внутренней мембраны митохондрий и наоборот.
Считают, что восстановленная форма флавиновых ферментов в цепи дыхательных катализаторов передает атомы водорода (протоны и электроны)
КоQ. Как всякий хинон, КоQ может существовать в окисленной и восстановленной форме, что и обеспечивает его функционирование в дыхательной цепи.
Убихинон синтезируется в тканях человека. Источником его образования служат мевалоновая кислота и продукты обмена фенилаланина и тирозина.
60
Признаки недостаточности КоQ у человека не описаны, но при некоторых состояниях повышается потребность в нем. На этом основании его стали относить к витаминоподобным веществам. Потребность в убихиноне для человека неизвестна.
Контрольные вопросы
1.Что является источником образования убихинона ?
2.Какое строение имеет убихинон (кофермент Q) ?
5.2.4.Строение и характеристика цитохромов и железосерных белков
Дальнейший перенос электронов от КоQ (или восстановленной формы флавинового фермента) на кислород осуществляет система цитохромов. В
процессе тканевого дыхания наиболее важную роль играют цитохромы b, c1, c, aa3. Все они имеют простетическую группу геминовую группу, близкую к гемму гемоглобина (простетическая группа цитохрома b, как считают,
идентична гему).
|
H3C |
|
CH=CH2 |
|
H3C |
N |
CH3 |
|
N |
Fe |
N |
–OOCCH CH |
N |
CH=CH2 |
|
2 |
2 |
|
|
–OOCCH2CH2 CH3
CH3
Схема 9. Строение гема, входящего в состав цитохромов b и с (цитохромы группы а содержат гем A, отличающийся от остальных набором заместителей в порфириновой
системе)
Цитохром b имеет различные формы. По мнению ряда авторов в дыхательной цепи функционируют цитохромы b562 и b566, называемые так по максимуму поглощения света. Они образуют комплекс, пересекающий
