
- •2.4.1. Ангиографическая семиотика
- •2.4.1.1. Заболевания артериальной системы
- •2.4.1.2. Ангиографическая семиотика острой артериальной непроходимости
- •2.4.1.3. Ангиографическая семиотика врожденных артериовенозных свищей
- •2.5. Исследование микроциркуляции
- •2.5.1. Транскутанное напряжение кислорода (ТсрО2)
- •2.5.2. Капилляроскопия
- •2.6.7. Коарктация аорты
- •2.7.1. Магнитно-резонансная ангиография
2.3. Внутрисосудистая ультразвуковая диагностика
Внутрисосудистое ультразвуковое исследование (ВСУЗИ) — инвазив- ный метод ультразвуковой диагнос- тики, позволяющий получать изоб- ражение просвета сосуда и тонких морфологических элементов, обра- зующих его стенку, в норме и при патологии.
Самые ранние публикации о при- менении внутрисосудистой эхогра- фии относятся к началу 60-х годов и связаны с именами T.Cieszynski (1960), R.Omoto и соавт. (1963). Они первыми разработали и использова- ли внутрисосудистое эхографиче- ское исследование интраоперацион- но, а в дальнейшем усовершенство- вали внутрисосудистое ультразвуко- вое оборудование. Благодаря науч- но-техническому прогрессу и совер- шенствованию способов обработки ультразвуковых сигналов в конце 80-х годов была создана современ- ная внутрисосудистая ультразвуко- вая аппаратура, которая была вне- дрена экспериментально и клиниче- ски.
Визуализация сосудистых струк- тур из внутреннего просвета сосуда стала возможной при введении в сосуд миниатюрного ультразвуко- вого датчика, расположенного на кончике катетера.
Действие современных эходатчи- ков, вмонтированых в конец ан- гиографического катетера, базиру- ется на принципах электронного или механического вращения ульт- развукового луча. Это достигается четырьмя способами:
вращением элемента на гибком стержне;
вращением зеркала на гибком стержне напротив стационарного датчика;
электронным вращением луча с помощью фазированной решетки;
электронным вращением луча с помощью микромотора в сочетании
с кольцевым датчиком и вращаю- щимся зеркалом [Померанцев Е.В. и др., 1992; Атьков О.Ю. и др., 1996]. Наиболее распространенные катетеры для ВСУЗИ имеют внеш- ний диаметр от 2,9 до 10 F и часто- ту датчика — 20—30 МГц.
Исследование выполняют во время стандартной катетеризации полостей сердца и сосудов. Датчик посылает ультразвуковой сигнал определенной частоты через про- свет сосуда, который, достигая его стенки, отражается от нее и вос- принимается на обратном пути хода луча тем же датчиком. Полученную с «отраженным» лучом информа- цию анализируют диагностической системой, соединенной с ультразву- ковым катетером, и выводят на эк- ран монитора в виде двухмерного изображения поперечного среза со- суда в реальном масштабе времени. По мере продвижения катетера по сосуду получают серию его попе- речных срезов, дающую ценную информацию об анатомическом строении, характере патологиче- ских изменений и состоянии струк- тур сосуда [Pandian N.G. et al., 1988; Yock P.G. et al., 1988].
Первоначальной и основной об- ластью применения ВСУЗИ яви- лась предоперационная диагности- ка поражения различных сосуди- стых бассейнов и оценка результа- тов интервенционных радиологиче- ских процедур. Быстрое внедрение ВСУЗИ в клиническую практику было связано с объективно сущест- вующими ограничениями ангиогра- фического метода в плане качест- венной и количественной оценки степени изменения сосуда при ате- росклеротическом поражении, осо- бенно при эксцентричном располо- жении бляшек. Кроме того, воз- можности ангиографии, в частно- сти при кальцинозе, осложненных
173
атеромах с надрывом внутреней оболочки сосуда или пристеночным тромбозом, а также кровоизлияни- ем в атерому, позволяют лишь при- близительно судить о субстрате па- тологического процесса. Нагляднее всего преимущества ВСУЗИ прояв- ляются при исследовании морфоло- гии сосуда после транслюминаль- ной баллонной ангиопластики (ТЛБАП). Процедура ТЛБАП со- провождается выраженным механи- ческим воздействием на слои сосу- дистой стенки, нередко приводя к их повреждению вплоть до образо- вания диссекции. ВСУЗИ позволя- ет судить о ее выраженности по ве- личине сектора окружности сосуда на поперечном срезе, вовлеченного в диссекцию. Это открывает перс- пективы точного прогнозирования проходимости сосуда после ТЛБАП и принятия решения о целесооб- разности повторной ТЛБАП или стентирования «неблагополучного» сегмента. Следует отметить, что по- пытки точно количественно оце- нить просвет сосуда при диссекции на основании ангиограмм встреча- ют значительные трудности из-за нечеткости контуров сосуда. В та- ком случае, как было сказано выше, важная информация может быть получена с помощью ВСУЗИ. В конце 80-х годов в литературе начинают регулярно появляться со- общения об использовании внутри- сосудистого ультразвука в экспери- менте и у пациентов с заболевания- ми периферических и коронарных сосудов [Pandian N., 1988; Yock P.G., 1988; Gussenhoven W.J., 1989, и др.]. Формируется научный под- ход к изучению сосудистой патоло- гии с помощью ВСУЗИ. До этого момента ВСУЗИ не имело широко- го распространения и применя- лось единичными исследователями. В конце 80-х — начале 90-х годов большинство исследователей свой первый опыт внутрисосудистых эхографических исследований на- чинало in vitro и в эксперименте на
животных, и лишь затем выполня- лись исследования у людей.
При изучении ультразвуковой картины строения различных типов артериальных сосудов и вен в нор- ме было обнаружено, что стенки артериального сосуда мышечного типа (бедренные артерии, коронар- ные артерии и др.) имеют трехслой- ную ультразвуковую анатомию. Причем на внутрисосудистой ска- нограмме внутренняя оболочка (интима) с внутренней базальной мембраной представлены внутрен- ним гиперэхогенным кольцом, на- ружная оболочка сосуда (адвенти- ция) с наружной базальной мембра- ной представлены наружным, также гиперэхогенным кольцом. Между яркими гиперэхогенными кольцами находится эхонегативная зона, со- ответствующая средней мышечной оболочке сосуда (медии). Ультра- звуковое отображение стенки арте- риального сосуда эластического типа имело характерное отличие в виде однослойного гиперэхогенно- го кольца, так как отсутствие мы- шечной оболочки не позволяло дифференцировать на сканограмме внутреннюю и наружную оболочки раздельно и они воспринимались как единый эхосигнал [Gussenho- ven E.J., 1989; Siegel R.J., 1993, и др.]. Для верификации сосудистых структур, получаемых на ультразву- ковых сканограммах, производи- лось сопоставление ультразвуковой картины с гистологическими среза- ми тех же самых сосудистых сег- ментов и была получена хорошая корреляция при их морфометрии.
Применение ВСУЗИ для диагно- стики патологических изменений сердечно-сосудистой системы про- демонстрировало большие преиму- щества нового метода и его высо- кую информативность при опреде- лении степени стенозирования, морфологического субстрата пора- жения сосудов, распространенно- сти патологического процесса по глубине и периметру сосудистой
174
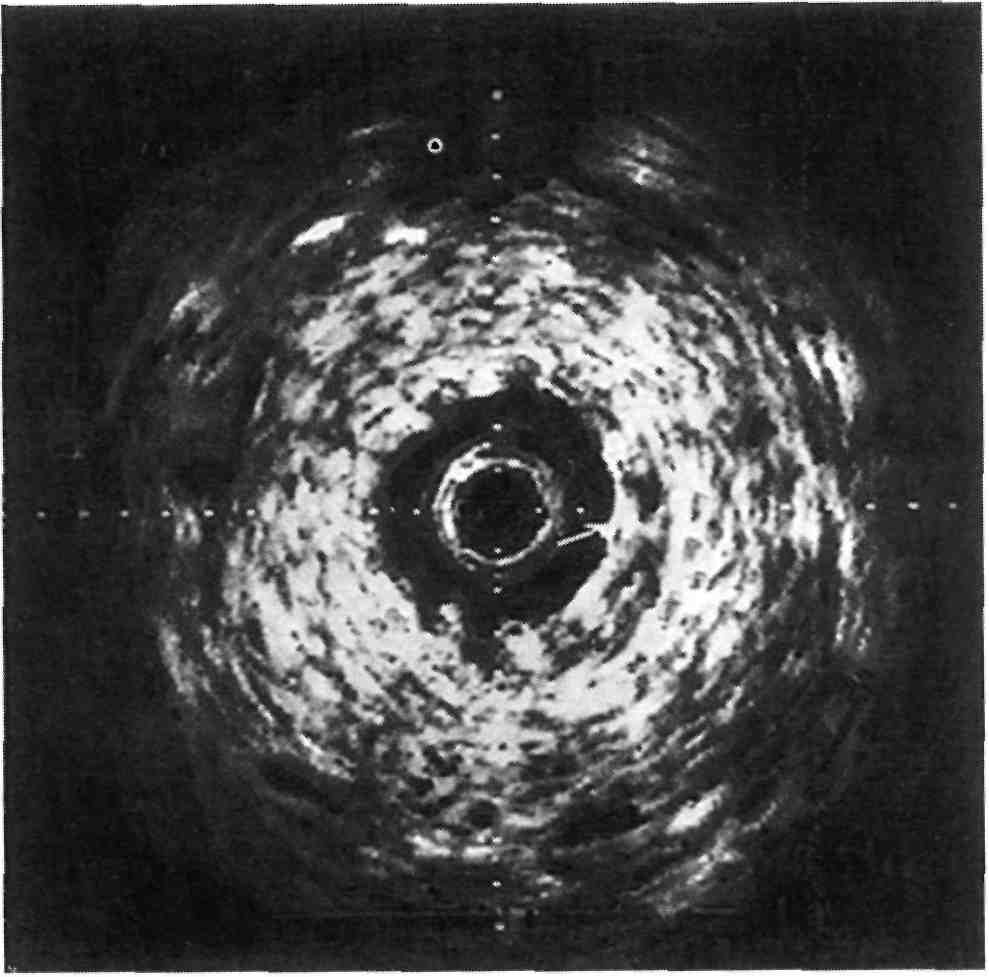
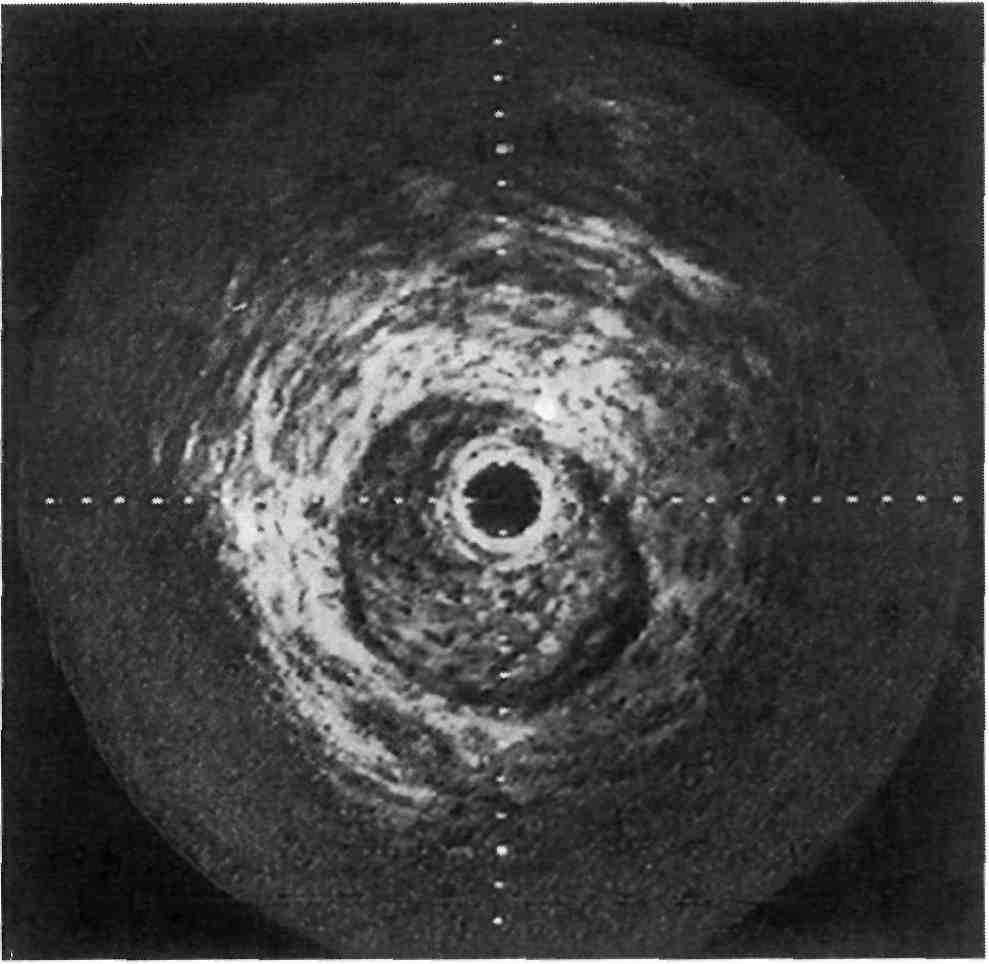
Рис. 2.21. Состояние после стентирова- ния коронарной артерии. Проходи- мость сосуда полностью восстановлена.
стенки. Метод позволил получать наиболее полную информацию о структуре сосудистых бляшек, их форме, консистенции, локализа- ции, протяженности. На рис. 2.20 представлена атеросклеротическая бляшка в коронарной артерии, поч- ти полностью закрывающая ее про- свет.
Кроме того, метод дает возмож- ность четко различать атеросклеро- тические поражения от гиперпла- стических процессов в стенке сосу- дов, диагностировать их аневризма- тические изменения, а также обна- руживать тромботические наложе- ния в просвете сосудов [Waller B.F., 1992].
Последнее время в связи с ин- тенсивным применением в рентге- ноэндоваскулярной хирургии раз- личных типов сосудистых стентов в литературе большое место уделяет- ся значению ВСУЗИ как метода, позволяющего определять показа- ния к стентированию и контроли- ровать правильность установки стента в просвете сосуда. При этом главной целью является достиже- ние оптимальной геометрической формы просвета, приближающейся
к естественной форме неизменен- ного сосуда, что обеспечивает адек- ватный кровоток [Colombo A. et al., 1995; Ino Т. et al., 1995]. На рис. 2.21 показан имплантированный стент в просвете коронарной арте- рии — проходимость сосуда полно- стью восстановлена.
Таким образом, приоритетная область применения ВСУЗИ — оценка результатов эндоваскуляр- ных вмешательств, так как новый внутрисосудистый метод позволяет однозначно судить о последствиях воздействия баллонной ангиопла- стики, различных атерэктомиче- ских методик на сосудистую стен- ку, четко определять степень выра- женности диссекции, контролиро- вать правильность установки сосу- дистых стентов [Yock P.G., 1991; Slepian M.J., 1991; Mintz G.S., 1992; Colombo A., 1995; Ino Т., 1995; Aad van der Lugt, 1995]. Подавляющее большинство внутрисосудистых эхографических исследований при- ходится на долю интракоронарных эндоваскулярных процедур. Это объясняется распространенностью коронарного атеросклероза, акту- альностью данной проблемы и как
175
следствие наибольшей потребно- стью в такого рода вмешательствах в клинической практике. Тем не менее имеются сообщения о при- менении ВСУЗИ и при более ред- кой патологии, например при бо- лезни Кавасаки — множественных аневризмах коронарных сосудов [Sugimura Т., 1994], васкулопатии коронарных артерий транспланти- рованного сердца [St.Goar F.G., 1992; Porter T.R., 1994; Klauss V., 1995].
В литературе встречаются немно- гочисленные сообщения о внутри- сосудистой эхографии при врож- денных пороках сердца и сосудов (синдроме Вильямса, коарктации аорты), периферических стенозах легочной артерии, тромбоэмболии легочной артерии, первичной ле- гочной гипертензии [Ino T. et al., 1995; Gorge G. et al., 1997] с небо- льшим числом наблюдений.
Совсем недавно возникла идея прижизненного изучения морфоло- гии легочно-артериальных сосудов с помощью ВСУЗИ при легочной гипертензии (ЛГ). В нашей стране эта идея была предложена А.В.Ива- ницким в 1995 г., практически од- новременно с другими зарубежны- ми авторами нашла свое подтверж- дение в серии проведенных иссле- дований. Данное направление явля- ется оригинальным и весьма перс- пективным как в научном, так и в практическом плане.
Первые внутрисосудистые иссле- дования в нашей стране проведены Е.В.Померанцевым и соавт. в 1992 г. Авторами была показана внутрисо- судистая эхографическая картина брюшной аорты и крупных под- вздошных сосудов в норме и при па- тологии. Начиная с 1995 г. выходят первые работы об использовании ВСУЗИ при эндоваскулярных вме- шательствах на бедренных артериях [Иваницкий А.В. и др., 1995] и при коронарном стентировании [Бабу- нашвили A.M. и др., 1995]. Кроме общепринятых, рутинных внутрисо-
судистых исследований, при интер- венционных радиологических про- цедурах в НЦССХ им. А.Н.Бакулева РАМН ведется большая научная ра- бота по изучению возможностей ВСУЗИ в диагностике легочной ги- пертензии.
Основной предпосылкой к при- менению ВСУЗИ для выявления морфологических изменений мел- ких легочно-артериальных сосудов при ЛГ была недостаточная инфор- мативность традиционных методов диагностики.
Методика ВСУЗИ во многом ли- шена недостатков, свойственных открытой легочной биопсии, одно- временно не уступая ей по инфор- мативности. Ограничением ВСУЗИ на сегодняшний день является не- возможность изучения сосудов с диаметром просвета меньше 1500 мкм из-за отсутствия датчиков-ка- тетеров размером менее 2,9 F. Тех- нические ограничения не позволя- ют выявлять плексиформные струк- туры, окклюзии мелких легочных сосудов, дилатационные пораже- ния, легочный гемосидероз, фибри- ноидный некроз, т. е. изменения, характерные для тяжелой степени ЛГ V—VI по классификации He- ath-Edwards (Н-Е). Есть надежда, что в будущем указанные техниче- ские трудности будут преодолены и информативность ВСУЗИ повысит- ся.
Доказано, что при легочной ги- пертензии происходит утолщение средней мышечной оболочки на всех уровнях артериально-сосуди- стого русла, начиная с более круп- ных эласто-мышечных сосудов уровня субсегментарных бронхов до самых дистальных внутридольковых ветвей уровня терминальной и рес- пираторной бронхиол — правило Хейворта [Haworth et al., 1977, 1978].
Применение высокочастотных датчиков с частотой 30 МГц позво- лило исследователям в норме диф- ференцировать слои сосудистой
176
стенки. A.S.Borges и соавт. (1997) считали, что в норме на ВСУЗИ ви- зуализируется тонкая интима, кото- рая значительно утолщается при ЛГ. D.D.Ivy и соавт. (1998) расце- нивали тонкий внутрений эхосиг- нал небольшой интенсивности как средний слой (медию) и предпола- гали, что интиму в норме обнару- жить при ВСУЗИ невозможно. По данным А.В.Иваницкого и соавт. (1998), в подавляющем большинст- ве случаев в норме на ВСУЗИ вы- является трехслойное строение нормальной легочной артерии уровня субсегментарных бронхов с дифференцировкой ее стенки на интиму, медию и адвентицию.
Сопоставление между внутрисо- судистыми эхографическими пока- зателями и гемодинамическими па- раметрами позволило выявить удовлетворительную корреляцион- ную зависимость между индексом толщины средней оболочки, изме- ренной по ВСУЗИ, и общим легоч- ным сопротивлением [Day R.W., 1997], толщиной интимы и давле- нием в легочной артерии [Ivy D.D., 1998].
В последнее время многие иссле- дователи изучали в остром клини- ческом эксперименте влияние фар- макологических препаратов на нор- мальную и измененную стенку ЛА при ЛГ под контролем ВСУЗИ. Ими не было отмечено достаточной корреляции между данными ВСУ- ЗИ-морфометрии и параметрами гемодинамики до и после примене- ния ацетилхолина, кислорода или закиси азота [Ivy D.D., 1998; Воr- ges A.S., 1997].
Таким образом, опыт примене- ния ВСУЗИ при патологии сосудов свидетельствует о значительной роли метода в оценке состояния морфологии различных сосудистых бассейнов. Особое приоритетное значение отводится внутрисосуди- стому исследованию при интервен- ционных процедурах. С помощью ВСУЗИ удается точнее, чем при ан-
гиографии, оценивать степень и распространенность диссекции, су- дить о качестве проведенной ТЛБАП по математически точным измерениям площади просвета, контролировать положение стента и его геометрическую форму. ВСУЗИ позволяет получать важную информацию при определении по- казаний к повторным эндоваску- лярным вмешательствам. На ВСУЗИ диагностируются минима- льные изменения просвета сосуда, которые четко не определяются на АГ. Это, однако, ни в коей мере не означает, что ангиография и ВСУЗИ являются конкурирующими методами, наоборот, они взаимно дополняют и расширяют заложен- ные в них возможности.
Литература
Атьков О.Ю., Эрбель Р., Караджева И. и др. Применение метода внутрисосудисто- го ультразвукового исследования у боль- ных с ишемической болезнью сердца// Визуализация в клинике. — 1996. — Де- кабрь. — С. 41—46.
Бабунашвили A.M., Иванов В.А. Улучше- ние геометрии просвета коронарной арте- рии путем чрескожной эндоваскулярной имплантации спиралевидного стента по- сле баллонной коронарной ангиопласти- ки//Грудн. и сердеч.-сосуд, хирургия. — 1995. - № 5. - С. 68-70.
Иваницкий А.В., Чигогидзе Н.А., Собо- лев А.В. и др. Первый опыт применения внутрисосудистого ультразвукового ска- нирования у пациента после операции вибромеханической реканализации и транслюминальной баллонной ангиопла- стики поверхностной бедренной арте- рии//Грудн. и сердеч.-сосуд, хирургия. — 1995. - № 5. - С. 70-72.
Иваницкий А.В., Соболев А.В., Лепихо- ва И.И. и др. Внутрисосудистое ультра- звуковое исследование легочных арте- рий // Грудн. и сердеч.-сосуд, хир. — 1998. - № 4. - С. 35-42.
Померанцев Е.В., Воронин В. А., Давы- дов С.А., Нечаев Д.Д. Первый опыт кли- нического применения внутрисосудисто- го ультразвукового сканирования в общей ангиографии//Тер. арх. — 1992. — Т. 64, № 12. - С. 10-17.
177
Aad van der Lugt, Gussenhoven E.J., Stij- nen T. et al. Comparison of intravascular ult- rasonic findings after coronary balloon angi- oplasty evaluated in vitro with histology// Am. J. Cardiol.- 1995.- Vol.76.- P. 661 — 666.
Borges A.S., Wensel R., Opitz C. et at. Relati- onship between haemodynamics and morp- hology in pulmonary hypertension. A quanti- tative intravascular ultrasound study//Eur. Heart J. - 1997. - Vol. 18, N 12. - P. 1988-1994.
Cieszynsky T. Intracardiac method for the in- vestigation of structure of the heart with the aid ultrasonics//Arch. Immunol. Ter. Dosw. - 1960. - Vol. 8. - P. 551-557.
Colombo A., Hall P., Nakamura S. et al. Int- racoronary stenting without anticoagulation accomplished with intravascular ultrasound guidance//Circulation.— 1995.— Vol. 91.— P. 1676-1688.
Day R.W., Tant L.Y. Pulmonary intravascu- lar ultrasound in infants and children with congenital heart disease//Cathet. Cardiovasc. Diagn. - 1997. - Vol. 41, N 4. - P. 395— 398.
Gassenhoven E.J., Essed C.E., Lancee C.T. et al. Arterial wall characteristics determined by intravascular ultrasound imaging: An in vitro study//J. Am. Coll. Cardiol. - 1989. - Vol. 14, N 4. - P. 947-952.
Gorge G, Schuster S., Ge J., Meyer J., Er- bel R. Intravascular ultrasound in patients with acute pulmonary embolism after treat- ment with intravenous urokinase and high-dose heparin//Heart. — 1997. — Vol. 77, N 1. - P. 73-77.
Haworth S.G., Reid L. A morphometric study of regional variation in lung structure in in- fants with pulmonary hypertension and con- genital cardiac defect: a justification of lung biopsy//Brit. Heart J. - 1978. - Vol. 40. - P. 825-831.
Haworth S.G, Sauer U., Buhlmeyer K, Reid L. Development of the pulmonary cir- culation in ventricular septal defect: a quan- titative structural study//Am. J. Cardiol. — 1977. - Vol. 40. - P. 781-788.
Heath D., Edwards J.E. The pathology of hy- pertensive pulmonary vascular disease. A description of six grades of structural changes in the pulmonary arteries with speci- al reference to congenital cardiac septal de- fects//Circulation. — 1958. — Vol. 18. - P. 533-537.
Ino Т., Okubo M., Akimoto K. et al. Mecha- nism of balloon angioplasty in children with
arterial stenosis assessed by intravascular ult- rasound and angiography//Am. Heart J. — 1995. - Vol. 129, N 1. - P. 132-138.
Ishii M., Kato H., Kawano T. et al. Evaluati- on of pulmonary artery histopathologic fin- dings in congenital heart disease: an in vitro study using intravascular ultrasound ima- ging//.!. Am. Coll. Cardiol. - 1995. - Vol. 26. - P. 272-276.
Ivy D.D., Neish S.R., Knudson O.A. et al. Int- ravascular ultrasonic characteristics and va- soreactivity of the pulmonary vasculature in children with pulmonary hypertension//Am. J. Cardiol. - 1998. - Vol. 81, N 6. - P. 740-748.
Kawano T. Wall Morphology of the pulmo- nary artery — intravascular ultrasound ima- ging and pathological evaluations//Kurume Med. J. - 1994. - Vol. 41. - P. 221-232.
Klauss V., Mudra H., Uberfuhr P., Theisen К Intraindividual variability of cardiac allograft vasculopathy as assessed by intravascular ult- rasound//Am. J. Cardiol. - 1995. - Vol. 76. - P. 463-466.
Kravitz K.D., Scharf G.R., Chandrasekaran K. In vivo diagnosis of pulmonary atherosclero- sis (Role of intravascular ultrasound)// Chest.- 1994. - Vol. 106. - P. 632-634.
Mintz G.S., Potkin B.N., Keren G. et al. Int- ravascular ultrasound evaluation of the effect of rotational atherectomy in obstructive athe- rosclerotic coronary artery disease//Circula- tion. - 1992. - Vol. 86, N 5. - P. 1383- 1393.
Omoto R. Ultrasonic intravenous sonde. — 2-nd report//Med. Ultrasound. — 1963. — Vol. 1. - P. 11.
Pandian N.G., Kreis A., Brockway В., Is- ner J.M. et al. Ultrasound angioscopy: Re- al-time, two-dimensional, intraluminal ultra- sound imaging of blood vessels//Am. J. Car- diol. - 1988. - Vol. 62. - P. 493-494.
Pandian N.G Intravascular ultrasound: great potential, great promise//Cardiology Trends. - 1990, March.
Porter T.R., Taylor D.O., Fields J. et al. Di- rect in vivo evaluation of pulmonary arterial pathology in chronic congestive heart failure with catheterbased intravascular ultrasound imaging//Am. J. Cardiol. — 1993. — Vol. 71. - P. 754-757.
Porter T.R., Mohanty P.K., Pandian N.G. In- travascular ultrasound imaging of pulmonary arteries. Methodology, clinical applications, and future potential//Chest. — 1994. — Vol. 106. - P.1551 —1557.
178
Rico и F., Nicocl P.H., Moser K.M., Peter- son K.L. Catheter-based intravascular ultra- sound imaging of chronic thromboembolic pulmonary disease//Am. J. Cardiol. — 1991. - Vol. 67. - P. 749-752.
Rien A.J., Premininger T.J., Perry S.B. et al. Generalized arteriopathy in Williams syndro- me: an intravascular ultrasound study//J.Am. Coll. Cardiol.- 1993.- Vol. 21.- P. 1727— 1730.
Siegel R.J., Chae J.S., Maurer G. et al. Histo- pathologic correlation of the three-layered intravascular ultrasound appearance of nor- mal adult human muscular arteries//Am. Heart. J.- 1993.- Vol. 126, N 4.- P. 872— 878.
Slepian M.J. Application of intraluminal ult- rasound imaging to vascular stenting//Intern. J. Card. Imag. - 1991. - Vol. 6. - P. 285— 311.
St.Goar F.G., Pinto F.J., Alderman E.L. et al. Detection of coronary atherosclerosis in young adult hearts using intravascular//Cir-
culation.- 1992.- Vol. 86, N 3.- P. 756—
763.
Sugimura Т., Kato H., Inoue О. et al. Intra- vascular ultrasound of coronary arteries in children (Assessment of the wall morphology and the lumen after Kawasaki disease)//Cir- culation,- 1994.- Vol. 89, N 1.- P. 258— 265.
Waller B.F., Pinkerton C.A., Slack J.D. Intra- vascular ultrasound: a histological study of vessels during life (The new «Gold standard» for vascular imaging) // Circulation. — 1992. - Vol. 85, N 6. - P. 2305-2310.
Yock P.G., Linker D.T., Saether O. et al. Int- ravascular two-dimensional catheter ultraso- und: Inital clinical studies (abstract)//Circu- lation. - 1988. - Vol. 78 (suppl. II). - P. II- 21.
Yock P.G., Fitzgerald P.J., Linker D.T., An- gelsen B.A.J. Intravascular ultrasound gui- dance for catheter-based coronary interventi- ons//! Am. Coll. Cardiol. - 1991. - Vol. 17, N 6. - P. 39B-45B.
2.4. Ангиографическая диагностика
Ангиографические исследования в значительной степени обеспечили бурное развитие сосудистой хирур- гии. Однако на сегодняшний день уже нельзя однозначно сказать, что и в настоящее время ангиография является «золотым стандартом» диагностики заболеваний аорты и периферических сосудов. Новей- шие неинвазивные методы визуали- зации: ультразвуковое дуплексное сканирование, компьютерная то- мография, магнитно-резонансная ангиография — не только снижают риск диагностических исследова- ний, но и обладают в ряде случаев большей разрешающей способно- стью. Общемировая тенденция раз- вития лучевой диагностики состоит во все более широком применении неинвазивных методик для выбора тактики и метода хирургического лечения. На современном этапе развития медицинских технологий ангиография все более становится лечебной процедурой и применяет-
ся в ходе рентгенохирургических, эндоваскулярных вмешательств.
Тем не менее относительная до- роговизна такого диагностического оборудования, как рентгеновские, компьютерные, электронно-эмис- сионные или магнитно-резонанс- ные томографы, ограничивает ши- рокое применение этих методов. В то же время ангиография благо- даря развитию компьютерных тех- нологий обработки и сохранения изображений, синтезу новых мало- токсичных рентгеноконтрастных препаратов продолжает оставаться одним из основных диагностиче- ских методов, который при относи- тельно небольших затратах позво- ляет получать интегральное изобра- жение любого участка сосудистого русла, служить методом верифика- ции данных, полученных другими способами лучевой визуализации. Внедрение дигитальной субтракци- онной ангиографии (ДСА) способ- ствовало повышению информатив-
179
ности ангиографических данных. Это сделало сложные инвазивные процедуры более быстрыми и менее опасными, с их помощью количест- во контрастных средств, вводимых в сосудистое русло для проведения диагностических и интервенцион- ных процедур, было существенно сокращено.
Показания и противопоказания к проведению диагностической анги- ографии. Подготовка больного. Эта- пы ангиографического исследова- ния:
определение показаний и про- тивопоказаний;
подготовка больного к исследо- ванию;
пункция или обнажение сосуда;
катетеризация сосуда;
введение контрастного вещест- ва;
рентгеновская съемка ангиогра- фического изображения;
удаление катетера, остановка кровотечения;
анализ результатов.
Общими показаниями к диагнос- тической ангиографии являются необходимость определения харак- тера, локализации патологического процесса и оценки состояния арте- риального или венозного русла в очаге поражения, изучения компен- саторных возможностей коллатера- льного кровотока, определение хи- рургической тактики лечения в каждом конкретном случае и содей- ствие выбору рационального метода операции. Частными показаниями для проведения ангиографического исследования служат врожденные аномалии сосудов и органов, трав- матические повреждения, окклюзи- онные и стенозирующие процессы, аневризмы, воспалительные, спе- цифические, опухолевые заболева- ния сосудов.
Абсолютных противопоказаний к ангиографическому исследованию нет. Относительными противопока- заниями являются острая недоста- точность печени и почек, активный
180
туберкулез в открытой форме и другие специфические заболевания в острой стадии течения, острые инфекционные заболевания, инди- видуальная непереносимость йоди- стых препаратов.
Подготовка больного к исследова- нию. Ангиографическое исследова- ние является хирургической мани- пуляцией, связанной с инвазией игл, проводников, катетеров и дру- гих инструментов в сосудистое рус- ло, сопровождается введением рентгеноконтрастного йодсодержа- щего вещества. В связи с этим его следует проводить после тщатель- ного общеклинического и инстру- ментального обследования, включа- ющего ультразвуковое и при необ- ходимости компьютерно-томогра- фическое, магнитно-резонансное.
Подготовка больного прежде все- го включает разъяснение пациенту необходимости проведения рентге- ноангиографического исследова- ния. Далее следует подробно выяс- нить анамнез больного для опреде- ления указаний на возможные в прошлом проявления аллергии к новокаину и йодсодержащим пре- паратам. При подозрении на инди- видуальную непереносимость и определении чувствительности бо- льного к йоду надо провести пробу по Демьяненко. При положитель- ной пробе от исследования нужно отказаться, провести десенсибили- зирующую терапию и вновь повто- рить пробу.
Накануне исследования проводят очистительную клизму, на ночь на- значают транквилизаторы. В день исследования больной не ест, ему тщательно выбривают волосы в об- ласти пункции сосуда. Непосредст- венно перед исследованием (за 30 мин) начинают премедикацию. Ис- следование обычно выполняют под местной анестезией. При повышен- ной чувствительности к йодистым препаратам для ангиографического исследования может быть исполь- зован интубационный наркоз.
Рис. 2.22. Обзорная аорто- грамма.
После окончания исследования катетер удаляют из сосуда и выпол- няют тщательный гемостаз прижа- тием пункционного отверстия. На- правление прижатия должно соот- ветствовать направлению предшест- вующей пункции сосуда. Затем на- кладывают асептическую давящую повязку с резиновой надувной ман- жетой на 2 ч (инструменты малого размера) или тугой марлевый валик (инструменты большого размера).
При транслюмбальной аортогра- фии и удалении катетера из аорты шприцем удаляют кровь из параа- ортальной клетчатки и накладыва- ют асептическую повязку или на- клейку. Больному необходимы строгий постельный режим в поло- жении на спине в течение 24 ч, контроль АД и наблюдение дежур- ного врача.
Методы ангиографии. Доступы к сосудистому руслу. По месту введе- ния контрастного вещества и по- следующей регистрации ангио- грамм выделяют:
прямые — вводится непосредст- венно в исследуемый сосуд;
непрямые — вводится в артери- альную систему для получения ве-
нозной или паренхиматозной фазы контрастирования органа. С разви- тием дигитальной субтракционной ангиографии нередко стали приме- нять непрямую артериографию с введением контрастного вещества в венозное русло.
По способу введения контраст- ного вещества различают следую- щие методы:
▲ пункционные — введение не- посредственно через пункционную иглу;
▲ катетеризационные — введение через катетер: общие;
полуселективные; селективные.
Обзорная аортография — контра- стное вещество вводят через кате- тер в брюшную или грудную аорту. Нередко такой способ контрастиро- вания называют «обзорной аорто- графией», так как за ним следует более детальное — селективное ан- гиографическое исследование како- го-либо отдельного артериального бассейна (рис. 2.22).
Полуселективная ангиография — контрастное вещество вводят в ма- гистральный сосуд с целью получе-
181
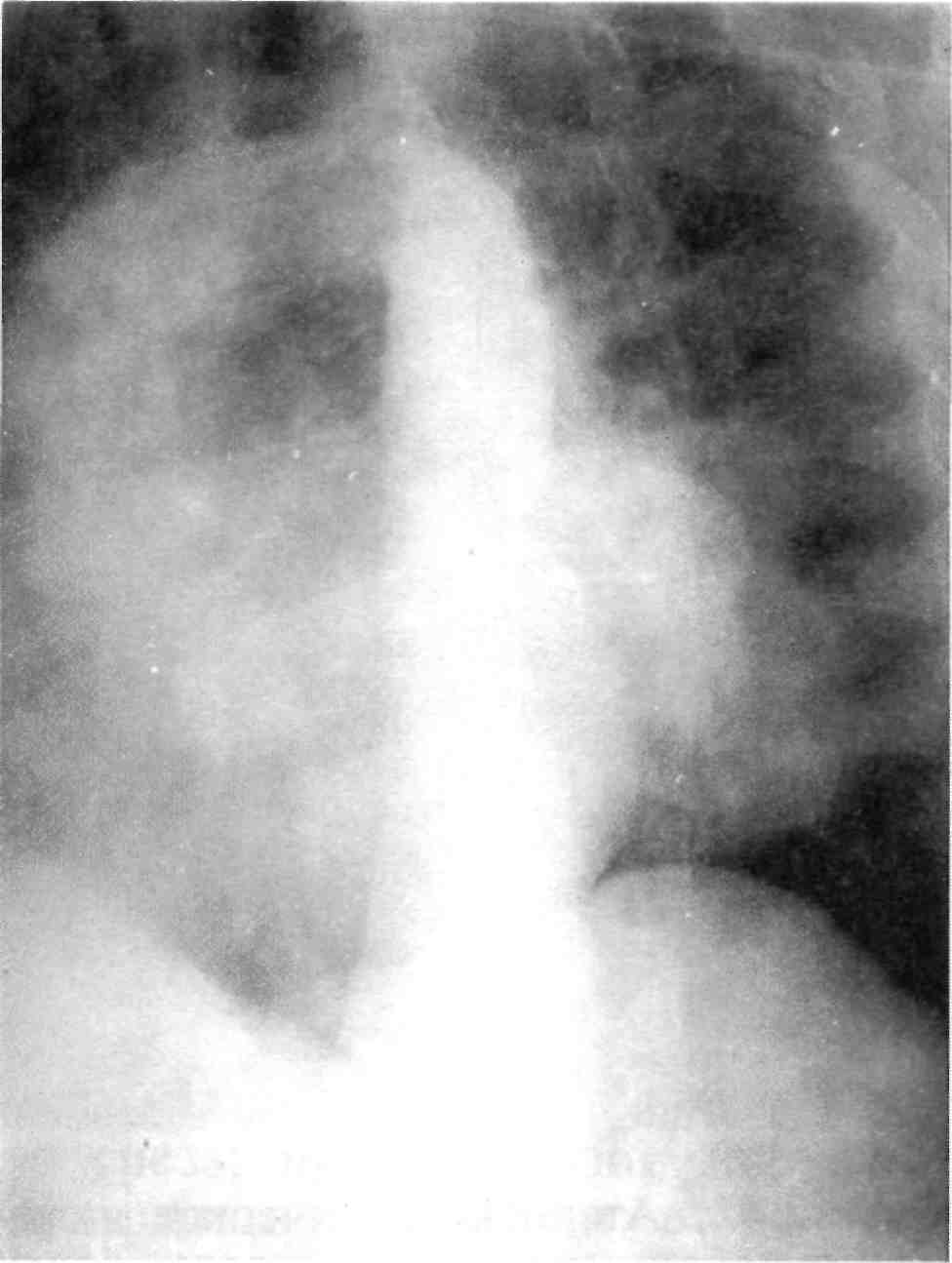
Рис. 2.23. Полуселективная ангиограм- ма.
ния контрастного изображения как данной артерии, так и близлежащих ее ветвей (рис. 2.23).
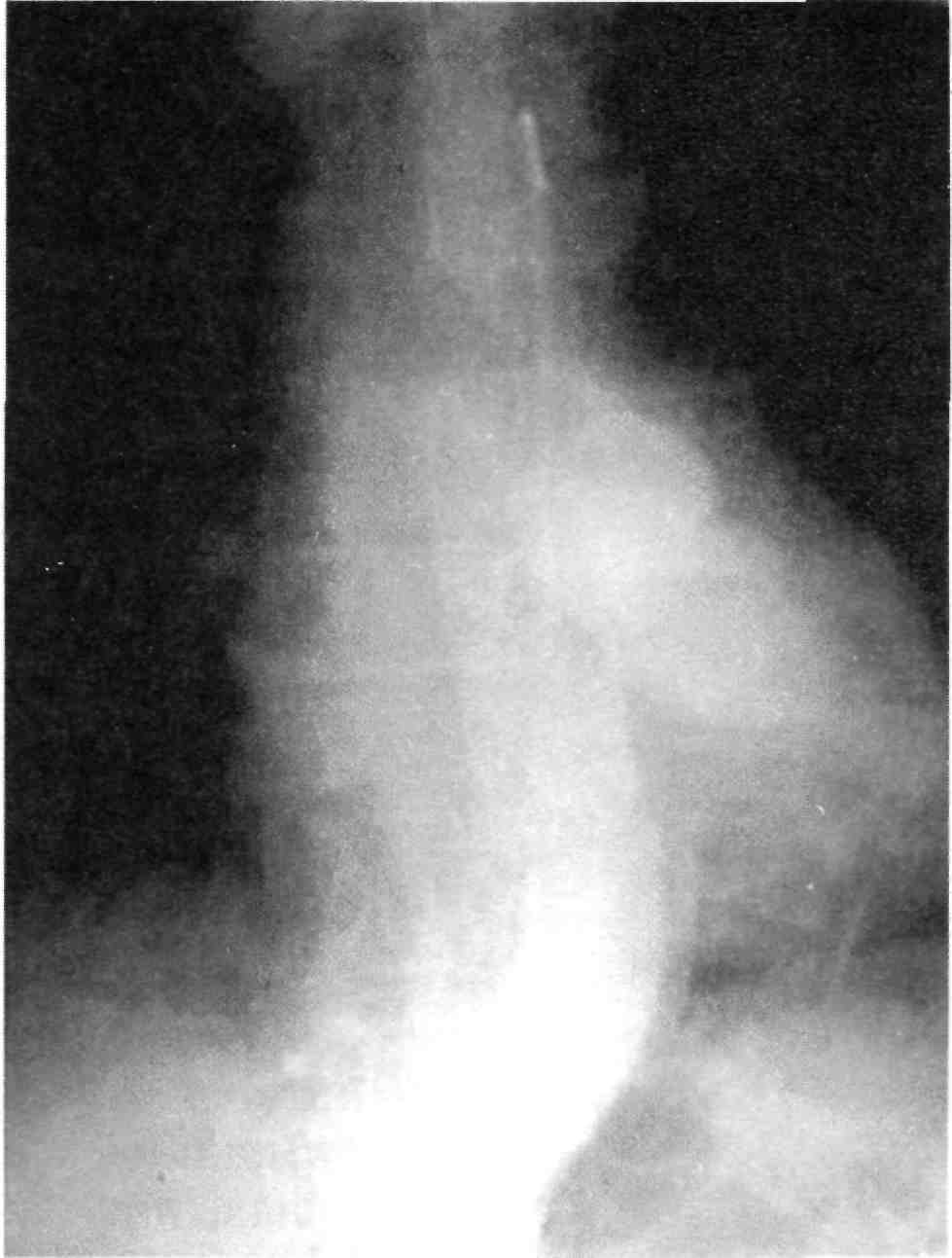
Селективная ангиография отвеча- ет основному принципиальному подходу к ангиографии — целена- правленному подведению контраст-
ного вещества максимально близко к месту патологии (рис. 2.24).
Виды катетеризации сосудов. Ан- теградная катетеризация — метод селективного подхода к сосудам: чрескожная катетеризация бедрен- ной, подколенной или общей сон- ной артерии и проведение модели- рованного катетера в сосуды на стороне поражения.
Ретроградная катетеризация — проведение катетера против тока крови при ангиографии пункцией бедренной, подколенной, подкры- льцовой, локтевой или лучевой ар- терий по Сельдингеру.
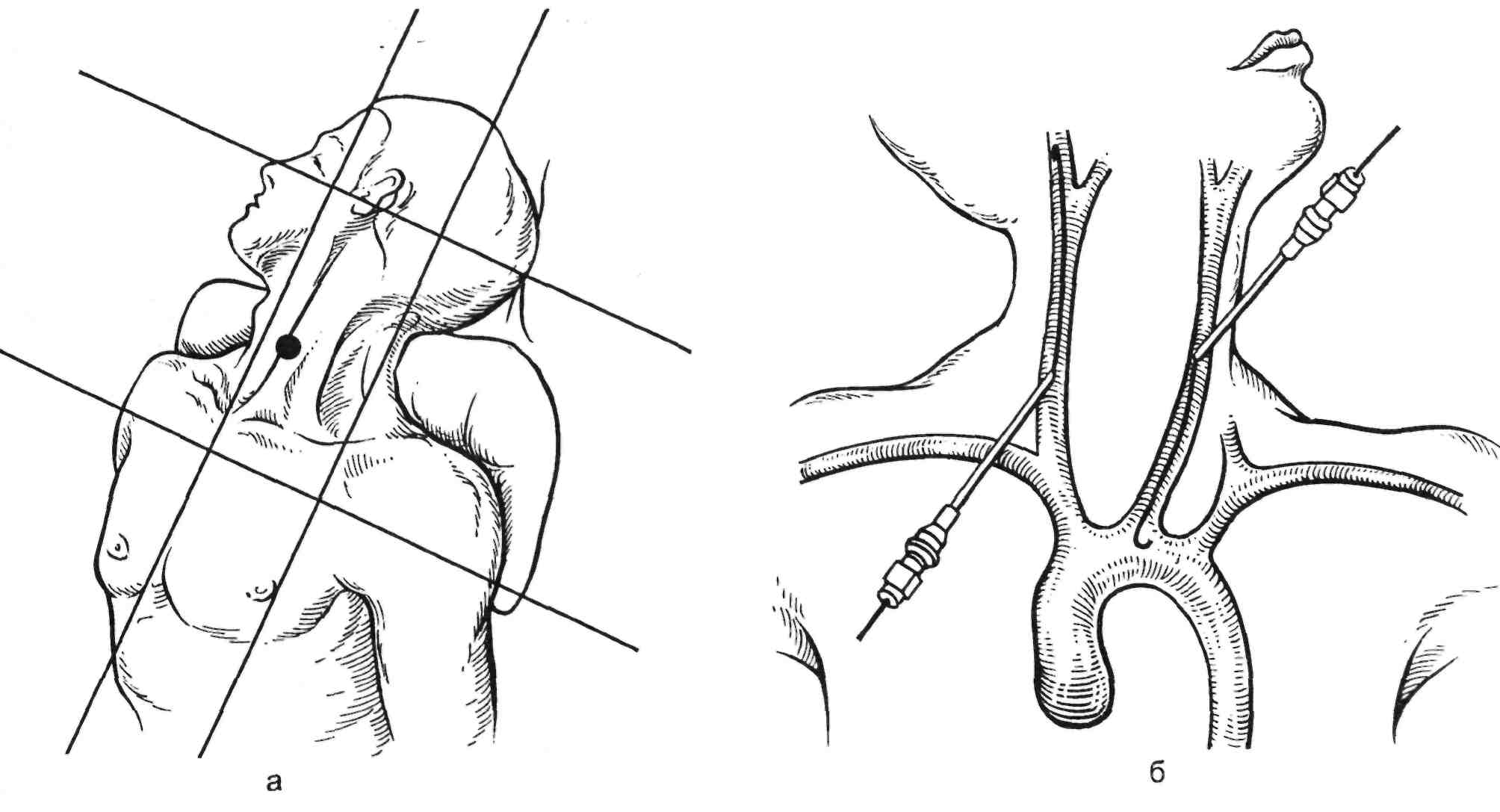
Ангиография артериальной систе- мы. Техника транслюмбалъной пун- кции абдоминальной аорты. Поло- жение больного — лежа на животе, руки согнуты в локтях и подложены под голову. Ориентирами для пунк- ции служат наружный край левой m.erector spinae и нижний край XII ребра, точка пересечения которых и является местом вкола иглы. После обезболивания кожи 0,25—0,5 % раствором новокаина делают небо- льшой разрез кожи (2—3 мм) и иглу направляют вперед, вглубь и меди- ально под углом 45° к поверхности

182
тела пациента (примерное направ- ление на правое плечо). По ходу иглы проводят инфильтрационную анестезию раствором новокаина.
По достижении парааортальной клетчатки явственно ощущаются передаточные колебания стенки аорты, подтверждающие правиль- ность выполнения пункции. В па- рааортальной клетчатке создается «подушка» из новокаина (40— 50 мл), после чего стенку аорты прокалывают коротким резким дви- жением. Свидетельством того, что игла находится в просвете аорты, является появление пульсирующей струи крови из иглы. Движе- ние иглы постоянно контролируют флюороскопией. Через просвет иг- лы в аорту вводят проводник и иглу извлекают. Чаще используют сред- нюю пункцию аорты на уровне L2. При подозрении на окклюзию или аневризматическое расширение ин- фраренального отдела аорты пока- зана высокая пункция супрареналь- ного отдела брюшной аорты на уровне Th12—L1 (рис. 2.25).
Транслюмбальная техника пунк- ции для ангиографии брюшной аорты почти всегда является вы- нужденной мерой, так как требуе- мый объем и скорость введения контрастного вещества на обыч- ном ангиографическом оборудова- нии (50—70 мл со скоростью 25— 30 мл/с) могут быть введены только через катетеры довольно большого диаметра — 7—8 F (2,3—2,64 мм). Попытки применения этих катете- ров для трансаксиллярного или ку- битального артериальных досту- пов сопровождаются различными осложнениями. Однако с развитием дигитальной субтракционной ан- гиографии, когда появилась воз- можность компьютерными спосо- бами усиливать рентгеноконтраст- ное изображение сосудов после введения относительно малого ко- личества контрастного вещества, стали все шире применять катетеры малых диаметров 4—6 F или 1,32—

Рис. 2.25. Уровни пункций для выпол- нения транслюмбальной аортографии.
а — высокий, б — средний, в — низкий; 1 — чревный ствол; 2 — верхняя брыжеечная ар- терия; 3 — почечные артерии; 4 — нижняя брыжеечная артерия.
1,98 мм. Такие катетеры позволяют безопасно и целесообразно осу- ществлять доступы через артерии верхних конечностей: подкрыльцо- вую, плечевую, локтевую, лучевую. Методика пункции общей бедрен- ной артерии по Сельдингеру. Пунк- цию бедренной артерии выполняют на 1,5—2 см ниже пупартовой связ- ки, в месте наиболее четкой пуль- сации. Определив пульсацию об- щей бедренной артерии, проводят местную инфильтрационную анес- тезию раствором новокаина 0,25— 0,5 %, но так, чтобы не потерять пульсацию артерии; послойно ин- фильтрируют кожу и подкожную клетчатку справа и слева от артерии до надкостницы лонной кости. Важно постараться приподнять ар- терию из костного ложа на кости, что облегчает пункцию, так как приближает стенку артерии к по- верхности кожи. После завершения анестезии делают небольшой над- рез кожи (2—3 мм) для облегчения проведения иглы. Иглу проводят под углом 45°, фиксируя артерию
183
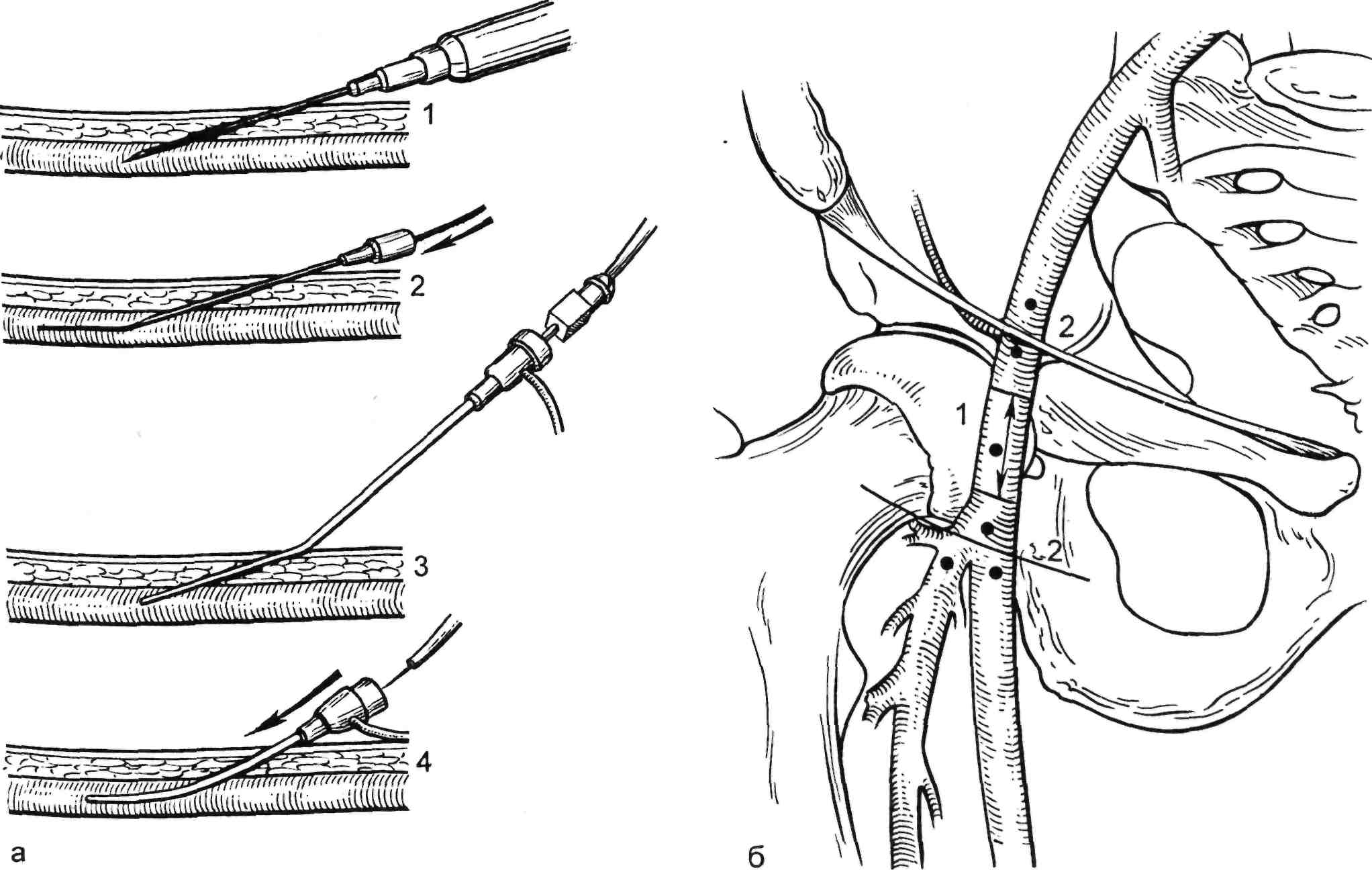
а: 1 — пункция сосуда иглой; 2 — в сосуд ретроградно вводят проводник; 3 — иглу удаляют, вводят буж и интродьюсер; 4 — интродьюсер в артерии; б: 1 — правильное место пункции бедренной артерии; 2 — нежелательное место пункции.
средним и указательным пальцами левой руки (при пункции правой бедренной артерии). Когда ее ко- нец соприкасается с передней стен- кой артерии, можно ощутить пуль- совые толчки. Прокол артерии сле- дует осуществлять резким коротким движением иглы, стараясь пункти- ровать при этом только переднюю ее стенку. Тогда струя крови посту- пает сразу через просвет иглы. Если этого не происходит, иглу медленно оттягивают назад вплоть до появле- ния струи крови или до выхода иглы из пункционного канала. Тог- да следует повторить попытку пун- кции.
Артерию прокалывают тонкой иглой с внешним диаметром 1 — 1,2 мм без центрального мандрена с косой заточкой как в антеград- ном, так и в ретроградном направ- лении в зависимости от цели ис- следования. При появлении струи
крови иглу наклоняют к бедру больного и через канал в просвет артерии вводят проводник. Поло- жение последнего контролируют флюороскопией. Затем проводник фиксируют в артерии, а иглу уда- ляют. По проводнику в просвет ар- терии устанавливают катетер или интродьюсер при длительных вме- шательствах со сменой катетеров (рис. 2.26).
В случаях когда бедренные арте- рии не могут быть пунктированы, например после шунтирующих опе- раций или при окклюзирующих за- болеваниях, когда закрыт просвет бедренной артерии, артерий таза или дистальный отдел аорты, дол- жен быть применен альтернатив- ный доступ.
Такими доступами могут быть подмышечные или плечевые арте- рии, транслюмбальная пункция аб- доминальной аорты.
184
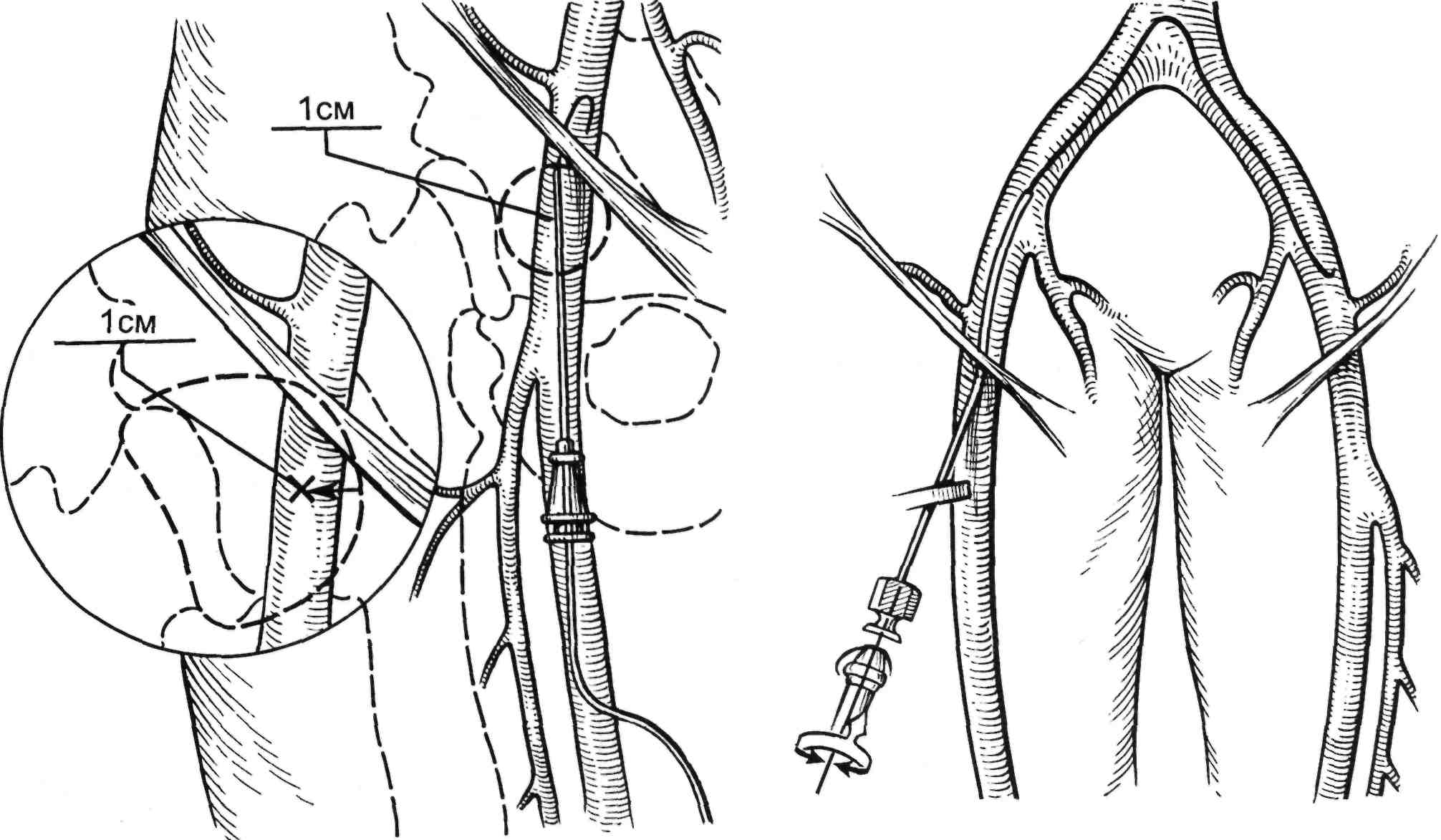
Контралатеральный бедренный доступ. Большинство эндоваску- лярных вмешательств на подвздош- ных артериях может быть выполне- но с помощью ипсилатеральной бедренной артерии. Однако некото- рые повреждения, включая стенозы дистальной части наружной под- вздошной артерии, не доступны из ипсилатеральной общей бедренной артерии. В этих случаях предпочти- тельна методика контралатерально- го доступа; кроме того, она позво- ляет выполнить вмешательство при многоуровневых стенозах бедрен- но-подколенной и подвздош- но-бедренной зоны. Для прохода через бифуркацию аорты обычно используют катетеры Cobra, Hook, Sheperd-Hook. Контралатеральный доступ при стентировании и эндо- протезировании артерии может быть затруднен при использовании баллонно-расширяемых стентов от- носительно жесткой конструкции. В этих случаях следует применять длинный интродьюсер на жестком проводнике «Amplatz syper stiff» и др. (рис. 2.27).
Техника контралатерального до- ступа имеет некоторые преимуще- ства по сравнению с антеградным доступом при вмешательствах в бедренно-подколенной зоне. Пер- вое — ретроградное проведение ка- тетера позволяет выполнить вмеша- тельство на проксимальной порции бедренной артерии, которая была бы недоступна при антеградной пункции. Второй аспект — придав- ливание артерии для осуществле- ния гемостаза и наложение давя- щей асептической повязки после вмешательства происходит на противоположной стороне от опе- рации, что в конечном итоге сни- жает частоту ранних послеопераци- онных осложнений.
Антеградный бедренный доступ. Технику антеградного доступа ис- пользуют многие авторы. Данный вид вмешательства обеспечивает более прямой доступ ко многим по- вреждениям в средней и дисталь- ной части бедренно-подколенного сегмента артерии. Самый близкий подход к стенозам и окклюзиям в артериях голени обеспечивает более
185
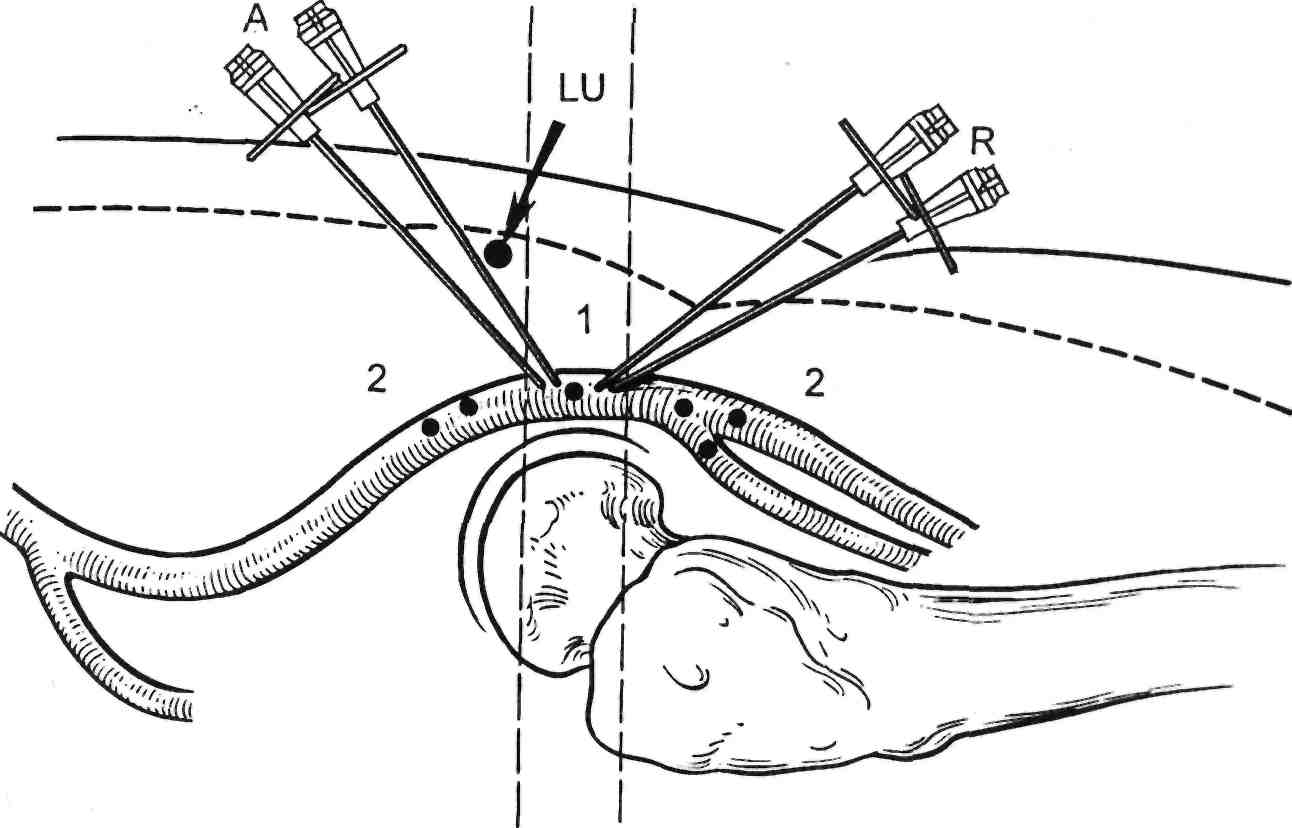
А — угол и направление иглы при антеградном досту- пе; LU — паховая связка; R — ретроградный доступ; 1 — место правильной пунк- ции бедренной артерии; 2 — нежелательное место пунк- ции.
точное управление инструментами. Однако, помимо потенциальных преимуществ, у антеградной техни- ки есть и недостатки. Для точного попадания в поверхностную бед- ренную артерию необходима более высокая пункция общей бедренной артерии. Пункция артерии выше паховой связки может привести к грозному осложнению — ретропе- ритонеальной гематоме. Такие при- емы, как введение контрастного препарата через пункционную иглу, помогают идентифицировать анато- мию бифуркации общей бедренной артерии. Для ее лучшего отображе- ния применяют косую проекцию, чтобы открыть угол бифуркации (рис. 2.28).
Подколенный доступ. Приблизи- тельно в 20—30 % стандартных слу- чаев техника антеградного и конт- ралатерального доступов в бедрен- ную артерию не в состоянии обес- печить доставку инструментов к ок- клюзированным участкам поверх- ностных бедренных артерий. В этих случаях показана техника подко- ленного доступа, который приме- няют лишь у пациентов с проходи- мыми дистальными сегментами по- верхностной бедренной артерии и проксимальными сегментами под- коленной артерии. Безопасный прокол подколенной артерии может быть осуществлен лишь более тон-
кими инструментами с диаметром не более 4—6 F. При использова- нии таких инструментов, как буры, дилатационные баллоны со стента- ми, допустимо применять интродь- юсеры 8—9 F, так как диаметр арте- рии в этом месте 6 мм. Техника пункции подколенной артерии сходна с техникой вышеописанных пункций. Подколенная артерия вместе с нервом и веной проходит сверху вдоль диагонали подколен- ного треугольника. Поверхностное расположение артерии в этом месте допускает ее ретроградную пунк- цию, которую выполняют точно над суставом. При этом пациент ле- жит на животе или на боку. Мани- пуляции выполняют под местной анестезией (рис. 2.29).
Доступ через плечевую артерию. Плечевой доступ — альтернативная техника проведения инструментов в аорту и ее ветви, часто используе- мая для диагностических процедур при невозможности осуществления пункции бедренной артерии или транслюмбальной пункции аорты. Кроме того, данный доступ может быть альтернативным подходом к эндоваскулярным вмешательствам на почечных артериях. Предпочти- тельнее использовать левую плече- вую артерию. Это продиктовано тем, что катетеризация правой пле- чевой артерии значительно повы-
186
шает риск эмболизации мозговых сосудов при проведении инстру- ментов через дугу аорты. Прокол плечевой артерии должен быть вы- полнен в ее дистальной части выше кубитальной ямки. В этом месте ар- терия лежит наиболее поверхност- но, гемостаз можно облегчить при- жатием артерии к плечевой кости (рис. 2.30).
Радиальный доступ через лучевую артерию сопровождается травмой меньшего, чем бедренная артерия, сосуда, что позволяет обойтись без непременного продолжительного гемостаза, периода покоя и посте- льного режима после эндоваскуляр- ного вмешательства.
Показания к радиальному досту- пу: хорошая пульсация лучевой ар- терии с адекватным коллатераль- ным кровообращением из локтевой артерии через ладонную артериаль- ную дугу. Для этого используют «Allen-тест», который должен быть проведен всем пациентам — канди- датам на проведение радиального доступа. Обследование проводят следующим образом:
придавливают лучевую и локте- вую артерии;
6—7 сгибательных-разгибатель- ных движений пальцев;
при разогнутых пальцах про- должают одновременное сжатие локтевой и лучевой артерий. Кожа руки бледнеет;
снять сдавление локтевой арте- рии;
продолжая придавливание ра- диальной артерии, контролируют цвет кожных покровов кисти.
В течение 10 с цвет кожи кисти должен вернуться к нормальному, что свидетельствует о достаточном развитии коллатералей. В этом слу- чае «Allen-тест» считается положи- тельным, радиальный доступ допус- тим.
Если цвет кожи кисти остался бледным, «Allen-тест» считается от- рицательным и радиальный доступ недопустим.
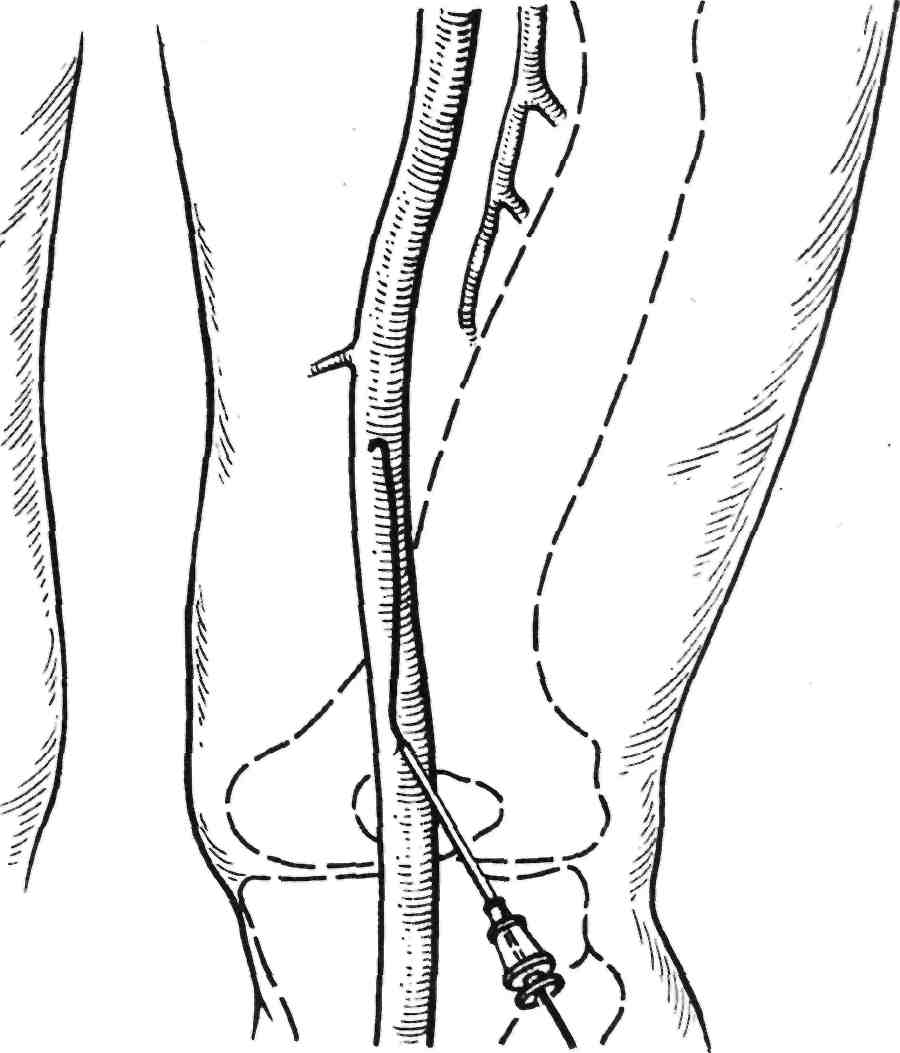
Рис. 2.29. Подколенный доступ.
Противопоказания к данному до- ступу — отсутствие пульса лучевой артерии, отрицательный «Allen- тест», наличие артериовенозного шунта для гемодиализа, очень ма-
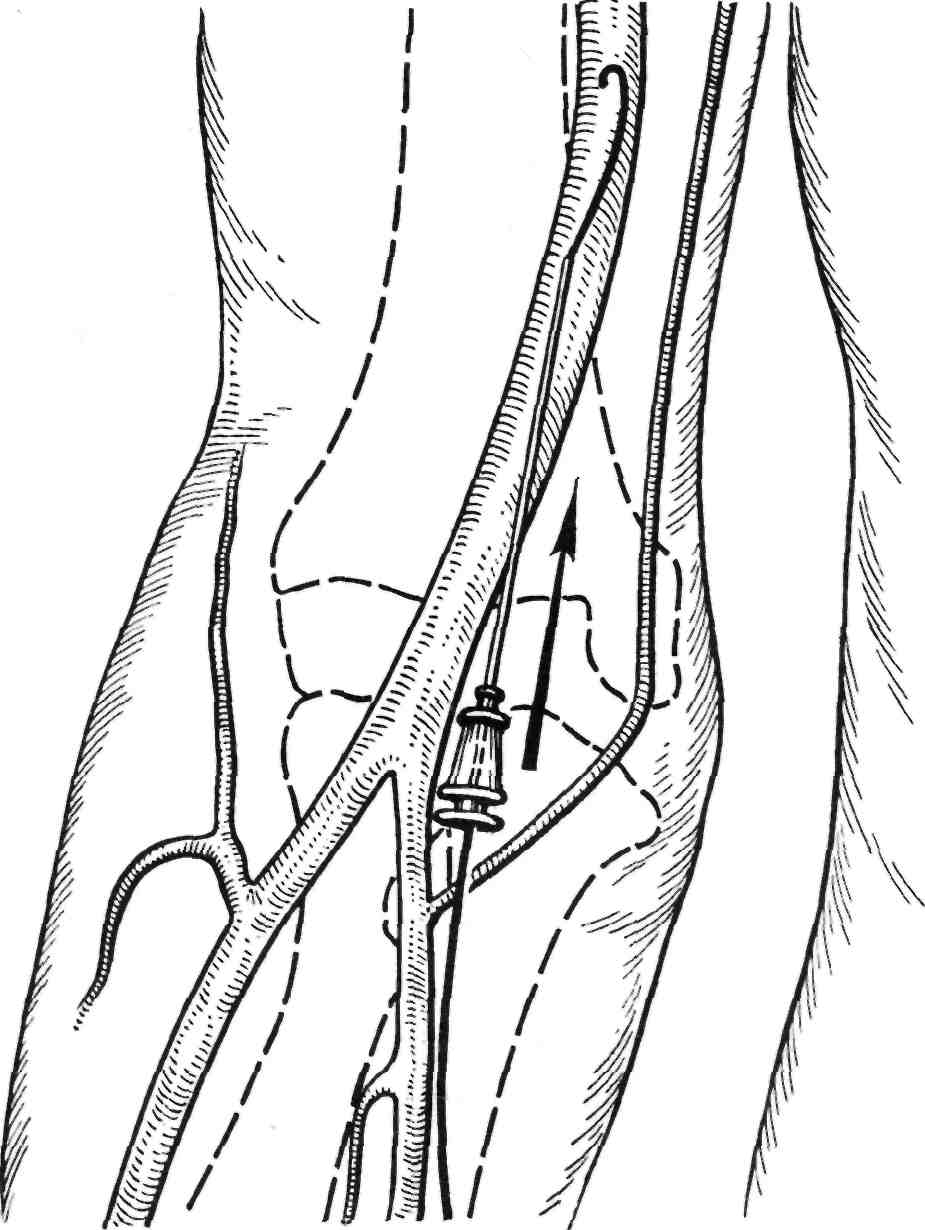
Рис. 2.30. Доступ через плечевую арте- рию.
187

Рис. 2.31. Доступ через лучевую артерию.
ленькая лучевая артерия, наличие патологии в. проксимальных арте- риях, необходимы инструменты размерами больше 7 F.
Техника радиального артериаль- ного доступа. Перед выполнением прокола определяют направление лучевой артерии. Пункцию артерии проводят на 3—4 см проксимальнее шиловидного отростка лучевой кос- ти. Перед проколом выполняют местную анестезию раствором но- вокаина или лидокаина через иглу, проведенную параллельно коже, так, чтобы исключить прокол арте- рии. Надрез кожи должен быть осу- ществлен также с большой осто- рожностью во избежание травмы артерии. Прокол производят от- крытой иглой под углом 30—60° к коже в направлении артерии (рис. 2.31).
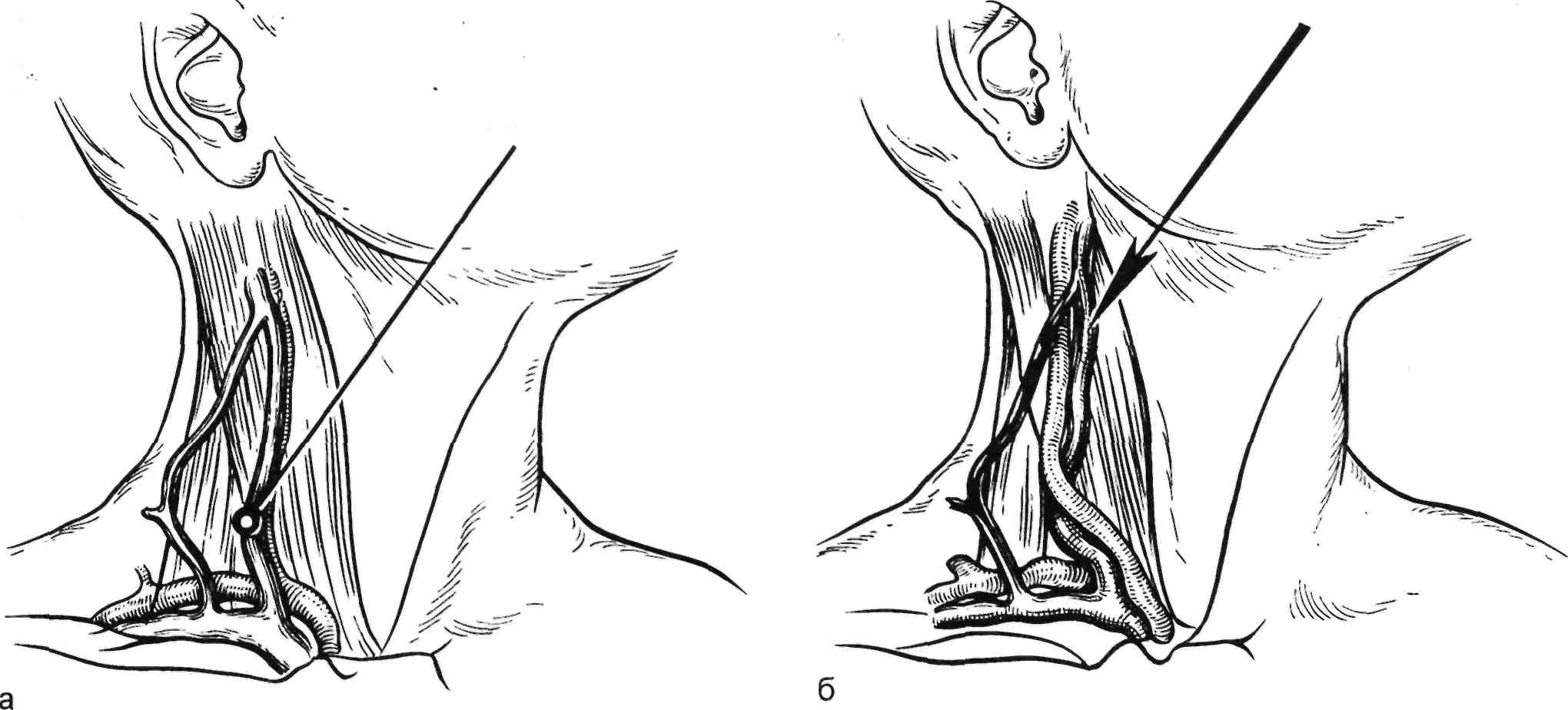
Техника прямой катетеризации сонных артерий. Пункция общей сонной артерии служит для селек- тивных исследований сонных арте- рий и артерий головного мозга.
Ориентирами являются m.ster- nocleidomastoideus, верхний край щитовидного хряща, пульсация об- щей сонной артерии. Верхний край щитовидного хряща указывает мес- тоположение бифуркации общей сонной артерии. После обезболива- ния делают прокол кожи кончиком скальпеля, m.sternocleidomastoideus оттесняют кнаружи и иглу продви-
гают вперед по направлению пуль- сации общей сонной артерии. Очень важно, чтобы пульсовые тол- чки ощущались не сбоку от кончи- ка иглы, а непосредственно перед ним, что указывает на ориентацию иглы к центру артерии. Это позво- ляет избежать касательных ранений стенки артерии и образования ге- матом. Артерию пунктируют корот- ким дозированным движением. При появлении струи крови через просвет иглы в артерию вводят про- водник и иглу удаляют. По провод- нику в просвет артерии устанавли- вают катетер, тип которого зависит от цели исследования (рис. 2.32).
Открытые доступы. Инструмен- ты большого диаметра ввиду опас- ности повреждения артерии не применяют, открытые доступы к сосудам осуществляют артериото- мией.
Инструментарий, дозы и скорость введения контрастного вещества. Для торакальной и абдоминальной аортографии необходимы катете- ры калибром 7-8 F длиной 100— 110 см, которые обеспечивают ско- рость введения контрастного пре- парата до 30 мл/с; а для перифери- ческой и селективной ангиогра- фии — катетеры 4—6 F длиной 60— 110 см. Обычно для инъекций кон- трастного средства в аорту служат катетеры с конфигурацией «Pig tail» — «поросячий хвостик» и мно-
188
жественными боковыми отверстия- ми. Контрастное вещество обычно вводят автоматическим инъекто- ром. Для селективной ангиографии применяют катетеры других конфи- гураций, каждая из которых обес- печивает избирательную катетери- зацию устья какой-либо одной ар- терии или группы ветвей аорты — коронарных, брахиоцефальных,
висцеральных и т.д. При этом для получения ангиограмм нередко вполне достаточно инъекции конт- растного средства вручную.
В настоящее время для ангиогра- фии чаще используют неионные водорастворимые контрастные ве- щества, содержащие от 300 до 400 мг йода в 1 мл («Ультравист-370», «Омнипак 300—350», «Визипак- 320», «Ксенетикс-350» и др.). В ред- ких случаях применяют ранее ши- роко используемый водораствори- мый ионный контрастный 60—76 % препарат «Урографин», который из-за выраженного болевого, неф- ро- и нейротоксического воздейст- вия следует ограничивать диагнос- тикой дистальных поражений арте- риального русла или использовать в
условиях интраоперационной ан- гиографии под интубационным наркозом.
Скорость введения контрастного средства должна соизмеряться с тех- никой съемки и со скоростью кро- вотока. Для инъекций в грудную аорту адекватной является скорость от 25 до 30 мл/с; для абдоминальной аорты — от 18 до 25 мл/с; для пери- ферических артерий (тазовые, бед- ренные) — скорость от 8 до 12 мл/с при использовании от 80 до 100 мл контрастного вещества. Это обеспе- чивает визуализацию артерий ниж- них конечностей вплоть до стоп. Скорость съемки для торакальной аортографии обычно составляет от 2 до 4 кадров/с; для абдоминальной аортографии — 2 кадра/с; для ко- нечностей в соответствии со скоро- стью кровотока — 1—2 кадра/с; для таза — 2—3 кадра/с и для сосудов голеней — от 1 до 1 кадра/3 с.
Дигитальная субтракционная ан- гиография требует меньшего объе- ма и меньшей скорости введения контрастного вещества. Так, для абдоминальной аортографии доста- точно введения 20—25 мл рентгено-
189
контрастного средства со скоро- стью 12—15 мл/с. А в ряде случаев возможно получение аортограмм с введением рентгеноконтрастного средства в венозное русло. Следует заметить, что при этом требуется достаточно большой объем контра- стного вещества — до 50—70 мл, и получаемые ангиограммы будут со- ответствовать качеству обзорных — общих ангиограмм. Наибольшего разрешения ДСА достигают при прямом селективном введении кон- трастного вещества в исследуемый сосуд с так называемой постпро- цессной компьютерной обработкой изображения — вычитанием маски (скелет и мягкие ткани), суммацией изображения, усилением и подчер- киванием сосудистого рисунка ан- гиограмм, продольной или объем- ной реконструкцией изображений нескольких анатомических облас- тей в одно целое. Важным достоин- ством современных ангиографиче- ских аппаратов являются возмож- ности непосредственного интраопе- рационного измерения диаметра сосудов, параметров стеноза или аневризмы артерии. Это позволяет быстро определить тактику рентге- нохирургического вмешательства, точно подобрать необходимые инструменты и имплантируемые устройства.
Осложнения. Любые рентгено- контрастные исследования не явля- ются абсолютно безопасными и со- пряжены с определенным риском. К возможным осложнениям отно- сят наружное и внутреннее крово- течение, тромбоз, эмболии артерий, перфорацию непунктируемой стен- ки сосуда проводником или катете- ром, экстравазальное или интраму- ральное введение контрастного ве- щества, обрыв проводника или ка- тетера, реакции, связанные с ток- сическим действием контрастных веществ. Частота и тип осложне- ний, встречающихся при пункции артерий, различны в зависимости от места катетеризации. Частота
осложнении различна: например, при бедренном доступе — 1,7 %; при транслюмбальном — 2,9 %; при плечевом доступе — 3,3 %.
Основные осложнения:
кровотечение может быть наруж- ным и внутренним (скрытым) с формированием пульсирующей ге- матомы и в дальнейшем псевдо- аневризмы;
тромбоз возникает при длитель- ной окклюзии сосуда либо его дис- секции; однако частота его значи- тельно уменьшилась с применени- ем катетеров и проводников мень- шего диаметра, уменьшением вре- мени операции и совершенствова- нием антикоагулянтных препара- тов;
эмболия развивается при разру- шении атеросклеротических бля- шек или отрыве тромбов от артери- альной стенки. Характер осложне- ния зависит от размера эмбола и конкретного сосуда, кровоснабжа- ющего этот артериальный бассейн;
артериовенозные свищи могут образоваться в результате одновре- менного пунктирования артерии и вены, наиболее часто при бедрен- ном доступе.
Условиями безопасности аорто- артериографии являются строгое соблюдение показаний, противопо- казаний и рациональный выбор ме- тодики исследования, проведение ряда профилактических мероприя- тий, направленных на борьбу с по- тенциальными осложнениями (про- мывание игл, катетеров и соедини- тельных трубок изотоническим рас- твором натрия хлорида с гепари- ном, тщательная проверка инстру- ментария). Манипуляции с провод- ником и катетером должны быть непродолжительными и малотрав- матичными. В ходе всего диагнос- тического исследования или лечеб- ного рентгенохирургического вме- шательства необходим контроль ЭКГ, АД, времени свертывания крови. Антикоагулянты, спазмоли- тики, десенсибилизирующие препа-
190
раты также способствуют профи- лактике осложнений и являются за- логом снижения риска ангиогра- фии.
При правильной пункции и тех- нике обращения с катетером, а так- же применении неионных или низ- коосмолярных контрастных средств частота осложнений при ангиогра- фии составляет менее 1,8 % [Petter- son H., 1995].
Ангиография венозной системы. Пункция бедренной вены. Техника выполнения пункции бедренной вены принципиально не отличается от пункции артерии, лишь по отно- шению к артерии бедренная вена у взрослых расположена медиальнее, а у детей — под артерией.
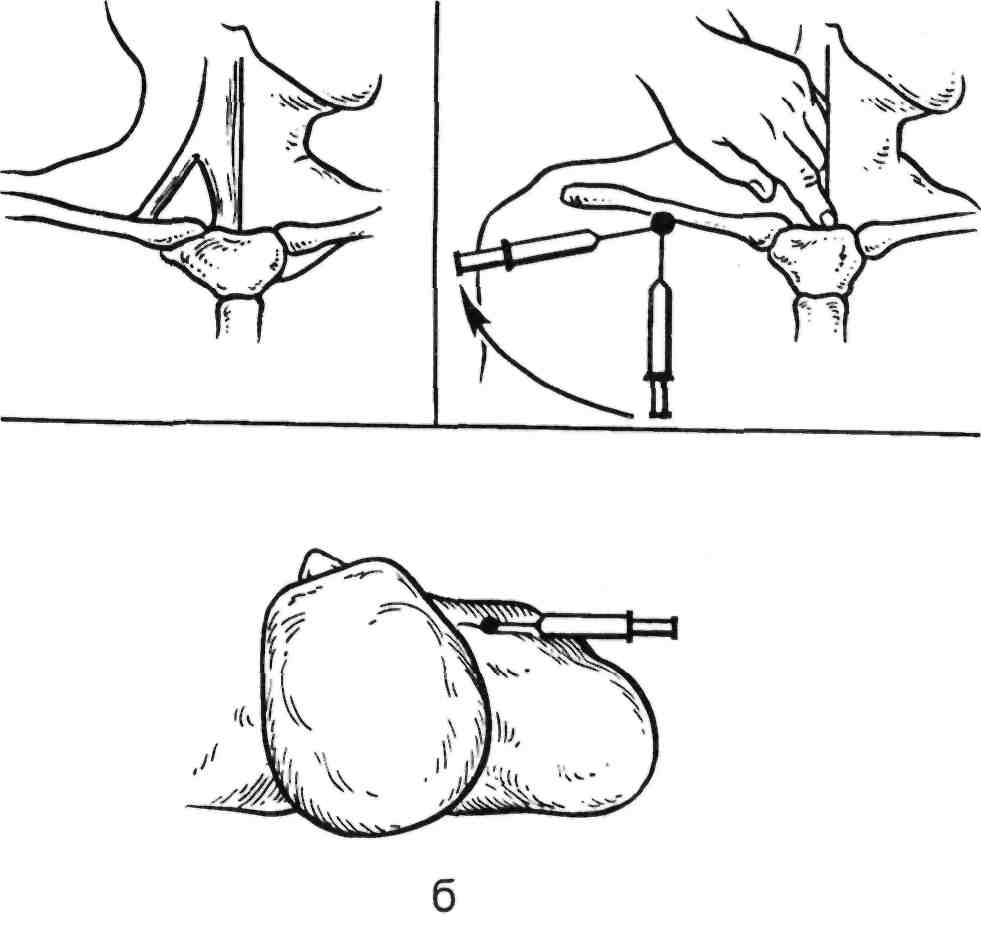
Пункция внутренней яремной вены. Ориентирами являются m.sternocleidomastoideus, ее сухожи- льные ножки, прикрепляющиеся к ключице и грудине, пульсация об- щей сонной артерии, наружная яремная вена. Используют два спо- соба пункции, которые выполняют под местной инфильтрационной анестезией 0,25—0,5 % Sol. Novoca- ini.
Первый способ: положение боль- ного на спине, голова повернута в
противоположную от места пунк- ции сторону. Между ножками m.sternocleidomastoideus определя- ют пульсацию общей сонной арте- рии. Артерию смещают медиально и проводят пункцию внутренней яремной вены. Направление иглы вглубь и ориентировочно на сосок с данной стороны. Попадание иглы в просвет вены определяют по по- ступлению венозной крови в шприц. Через просвет иглы в вену вводят проводник и по последнему устанавливают интродьюсер. При данном способе пункции вена рас- положена на глубине 3 см от повер- хности кожи. Более глубокое про- никновение чревато повреждением купола плевры. Пункцию лучше проводить при задержке дыхания на глубоком вдохе, так как при этом повышается венозное давле- ние и ощущение прокола стенки вены становится более отчетливым (рис. 2.33).
Второй способ: положение боль- ного то же. Посередине m.sternocle- idomastoideus пересекается наруж- ной яремной веной, которая обыч- но хорошо видна под кожей. Опре- деляют пульсацию общей сонной артерии и, сместив последнюю ла-
191
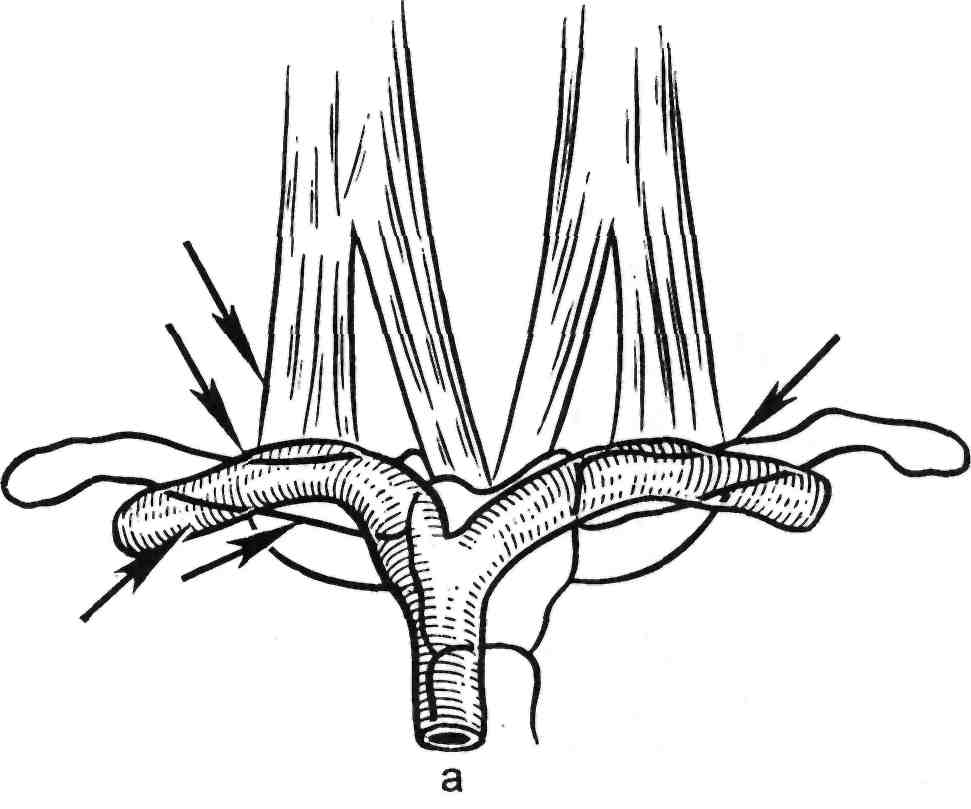
терально, производят пункцию внутренней яремной вены, которая располагается медиальнее и глубже общей сонной артерии (на глубине около 5—7 см от поверхности ко- жи). Контроль правильности вы- полнения пункции изложен выше. Направление иглы то же. При дан- ном способе пункции возможна ошибочная пункция общей сонной артерии, определить которую не- сложно по появлению пульсирую- щей струи крови из иглы. В этом случае иглу извлекают и осуществ- ляют гемостаз прижатием.
Пункцию подключичной вены про- изводят в области нижнего края средней трети ключицы. Иглу на- правляют между ключицей и 1-м ребром вверх, кнутри и медиально. Стилет иглы удаляют и определяют правильное положение иглы по по- ступлению крови в шприц. Затем через иглу в просвет вены вводят проводник до правого предсердия и по последнему устанавливают инт- родьюсер для предупреждения из- лишней травмы стенок вены и воз- душной эмболии. При надключич- ном способе пункции подключич- ной вены иглу направляют по внут- ренней поверхности ключицы вниз, кнутри и медиально. Пункцию так- же выполняют под местной анес-
тезией раствором новокаина (рис. 2.34).
Пункция периферических вен сто- пы. Используют для восходящей флебографии. Катетеризация — только в антеградном направлении из-за особенностей анатомического строения вен. Обычно предпочте- ние отдается медиальной вене боль- шого пальца стопы, поскольку она наиболее доступна для пункции. Более латеральные дорсальные ве- ны стопы также могут быть выбра- ны для пункции, так как в этом случае ретроградное введение ка- нюли может обеспечить лучшее за- полнение глубоких вен голени.
Восходящая флебография конечностей. Наиболее распростра- ненный способ визуализации вен нижних конечностей — от уровня стопы до нижней полой вены (рис. 2.35). Этот метод считается «золо- тым стандартом» для оценки мор- фологии вен нижних конечностей, их клапанов и характера кровотока. Визуализируют только вены, несу- щие кровь, смешанную с контраст- ным веществом. Глубокие бедрен- ные и внутренние подвздошные вены зачастую не контрастируются. Несостоятельные клапаны или ве- нозная обструкция могут обусло- вить коллатеральный кровоток и
192
дренирование в поверхностные вены. Это может мешать заполне- нию контрастным веществом глу- боких вен.
Исследование проводят в специа- лизированных рентгеноперацион- ных на разных уровнях и в различ- ных проекциях при введении конт- растного вещества через канюлю, введенную в тыльную вену стопы.
Условия и позиции съемки. Испо- льзование горячего мокрого поло- тенца может помочь выявлению вен за счет их усиленного кровена- полнения. Наклон рентгеновского стола также увеличивает выявляе- мость вен за счет увеличения гид- ростатического давления. При отечных стопах необходимо длите- льное и надежное сдавление соот- ветствующего участка тыла стопы. Иногда применяют нитроглицери- новую мазь для получения местного расширения подкожных вен стопы для более легкой пункции. Для форсирования проникновения кон- трастного средства в глубокие вены накладывают резиновый жгут в надлодыжечной области. Иногда такой подход препятствует заполне-
нию передней большеберцовой вены. Жгуты можно также накла- дывать на более высоких уровнях. Обследование выполняют при на- клоне флюороскопического стола под углом 45—60° к полу в положе- нии больного лежа, пока контраст- ное вещество не достигнет тазовой области. Затем стол опускают, и ко- нечность пассивно поднимается, в то время как пациент производит маневр Вальсальвы для максималь- ного заполнения контрастным ве- ществом тазовых вен и вен нижних конечностей. Это важно при обсле- довании на расслабленной, нена- груженной конечности, поскольку в противном случае глубокие вены будут сдавлены мышцами конечно- сти. Вены голеней должны быть ви- зуализированы в трех проекциях: латеральной косой, переднезадней и медиальной косой. Вены, распо- ложенные выше колена, требуют выполнения одной — двух проек- ций.
Объем и скорость введения конт- растного вещества. Для флебо- графии могут быть использованы только водорастворимые неионные
193
контрастные вещества, содержащие среднюю концентрацию атомов йода, — «Омнипак-280», «Ультра- вист-300», «Ксенетикс-300», вводи- мые вручную в количестве 40— 50 мл для одной конечности.
Осложнения редки и в большин- стве случаев связаны с технически- ми погрешностями. Одним из са- мых частых осложнений при пунк- ции подключичной вены является пневмоторакс. Правильная методи- ка и правильное определение мес- тоположения катетера являются основополагающими для предот- вращения этого грозного осложне- ния. Не выявленный своевременно пневмоторакс может привести к на- рушению вентиляционной функ- ции легких и к декомпенсации ге- модинамики. В связи с тем что все крупные венозные стволы находят- ся в непосредственной близости от артериальных, возможна пункция крупных артерий (сонные, подклю- чичные, бедренные). Для избежа- ния кровотечения необходим на- дежный гемостаз. Могут иметь мес- то различные осложнения, связан- ные с манипуляциями катетерами в полостях сердца и легочных артери- ях (аритмии, остановки дыхания). Следует также быть готовым к не- медленному купированию возмож- ных анафилактических реакций. Возможны тошнота, вазовагальные реакции и боль при инъекции. Во избежание постфлебографического тромбоза следует применять низко- осмолярное, предпочтительно неи- онное контрастное вещество. Ион- ные контрастные вещества с более высокой осмолярностью вызывают тромбоз в 10—60 % случаев. Для снижения такого риска гиперосмо- лярные контрастные вещества дол- жны быть разбавлены до концент- рации 200—300 мг/мл. После завер- шения исследования через канюлю промывают венозное русло конеч- ности большим объемом теплого изотонического раствора натрия хлорида с гепарином до 150 мл. По-
сле удаления канюли из вены дела- ют массаж икроножных мышц, об- ласти колена и бедра с целью опо- рожнения подкожных вен от конт- растного вещества. Степень опо- рожнения подкожных вен легко определяют рентгеноскопически.
Экстравазация контрастного
средства в месте пункции может произойти из-за смещения канюли или неудавшегося прокола вены. Это обычно не вызывает каких-ли- бо осложнений при применении низкоосмолярных контрастных ве- ществ. При использовании высоко- осмолярных контрастных веществ возможно появление боли и даже некроза кожи.
Восходящая флебография ниж- них конечностей все еще является наиболее важным методом диагнос- тики тромбоза глубоких вен, но ее роль в диагностике первичной ве- нозной недостаточности ограниче- на.
Ретроградную флебографию испо- льзуют для демонстрации клапан- ной недостаточности на верхнебед- ренном уровне. Общую бедренную вену антеградно пунктируют и кон- трастное вещество вводят во время маневра Вальсальвы при положе- нии пациента полулежа. Это позво- ляет оценить степень ретроградного оттока контрастного вещества через несостоятельные клапаны в вены бедра.
Флебография верхней конечности. Показанием часто являются подо- зрение на тромбоз подмышечной, подключичной вены или их об- струкция опухолью.
Через локтевую вену катетеризи- руют базилярную вену. Вводят кон- трастное вещество и выполняют снимки плеча и средостения. Жгу- ты не используют. Риск послефле- бографического тромбоза меньше, чем в нижних конечностях; воз- можно, вследствие лучших возмож- ностей обеспечения адекватного от- тока крови из вен верхних конечно- стей.
194
Объем и скорость введения конт- растного вещества. Количество контрастного препарата, необходи- мого для исследования, обычно со- ставляет 20—50 мл. Если применя- ют автоматический инъектор, то скорость инъекции может состав- лять 6—10 мл/с.
Позиции съемки. Обычно получа- ют изображения плечевых, подмы- шечных, подключичных и брахио- цефальных вен, верхней полой вены в одной или двух проекциях. При подозрении на обструкцию верхней полой вены можно проводить одно- временное контрастирование вен обеих верхних конечностей.
Кавография. Для ангиографии нижней полой вены обычно ис- пользуют трансфеморальный или трансъюгулярный венозный доступ. Последний показан в тех случаях, когда необходимо выявить источ- ники тромбоэмболии легочной ар- терии и возможен тромбоз просвета нижней полой вены, подвздошных вен. В связи с этим, как правило, это исследование проводят как илеокавографию. В вену вводят прямой катетер или катетер типа Pig tail с установкой его кончика на уровне бифуркации нижней полой вены (рис. 2.36).
Условия и позиции съемки. Серий- ную съемку выполняют в прямой и боковой проекциях во время инъ- екции 40—80 мл контрастного сред- ства «Омнипак-350» или «Ультра- вист-370» со скоростью 15—20 мл/с. Пациент должен выполнить маневр Вальсальвы форсированным натуживанием. При дигитальной субтракционной ангиографии кон- центрация и объем контрастного вещества могут быть существенно снижены — до 20 мл со скоростью введения 12—15 мл/с. Комбиниро- ванная ангиография тазовых и по- лых вен может быть выполнена од- новременно введением контрастно- го вещества через катетер, установ- ленный в паховой области, в обе общие бедренные вены.
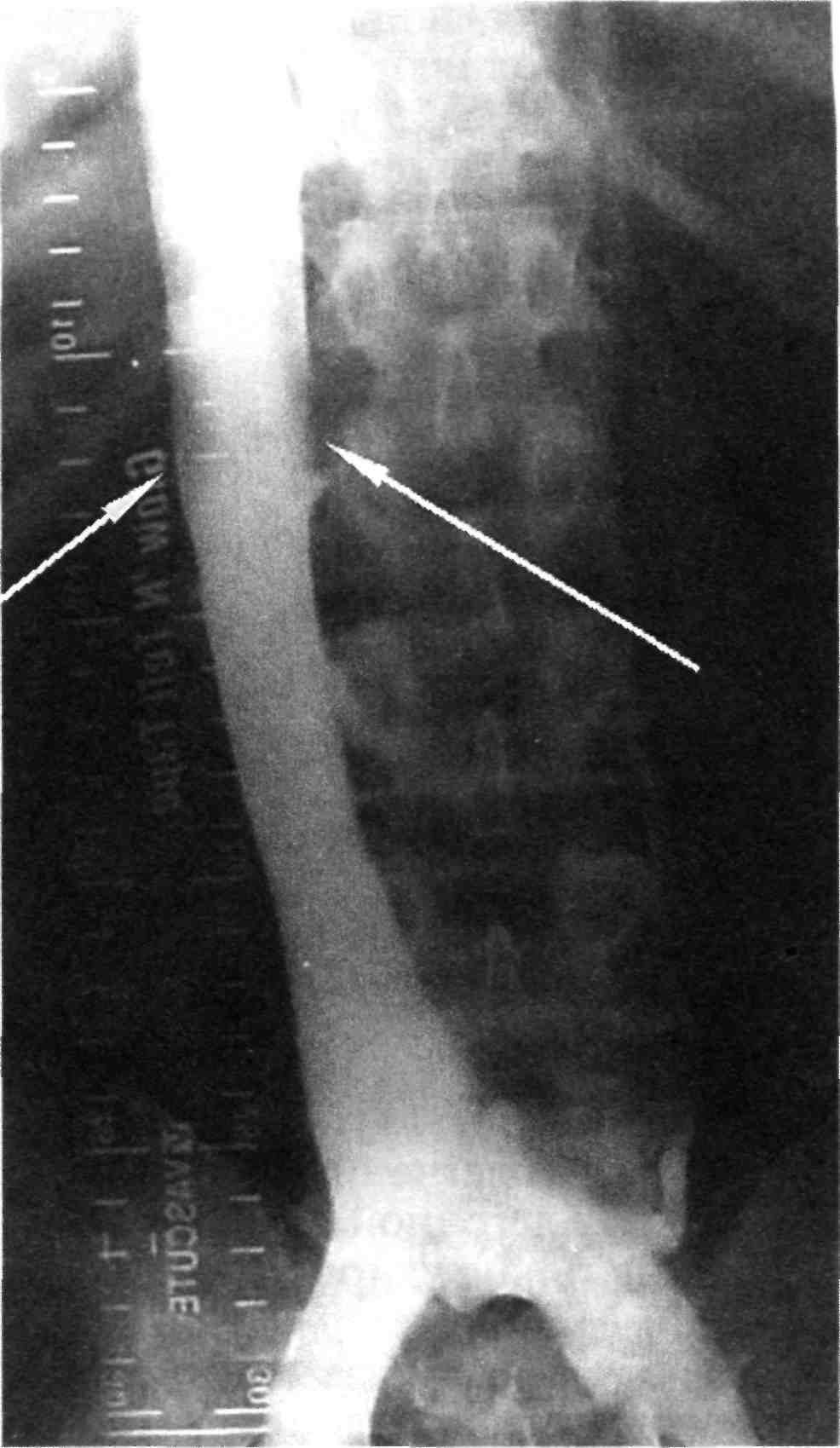
Рис. 2.36. Нижняя кавография.
Ангиопульмонография — наибо- лее информативный метод в диа- гностике аномалий развития лег- ких, изменений сосудистого русла, вызванных опухолью, хронически- ми неспецифическими заболевани- ями легких, бронхоэктатической болезнью, туберкулезом, при подо- зрении на тромбоэмболию легоч- ной артерии, особенно если выра- жена сердечно-сосудистая недоста- точность, а данных других методов исследования недостаточно.
Последовательность комплексно- го рентгеноконтрастного исследо- вания определяется клинической ситуацией. Во всех случаях прежде всего необходимо регистрировать давление в легочной артерии и пра- вых отделах сердца. Затем при по-
195
дозрении на массивную легочную эмболию выполняют общую ангио- пульмонографию. Для уточнения локализации эмболии дополнитель- но к общим ангиопульмонограм- мам выполняют не только селек- тивные и суперселективные катете- ризации с введением контрастного вещества в главные или долевые ветви, но и снимки в прямой, боко- вой или косой проекциях. И нако- нец, если позволяет состояние бо- льного, проводят илеокавографию.
При подозрении на тромбоэмбо- лию легочной артерии и наличие тромба в нижней полой вене следует использовать подключичный доступ в венозное русло или доступ через внутреннюю яремную вену. Весь объем рентгеноконтрастного иссле- дования может быть выполнен с по- мощью одного катетера 7 F с откры- тым концевым и боковыми отвер- стиями. Для облегчения катетериза- ции ствола легочной артерии это должен быть ангулированный под углом 110—115° катетер Pig tail.
Общую ангиопульмонографию осуществляют после введения 50—80 мл контрастного вещества в ствол легочной артерии. Количест- во вводимого контрастного вещест- ва и скорость его введения зависят от состояния больного и степени легочной гипертензии. Если повы- шение давления в легочной артерии выраженное и имеется подозрение на массивную эмболию, достаточно ввести 50—60 мл контрастного ве- щества со скоростью, не превыша- ющей 25 мл/с. Если давление в ма- лом круге кровообращения в нор- ме, контрастное вещество можно вводить со скоростью до 40 мл/с. Серию снимков следует подбирать индивидуально у каждого больного так, чтобы получить все фазы про- хождения контрастного вещества по сосудам легких — артериальную, паренхиматозную или капилляр- ную, венозную.
Необходимость в дополнитель- ных селективных исследованиях
возникает не всегда. К ним обычно следует прибегать, когда имеются какие-либо сомнения относительно локализации и объема поражения сосудистого русла легких. Очень часто приходится проводить селек- тивное контрастирование левой главной ветви в связи с тем, что она во многих случаях в стандарт- ной переднезадней проекции не видна на всем своем протяжении. Селективную ангиографию левой главной ветви легочной артерии проводят во второй косой проек- ции. Если имеются сомнения отно- сительно наличия или отсутствия эмболов в правой главной ветви, следует отдать предпочтение селек- тивному исследованию, выполняе- мому одновременно в прямой и бо- ковой проекциях.
Обследование больных с хрони- ческой постэмболической легочной гипертензией имеет существенные особенности. Во всех случаях до- полнительно к общей ангиопульмо- нографии следует осуществлять се- лективное рентгеноконтрастное ис- следование: справа — в прямой и боковой проекциях, слева — во второй косой. Если в связи с тяже- стью состояния пациента невоз- можно одновременно провести весь комплекс исследований, то его сле- дует разделить на 2 этапа — в тече- ние 2 дней. Необходимость такого тщательного рентгеноконтрастного исследования диктуется тем, что тромбоэмболы при большой длите- льности заболевания плотно фик- сируются к стенке сосуда и могут не визуализироваться в стандарт- ной переднезадней проекции.
2.4.1. Ангиографическая семиотика
2.4.1.1. Заболевания артериальной системы
Диагностика атеросклеротических поражений брахиоцефальных сосу- дов. Предоперационная ангиогра- фия брахиоцефальных артерий, по
196
мнению многих авторов, должна применяться только тогда, когда после проведения всего комплекса УЗИ-диагностики достоверность диагноза вызывает сомнение. Это положение не является отказом от ангиографии как от стандартного метода диагностики, а лишь спо- собствует снижению риска ослож- нений и стоимости лечения боль- ных. Но если ангиографическое ис- следование проводится, оно дол- жно быть всеобъемлющим. Его сле- дует проводить так же, как ангио- графию дуги аорты, и как минимум в двух проекциях с возможным до- полнительным селективным иссле- дованием отдельных брахиоцефаль- ных артерий.
Визуализация брахиоцефальных артерий достигается введением 50—70 мл контрастного вещества при скорости введения 25—30 мл/с. Съемку производят в двух проекци- ях при выведении левого плеча па- циента вперед на 15—20° с частотой съемки 2 кадра/с в течение 4—5 с. По характеру поражений принято выделять следующие признаки по- ражения: сужение, окклюзию, пато- логическую извитость, расширение, локализованное или протяженное, синдром обкрадывания мозговых сосудов, выражающийся в ретро- градном кровотоке по сонным или позвоночным артериям, коллатера- льное кровообращение.
Наиболее частым поражением является сужение устьев и магист- ральных отделов брахиоцефальных артерий. По характеру сужения вы- деляют тубулярные стенозы разной протяженности — от 1,5 см до тота- льного сужения всей артерии; лока- льные циркулярные стенозы разной степени выраженности; асиммет- ричные пристеночные стенозы, обусловленные, как правило, нали- чием атеросклеротической бляшки; и протяженное неравномерное су- жение сосудов. Тубулярные стено- зы артерий с гладкими стенками более характерны для аортоартери-

Рис. 2.37. Аортоартериография ветвей дуги аорты при атеросклерозе. Стрел- ками обозначены окклюзии левой об- щей сонной и левой подключичной ар- терий.
ита, в то время как локализованные стенозы или протяженные неравно- мерные сужения сосудов в большей степени присущи атеросклеротиче- ским поражениям артерий (рис. 2.37).
Важной особенностью атероскле- роза является то, что он поражает внечерепные отделы артерий голов- ного мозга в 5 раз чаще, чем инт- ракраниальные артерии. В боль- шинстве случаев поражение арте- рий носит сегментарный характер. При этом дистальные отделы оста- ются проходимыми.
Анализ частоты распределения атеросклеротических поражений брахиоцефальных артерий показы- вает, что наиболее часто стеноз или окклюзия поражают устья позво- ночных артерий. Второе место по
197
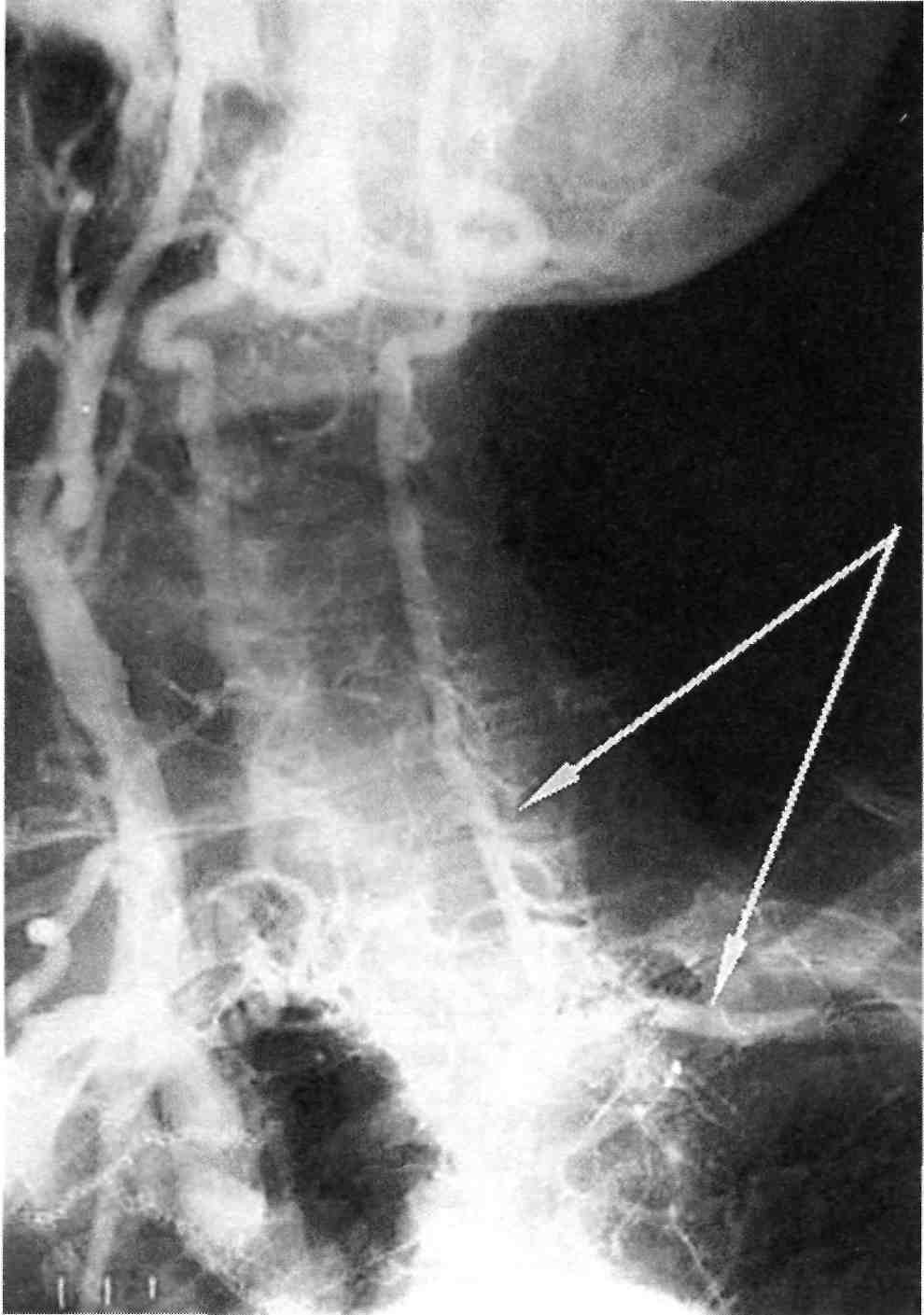
Рис. 2.38. Синдром позвоночно-под- ключичного обкрадывания. Стрелками обозначено ретроградное контрастиро- вание левой позвоночной артерии и контрастирование второго сегмента подключичной артерии.
частоте поражения занимают сте- ноз или окклюзия бифуркации об- щей сонной артерии с переходом на начальный сегмент внутренней сонной артерии и устье наружной сонной артерии.
Для правильной и полной ангио- графической оценки состояния брахиоцефальных артерий, пора- женных атеросклерозом, необходи- мо учитывать, что стенозы арте- рий, возникающие в местах разви- тия атеросклеротических бляшек, продолжают прогрессировать лока- льно, приводя к окклюзии артерии. При этом дистальные отделы дан- ной артерии могут оставаться про- ходимыми благодаря коллатераль- ному кровотоку, нередко ретро- градному, с синдромом обкрадыва-
ния соседних сосудистых бассей- нов. Так, при окклюзии брахиоце- фального ствола могут быть прохо- димыми подключичная, общая сонная и позвоночная артерии, а при окклюзии левой подключич- ной артерии чаще всего сохраняет- ся проходимость второго и третье- го сегментов артерии и дистально- го русла верхней левой конечно- сти, нередко за счет ретроградного кровоснабжения через ипсилатера- льную позвоночную артерию, ко- торая в свою очередь получает кро- воток через анастомозы виллизиева круга из бассейна контралатераль- ных брахиоцефальных артерий (рис. 2.38).
При окклюзии внутренней сон- ной артерии, как правило, тромби- руется весь сегмент артерии вплоть до интракраниальной ее части, включая сифон. Исключение со- ставляют только те случаи, когда от внутренней сонной артерии в ее шейном отделе отходит ветвь. Тогда благодаря коллатеральному крово- снабжению тромбоз распространя- ется только до этой ветви.
Сопоставление клинических и ангиографических данных показа- ло, что важными моментами в оценке функционирования голов- ного мозга являются оценка колла- терального кровотока по восходя- щим артериальным ветвям сосудов шеи и функциональная значимость клинических проявлений при синд- роме обкрадывания головного моз- га.
Диагностика поражений брахио- цефальных сосудов при аортоарте- риите. Морфологической особенно- стью поражения сосудистой стенки при аортоартериите является ее значительное утолщение на боль- шом протяжении. Поэтому харак- терными ангиографическими при- знаками для этого заболевания яв- ляются протяженные симметрич- ные стенозы дистальных отделов подключичных артерий, общих сонных артерий. Для аортоартерии-
198
та нехарактерно поражение внут- ренних сонных артерий (рис. 2.39). У больных аортоартериитом, как правило, приходится выполнять панаортографию для оценки степе- ни поражения артерий других ана- томических областей. По нашим данным, только у 46 % больных имелись изолированные поражения ветвей дуги аорты. В остальных случаях наблюдались сочетанные поражения брахиоцефальных арте- рий с другими артериальными бас- сейнами.
Диагностика аневризм грудной аорты. Рентгенологическое, эхокар- диографическое, КТ, МР-обследо- вание у большинства больных дает возможность диагностировать анев- ризму грудной аорты. Несмотря на это, нередко окончательный диа- гноз (локализация и протяженность аневризмы, наличие и распростра- ненность диссекции, участки фене- страции) может быть установлен лишь после рентгеноконтрастной аортографии. В особенности это касается таких анатомически слож- ных областей, как дуга аорты и устья брахиоцефальных артерий, участок брюшной аорты в зоне от- хождения висцеральных и почеч- ных артерий.
Доступом для проведения этого исследования могут служить бед- ренные артерии или правые плече- вая и подмышечная артерии. С раз- витием ДСА в последние годы все чаще стали применять малые арте- риальные доступы через правую локтевую и лучевую артерии. В по- следнем случае используют катетер 5 F. Конец катетера устанавливают в средней трети восходящей аорты. Аортографию выполняют в двух проекциях — прямой и левой косой или боковой для более полной оценки всех отделов грудной аорты и состояния устьев брахиоцефаль- ных сосудов.
Аневризматические изменения начального отдела аорты — синусов Вальсальвы и восходящей аорты
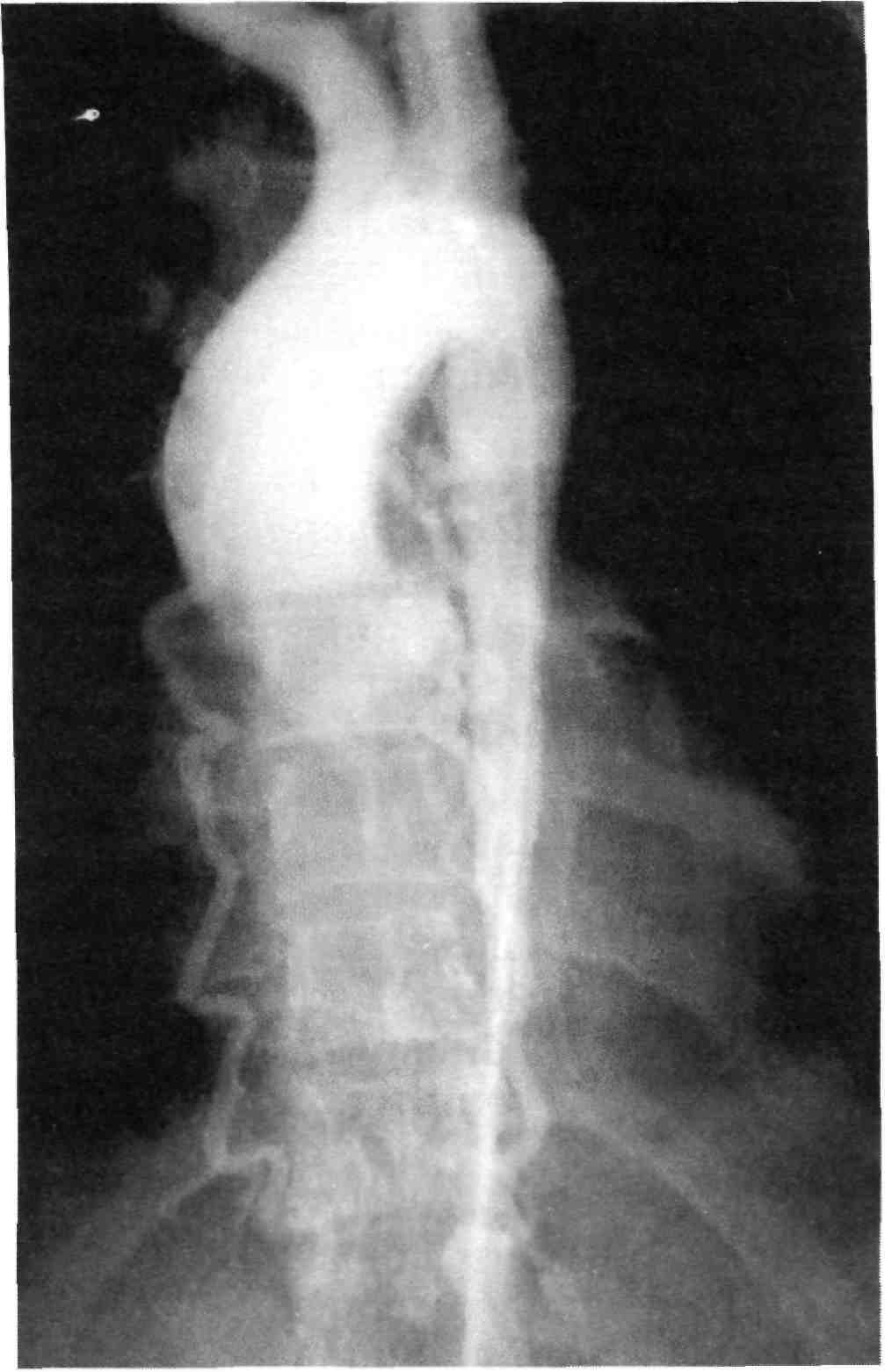
Рис. 2.39. Аортография при неспеци- фическом аортоартериите.
чаще связаны с системными врож- денными заболеваниями, проявля- ющимися дегенерацией соедините- льной ткани (синдромы Марфана, Эйлера, миксоматозной эктазии аортального кольца). При этом на ангиограммах расширение аорты начинается практически от фиброз- ного кольца аортального клапана и нет типичного сужения между си- нусами Вальсальвы и восходящим отделом. В большинстве наблюде- ний можно зарегистрировать регур- гитацию струи контрастного веще- ства из корня аорты в полость лево- го желудочка, что свидетельствует о недостаточности аортального кла- пана.
При атеросклеротической анев- ризме восходящего отдела аорты отмечается значительное тотальное увеличение поперечника аорты (до
199
6—8 см) в области аневризмы с преимущественным увеличением аорты вправо и постепенным суже- нием по направлению к плечего- ловному стволу. При этом обычно виден нормальный размер синусов Вальсальвы и дуги аорты. Функция аортального клапана, как правило, не нарушена.
Для микотических, сифилитиче- ских и других инфекционных аорти- тов более характерно формирова- ние мешковидных аневризм, кото- рые обычно располагаются в сред- ней и дистальной трети восходящей аорты, не захватывая синусов Валь- сальвы. Основание аневризмы — шейка чаще широкая и может быть отчетливо выявлена при аортогра- фии. Неравномерное контрастиро- вание полости аневризмы свидете- льствует о ее пристеночном тром- бозе.
При аневризмах дуги аорты в процесс обычно вовлечены устья брахиоцефальных сосудов. Анев- ризма дуги аорты чаще всего вызва- на инфекционным аортитом, поэ- тому, как правило, имеет мешко- видный характер. Однако шейку аневризмы ангиографическими ме- тодами обнаружить трудно. Приме- нение спиральной КТ с контраст- ным усилением или МРТ позволяет выполнить мультипланарную или трехмерную реконструкцию дуги аорты.
Аневризмы нисходящей части грудной аорты обычно начинаются на 2—4 см ниже левой подключич- ной артерии. При аортографии так- же необходимо производить съемку в двух проекциях. Данные аорто- графии следует сопоставлять с ре- зультатами трансэзофагеальной ЭхоКГ, КТ, МРТ. Это связано с тем, что аневризмы данной локали- зации часто подвергаются присте- ночному тромбозу и ангиографиче- ские размеры ее полости не соот- ветствуют истинным. Кроме трав- матических и послеоперационных, здесь часто наблюдаются и атероск-
200
леротические аневризмы. Однако в некоторых (до 3 %) случаях в каче- стве этиологического фактора анев- ризм этой локализации может вы- ступать и неспецифический аор- тоартериит. Торакоабдоминальные аневризмы обычно носят более рас- пространенный характер. Аневриз- матическое расширение в этом слу- чае начинается со среднего сегмен- та нисходящей аорты и захватывает проксимальный сегмент брюшной аорты в области отхождения почеч- ных и висцеральных артерий. Анев- ризма оканчивается чаще всего в инфраренальном отделе. При тора- коабдоминальных аневризмах аор- тография обязательно должна про- изводиться в двух проекциях для выяснения состояния начальных сегментов висцеральных артерий (рис. 2.40).
Диагностика расслаивающих
аневризм аорты. При подозрении на расслаивающую аневризму аорты ангиографическое исследование помогает уточнить протяженность ложного просвета аорты, обнару- жить фенестрации аневризматиче- ского мешка и оценить состояние устьев брахиоцефальных и висцера- льных ветвей аорты. Ангиографиче- скому исследованию должны пред- шествовать менее инвазивные ме- тоды диагностики — УЗИ, КТ, МРТ.
Риск ангиографического иссле- дования при расслаивающей анев- ризме аорты повышен из-за опас- ности введения контрастного веще- ства в ложный просвет аорты и до- полнительных повреждений стенок аневризматического мешка. Поэто- му независимо от доступа в артери- альное русло, который может быть как бедренным, так и подмышеч- ным, плечевым, локтевым, манипу- ляции катетером в просвете аорты следует выполнять с особой осто- рожностью. Перед аортографией следует убедиться в правильном по- ложении катетера — в истинном просвете аорты. Для этого при бед-
ренном доступе следует провести конец катетера Pig tail до корня аорты и в полость левого желудоч- ка, а затем установить его в требуе- мом сегменте аорты. При брахиаль- ном доступе следует провести кате- тер Pig tail через грудную аорту в область наружных подвздошных ар- терий, а затем вернуть его в иссле- дуемый сегмент аорты.
Аортографию обязательно про- водят в двух проекциях. При тора- коабдоминальных аневризмах про- изводят панаортографию — иссле- дование всех отделов аорты. При анализе ангиограмм следует обра- щать внимание на главный при- знак расслаивающей аневризмы — двойной контур аорты. При этом истинный просвет аорты чаще все- го уже ложного и расположен ме- диально (рис. 2.41). Ложный про- свет аорты неравномерно расши- рен, извит, может быть неравно- мерно контрастирован. При пора- жении абдоминального отдела аор- ты часто выявляются отрывы по-
чечных артерий от истинного про- света аорты с заполнением контра- стом из ложного просвета. Около 4 % расслаивающих аневризм тора- коабдоминальной локализации мо- жет распространяться на под- вздошные артерии. Это требует бо- лее распространенного ангиогра- фического обследования, включа- ющего артерии таза.
Диагностика окклюзионных забо- леваний брюшной аорты. Ангиогра- фическая семиотика окклюзионно- стенотических поражений брюш- ной аорты определяется морфоло- гией и локализацией процесса в ее стенке. Наиболее частыми приоб- ретенными заболеваниями этой ло- кализации являются атеросклероз и неспецифический аортоартериит; врожденными — гипоплазия и фиб- розно-мышечная дисплазия.
Для атеросклеротического пора- жения брюшной аорты типична ло- кализация дистальнее почечных артерий. Атеросклеротические из- менения в аортоподвздошном сег-
201
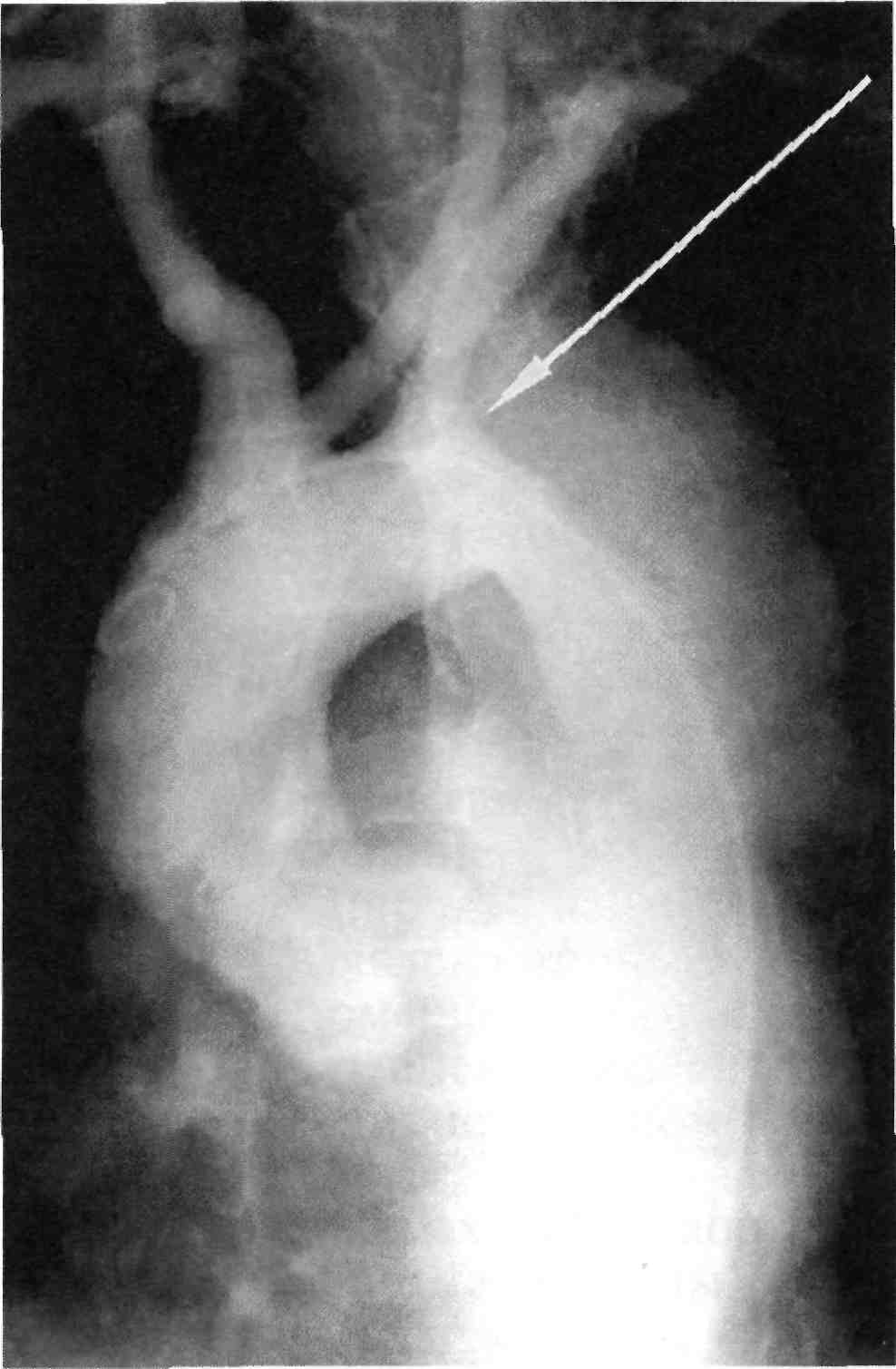

Рис. 2.42. Атеросклеротическое пора- жение абдоминального отдела аорты (верхняя стрелка) и подвздошных арте- рий (нижние стрелка).
Рис. 2.41. Расслаивающая аневризма грудной аорты. Стрелкой указана про- ксимальная фенестрация.
менте обычно имеют типичную картину: бляшки чаще всего распо- лагаются по задней стенке аорты и подвздошных артерий. Наиболее часто повреждается бифуркация брюшной аорты. Подвздошные ар- терии страдают чаще в месте от- хождения внутренней подвздошной артерии. Это обязательно надо иметь в виду при планировании объема и протяженности ангиогра- фического исследования — от ин- терренального отдела брюшной аорты до подколенных артерий — и при интерпретации ангиогра- фической картины. Для развития атеросклеротического поражения стенки аорты и ее ветвей характер- но несколько стадий. Наиболее ранними признаками являются уд- линение и изогнутость брюшной аорты и подвздошных артерий, не-
редко с S-образным искривлением последних. Другими ранними при- знаками атеросклероза являются уменьшение степени контрастиро- вания по краю сосудов и появле- ние мелких краевых «дефектов на- полнения» (рис. 2.42).
Дальнейшее прогрессирование атеросклеротического процесса
приводит к появлению крупных краевых и центральных «дефектов наполнения»; контуры аорты и под- вздошных сосудов становятся не- ровными, изломанными, фестонча- тыми.
При далеко зашедшем атероскле- розе выявляется перерыв тени сосу- да — окклюзия, которая может быть ограниченной (сегментарная) и распространенной. Для окклюзии характерно наличие культи пора- женного сосуда, форма которой мо- жет быть весьма разнообразной. Для окклюзии брюшной аорты ха- рактерны цилиндрическая и кони- ческая культя; для окклюзии общей подвздошной артерии — кониче-
202
:

1 — окклюзия левой почеч- ной артерии; 2 — критиче- ский стеноз правой почеч- ной артерии; 3 — верхняя брыжеечная артерия.
ская культя и культя в форме косо- го среза; при окклюзии наружной подвздошной артерии встречается только коническая культя.
Важным признаком того, что данный перерыв тени контрастиро- ванного сосуда является истинной культей, служит наличие расширен- ных коллатеральных сосудов, отхо- дящих от участков артериального ствола, расположенных выше обла- сти перерыва. Изолированные ок- клюзии артериальных сосудов — явление довольно редкое. Чаще имеются сочетанные поражения аорты, подвздошных и бедренных артерий и их ветвей (рис. 2.43).
Важным косвенным признаком атеросклеротического поражения аорты и ее ветвей является кальци- ноз стенок сосудов. Однако нет прямого параллелизма между степе- нью и распространенностью каль- цинирования сосудистых стенок и сужением или окклюзией их про- света.
При анализе ангиограмм следует различать стенотические пораже- ния брюшной аорты и односторон- нее стенозирование или окклюзию подвздошных артерий и поражение бифуркации брюшной аорты и обе- их подвздошных артерий — синд- ром Лериша. При этом очень важна
оценка путей коллатерального кро- вообращения.
При высоких окклюзиях брюш- ной аорты (выше уровня нижней брыжеечной артерии) артерии таза контрастируются путем окольного кровоснабжения через систему вис- церальных коллатералей: верхней брыжеечной артерии и ее связи с ветвями нижней брыжеечной арте- рии (межартериальная дуга Риола- на), которые в свою очередь связа- ны с a.hypogastrica. Ветви послед- ней анастомозируют с ветвями бед- ренной артерии и глубокой артерии бедра (рис. 2.44).
При низкой окклюзии аорты (ниже нижней брыжеечной артерии) в окольном кровоснабжении участ- вуют как висцеральные, так и пари- етальные коллатерали. Основными путями являются ветви нижней брыжеечной артерии и их связи с артериальным сплетением вокруг прямой кишки, а также поясничные артерии и их связи с a.hypogastrica.
В описании окклюзионно-стено- тических поражений артерий таза следует обязательно указывать сте- пень поражения общих подвздош- ных артерий, отдельно степень по- ражения внутренних подвздошных артерий и состояние дистального сосудистого русла (наружная под-
203
 Рис.
2.44. Низкая окклю-
зия абдоминального
отде-
ла аорты.
Рис.
2.44. Низкая окклю-
зия абдоминального
отде-
ла аорты.
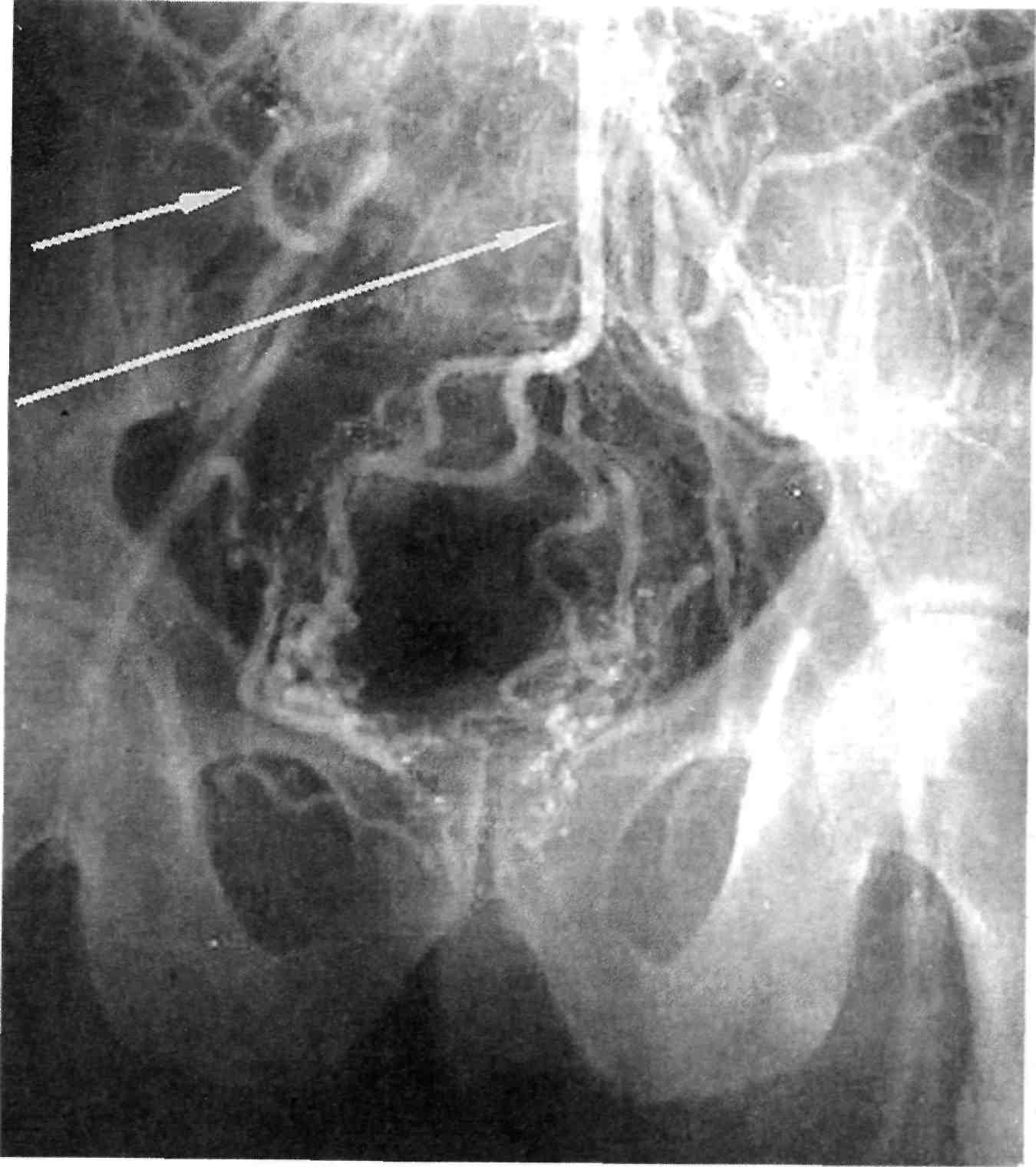
204
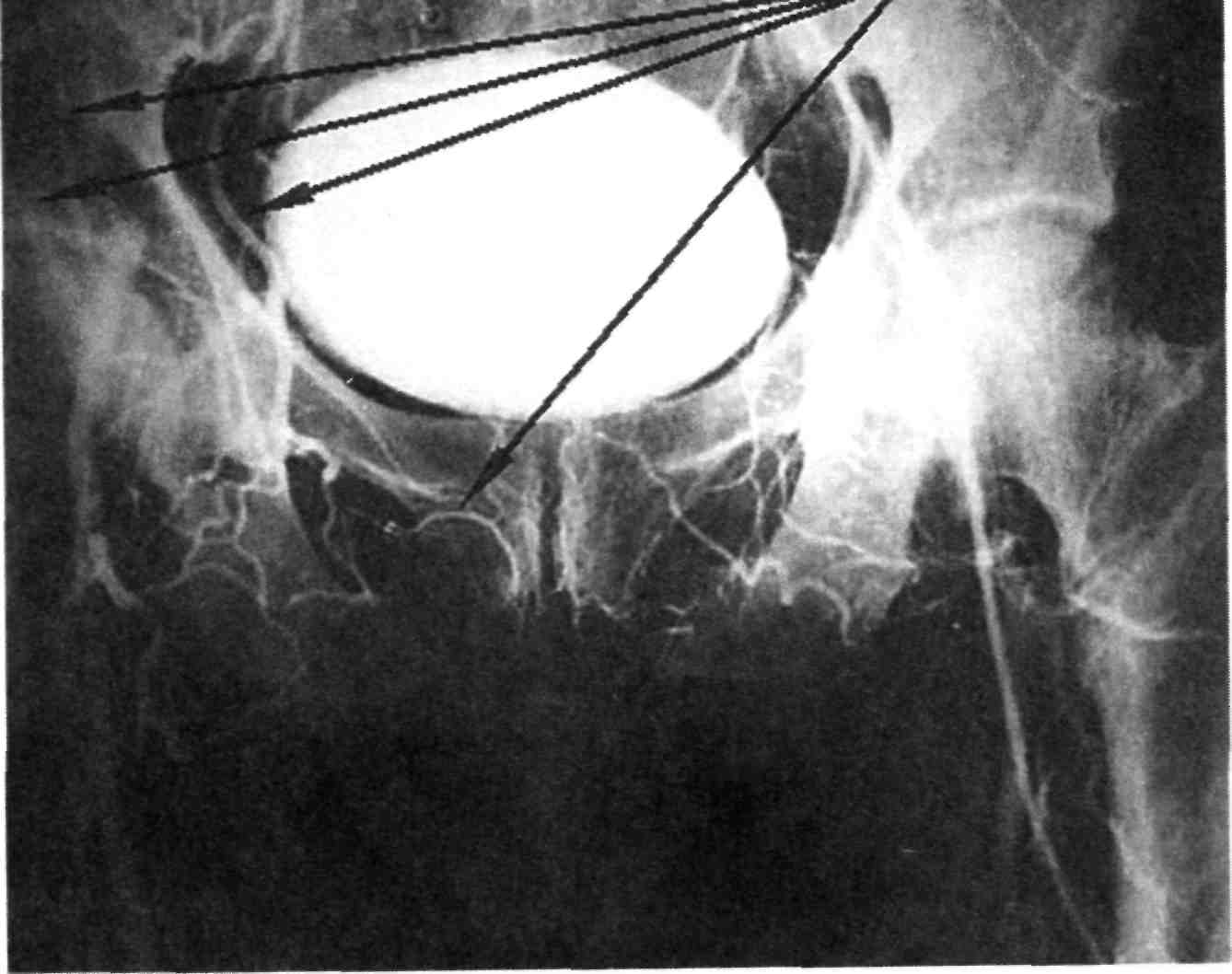
вздошная, бедренная, подколенная артерия и сосуды голени).
При окклюзии общей подвздош- ной артерии коллатерали близки к тем, которые формируются при за- купорке брюшной аорты. Однако здесь большее значение имеют па- риетальные пути кровоснабже- ния — поясничные артерии и их анастомозы; в меньшей степени — система нижней брыжеечной арте- рии (рис. 2.45).
При закупорке наружной под- вздошной артерии основной колла- теральной магистралью является a.hypogastrica, ветви которой ана- стомозируют с ветвями бедренной артерии и глубокой артерии бедра (рис. 2.46).
При окклюзии бедренной арте- рии в ее верхней и средней третях очень важна оценка проходимости глубокой артерии бедра как основ- ной коллатерали. Принято считать, что если, по ангиографическим данным, глубокая артерия проходи- ма до второй перфорантной ветви, она пригодна для аортобедренной реконструкции (рис. 2.47).
При сегментарной окклюзии бед- ренной артерии в области гунтерова
канала основную роль коллатералеи играют мышечные ветви, отходя- щие от артерии выше места окклю- зии. При закупорке подколенной артерии важное значение имеют анастомозы между верхними и нижними артериями коленного су- става (рис. 2.48).
В целом следует подчеркнуть, что даже на сегодняшний день, несмот- ря на успешное развитие новейших диагностических методик оценки динамики кровоснабжения по ма- гистральным артериям конечно- стей, только ангиография дает воз- можность наиболее точной и все- сторонней оценки коллатерального русла, развивающегося при окклю- зивных поражениях артерий таза и нижних конечностей.
При неспецифическом аортоар- териите в обязательном поряд- ке производят двухпроекционное ангиографическое исследование брюшной аорты. Оно позволяет об- наружить основные отличия макро- морфологических поражений аорты и ее ветвей от атеросклеротических поражений. Для атеросклероза ха- рактерны более частое поражение брюшной аорты и наличие локаль-
205

ных дефектов контрастирования на месте атеросклеротических бляшек. При аортоартериите сужение про- света аорты имеет большую протя- женность, а локализация пораже- ния отличается от таковой при ате- росклерозе. «Излюбленные» места поражения при аортоартериите -
торакоабдоминальный отдел аорты, сонные артерии и дистальные сег- менты подключичных артерий. При поражении аортоартериитом брюш- ной аорты обычно вовлечены в процесс устья чревной и верхней брыжечной артерий. Ни при каком другом окклюзионном процессе

Рис. 2.48. Окклюзия нижней трети поверхностной бедренной артерии и подколен- ной артерии (пути коллатерального кровоснабжения конечности).
206
коллатерали (дуга Риолана) не бы- вают так развиты, как при аортоар- териите (рис. 2.49).
При стенозе чревной артерии от- мечается превышение диаметра об- щей печеночной артерии над селе- зеночной за счет перераспределе- ния кровотока (в норме, наоборот, диаметр селезеночной артерии бо- льше). При полной окклюзии чрев- ной артерии нет прямого контра- стирования. Контраст заполняет ее после ветвей верхней брыжеечной артерии через поджелудочно-две- надцатиперстные и желудочно-две- надцатиперстные артерии. Выявить это можно при селективной мезен- терикографии.
Стеноз верхней брыжеечной ар- терии выявляется только в боковой проекции, так как обычно сужение располагается на протяжении пер- вых двух сантиметров от устья. Для поражения верхней брыжечной ар- терии характерны расширение ниж- ней брыжеечной артерии и дуги Ри- олана. При этом последовательная оценка всех кадров серии ангио- грамм позволяет заметить, что кро- воток по дуге Риолана идет в кра- ниальном направлении, и сначала контрастируется нижняя, затем верхняя брыжеечная артерия. Ре- же выявляется чревно-брыжеечный анастомоз, по которому контраст движется в каудальном направле- нии. Выявить это можно при селек- тивной целиакографии.
При окклюзии нижней брыжееч- ной артерии ее контрастирование происходит за счет дуги Риолана, которая функционирует в данном случае в каудальном направлении. Кроме того, может выявляться рек- тально-брыжеечный анастомоз.
При сочетанном поражении чревной и верхней брыжеечной ар- терий весь кровоток идет в краниа- льном направлении через нижнюю брыжеечную артерию и дугу Риола- на.
Для атеросклероза типична узкая длинная дуга Риолана. Для аортоар-
Рис. 2.49. Аортография при аортоарте- риите. Абдоминальный отдел аорты и подвздошные артерии, выраженная дуга Риолана.
териита, наоборот, характерна ши- рокая и короткая дуга Риолана. По особенностям строения дуги Риола- на часто можно судить об этиоло- гии поражения.
Ангиографическая диагностика облитерирующего тромбангиита
основана на обнаружении двусто- ронних симметричных сегментар- ных периферических окклюзии в области голеней и стоп. Нередко можно обнаружить более протя- женные участки окклюзии артерий, которые окружены множественны- ми извитыми мелкими коллатера- лями, повторяющими ход окклюзи- рованных сосудов — vasa vasorum. Это довольно типичный признак для поражения артерий тромбанги- итом. При этом обычное коллатера- льное кровоснабжение через глубо- кую артерию бедра или ветви бед-
207
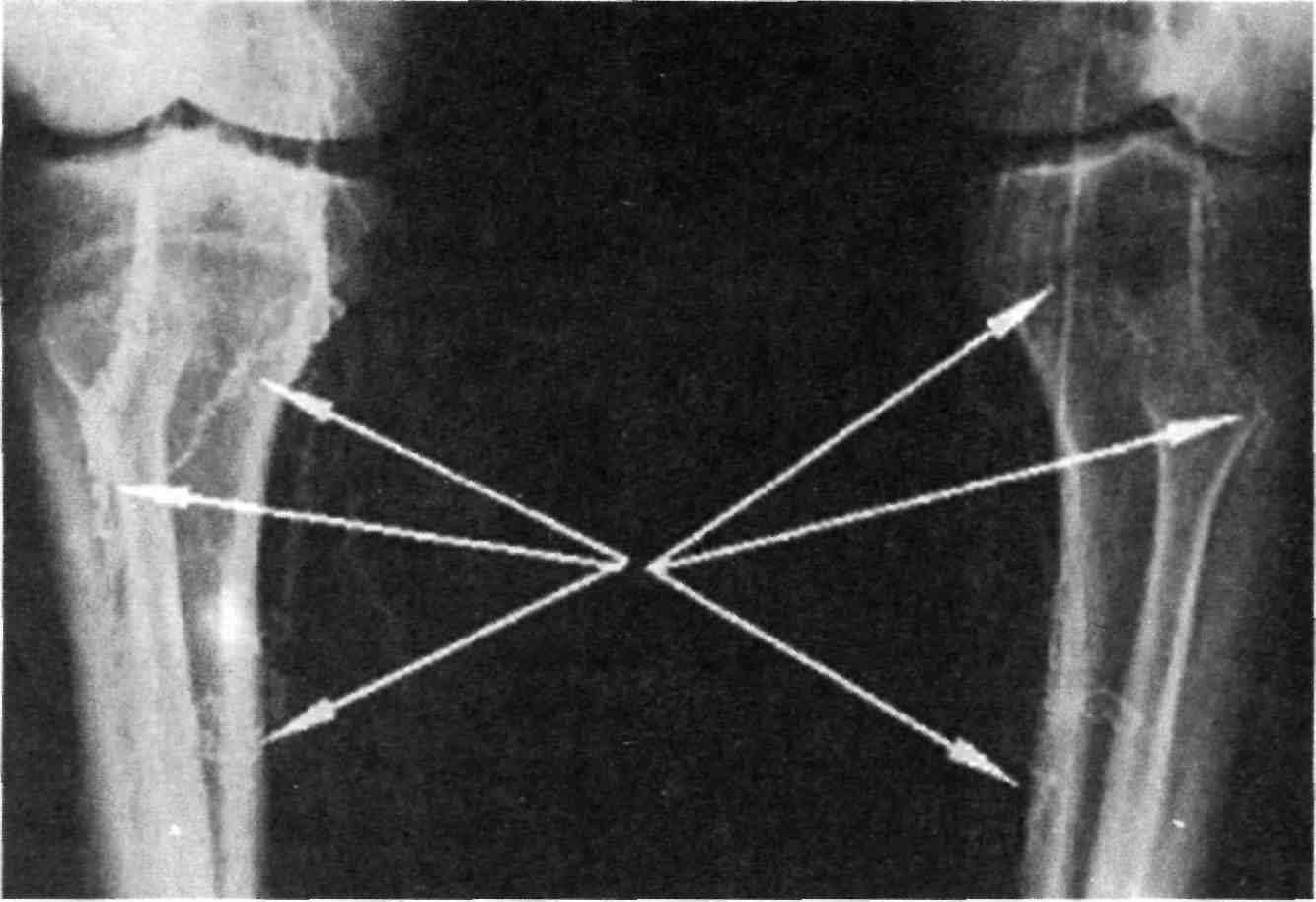
ренной артерии, артерии, огибаю- щие коленный сустав, как правило, неэффективно из-за поражения этих сосудов и их более мелких вет- вей (рис. 2.50).
При облитерирующем тромбан- гиите формируется ряд характер- ных для этого заболевания призна- ков: симметричные равномерные протяженные сужения артерий, за- нимающие целые сегменты конеч- ностей (бедренные артерии, арте- рии голени); форма культи артерий коническая. Это происходит при неизмененном просвете более крупных магистралей без пораже- ния стенки аорты, подвздошных артерий.
Принято выделять 5 форм ангио- графической картины заболевания, которые приблизительно соответст- вуют стадиям клинического тече- ния тромбангиита.
Первая стадия — магистральные артерии проходимы, в дистальных отделах сужены (спазмированы), много извитых коллатералей.
Вторая стадия — окклюзия основных артерий голени при про- ходимых бедренной и подколенной артериях с развитыми коллатера- лями.
Третья стадия — стенозирование сегментов бедренной или подко-
ленной артерии с развитой сетью коллатералей.
Четвертая стадия — окклюзия бедренной артерии с извитыми эф- фективными коллатералями.
Пятая стадия — проксимальный блок на уровне бедренной артерии и дистальный блок на уровне арте- рий голени с недостаточными кол- латералями.
