
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (3)
.pdf
Российская
гастроэнтерологическая
ассоциация Российское общество по изучению печени
Учредитель:
Российская гастроэнтерологическая ассоциация.
Периодичность издания:
1 раз в 2 месяца.
Тираж 3000 экз.
Подписной индекс 73538.
Журнал зарегистрирован Комитетом РФ по печати 15.12.1994 г. (Регистрационный № 013128).
Founder: Russian Gastroenterological
Association.
Published bimonthly.
Circulation 3000 copies.
Subscription No 73538.
The journal is registered by the Press Committee of Russian Federation on December 15, 1994. (Reg. No. 013128).
119881, ГСП-3, Москва, ул. Погодинская, 5, кафедра
пропедевтики внутренних болезней Московской медицинской академии,
“Российский журнал гастроэнтерологии, гепатологии, колопроктологии”.
“Russian Journal of Gastroenterology, Hepatology, Coloproctology”,
The Propaedeutics Chair of Internal Medicine, The Moscow Medical Academy, Pogodinskaya ul., 5, Moscow, 119881, GSP-3, Russia.
Российский журнал Гастроэнтерологии, Гепатологии, Колопроктологии
Научно практический журнал
π 5 |
X |
2000 |
|
Издательский дом «М-Вести»

Состав редакционной коллегии и редакционного совета журнала
Главный редактор:
В.Т.Ивашкин
Редакционная коллегия:
Е.К.Баранская
С.А.Булгаков
Г.И.Воробьев
П.Я.Григорьев А.В.Калинин (зам. главного редактора) З.А.Лемешко А.С.Логинов А.Ф.Логинов И.В.Маев М.В.Маевская А.М.Ногаллер Ю.М.Панцырев А.И.Парфенов
Г.Г.Пискунов (ответственный секретарь) Л.М.Портной С.И.Рапопорт В.В.Серов Ю.В.Тельных А.С.Трухманов А.И.Хазанов С.А.Чернякевич
А.А.Шептулин (зам. главного редактора)
Редакционный совет:
З.Г.Апросина |
Москва |
В.М.Арутюнян |
Ереван |
О.Я.Бабак |
Харьков |
Э.Г.Григорян |
Ереван |
А.К.Ерамишанцев |
Москва |
Е.И.Зайцева |
Смоленск |
А.Р.Златкина |
Москва |
А.И.Ирнюс |
Вильнюс |
Б.В.Киркин |
Москва |
Г.Ф.Коротько |
Краснодар |
С.А.Курилович |
Новосибирск |
В.А.Максимов |
Москва |
Ю.Х.Мараховский |
Минск |
Г.А.Минасян |
Ереван |
О.Н.Минушкин |
Москва |
В.С.Моисеев |
Москва |
И.А.Морозов |
Москва |
Л.К.Пархоменко |
Харьков |
С.Д.Подымова |
Москва |
Т.С.Попова |
Москва |
Л.В.Прохорова |
Екатеринбург |
Е.И.Ткаченко |
Санкт-Петербург |
И.Л.Халиф |
Москва |
Г.В.Цодиков |
Москва |
А.В.Шапошников |
Ростов-на-Дону |
Editor-in-chief:
V.T.Ivashkin
Editorial board:
Ye.K.Baranskaya
S.A.Bulgakov
G.I.Vorobiev
P.Ya.Grigoriev
A.V.Kalinin (deputy editor-in-chief) Z.A.Lemeshko
A.S.Loginov
A.F.Loginov
I.V.Mayev
M.V.Mayevskaya
A.M.Nogaller
Yu.M.Pantsyrev
A.I.Parfyenov
G.G.Piskunov (senior contributing editor) L.M.Portnoy
S.I.Rapoport
V.V.Serov
Yu.V.Tel’nykh
A.S.Troukhmanov
A.I.Khazanov
S.A.Chernyakevich
A.A.Sheptulin (deputy editor-in-chief)
Editorial council:
Z.G.Aprosina |
Moscow |
V.M.Arutyunyan |
Yerevan |
O.Ya.Babak |
Kharkov |
E.G.Grigoryan |
Yerevan |
A.K.Yeramishantsev |
Moscow |
Ye.I.Zaytseva |
Smolensk |
A.R.Zlatkina |
Moscow |
A.I.Irnyus |
Vilnius |
B.V.Kirkin |
Moscow |
G.F.Korot’ko |
Krasnodar |
S.A.Kurilovich |
Novosibirsk |
V.A.Maximov |
Moscow |
Yu.Kh.Marakhovsky |
Minsk |
G.A.Minasyan |
Yerevan |
O.N.Minushkin |
Moscow |
V.S.Moiseev |
Moscow |
I.A.Morozov |
Moscow |
L.K.Parkhomenko |
Kharkov |
S.D.Podymova |
Moscow |
T.S.Popova |
Moscow |
L.V.Prokhorova |
Yekaterinburg |
Ye.I.Tkachenko |
Saint-Petersburg |
I.L.Khalif |
Moscow |
G.V.Tsodikov |
Moscow |
A.V.Shaposhnikov |
Rostov-on-Don |
Ивашкин В.Т., Маммаев С.Н., Буеверов А.О., 7 Шульпекова Ю.О., Маевская М.В., Галимова С.Ф.
Механизмы иммунного "ускользания" при вирусных гепатитах
Ющук Н.Д., Бродов Л.Е.
13Дифференциальная диагностика и лечение острых кишечных инфекций
Секачева М.И.
16Роль бактериальных токсинов и инвазивных бактерий в патогенезе болезней желудочно-кишечного тракта
Маевская М.В.
21Применение лактулозы в клинической практике: механизмы действия и показания
Гейвандова Н.И., Ягода А.В., Хубиев Ш.М.
26Влияние реаферона на продукцию фактора некроза опухоли α мононуклеарами у больных хроническими вирусными гепатитами
Маммаев С.Н., Шульпекова Ю.О., Левина А.А.,
30Лукина Е.А., Ивашкин В.Т.
Содержание провоспалительных цитокинов и факторов роста в сыворотке крови больных хроническими вирусными гепатитами и циррозом печени
Синяченко О.В., Казаков В.Н., Губергриц Н.Б.,
35Череватская Е.Ю., Пизон У., Миллер Р., Файнерман В.Б., Томаш О.В.
Динамическое поверхностное натяжение крови у больных хроническими гепатитами
Осадчук М.А., Кашкина Е.И.
39Динамика формирования этиологических форм хронического панкреатита
Каримов Х.Я., Усманов М.М., Рахимов К.Р.
43Полостное и мембранное пищеварение и всасывание углеводов при экспериментальной язве двенадцатиперстной кишки
Ивашкин В.Т., Трухманов А.С., Ивашкина Н.Ю.
47Эффективность нового ингибитора протонной помпы париета при лечении гастроэзофагеальной рефлюксной болезни
Старостин Б.Д.
50Фармакоэкономические аспекты лечения гастроэзофагеальной рефлюксной болезни
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
5/2000 |
3 |

Субботин В.М., Давидов М.И., Абдрашитов Р.Р., Файнштейн А.В.
Кишечные камни
Ардатская М.Д., Минушкин О.Н., Прихно Н.И., Дубинин А.В.
63Летучие жирные кислоты и их диагностическое и прогностическое значение в гастроэнтерологической клинике
70 |
Маев И.В., Черемушкин С.В., Лебедева Е.Г. |
|
Синдром раздраженного кишечника |
||
|
Махов В.М.
76Хронический алкогольный панкреатит: имеются ли основания для выделения его в отдельную рубрику?
Калинин А.П.
79Оперативное лечение нейроэндокринных опухолей поджелудочной железы
Лапина Т.Л., Зольникова О.Ю., Ивашкин В.Т., Напалкова Н.Н.,
85Трухманов А.С., Коньков М.Ю., Пономарев А.Б.
Острая лекарственная язва пищевода: быстрое заживление на фоне лечения лансофедом
Бурков С.Г., Бурдина Е.Г., Гурова Н.Ю., Кутасова Т.П.,
87Свирчев В.В., Шипилова Т.Ю.
Редкий случай аденокарциномы тощей кишки
Российский журнал
4 |
5/2000 |
гастроэнтерологии, гепатологии, колопроктологии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
Ivashkin V.T., Mammayev S.N., Buyeverov A.O., |
|||||
|
|
|
|
|
|
|
|
Mechanisms of immune “escape" at viral hepatites |
|||||
13 |
Yuschuk N.D., Brodov L.Ye. |
|||||
Differential diagnostics and treatment of acute intestinal infections |
||||||
Sekacheva M.I.
16The role of bacterial toxins and invasive bacteria in pathogenesis of gastro-intestinal diseases
Mayevskaya M.V.
21The application of lactulose in clinical practice: mechanisms of action and indications
Geyvandova N.I., Yagoda A.V., Khubiyev Sh.M.
26Influence of reaferon on production of the tumor necrosis factor α by mononuclear cells in patients with chronic viral hepatites
Mammayev S.N., Shulpekova Yu.O., Levina A.A.,
30Lukina Ye.A., Ivashkin V.T.
Content of proinflammatory cytokines and growth factors in blood serum of the patients with chronic viral hepatites and liver cirrhosis
Sinyachenko O.V., Kazakov V.N., Gubergrits N.B.,
35Cherevatskaya Ye.Yu., Pizon U., Miller R., Finerman V.B., Tomash O.V.
Dynamic blood surface tension in patients with chronic hepatites
Osadchuk M.A., Kashkina Ye.I.
39Dynamics of development of different etiologic forms of chronic pancreatitis
Karimov Kh.Ya., Usmanov M.M., Rakhimov K.R.
43Luminal and membrane digestion and absorption of carbohydrates in experimental duodenal ulcer
Ivashkin V.T., Troukhmanov A.S., Ivashkina N.Yu.
47Efficacy of the new proton pump inhibitor – pariet in the treatment of gastroesophageal reflux disease
50 |
Starostin B.D. |
Pharmaco-economical aspects of gastroesophageal reflux disease treatment |
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
5/2000 |
5 |
56 |
Mayev I.V., Cheremushkin S.V., Lebedeva Ye.G. |
Irritable bowel syndrome |
Subbotin V.M., Davidov M.I., Abdrashitov R.R., Faynshtein A.V.
63Intestinal stones
Ardatskaya M.D., Minushkin O.N., Prikhno N.I., Dubinin A.V.
70Volatile fatty acids and their diagnostic and prognostic significance in gastroenterological practice
Makhov V. M.
76Chronic alcoholic pancreatitis: are there any reasons to define it as a separate class of disease?
79 |
Kalinin A.P. |
Surgical treatment of pancreatic neuroendocrine tumors |
Lapina T.L., Zol'nikova O.Yu., Ivashkin V.T., Napalkova N.N.,
85Troukhmanov A.S., Kon'kov M.Yu., Ponomarev A.B.
An acute drug-induced ulcer of the esophagus: fast healing at lansophed treatment
Bourkov S.G., Burdina Ye.G., Gurova N.Yu., Kutasova T.P.,
87Svirchev V.V., Shipilova T.Yu.
The rare case of jejunal adenocarcinoma
Российский журнал
6 |
5/2000 |
гастроэнтерологии, гепатологии, колопроктологии |

УДК [616.36-002:578.891]-092:612.017.1
МЕХАНИЗМЫ ИММУННОГО «УСКОЛЬЗАНИЯ» ПРИ ВИРУСНЫХ ГЕПАТИТАХ
В.Т. Ивашкин, С.Н. Маммаев, А.О. Буеверов, Ю.О. Шульпекова, М.В. Маевская, С.Ф. Галимова
(Клиника пропедевтики внутренних болезней Московской медицинской академии им. И.М. Сеченова)
Несмотря на постоянно расширяющийся объем знаний о причинах болезней печени, многие вопросы, касающиеся механизмов возникновения и прогресси-
рования этой патологии, остаются открытыми. Недостаточно изучены факторы, позволяющие
вирусам гепатита В (HBV) и гепатита С
(HCV) сохраняться в организме, и условия, влияющие на развитие хронических форм болезни. В связи с этим внимание исследователей все чаще обращается на взаимодействие вирусов и иммунной системы организма, которое предопределяет дальнейшее течение болезни.
Множество вирусов обусловливает развитие патологических процессов. При этом репликация вирусов обеспечивается жизнеспособностью клет- ки-хозяина. Однако внедрение вируса в клетку макроорганизма – это в первую очередь “сигнал опасности" [24], который приводит в состояние готовности врожденные и адаптивные иммунные механизмы, направленные на ограничение и элиминацию инфекции. Для обеспечения собственного выживания при формировании хронического воспаления вирусы должны использовать пути, которые позволяют им избежать действия защитных иммунных реакций организма.
Среди вирусов, способных вызывать поражение печени у человека, только HBV и HCV могут являться самостоятельными этиологическими факторами хронических заболеваний. Изучение механизмов, используемых HBV и HCV для “ускользания" от иммунного контроля организма, важно для разработки эффективных терапевтических мероприятий.
Представления о механизмах иммунного “ускользания" гепатотропных вирусов постоянно расширяются. В немалой степени это обусловлено изучением других возбудителей, способных вызывать повреждение печени у человека и животных, таких, как вирус Эпштейна–Барра (EBV), вирус иммунодефицита человека (ВИЧ) и вирус мышиного лимфоцитарного хориоменингита (LCMV).
ИММУННЫЙ ОТВЕТ И КЛИРЕНС ГЕПАТОТРОПНЫХ ВИРУСОВ
При острых HBV- и HCV-инфекциях мощный противовирусный ответ Т-лимфоцитов способствует элиминации вируса, в то время как при хроническом гепатите специфический ответ Т-лим- фоцитов слабый или отсутствует. Механизмы, ведущие к снижению эффективности Т-клеточного ответа при хроническом вирусном гепатите, будут обсуждены ниже.
Иммунные реакции при вирусной инфекции могут быть разделены на врожденные, обусловленные системой комплемента, мононуклеарными фагоцитами и естественными киллерами, и адаптивные, формирующиеся в процессе ответа на действие специфических антигенов. Врожденные факторы иммунитета служат базой включения адаптивной реакции лимфоцитов. Важнейшая особенность последней – избирательное вовлечение в иммунный ответ только тех лимфоцитов, которые несут рецепторы, распознающие антигены.
Нативный антиген распознается только иммуноглобулиновыми рецепторами В-лимфоцитов, которые продуцируют антитела. Т-лимфоциты распознают фрагменты антигена, встроенные в молекулы главного комплекса гистосовместимости – major histocompatibility complex (MHC).
Антигенный пептид должен презентироваться CD4+-лимфоцитам (Т-хелперам) в комплексе с молекулами MHC II класса. Эти молекулы экспрессируются лишь немногими популяциями клеток, которые облигатно или факультативно выполняют функции антигенпрезентирующих клеток (АПК). К ним относятся дендритные клетки, В-лимфоциты, активированные макрофаги и др. Пролиферация СD4+-лимфоцитов способствует выработке цитокинов, ответственных за формирование антигенспецифического клеточного и гуморального иммунитета.
СD8+-лимфоциты (Т-цитотоксические –
ЦТЛ) распознают антигенные пептиды, связан-
Российский журнал
гастроэнтерологии, гепатологии, колопроктологии |
5/2000 |
7 |

ные с молекулами MHC I класса. Поскольку они присутствуют практически на всех ядерных клетках организма, любая клетка, несущая молекулы MHC I класса в комплексе с антигенным пептидом, может активировать клон ЦТЛ. Биологической ролью данной активации является удаление мутантных или инфицированных вирусом клеток.
“НЕВИДИМЫЙ ВИРУС"
Вирусы могут “ускользать" от иммунного распознавания путем проникновения в области, недоступные для иммунокомпетентных клеток. HBV кодирует обратную транскриптазу, что позволяет ему интегрироваться в ДНК генома клет- ки-хозяина, избегая иммунного распознавания. HCV, генетическим материалом которого является РНК, не способен к подобной интеграции. Однако недавнее открытие комплементарной ДНК РНК-содержащего вируса LCMV [17, 49] позволяет предположить возможность использования данного механизма HCV.
Установлено, что HBV может реплицироваться во многих тканях организма. В частности, выявлена экспрессия HBsAg в почках и поджелудочной железе, где имеются микрососудистые барьеры, которых нет в печени, что может препятствовать распознаванию его цитотоксическими Т-лимфоцитами [8]. Хотя с проникновением HBV в другие органы и ткани не происходит иммунного цитолиза органов, это обеспечивает потенциальный резервуар вируса. При благоприятных условиях HBV может вновь “переселяться" в печень. Подобные механизмы могут использоваться и HCV, что отражает его тропизм и способность реплицироваться в клетках иммунной системы, включая моноциты/макрофаги и В-клетки, но, вероятно, не в Т-лимфоци- тах [20].
Другой механизм уклонения от иммунного распознания – потеря антигенности. Мутации в pre- core-области генома HBV могут обусловливать потерю экспрессии HBeAg. Это способствует маскировке одной из основных мишеней цитотоксического иммунного ответа [5, 6].
“УСКОЛЬЗАНИЕ" ОТ АНТИТЕЛ
Антитела, направленные против вирусных антигенов, приводят к иммунному клиренсу вирусов при многих инфекционных болезнях. При острой HBV-инфекции антитела, которые связываются с оболочечными антигенами HBV, включая HBsAg, способствуют элиминации возбудителя. Но ведущая роль в клиренсе вируса принадлежит Т-лимфоцитам.
С появлением штаммов HBV с мутациями в оболочечных генах иммунокомпетентные клетки утрачивают способность обнаруживать HBsAg. Это обстоятельство позволяет вирусу персистиро-
вать в организме, несмотря на наличие анти-HBs [12, 16, 32]. Антитела к HBeAg и HBсAg при HBV-инфекции как при острой, так и при хронической, по-видимому, не способны предотвратить инвазию вируса.
При HCV описаны мутации гена, кодирующего гипервариабельный оболочечный регион Е2 (кодирует антителосвязывающие домены). Данные мутации предотвращают образование антител к HCV, которые потенциально могут блокировать вирус и способствовать его клиренсу. Результаты экспериментов, полученные на шимпанзе, дают основание предположить наличие подобного механизма и у человека [44].
Антитела распознают антигенные эпитопы, представленные определенной последовательностью аминокислот. При ВИЧ-инфекции замена последовательности одной аминокислоты в эпитопе ведет к изменению формы оболочечного антигена, при которой теряется возможность распознавания последнего антителами [45]. Подобные последствия могут наблюдаться и при точечных мутациях определенных эпитопов оболочечных антигенов HBV и HCV.
НАРУШЕНИЕ ПРОЦЕССИНГА И ПРЕЗЕНТАЦИИ АНТИГЕНОВ
Пути связывания эндогенных и экзогенных антигенов и их представление Т-лимфоцитам хорошо известны. Т-лимфоциты способны распознавать лишь определенные фрагменты антигена. Это связано с особенностями специфического
Т-клеточного рецептора (ТКР): он распознает только антигенные детерминанты, встроенные в молекулы МНС.
Для включения реакций иммунитета недостаточно, чтобы антиген или его комплекс с молекулой МНС связался с рецепторами соответствующих клеток. Для развития полноценного иммунного ответа требуется установление определенных межклеточных взаимодействий. Главными участниками межклеточных взаимодействий являются АПК и Т-хелперы: АПК осуществляют обработку (процессинг) антигена и его представление (презентацию) Т-хелперам.
Суть процессов, осуществляемых АПК в отношении антигена, состоит в его поглощении, фрагментации и встраивании фрагментов в молекулу МНС. В результате образуется комплекс, распознаваемый ТКР (рис. 1). Специфическое распознавание осуществляется благодаря конформационному взаимодействию как между антигенными детерминантами и молекулой МНС, так и между ТКР и комплексом МНС – антиген.
Последовательное представление антигенных пептидов молекулам МНС зависит от взаимного расположения пептидов и молекул МНС, их конформационного взаимодействия с формированием стабильного комплекса и экспрессии комплек-
Российский журнал
8 |
5/2000 |
гастроэнтерологии, гепатологии, колопроктологии |
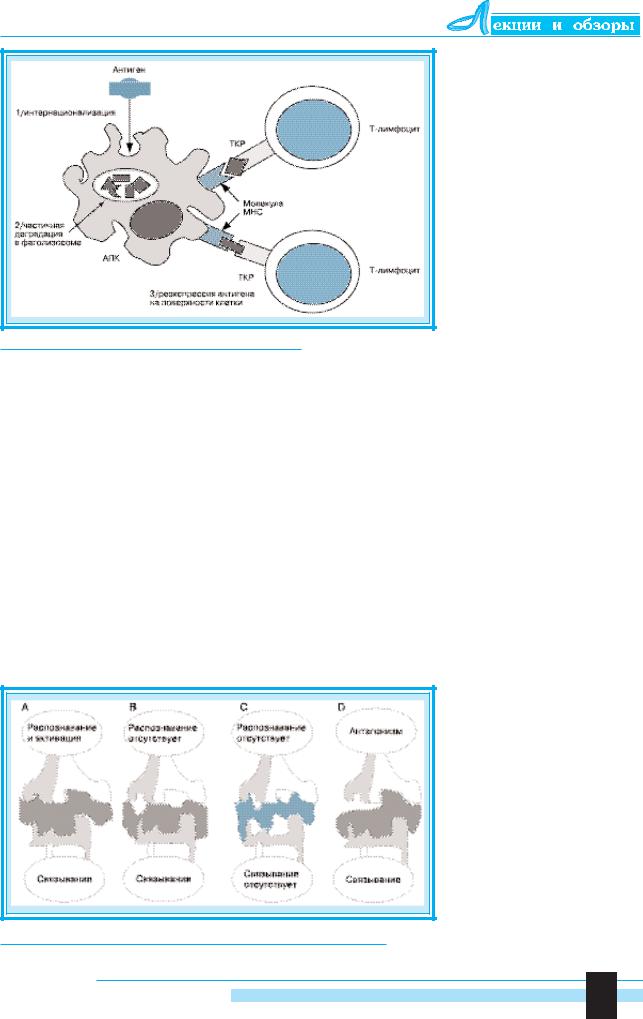
тид заполняет щель в молекуле МНС, что является структурной основой для презентации антигена.
Вариабельность остатков и, следовательно, конфигурации связывающей щели определяют разнообразие молекул МНС по их сродству к различным пептидам. Мутации аминокислот, составляющих антигенные детерминанты пептида, вероятно, препятствуют их связыванию с молекулами МНС за счет нарушения конфигурации щели. В результате утрачивается возможность распознавания данного комплекса Т-клетками.
Каждая аминокислота кодируется тремя кодонами нуклеиновых кислот. В результате ошибок при транскрипции гено-
ма вируса при последующих репликациях изменения нуклеиновых кислот вносятся в генетический код. Эти измененные коды могут нарушать структуру и функцию белков, необходимых для репликации вируса, что закономерно ведет к его гибели.
Однако встречаются также нелетальные мутации в эпитопах антигенов, при которых изменяется сродство последних к молекулам МНС и связывание данного антигена с щелью молекулы МНС. С потерей сродства антигенного пептида к молекулам МНС, вероятно, нарушается иммунное распознавание его Т-клетками. Генетические мутации, обеспечивающие возможность “ускользания" от иммунного ответа организма, обнаруживаются в HBV и HCV, использующих соответственно обратную транскриптазу и РНК-полиме- разу при транскрипции генома.
В отличие от ДНК-полимеразы данные ферменты функционально малоактивны, что обусловливает множество ошибок при транскрипции. Особенно это характерно для HCV, который использует РНК-полимера- зу не только для транскрипции, но также и для активной репликации, во время которой образуется большое количество ква-
зиштаммов [30].
Эти мутации названы мутациями иммунного “ускользания" [22, 31]. Они могут наблюдаться в трех вариантах (рис. 2). Во-первых, изменения в аминокислотных остатках антигенных пептидов в местах их фиксации могут приводить к нарушению контакта с щелью молекулы МНС (С). Во-вторых,
9

препятствовать Т-клеточному распознаванию могут изменения структуры ТКР (В). При третьем типе мутаций незначительно измененные пептидные лиганды способны связываться с молекулой МНС и ТКР. Однако это взаимодействие ведет не к активации Т-лимфоцитов, а к формированию иммунной толерантности – так называемому антагонизму (D).
Таким образом, мутации вирусов, результатом которых является потеря связи комплекса МНС
– пептид с ТКР в разных комбинациях, могут способствовать иммунному “ускользанию". Антагонизм ЦТЛ впервые описан для измененного пептидного лиганда ядерного белка HBV [4]. Антагонизм эпитопов HCV и цитотоксических Т-лимфоцитов описан у шимпанзе [46] и человека [7, 40]. Однако при изучении этого явления в популяции выявлено, что оно происходит нечасто [7]. Важность пептидного антагонизма как способа иммунного “ускользания" еще предстоит установить.
НАРУШЕНИЕ ФУНКЦИИ АКТИВИРОВАННЫХ Т-КЛЕТОК
Стимулированные в результате представления антигена Т-клетки становятся функционально активными. Большинство Т-хелперов секретирует цитокины, участвующие в формировании гуморального (Тh2) или клеточного (Тh1) иммунитета. СD8+-Т-клетки проявляют специфическую цитотоксичность против антигенов, связанных с МНС I класса, или вырабатывают цитокины. Нередко реализуются оба механизма.
Т-клеточные эпитопы вируса различаются по иммуногенности. Одни эпитопы вызывают мощный поликлональный Т-клеточный ответ у большинства инфицированных больных, в то время как другие слабо иммуногенны, а некоторые могут быть обнаружены in vitro только с помощью стимуляции пептидами. Первые называются иммунодоминантными эпитопами, вторые – субдоминантными, а последние – криптогенными. Потеря иммунодоминантных эпитопов может быть достаточной для персистирования инфекции.
Мощная стимуляция иммунодоминантными эпитопами может привести к истощению клона Т-клеток [11, 29], когда они становятся толерантными после пролонгированной стимуляции или даже после слабой пролиферации [21]. Этому способствует высокая вирусная нагрузка [11, 29, 48]. Пролонгированная стимуляция иммунодоминантных Т-лимфоцитов способна индуцировать их гибель путем апоптоза. В результате остаются лишь клетки, распознающие субдоминантные эпитопы. Эти Т-лимфоциты могут контролировать вирусную репликацию, но не способны элиминировать вирус. Нередко это наблюдается при хронических гепатитах В и С.
Недавно описан так называемый феномен исходной антигенной погрешности как особый ва-
риант Т-клеточной реакции на вирусы [18, 25]. Суть феномена заключается в том, что после сильной антигенной стимуляции контакт с новым антигеном приводит к иммунному ответу не на него, а на предыдущий иммуноген. Неясно, является ли это результатом действия Т-клеток памяти, подавляющих АПК, представляющие новый антиген [19, 35], возможно, посредством секреции γ-интерферона (ИФН), или индукцией толерантности ЦТЛ [25]. Этот феномен используют многие вирусы, способные к генерации квазиштаммов, в том числе HCV.
Продемонстрирована способность предварительно активированных Т-лимфоцитов подавлять иммунные реакции, направленные против HBV или HCV, и устранять АПК или другие Т-лимфо- циты. Так, HBcAg-специфические СD8+-Т-клет- ки, подавляющие пролиферацию СD4+-Т-клеток, обнаружены в печени больных хроническим гепатитом В [10].
МИМИКРИЯ ИММУННЫХ МЕДИАТОРОВ
При многих вирусных инфекциях синтезируются молекулярные соединения, способные изменять течение иммунных реакций. Ряд вирусов стимулирует секрецию таких цитокинов, как интерлей- кин-1 (ИЛ), ИЛ-8, туморнекротизирующий фактор (ТНФ, или TNF), ИФН-α, ИФН-β и ИФН-γ, обладающих противовирусной активностью.
Однако вирусы способны также секретировать аналоги или антагонисты цитокинов и их рецепторов, модулируя иммунные реакции макроорганизма. Так, EBV кодирует аналог ИЛ-10, который ингибирует синтез ИНФ-γ и усиливает экспрессию МНС II класса [34, 38]. Вирус коровьей оспы продуцирует два белка, связывающихся с интерферонами, а также аналоги интерферонового рецептора и рецепторов ИЛ-1 и ИЛ-6 [9, 36, 37, 39]. Аденовирусы кодируют три белка, блокирующих TNF-зависимый лизис клеток [14, 49].
Некоторые из этих механизмов использует HBV. В частности, HBcAg способен ингибировать транскрипцию ИФН-β [42, 43]. Ядерный белок HCV может связывать рецептор лимфотоксина β – один из рецепторов семейства TNF, участвующих в передаче сигналов апоптоза, предотвращая тем самым гибель поврежденных гепатоцитов [23].
Благодаря изучению иммунного ответа при остром и хроническом вирусных гепатитах выявлены черты разительного сходства между HBV- и HCV-инфекциями. У пациентов с острой саморазрешающейся HBVили HCV-инфекцией выявляется мощный поликлональный CD4+- и СD8+-Т-клеточный ответ на различные вирусные эпитопы [15, 27, 41].
При хронической инфекции Т-клеточный ответ существенно более слабый и направлен против
Российский журнал
10 |
5/2000 |
гастроэнтерологии, гепатологии, колопроктологии |
