
- •Трансаминирование аминокислот:
- •Дезаминирование аминокислот.
- •Включение безазотистого остатка аминокислот в ОПК.
- •Биосинтез аминокислот.
- •Метаболизм отдельных аминокислот.
- •Декарбоксилирование аминокислот и образование биогенных аминов.
- •Азотсодержащие соединения – производные гистидина.
- •Биологическая роль аргинина.
- •Инактивация биогенных аминов.
Содержание
1.Трансаминирование аминокислот
2.Дезаминирование аминокислот
3.Включение безазотистого остатка аминокислот в ОПК
4.Биосинтез аминокислот
5.Метаболизм отдельных аминокислот
6.Декарбоксилирование аминокислот и образование биогенных аминов
7.Азотсодержащие соединения – производные гистидина
8.Биологическая роль аргинина
9.Инактивация биогенных аминов
ИНТЕНСИВ: МЕТАБОЛИЗМ АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ
ВЕБИНАР 3: Метаболизм аминокислот
|
1 |
|
|
|
В клетках аминокислоты используются для |
|
|
синтеза белков в процессе |
синтеза различных биологически |
катаболизма |
|
трансляции |
активных соединений |
начинается с отщепления |
|
|
|
||
|
|
а-аминогруппы в результате: |
|
|
трансаминирования |
дезаминирования |
|
|
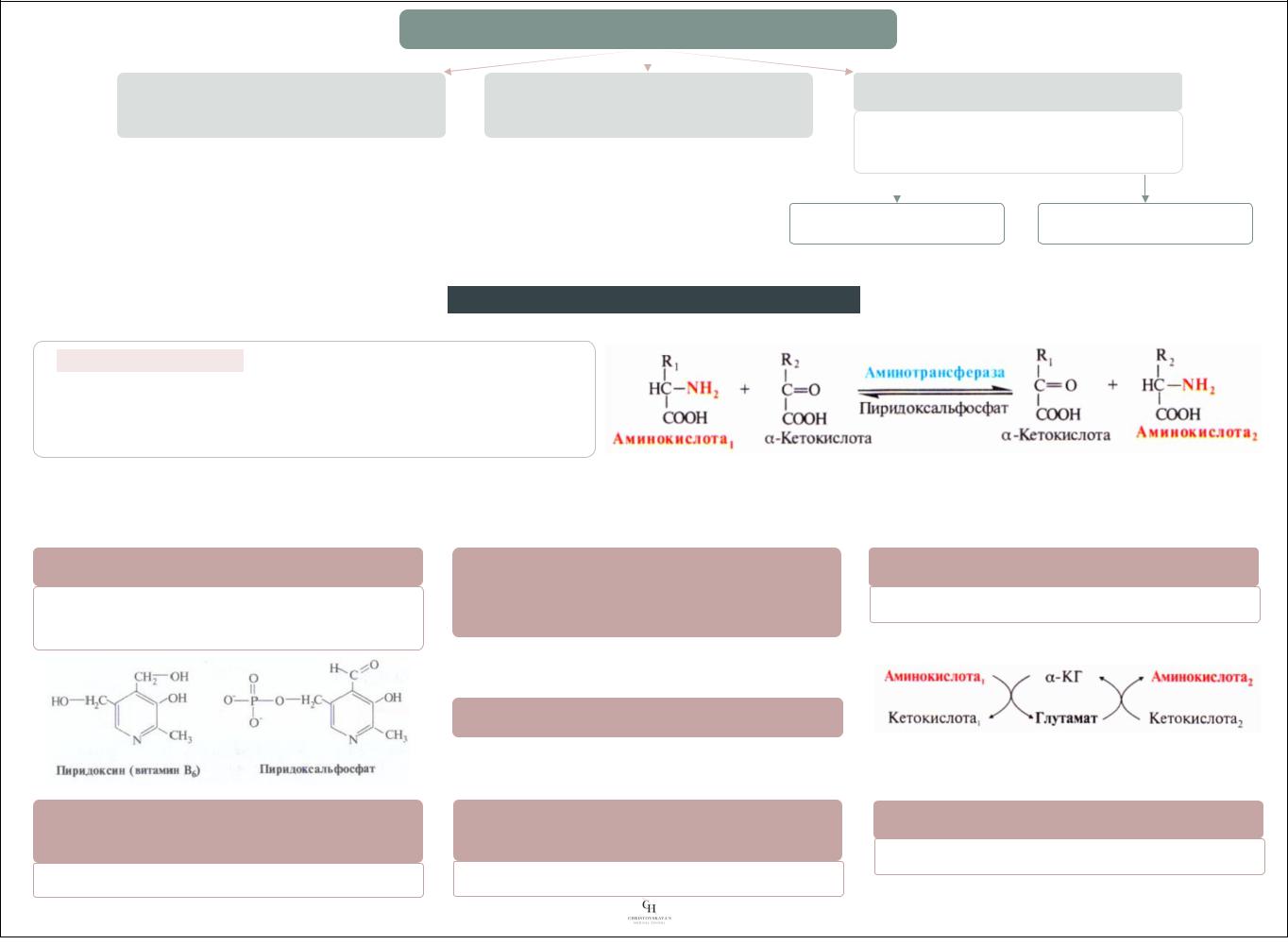
Трансаминирование аминокислот: |
|
|
Трансаминирование – реакция переноса а-аминогруппы |
|
|
|
аминокислоты (донор) на а-кетокислоту (акцептор), в |
|
|
|
результате которой образуется новая аминокислота (из |
|
|
|
кетокислоты) и новая кетокислота (из аминокислоты). |
|
|
|
|
Особенности трансаминирования |
|
|
Кофермент |
В результате реакции |
Основной акцептор аминогруппы |
|
пиридоксальфосфат |
общее количество аминокислот в |
|
а-кетоглутарат |
организме не изменяется |
|
||
(производное витамина В6 – пиридоксина) |
|
|
|
|
|
|
|
|
Реакции легко обратимы |
|
|
Аминокислоты, не способные |
Ферменты, катализирующие реакции |
Основной донор аминогруппы |
|
подвергнуться трансаминированию |
трансаминирования |
|
глутамат |
|
|
|
|
лизин, треонин и пролин |
аминотрансферазы (трансаминазы) |
|
|
2
Наиболее часто в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных
глутамат (соответствующая |
аланин (соответствующая |
аспартат (соответствующая |
кетокислота – а-кетоглутарат) |
кетокислота – пируват) |
кетокислота – оксалоацетат) |
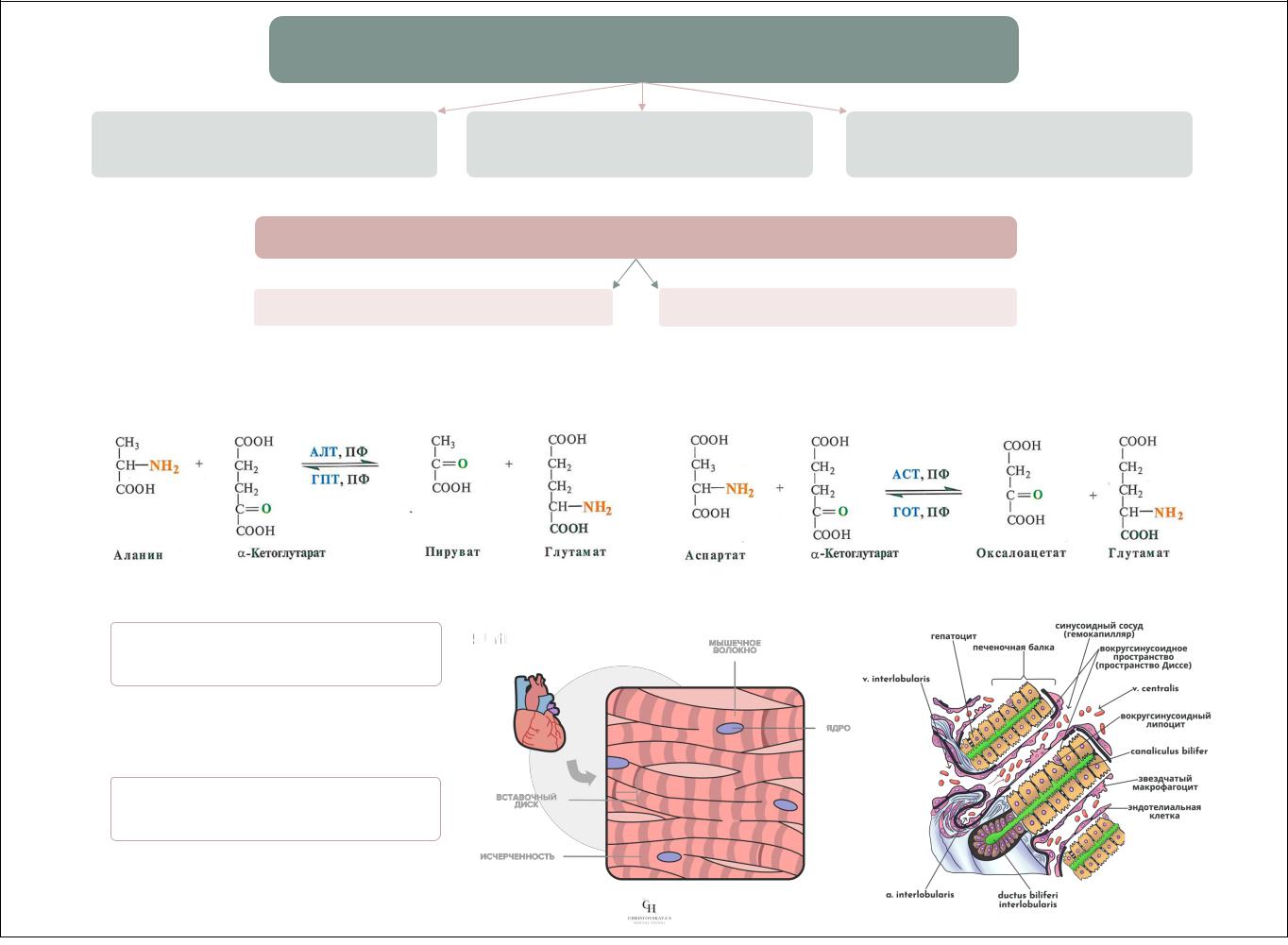
Наиболее распространенные аминотрансферазы
аланинаминотрансфераза (АЛТ) |
аспартатаминотрансфераза (АСТ) |
катализирует реакцию |
катализирует реакцию |
трансаминирования между |
трансаминирования между |
аланином и а-кетоглутаратом |
аспартатом и а-кетоглутаратом |
Локализация аминотрансфераз
аланинаминотрансфераза (АЛТ)
цитоплазма гепатоцитов и кардиомиоцитов
аспартатаминотрансфераза (АСТ)
цитоплазма и митохондрии гепатоцитов и кардиомиоцитов
3 |
|
Биологическое значение трансаминирования |
|
заключительный этап синтеза заменимых |
первая стадия непрямого дезаминирования |
аминокислот в организме |
большинства аминокислот (начальный этап |
(из кетокислот синтезируются аминокислоты, |
их катаболизма) |
необходимые для существования клеток) |
образующиеся кетокислоты вступают в |
|
общий путь катаболизма или используются |
|
в глюконеогенезе |
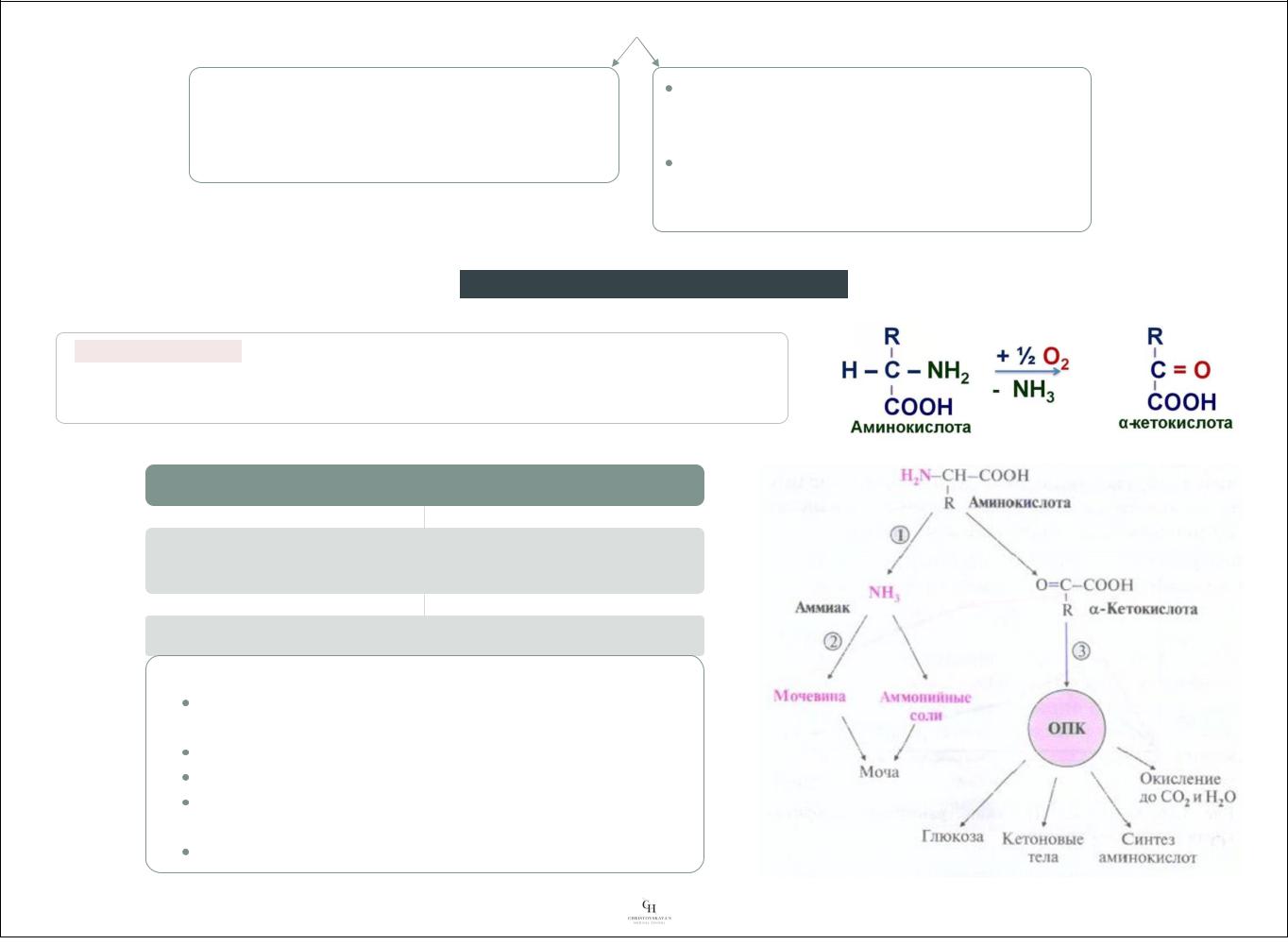
Дезаминирование аминокислот. |
|
Дезаминирование – реакция отщепления а-аминогруппы от аминокислоты, в |
|
результате которой образуется соответствующая а-кетокислота (безазотистый |
|
остаток), а аминогруппа выделяется в виде молекулы аммиака. |
|
Направления метаболизма продуктов дезаминирования |
|
аммиак – выводится из организма в виде мочевины или |
|
солей аммония |
|
безазотистый остаток (а-кетокислота) |
|
использование: |
|
образование аминокислот в результате |
|
трансаминирования |
|
как субстрат для глюконеогенеза |
|
как субстрат для кетогенеза |
|
анаплеротические реакции для восполнения уровня |
|
метаболитов ОПК (общего пути катаболизма) |
|
окисление до СО2 и Н2О с выделением энергии |
|

4
Особенности дезаминирования
В результате дезаминирования общее количество |
Лизин – аминокислота, не способная подвергнуться |
аминокислот организма уменьшается |
дезаминированию |
Ускорение реакций дезаминирования происходит при увеличении активности процесса расщепления белков в организме (протеолиза), который активируется при:
голодании ускорение распада |
сахарном диабете и других длительно |
поступлении с пищей большого |
белков |
текущих тяжелых заболеваниях |
количества белков, поскольку |
|
ускорение распада белков |
аминокислоты не имеют в организме |
|
|
какой-либо специфической |
|
|
формы депонирования |
Этапы процесса катаболизма аминокислот
1
Дезаминирование аминокислот
2
Обезвреживание аммиака  образование конечных продуктов азотистого обмена (мочевины и аммонийных солей)
образование конечных продуктов азотистого обмена (мочевины и аммонийных солей)
3
Включение а-кетокислот в ОПК
Виды дезаминирования аминокислот
Прямое окислительное дезаминирование |
Внутримолекулярное дезаминирование |
глутамат |
гистидин |
Прямое неокислительное дезаминирование |
Непрямое дезаминирование (трансдезаминирование) |
серин и треонин |
большинство аминокислот |
5
6
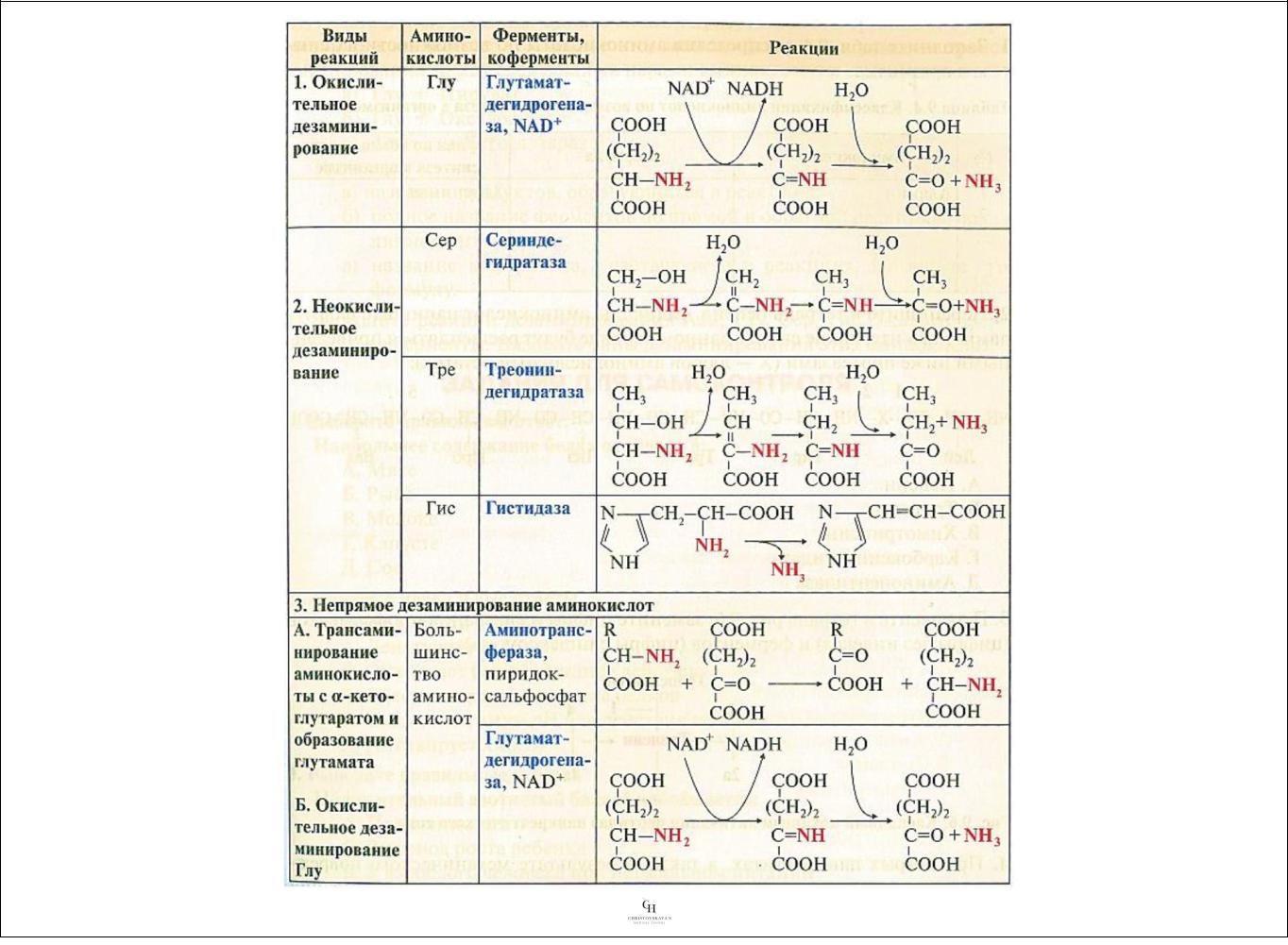
Прямое окислительное дезаминирование;
Реакция
глутамат |
NAD+ |
а-кетоглутарат |
NH3 |
NADH+H+ |
Фермент |
Кофермент |
глутаматдегидрогеназа |
NAD+ (производное витамина В3 или РР |
|
– никотиновой кислоты) |
Стадии окислительного дезаминирования глутамата
1
Ферментативное дегидрирование глутамата с образованием а-иминоглутарата
2
Неферментативное гидролитическое отщепление иминогруппы от а-иминоглутарата в виде аммиака с
образование а-кетоглутарата
|
Регуляция активности глутаматдегидрогеназы |
Аллостерические ингибиторы |
Активаторы |
АТФ, ГТФ и NADH+H+ |
АДФ и NAD+ |
Индукторы синтеза
кортизол тироксин (Т4)
7
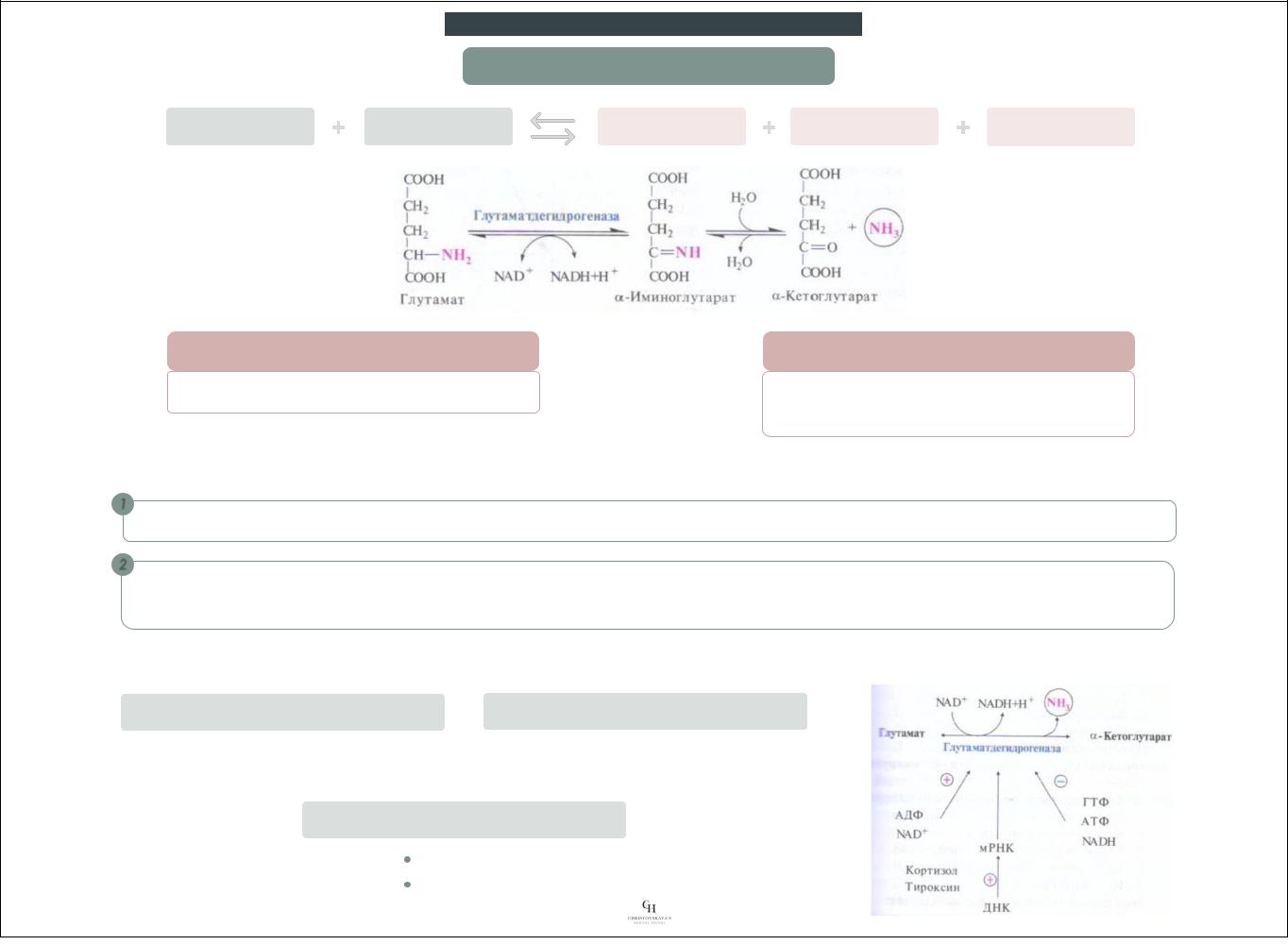
Прямое неокислительное дезаминирование.
Аминокислоты, способные подвергнуться |
|
Серин |
|
Треонин |
неокислительному дезаминированию |
|
|
||
|
|
|
|
Реакция неокислительного дезаминирования серина
серин |
пируват |
NH3 |
Фермент |
Кофермент |
сериндегидратаза |
пиридоксальфосфат (производное |
|
витамина В6 – пиридоксина) |
Реакция неокислительного дезаминирования треонина
треонин |
а-кетобутират |
NH3 |
Фермент |
Кофермент |
треониндегидратаза |
пиридоксальфосфат (производное |
|
витамина В6 – пиридоксина) |
8
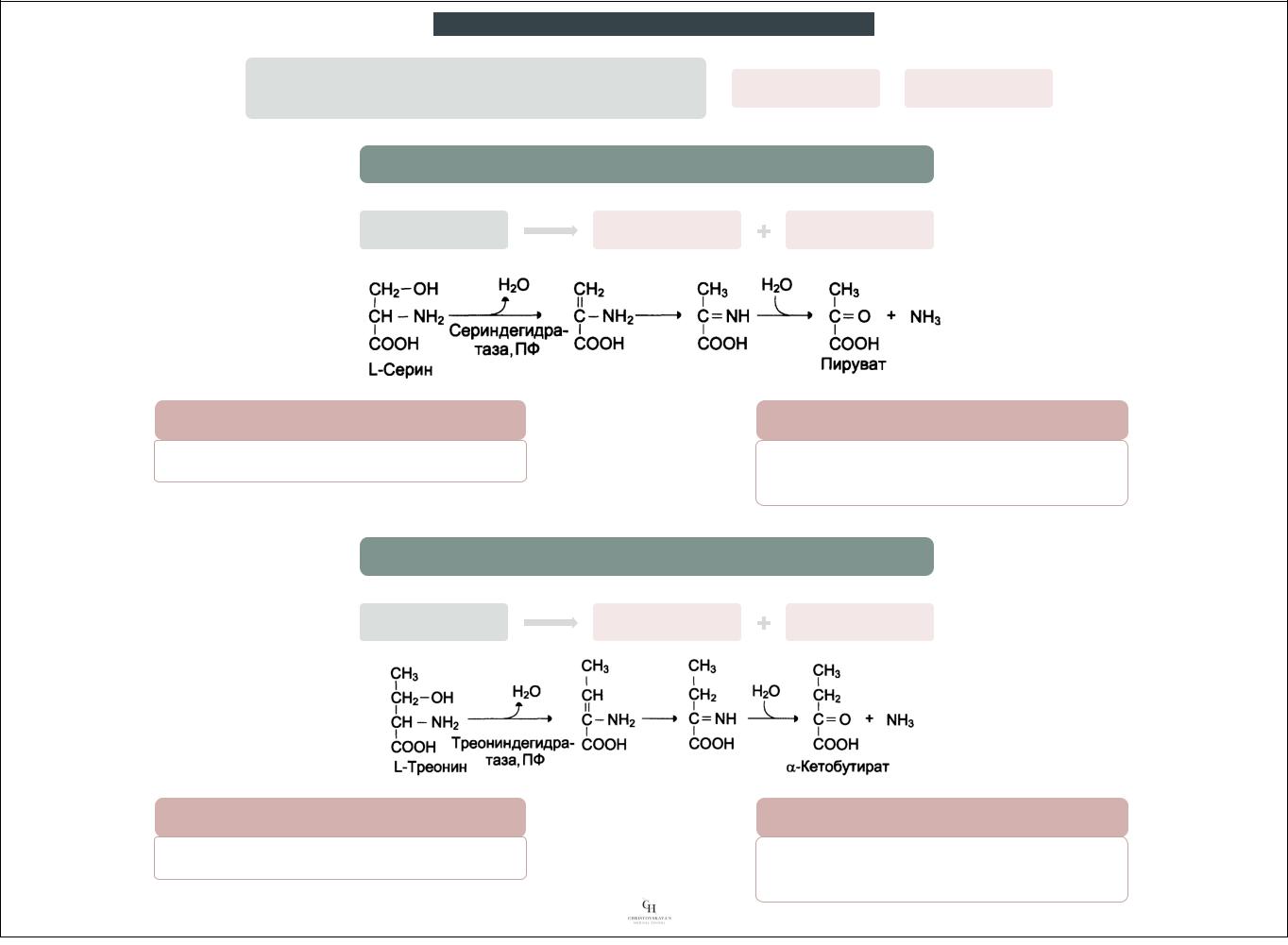
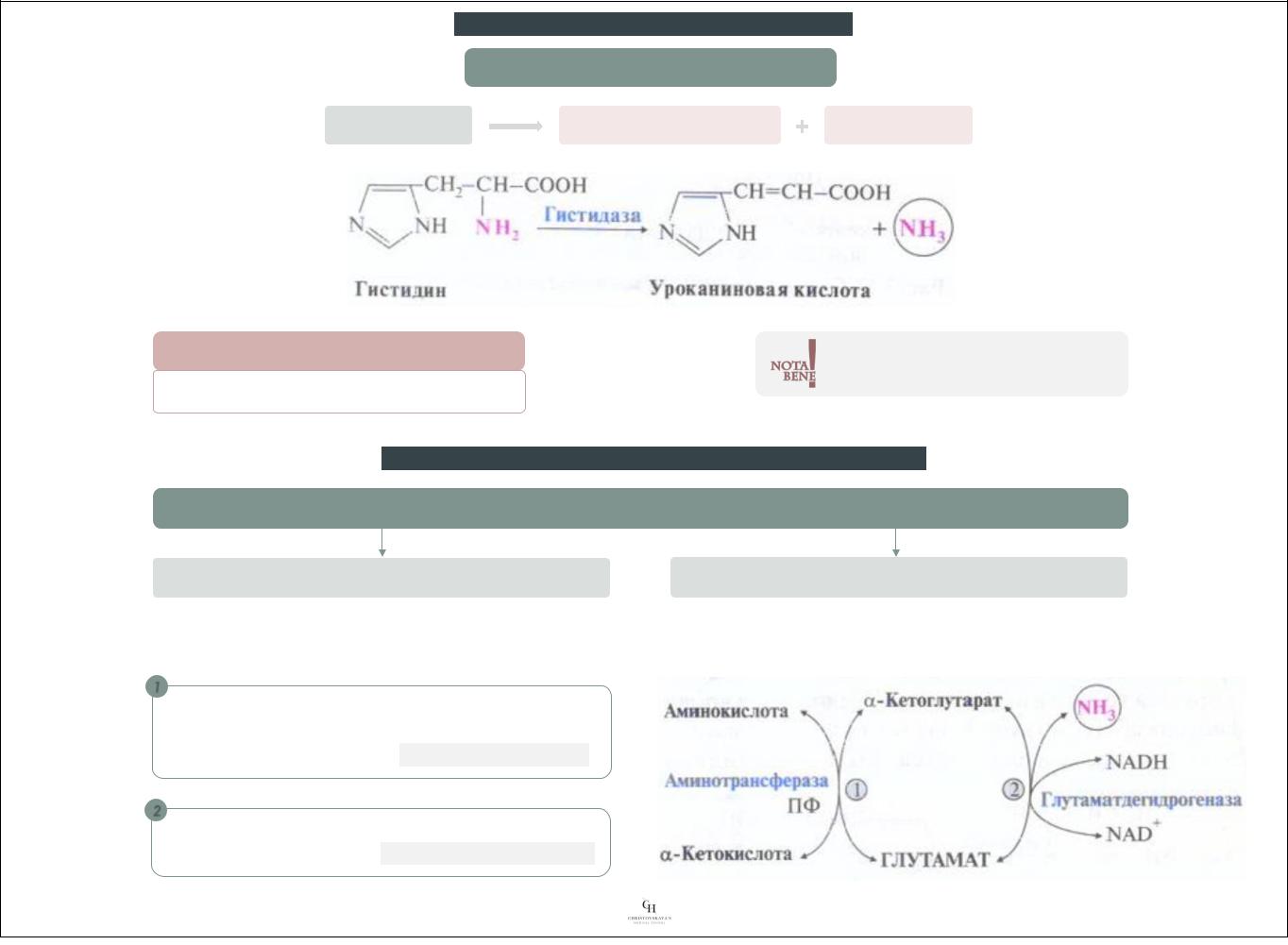
Внутримолекулярное дезаминирование,
Реакция
гистидин |
уроканиновая кислота |
NH3 |
Фермент |
Реакция происходит только в |
гистидаза (гистидинаммиаклиаза) |
печени и коже. |
|
Непрямое дезаминирование (трансдезаминирование),
Виды непрямого дезаминирования
непрямое окислительное дезаминирование |
непрямое неокислительное дезаминирование |
Этапы непрямого окислительного дезаминирования
1
Трансаминирование аминокислоты с а-кетоглутаратом с образованием кетокислоты и глутамата (фермент – аминотрансфераза)
2
Прямое окислительное дезаминирование глутамата (фермент – глутаматдегидрогеназа)
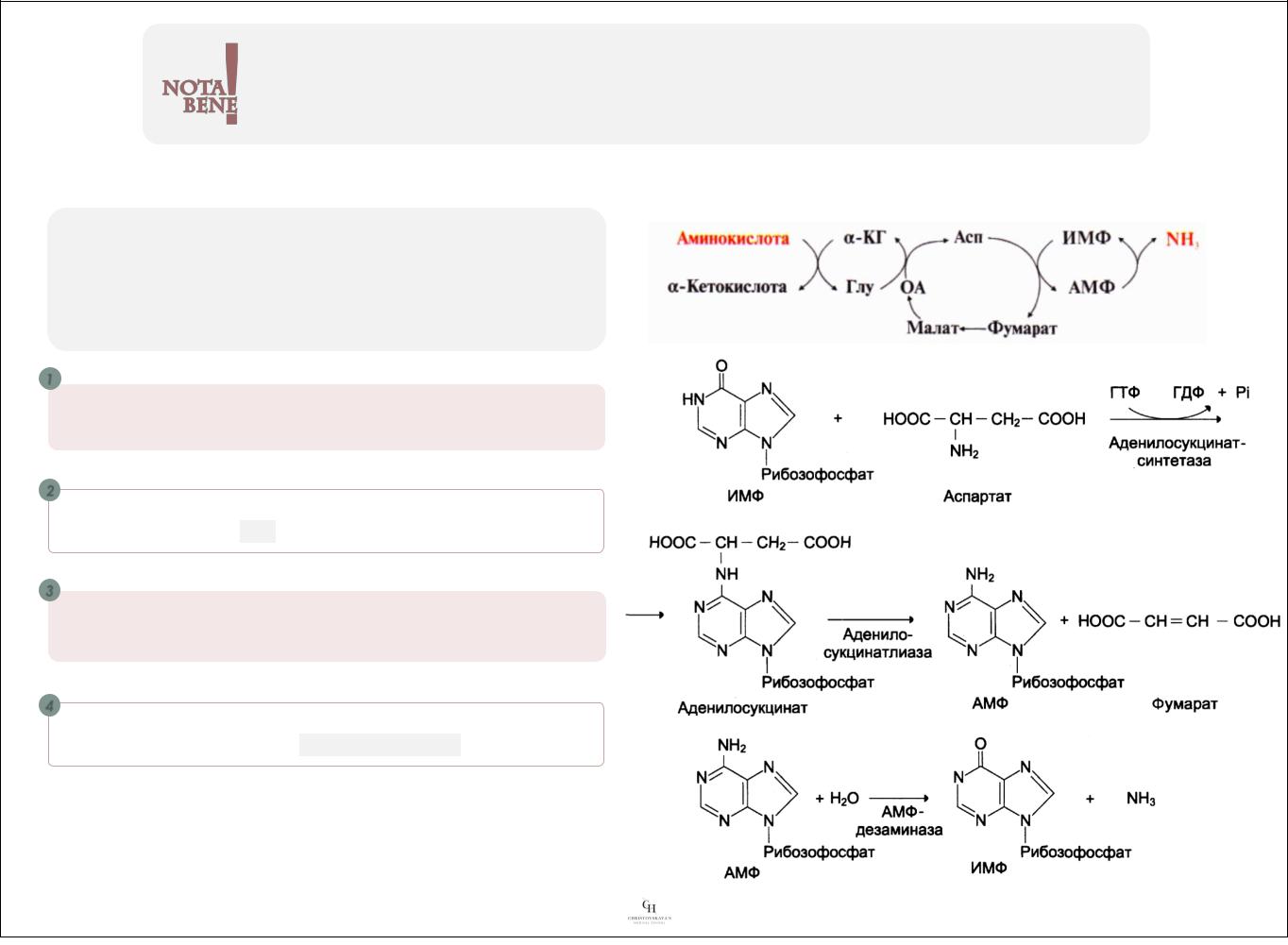
9
Непрямое дезаминирование – основной способ дезаминирования большинства аминокислот. Оба этапа непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей кетокислоты.
Стадии непрямого неокислительного дезаминирования с участием цикла ИМФ-АМФ
Непрямое неокислительное дезаминирование
преобладает в мышечной ткани при интенсивной работе, в результате которой накапливается молочная кислота.
Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное накоплением лактата
1
Трансаминирование аминокислоты с а-кетоглутаратом и образование кетокислоты и глутамата
2
Трансаминирование глутамата с оксалоацетатом (фермент – АСТ) и образование аспартата
3
Перенос аминогруппы с аспартата на ИМФ (инозинмонофосфат) и образование АМФ с фумаратом
4
Гидролитическое дезаминирование АМФ (фермент – АМФ-дезаминаза)
