

Т И М И Н О Л Е Г А Л Е К С Е Е В И Ч
Лекции по общей биохимии
ДЛЯ СТУДЕНТОВ МЕДИЦИ НСКИХ ВУЗОВ
2 0 1 8

О Г Л А В Л Е Н И Е |
|
АМИНОКИСЛОТЫ И БЕЛКИ ........................................................................................................... |
4 |
Классификация аминокислот................................................................................................... |
4 |
Аминокислоты как лекарственные препараты........................................................................ |
7 |
Физико-химические свойства аминокислот ............................................................................ |
8 |
Строение и свойства пептидной связи .................................................................................... |
9 |
Функции белков...................................................................................................................... |
11 |
Уровни организации белковой структуры ............................................................................ |
11 |
Физико-химические свойства белков .................................................................................... |
16 |
Классификация белков ........................................................................................................... |
19 |
ВИТАМИНЫ.................................................................................................................................. |
30 |
Жирорастворимые витамины................................................................................................. |
32 |
Водорастворимые витамины.................................................................................................. |
40 |
ФЕРМЕНТЫ .................................................................................................................................. |
55 |
Строение ферментов............................................................................................................... |
57 |
Принципы количественного определения активности ферментов ...................................... |
60 |
Свойства ферментов............................................................................................................... |
60 |
Регуляция активности ферментов in vivo .............................................................................. |
63 |
Ингибирование ферментов .................................................................................................... |
67 |
Энзимопатологии ................................................................................................................... |
70 |
Использование ферментов и их ингибиторов в медицине................................................... |
70 |
Классификация ферментов .................................................................................................... |
72 |
Номенклатура ферментов....................................................................................................... |
72 |
ОБЩИЕ ПУТИ БИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ .......................................................................... |
80 |
Основные источники энергии в клетке ................................................................................. |
82 |
Окислительное декарбоксилирование пировиноградной кислоты ...................................... |
83 |
Цикл трикарбоновых кислот.................................................................................................. |
85 |
Окислительное фосфорилирование ....................................................................................... |
88 |
Разобщители ........................................................................................................................... |
92 |
Ингибиторы ферментов дыхательной цепи .......................................................................... |
93 |
Коэффициент Р/О ................................................................................................................... |
94 |
Гипоэнергетические состояния.............................................................................................. |
94 |
Использование АТФ и его предшественников в медицине ................................................. |
94 |
ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ .............................................................................................. |
96 |
Азотистый баланс................................................................................................................... |
96 |
Внешний обмен аминокислот и белков................................................................................. |
97 |
Транспорт аминокислот через мембраны............................................................................ |
102 |
Нарушение процессов переваривания белков..................................................................... |
104 |
Детоксикационные системы печени .................................................................................... |
106 |
Внутриклеточный обмен аминокислот................................................................................ |
107 |
ОБРАЗОВАНИЕ И УБОРКА АММИАКА ......................................................................................... |
122 |
Основные источники аммиака в организме ....................................................................... |
122 |
Связывание аммиака ............................................................................................................ |
122 |
Транспорт аммиака............................................................................................................... |
123 |
Удаление аммиака из организма.......................................................................................... |
124 |
Гипераммониемии ................................................................................................................ |
126 |
Гипотезы токсичности аммиака........................................................................................... |
127 |
ОБМЕН ОТДЕЛЬНЫХ АМИНОКИСЛОТ........................................................................................ |
128 |
Пути использования глутаминовой и аспарагиновой кислот............................................ |
128 |
Пути использования цистеина ............................................................................................. |
128 |
Пути использования глицина и серина................................................................................ |
130 |

biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
2 |
Взаимосвязь обмена глицина, серина, цистеина и метионина ........................................... |
131 |
|
Обмен фенилаланина и тирозина......................................................................................... |
132 |
|
Катаболизм аминокислот с разветвленной цепью .............................................................. |
140 |
|
Обмен триптофана................................................................................................................ |
|
142 |
Обмен аргинина.................................................................................................................... |
|
143 |
СТРОЕНИЕ И ОБМЕН НУКЛЕОТИДОВ......................................................................................... |
146 |
|
Внешний обмен нуклеопротеинов....................................................................................... |
146 |
|
Пуриновые нуклеотиды ....................................................................................................... |
|
147 |
Нарушение обмена пуриновых оснований.......................................................................... |
153 |
|
Пиримидиновые нуклеотиды............................................................................................... |
155 |
|
Синтез дезоксирибонуклеотидов......................................................................................... |
157 |
|
Нарушение обмена пиримидиновых оснований ................................................................. |
161 |
|
Нуклеозиды и нуклеотиды как лекарственные препараты................................................. |
161 |
|
МАТРИЧНЫЕ БИОСИНТЕЗЫ....................................................................................................... |
|
162 |
Строение нуклеиновых кислот ............................................................................................ |
162 |
|
синтез нуклеиновых кислот ................................................................................................. |
166 |
|
Синтез белка – трансляция................................................................................................... |
176 |
|
Генотипическая гетерогенность .......................................................................................... |
181 |
|
СТРОЕНИЕ И ОБМЕН УГЛЕВОДОВ .............................................................................................. |
182 |
|
Функции углеводов .............................................................................................................. |
|
182 |
Классификация ..................................................................................................................... |
|
182 |
Использование углеводов в биологии и медицине ............................................................. |
187 |
|
Внешний обмен углеводов................................................................................................... |
187 |
|
Переваривание углеводов у детей ....................................................................................... |
188 |
|
Перенос глюкозы через мембраны ...................................................................................... |
189 |
|
Реакции взаимопревращения сахаров ................................................................................. |
190 |
|
Судьба и источники глюкозы в клетке ................................................................................ |
194 |
|
Метаболизм гликогена ......................................................................................................... |
|
195 |
Гликогеновые болезни ......................................................................................................... |
|
200 |
Окисление глюкозы.............................................................................................................. |
|
202 |
Глюконеогенез...................................................................................................................... |
|
209 |
Метаболизм этанола............................................................................................................. |
|
215 |
Пентозофосфатный путь окисления глюкозы ..................................................................... |
217 |
|
Регуляция концентрации глюкозы в крови ......................................................................... |
221 |
|
СТРОЕНИЕ И ОБМЕН ЛИПИДОВ ................................................................................................. |
223 |
|
Классификация липидов |
...................................................................................................... |
223 |
Функции липидов ................................................................................................................. |
|
223 |
Строение липидов ................................................................................................................ |
|
225 |
Внешний обмен липидов...................................................................................................... |
232 |
|
Свойства, состав и функции желчи ..................................................................................... |
234 |
|
Переваривание липидов у детей .......................................................................................... |
237 |
|
Нарушение переваривания липидов .................................................................................... |
237 |
|
Всасывание липидов ............................................................................................................ |
|
238 |
Формы транспорта липидов в крови.................................................................................... |
240 |
|
Транспорт триацилглицеролов ............................................................................................ |
240 |
|
Промежуточный обмен липидов ......................................................................................... |
243 |
|
Кетоновые тела..................................................................................................................... |
|
251 |
Запасание жиров................................................................................................................... |
|
252 |
Синтез триацилглицеролов и фосфолипидов...................................................................... |
257 |
|
Нарушения обмена триацилглицеролов .............................................................................. |
261 |
|
Обмен холестерола............................................................................................................... |
|
263 |
Транспорт холестерола и его эфиров................................................................................... |
265 |
|

biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
3 |
Нарушения обмена холестерола .......................................................................................... |
267 |
|
Нарушения транспорта липидов .......................................................................................... |
270 |
|
Липидозы .............................................................................................................................. |
|
271 |
ГОРМОНЫ .................................................................................................................................. |
|
273 |
Классификация гормонов..................................................................................................... |
273 |
|
Механизмы действия гормонов ........................................................................................... |
274 |
|
Иерархия и принципы регуляции гормональных систем ................................................... |
278 |
|
Гормоны гипоталамуса ........................................................................................................ |
|
279 |
Гормоны гипофиза ............................................................................................................... |
|
279 |
Гормоны, регулирующие обмен кальция и фосфора .......................................................... |
283 |
|
Гормоны тиреоидной функции ............................................................................................ |
285 |
|
Гормоны периферических желез ......................................................................................... |
289 |
|
Группа гормонов репродуктивной системы........................................................................ |
298 |
|
Гормоны гипоталамо-гипофизарно-надпочечниковой системы ........................................ |
304 |
|
АЗОТСОДЕРЖАЩИЕ ВЕЩЕСТВА КРОВИ..................................................................................... |
309 |
|
Белки крови........................................................................................................................... |
|
309 |
Индивидуальные белки плазмы крови ................................................................................ |
312 |
|
Ферменты крови ................................................................................................................... |
|
315 |
Остаточный азот крови ........................................................................................................ |
|
316 |
ОБМЕН ЖЕЛЕЗА ......................................................................................................................... |
|
318 |
Метаболизм железа .............................................................................................................. |
|
318 |
Регуляция обмена железа ..................................................................................................... |
320 |
|
Нарушение обмена железа ................................................................................................... |
322 |
|
ГЕМОПРОТЕИНЫ. ОБМЕН ГЕМА ............................................................................................... |
324 |
|
Строение и синтез гема ........................................................................................................ |
|
324 |
Миоглобин ............................................................................................................................ |
|
326 |
Гемоглобин ........................................................................................................................... |
|
327 |
Дыхательная функция крови................................................................................................ |
331 |
|
Катаболизм гема ................................................................................................................... |
|
332 |
Нарушения обмена билирубина........................................................................................... |
334 |
|
КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ ........................................................................................ |
339 |
|
Роль ионов водорода ............................................................................................................ |
|
339 |
Основные показатели КОС .................................................................................................. |
339 |
|
Компенсация изменений концентрации ионов водорода в плазме крови.......................... |
343 |
|
Виды нарушений кислотно-основного состояния и их компенсация ................................ |
348 |
|
ВОДНЫЙ БАЛАНС....................................................................................................................... |
|
352 |

АМ И НОК ИС ЛОТЫ И БЕЛКИ
Аминокислоты по строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. Таким образом, в аминокислотах обязательно присутствует карбоксильная группа (СООН), аминогруппа (NH2), асимметричный атом углерода и боковая цепь (радикал R). Строением боковой цепи аминокислоты и отличаются друг от друга. Именно радикал придает аминокислотам большое разнообразие строения и свойств.
Аминокислоты являются строительными блоками белковых молекул, но необходимость их изучения кроется не только в данной функции. Несколько аминокислот являются источником для образования нейромедиаторов в ЦНС (гистамин, серотонин, гаммааминомасляная кислота, дофамин, норадреналин), другие сами являются нейромедиаторами (глицин, глутаминовая кислота).
Те или иные аминокислоты необходимы для синтеза пуриновых и пиримидиновых оснований без которых нет нуклеиновых кислот, используются для синтеза низкомолекулярных биологически важных соединений (креатин, карнитин, карнозин, ансерин и др.).
Аминокислота тирозин целиком входит в состав гормонов щитовидной железы (тироксин, трийодтиронин) и мозгового вещества надпочечников (адреналин, норадреналин).
С нарушением обмена аминокислот связан ряд наследственных и приобретенных заболеваний, сопровождающихся серьезными проблемами в развитии организма (цистиноз, гомоцистеинемия, лейциноз, тирозинемии и др). Самым известным примером является фенилкетонурия.
К Л АС С И Ф И К АЦ И Я АМ ИН ОК ИСЛО Т
Из-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты делятся:
1.В зависимости от положения аминогруппы.
2.По абсолютной конфигурации молекулы.
3.По оптической активности.
4.По участию аминокислот в синтезе белков.
5.По строению бокового радикала.
6.По кислотно-основным свойствам.
7.По необходимости для организма.
Взависимости от положения аминогруппы
Выделяют и другие аминокислоты. Для организма млекопитающих наиболее характерны -аминокислоты.
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
5 |
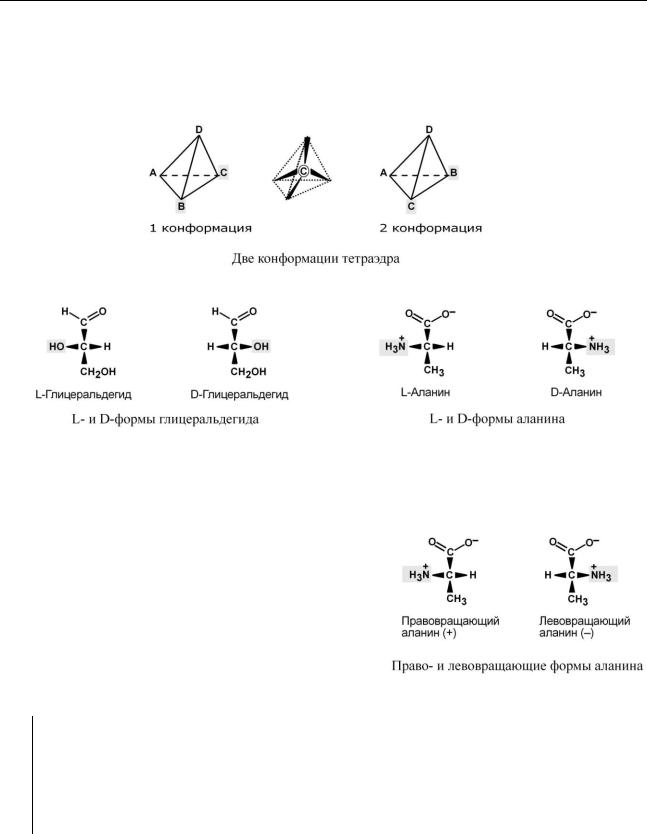
По абсолютной конфигурации молекулы
По абсолютной конфигурации молекулы выделяют D- и L-формы. Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в-положении.
В белке любого организма содержится только один изомер, для млекопитающих это L-аминокислоты. Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию, т.е. L-форма переходит в D-форму.
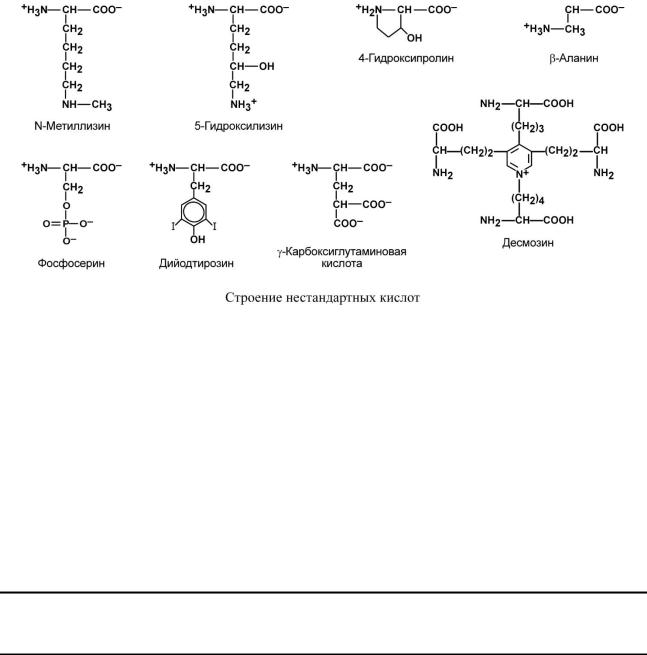
По оптической активности
По оптической активности аминокислоты делятся на право- и левовращающие.
Наличие ассиметричного атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризованного света, проходящего через раствор. В соответствии с углом поворота вы-
деляют правовращающие (+) и левовращающие (–) изомеры.
Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.

Аминокислоты и белки |
6 |
|
|
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
7 |
|
|
|
По участию аминокислот в синтезе белков
Выделяют протеиногенные (20 АК) и непротеиногенные (около 40 АК). Все протеиногенные аминокислоты являются -аминокислотами.
На примере протеиногенных аминокислот можно показать дополнительные способы классификации:
o по строению бокового радикала – неполярные (алифатические, ароматические) и полярные (незаряженные, отрицательно и положительно заряженные),
oэлектрохимическая – по кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (Асп, Глу) и основные (Лиз, Арг, Гис) аминокислоты,
oфизиологическая классификация – по необходимости для организма выделяют незаменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две аминокислоты являются условно незаменимыми (Арг, Гис), т.е. их синтез происходит в недостаточном количестве.
АМ ИНОК И СЛО ТЫ К АК ЛЕ К АР С ТВЕ ННЫ Е ПР Е П АР АТЫ
Метионин, незаменимая кислота, содержит мобильную метильную группу, которая может передаваться на другие соединения. Благодаря этому она участвует в синтезе холина, фосфолипидов, обмене витаминов В12 и фолиевой кислоты. В реакциях биосинтеза белка метионин является инициирующей аминокислотой. Он участвует в процессах обезвреживания токсинов в печени.
Метионин ("ациметион") и его активные производные (как вещество "адеметионин" в составе препарата "Гептрал") используют для профилактики и лечения различных заболеваний печени как липотропный фактор, препятствующий накоплению жира, при токсических поражениях печени, при атеросклерозе и в качестве антидепрессанта для улучшения синтеза нейромедиаторов.
Глутаминовая кислота – является предшественником -аминомасляной кислоты (ГАМК), являющейся тормозным медиатором нервной системы (препараты "Аминалон", "Пикамилон"). ГАМК также играет значительную роль в регуляции тонуса мозговых сосудов кровообращении головного мозга. Сам по себе глутамат является нейромедиаторной аминокислотой, стимулирующей передачу возбуждения в синапсах ЦНС. Кроме этого, глутамат
Аминокислоты и белки |
8 |
|
|
участвует в обезвреживании аммиака, синтезе пуриновых и пиримидиновых оснований, играет ведущую роль в обмене других аминокислот. Потребность организма в глутаминовой кислоте выше всех остальных аминокислот.
Глицин является медиатором ЦНС тормозного действия. Улучшает метаболизм в тканях мозга. Оказывает успокаивающее действие. Нормализует сон, уменьшает повышенную раздражительность, депрессивные состояния.
Цистеин участвует в метаболизме хрусталика глаза. Зачастую нарушения хрусталика связаны с недостатком цистеина, поэтому цистеин применяют на начальных стадиях катаракты.
Комплексный препарат глутаминовой кислоты, цистеина и глицина "Вицеин" используют в виде глазных капель.
Гистидин – условно незаменимая аминокислота. Используется при лечении гепатитов, язв желудка и двенадцатиперстной кишки.
Церебролизин – гидролизат вещества мозга свиньи, содержащий низкомолекулярные пептиды (15%) и аминокислоты (85%). Используется при нарушениях функций ЦНС, мозговых травмах, кровоизлияниях, вегетативных дистониях и т.п.
Препараты для парентерального питания: полиамин (набор 13 аминокислот), вамин (набор 18 аминокислот), ваминолакт (набор 18 аминокислот, соответствующих составу грудного молока), гидролизин (гидролизат белков крови крупного рогатого скота), аминотроф (гидролизат казеина), аминосол (смесь 15 аминокислот), фибриносол (гидролизат фибрина крови).
Ф И З И К О - Х И М И Ч Е С К И Е СВОЙС ТВ А АМ ИНОК И СЛО Т
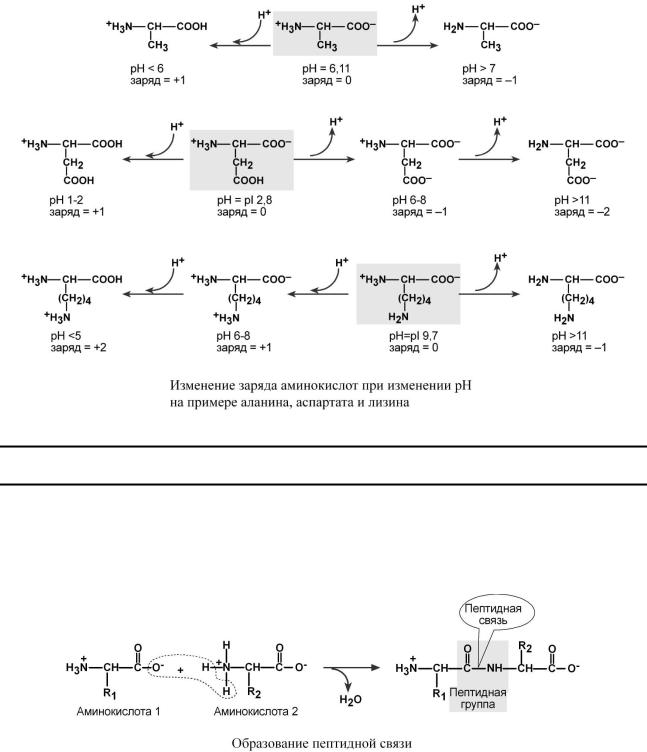
1. Являются амфотерными электролитами. Аминокислоты сочетают в себе свойства
кислот и оснований. Соответственно, в водном растворе аминокислоты ведут себя как кислоты
– доноры протонов и как основания – акцепторы протонов.
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектриче-
ским. Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты:
opI большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин),
o pI кислых аминокислот – рI глутамата 3,2, рI аспартата 2,8,
o pI основных аминокислот – pI гистидина 7,6, pI аргинина 10,8, pI лизина 9,7.
pI гистидина позволяет ему использоваться в гемоглобиновой буферной системе и в функции особых веществ миоцитов (карнозина, анзерина) в которых он содержится. Эти соединения легко принимают и легко отдают ионы водорода при малейших сдвигах рН среды (в норме 7,35-7,45).
2. Заряд аминокислот зависит от величины рН среды.
Отправным пунктом для понимания причин появления заряда у аминокислот является величина изоэлектрической точки (pI). Ситуация различается для нейтральных, кислых и основных аминокислот.
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2018г) |
9 |
|
|
|
С ТР ОЕ НИЕ И С ВОЙ С ТВ А ПЕ ПТИД НОЙ СВ ЯЗ И
Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула.
Пептидная связь – это связь между -карбоксильной группой одной аминокислоты и-аминогруппой другой аминокислоты.
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным.
Например, аланил-серил-триптофан или -глутаминил-цистеинил-глицин (по-другому называемый глутатион).
