
4 курс / Акушерство и гинекология / Гинекология 2010 №03
.pdf
ЙазЦдйгйЙаь
Ê Û Ì ‡ Î |
‰ Î fl Ô ‡ Í Ú Ë Í Û ˛ ˘ Ë ı |
‚ ‡ ˜ Â È |
Главная тема номера: воспалительные заболевания
N0 3 ÚÓÏ 12 / 2010
ISSN 2079-5696


ГИНЕКОЛОГИЯ Том 12, № 3, 2010 ISSN 2079-5696
Главный редактор Проф. В.Н. Прилепская Научные обозреватели
Академик РАМН, проф. В.Н. Серов Академик РАМН, проф. Г.М. Савельева Академик РАМН, проф. Г.Т. Сухих Член-корр. РАМН, проф. Е.М. Вихляева Член-корр. РАМН, проф. Г.А. Мельниченко Проф. В.П. Козаченко
Ответственный секретарь К.м.н. А.А. Куземин
Издательский холдинг «Медиа Медика» Почтовый адрес:
Москва, 127055, а/я 37 Телефон редакции:
(495) 926-29-83 E-mail: media@consilium-medicum.com
Директор издательства С.А. Дроздовская Главный редактор издательства П.В. Морозов
Зам. главного редактора издательства Б.А. Филимонов Директор по маркетингу и продажам Т.Л. Скоробогат Выпускающий редактор А.В. Шухова
Менеджер по работе с подписчиками Самойлина Наталья Евгеньевна
тел.: (495) 926-29-83, доб. 125 Е-mail: samoilina@con-med.ru
Генеральный директор А.Ю. Борисов
Бесплатная тематическая рассылка по специалистам
Зарегистрирован в Государственном комитете Российской Федерации по печати Рег. номер: 019067 Тираж: 15 000
Редакция не несет ответственности за содержание рекламных материалов
Встатьях представлена точка зрения авторов, которая может не совпадать с мнением редакции журнала.
Полное или частичное воспроизведение материалов, опубликованных в журналах или на сайте издательства, допускается только с письменного разрешения редакции.
Все права защищены ♥ 2010 «Медиа Медика»
Все материалы данного выпуска можно посмотреть на сайте: www.consilium-medicum.com
|
С О Д Е Р Ж А Н И Е |
|
|
|
|
|
|
|
|
|
ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ |
|
|
|
|
Экология влагалища и воспалительные заболевания половых органов |
|
|
|
|
И.И.Баранов |
4 |
|
|
|
|
|
|
|
|
Подходы к рациональному выбору антибактериальной терапии |
|
|
|
|
воспалительных заболеваний органов малого таза у женщин |
|
|
|
|
В.В.Рафальский, Е.В.Довгань, М.В.Остроумова |
6 |
||
|
|
|
|
|
|
Применение препарата Нео-Пенотран® форте для лечения урогенитальных |
|
|
|
|
инфекций во время беременности |
|
|
|
|
О.И.Немченко, Ю.Б.Терехова |
12 |
||
|
|
|
|
|
|
Инновационный подход к лечению трубно-перитонеального бесплодия |
|
|
|
|
Е.А.Петрович, И.Б.Манухин |
15 |
||
|
|
|
|
|
|
ГИНЕКОЛОГИЧЕСКАЯ ЭНДОКРИНОЛОГИЯ |
|
|
|
|
Возможности применения дидрогестерона у женщин |
|
|
|
|
с недостаточностью лютеиновой фазы менструального цикла |
|
|
|
|
Е.А.Межевитинова, Э.Р.Довлетханова |
21 |
||
|
|
|
|
|
|
Консенсус российских экспертов по проблеме метаболического синдрома |
|
|
|
|
в Российской Федерации: определение, диагностические критерии, |
|
|
|
|
первичная профилактика и лечение |
25 |
||
|
|
|
|
|
|
ФАРМАКОТЕРАПИЯ ПРИ БЕРЕМЕННОСТИ |
|
|
|
|
Поливитаминные препараты и нутриенты: роль в восполнении дефицита |
|
|
|
|
фолиевой кислоты и йода у беременных |
|
|
|
|
В.Н.Прилепская, А.В.Ледина |
32 |
||
|
|
|
|
|
|
Профилактическое применение Магне-В6 у беременных женщин |
|
|
|
|
с артериальной гипертонией и ожирением, страдающих невынашиванием |
|
|
|
|
беременности |
|
|
|
|
Н.Г.Кошелева, Е.В.Никологорская |
35 |
|
|
|
|
|
|
|
|
Применение лактулозы в лечении запоров у беременных женщин |
|
|
|
|
Т.Н.Сокур, Н.В.Дубровина |
38 |
||
|
|
|
|
|
|
Резолюция Всероссийского конгресса |
|
|
|
|
«Амбулаторно-поликлиническая практика – новые горизонты» |
41 |
|
|
|
|
|
|
|
ПСИХОГИНЕКОЛОГИЯ Роль Афобазола в коррекции психоэмоциональных расстройств у женщин
в климактерическом периоде
Г.Б.Дорофеева, В.И.Дорофеев |
43 |
|
|
Оценка степени психоэмоциональных нарушений у юных женщин при первом медицинском аборте
М.Б.Красникова, В.Л.Юлдашев |
47 |

В О С П А Л И Т Е Л Ь Н Ы Е З А Б О Л Е В А Н И Я
Экология влагалища и воспалительные заболевания половых органов
И.И.Баранов ФГУ «Научный центр акушерства, гинекологии и перинатологии им. В.И.Кулакова»
Минздравсоцразвития РФ (дир. – акад. РАМН Г.Т.Сухих), Москва
Сбалансированное состояние вагинальной экосистемы обеспечива-
ется за счет особенностей анатомического строения влагалища, гистологической структуры слизистой оболочки, свойств влагалищной жидкости, спектра микрофлоры и ее метаболитов. При этом барьерная функция влагалища в отношении патогенных микроорганизмов, в том числе сексуаль- но-трансмиссивных инфекций, осуществляется благодаря целостности слизистой оболочки, механизмам врожденного иммунитета и функционированию нормальной микрофлоры.
åÂı‡ÌËÁÏ˚ Á‡˘ËÚ˚
Механизмы защиты слизистой оболочки влагалища включают в себя много факторов и являются продуктом совместной деятельности макроорганизма и микрофлоры, которые в комплексе защищают экосистему влагалища от патогенных микроорганизмов. Поверхность слизистых оболочек нижних половых путей женщины представляет собой главные ворота для входа инфекционных агентов, играет фундаментальную роль в патогенезе первичной инфекции.
Слизистые оболочки служат физическими барьерами (эпителиальные клетки и муцины), имеют низкий рН среды, осуществляют фагоцитоз, обусловленный гранулоцитами или макрофагами, освобождение реактивных видов кислорода и протеаз, имеющих антимикробные свойства, а также других биологически активных веществ (лизоцим, трансферазы, комплемент, фибронектин, дефенсины). Эти механизмы представляют первую линию локальной защиты, осуществляемой слизистыми оболочками, некоторые из них регулируются цитокинами или другими факторами, увеличивающими защиту от патогенов.
Обеспечение барьерной функции в отношении большинства микроорганизмов осуществляется за счет неспецифической иммунологической резистентности посредством выработанных в процессе фило- и онтогенеза систем. Система локальной иммунной защиты служит мощным препятствием инфицированию внутренних половых органов. Многослойный плоский эпителий слизистой оболочки влагалища преграждает путь инфекционным агентам в подлежащие тка-
ни. Помимо выполнения барьерной функции, в нормальных условиях эпителиальные клетки, защищающие женский репродуктивный тракт, контролируют микрофлору влагалища, продуцируя значительный ряд медиаторов врожденного иммунитета.
Высокая активность в секретах слизистых оболочек комплемента и лизоцима способствует бактериолизу, препятствует цитоадгезии микроорганизмов к слизистой оболочке. Катионные антимикробные полипептиды, включающие дефенсины, являются эффекторными молекулами врожденного иммунитета слизистых оболочек в защите от микробов и вирусов.
Защитный врожденный ответ против патогенных микроорганизмов инициируется вагинальным эпителием с помощью toll-подобных рецепторов, которые распознают ассоциированные с микробами молекулярные паттерны. Нормальная микрофлора слабо иммуногенна для организма-хо- зяина из-за того, что клетки слизистых оболочек характеризуются низкой или поляризованной экспрессией tolllike рецепторов. Экспрессия этих рецепторов может усиливаться в ответ на медиаторы воспаления.
Нейтрофилы являются первыми иммунными клетками, прибывающими на место инфекции. Они быстро инициируют микробиоцидную функцию, продуцируя антимикробные продукты и провоспалительные цитокины, способствующие сдерживанию инфекции. Это позволяет приобретенной иммунной системе иметь время для генерации иммунитета и памяти.
аППЫММ‡fl Б‡˘ЛЪ‡
Система локальной гуморальной иммунной защиты, важным компонентом которой является секреторный IgA, продуцируемый клетками слизистой оболочки влагалища и шейки матки, служит мощным препятствием инфицированию внутренних половых органов. Антитела могут служить прямым препятствием прикреплению бактерий или вирусов к поверхности слизистой оболочки, активизировать каскад комплемента в уничтожении чувствительных микроорганизмов, усиливать поглощение или разрушение микробов фагоцитарными клетками. Присутствие секреторного IgA коррелирует с устойчивостью к инфицирова-
нию разными патогенами бактериальной, вирусной и грибковой природы.
ЗО‡„‡ОЛ˘МУВ ТУ‰В КЛПУВ
Влагалищное содержимое состоит из жидкостного и клеточного компонентов, слизи, продуцируемой цервикальными железами, транссудата, десквамированного эпителия влагалища
иматки, лейкоцитов и микроорганизмов. Процесс образования влагалищного содержимого относительно постоянен и количественно составляет от 0,7 до 4,5 мл/сут. При половом возбуждении продукция влагалищной жидкости увеличивается, что происходит благодаря притоку крови во влагалищное венозное сплетение с последующей транссудацией.
Влагалищная жидкость содержит органические и неорганические вещест-
ва. Среди электролитов необходимо отметить ионы Na+, К+, Mg+ и хлориды, их содержание оказывает регулирующее воздействие на транссудацию ве-
ществ через слизистую оболочку влагалища. Концентрация Na+, К+ и хлоридов во влагалищной жидкости зна-
чительно отличается от показателей в крови. Так, например, содержание Са2+
иK+ во влагалищной жидкости в 6 раз
превышает этот показатель в плазме крови, уровень Na+ и хлоридов состав-
ляет соответственно 46 и 61% от уровня в плазме. Концентрация ионов Mg2+ в физиологических условиях в 4 раза выше, чем в сыворотке крови. Большую роль в регуляции метаболизма играют микроэлементы – железо, медь, цинк, кобальт, которые занимают важное место в обеспечении полноценности процессов фертильности и овуляции, нормального течения беременности. Установлено влияние половых гормонов на обмен микроэлементов в организме женщины.
Процесс транссудации носит пассивный характер, при этом эпителий
влагалища активно реабсорбирует ионы Na+ и воду, вследствие чего и формируется трансвагинальная разница потенциалов – один из важнейших биофизических показателей влагалища, во многом определяющий гомеостаз влагалищной жидкости и состав ее микрофлоры. Среднее количество белка во влагалищной жидкости составляет 18 мг/л. При электрофоретическом разделении определяются альбумин, α1-антитрипсин, α2-гаптогло-
4 ГИНЕКОЛОГИЯ | ТОМ 12 | №3

В О С П А Л И Т Е Л Ь Н Ы Е З А Б О Л Е В А Н И Я
бин, α2-макроглобулин, β-липопроте- иды, орозомукоид, церулоплазмин, а также IgА, IgG, IgМ, лактоферрин и трансферрин. Лактоферрин и трансферрин относятся к группе сидерофилинов, ограничивают доступность железа бактериям, прочно связывая этот микроэлемент, поэтому представляют собой самостоятельную систему естественного иммунитета. Железо, связанное с лактоферрином, может играть определенную роль в генерации активных форм кислорода ацидофильной микрофлорой влагалища. Особенно важно присутствие во влагалищной жидкости лактоферрина, поскольку этот белок сохраняет способность удерживать железо и в кислом диапазоне рН, характерном для влагалищной жидкости в норме.
åËÍ ÓÓ „‡ÌËÁÏ˚
Микроорганизмы используют железо для обеспечения синтеза главным образом железосеропротеидов и цитохромов. В условиях дефицита железа микроорганизмы усиленно продуцируют сидерохромы, при этом вирулентность микроорганизмов в значительной степени зависит от способности сидерохромов конкурировать с сидерофилинами организма-хозяина за присутствующее в тканях и биологических жидкостях железо. С этим можно связать тот факт, что при бактериальном вагинозе происходит 30-кратное увеличение содержания трансферрина во влагалищной жидкости. При сидеропенических состояниях нарушается метаболизм эпителиальных клеток, что приводит к атрофии слизистых оболочек. Возможно, это является одной из причин нарушения функции и повышенной десквамации эпителия при бактериальном вагинозе.
IgA и IgG преимущественно поступают во влагалище из крови или частично синтезируются в слизистой оболочке влагалища. Роль этих белков велика, поскольку они участвуют в формировании неспецифического иммунитета влагалища и обеспечивают защиту от болезнетворных микроорганизмов.
дЛТОУЪ˚
Молочная, уксусная, а также летучие жирные кислоты с короткой углеродной цепочкой также являются важными составляющими содержимого влагалища. Они образуются из углеводов, попадающих во влагалищную жидкость из клеток эпителия. Лактобактерии ферментируют углеводы до алифатических жирных кислот, которые являются нормальной физиологической составляющей влагалищной жидкости и обеспечивают поддержание кислотности влагалищного содержимого. В норме рН соответствует кислому диапазону и находится в пределах 3,7–4,5. Во влагалищной жидкости обнаружены 13 аминокислот: аланин,
аргинин, аспарагиновая кислота, глицин, гистидин, лейцин, изолейцин, пролин, серин, таурин, треонин, триптофан и валин. Количественно содержание аминокислот приближается к значениям в плазме крови, однако уровнь содержания глутаминовой кислоты и цистеина имеет тенденцию к увеличению.
аМЩВНˆЛУММУ-‚УТФ‡ОЛЪВО¸М˚В Ф УˆВТТ˚
Вразвитии осложнений беременности (преждевременные роды, разрыв амниотических оболочек и др.) наряду с указанными ферментами важная
роль принадлежит фосфолипазе А2 как ферменту, активирующему простагландиновый синтез. При микстин-
фекциях активность фосфолипазы А2 во влагалищной жидкости достоверно выше, чем при моноинфекции. Актив-
ность этого фермента ингибируется ионами Са2+. Малейшее изменение баланса кальция приводит к изменению суммарной гидролитической активности фосфолипазы. В небольших количествах во влагалищной жидкости обнаруживается и фосфолипаза С.
Вцервикальной слизи содержится до 5 нг/г влажной массы простагландинов, что превышает их содержание
вдругих органах. Природа и биологическое значение их столь высокого содержания не определены. Важным компонентом активации простагландинового синтеза является повышение при влагалищных инфекциях содержания эндотоксина. Гемолитический эндотоксин (цитолизин) массой 59 кД относится к так называемым сульфгидрильным цитолизинам, которые при контакте с клеточной мембраной вызывают разрушение клетки. Эндотоксин продуцируется грамположительными бактериями и по своим биологическим параметрам похож на гемолизин Escherichia coli, его действие блокируется осмотическими протекторами и экзогенными липидными мембранами.
Существует много факторов, которые наносят вред экосистеме влагалища и приводят к снижению иммунной защиты. Присоединение патогенной микрофлоры приводит к воспалению и облегчению проникновения через эпителий в кровь полового партнера таких опасных возбудителей болезней, как вирусы гепатита В и С, герпеса, ВИЧ и др. Очевидно, что состояние местного иммунитета играет важную роль в поддержании оптимальных физиологических условий, а также в патогенезе инфекционных заболеваний влагалища.
Инфекционно-воспалительные заболевания мочеполовых органов вызываются большой группой бактерий и вирусов. Наиболее часто наряду с гонококками, трихомонадами, хламидиями обнаруживаются условно-пато- генные строгие анаэробные микроорганизмы – бактероиды, пептококки,
пептострептококки, фузобактерии, а также представители кишечной микрофлоры семейства Enterobacteriaceae. Подобные полимикробные процессы (микстинфекции) характеризуются тем, что этиологическим фактором выступает не какой-либо отдельно взятый микроб, а их ассоциация с присущими только ей биологическими свойствами.
За последние 100 лет отчетливо прослеживается эволюция возбудителей, вызывающих инфекционные заболевания женских половых органов. Так, до применения сульфаниламидных препаратов (до 1930-х годов) основным возбудителем послеродовых, послеабортных и хирургических инфекций являлся стрептококк. Появление сульфаниламидов способствовало уменьшению частоты стрептококковых инфекций и увеличению стафилококковых. Открытие и применение антибиотиков привели к постепенному преобладанию грамотрицательной микрофлоры (в основном группы энтеробактерий). В настоящее время реальную клиническую значимость приобрела группа так называемых услов- но-патогенных возбудителей.
аМЪЛПМ‡fl „Л„ЛВМ‡
Важность регулярной интимной гигиены, стабильность рН и микрофлоры влагалища в поддержании сбалансированного состояния вагинальной экосистемы широко известна и достаточно описана. Основой нормальной вагинальной микрофлоры являются лактобактерии, продуцирующие молочную кислоту и поддерживающие рН среды в диапазоне 3,8–4,5, что создает естественный барьер для проникновения и размножения условно-па- тогенных микроорганизмов. Вульварная рН у женщин в репродуктивном периоде составляет 5,2, она менее кислая по сравнению с рН влагалища, но вполне достаточна для защиты наружных половых органов от посторонних воздействий и раздражений. В течение менструального цикла рН влагалища изменяется у одной и той же женщины. Соответственно изменениям рН в определенных пределах может изменяться и микрофлора.
Снижение уровня эстрогенов во время менструации, лактации, а также у женщин с хронической гипоэстрогенией приводит к уменьшению гликогеновой насыщенности влагалищного эпителия, сокращению количества лактобактерий, уменьшению образования молочной кислоты и резкому повышению рН. Это создает условия для колонизации влагалища услов- но-патогенной флорой и является пусковым механизмом в развитии вагинитов, бактериального вагиноза и кандидоза. В постменопаузе глубокий дефицит эстрогенов предопределяет клиническую картину вульвовагинальной атрофии и атрофического вагинита.
ГИНЕКОЛОГИЯ | ТОМ 12 | №3 5

В О С П А Л И Т Е Л Ь Н Ы Е З А Б О Л Е В А Н И Я
В ряде исследований доказана корреляция между вагинальным водородным показателем и интимной гигиеной в разных возрастных группах и патофизиологических состояниях (препубертатный, детородный, беременность, лактация, предменопауза и менопауза) женщин, особенно учитывая навыки и привычки в гигиене и одежде (в том числе использование прокладок).
Обмывание наружных половых органов – важная часть интимной гигиены. При нарушении кислотно-щелоч- ного баланса вульвы риск активизации любой, в том числе и вирусной инфекции возрастает. Процесс обмывания наружных половых органов для профилактики вирусных инфекций целесообразнее осуществлять с применением немыльных средств, исключающих ощелачивание вульварной среды и возникновение или поддержание бактериального вагиноза и возможное обострение вирусных инфекций. Поэтому лучше использовать те средства, которые нормализуют или, по крайней мере не влияют на нормальный кислотно-щелочной баланс.
Для гигиены рекомендовано использование природных растительных экстрактов, в частности экстрактов шалфея (Salvia officinalis), тимьяна (Thymus vulgaris) и ромашки (Chamomila matricaria), которые обладают фармакологической и микробиологической активностью, причем их действие связывают с наличием в них активных компонентов, которыми являются, соответственно, салвиол и пинен, тимол и карвакрол и бисаболол. Для всех перечисленных натуральных растительных экстрактов (шалфей, тимьян и ромашка) клинически подтверждены экспериментальные данные по их активности в отношении бактерий, микозов и воспалений. В результате антибактери-
ального и микостатического действия активных компонентов, содержащихся в экстрактах тимьяна и шалфея, вагинальный pH был уменьшен до нормального значения, что подтверждает полезность использования в интимной гигиене подходящих средств, предназначенных для защиты от вульвовагинальных инфекций.
г‡НЪ‡ˆЛ‰ оВПЛМ‡
Помимо средств растительного происхождения, заслуживает внимания Лактацид Фемина – серия средств интимной гигиены для женщин разного возраста. Указанные средства предназначены не просто для очищения и ухода за областью наружных половых органов, но еще и обеспечивают естественную защиту от воспаления и инфекций.
Лечебно-профилактический эффект средств данной серии обеспечивается за счет содержания молочной кислоты и рН 5,2 (средство ежедневной интимной гигиены, мусс, салфетки) для женщин репродуктивного возраста и рН 3,5 – средство для чувствительной кожи, которое показано женщинам старшей возрастной группы. Молочная кислота помогает поддерживать и восстанавливать физиологический рН наружных половых органов, что способствует росту лактобактерий и препятствует размножению условно-патогенной флоры. Уникальной особенностью Лактацида является отсутствие мыла в его составе, мягкие моющие компоненты (лаурилсульфат магния) очищают кожу и слизистые оболочки половых органов, удаляют раздражающие выделения и колонизирующие промежность микроорганизмы.
Исследования, проведенные в нашей стране и за рубежом, подтвердили отсутствие побочных эффектов и нежелательных реакций, поэтому сред-
ства серии Лактацид Фемина можно широко рекомендовать женщинам для ежедневной интимной гигиены.
Это позволяет:
•поддерживать и восстанавливать нормальный рН и состав микрофлоры половых путей в репродуктивном возрасте, профилактируя развитие дисбиозов и вагинитов;
•значительно уменьшить выраженность симптомов вульвовагинальной атрофии (сухость, зуд, дискомфорт) и атрофического вагинита (выделения, запах) в постменопаузе.
Таким образом, вагинальная экосистема – это изолированная и достаточно защищенная структура. Вместе
стем баланс этой системы легко изменяется под влиянием анатомической близости с прямой кишкой и мочевым пузырем, гормонального профиля, беременности, травм, половых актов, фармакологического лечения, несоблюдения правил гигиены.
Литература
1.Заболевания шейки матки, влагалища и вульвы. Под ред. В.Н.Прилепской. М.: МЕДпресс, 2003.
2.Прилепская В.Н., Межевитинова Е.А. Предменструальный синдром. Гинекология. 2005; 67 (4): 210–4.
3.Роговская С.И., Прилепская В.Н. Профилактика папилломавирусной инфекции и рака шейки матки. Гинекология. 2005; 7 (1): 3–6.
4.Anelli R, Benvenuti C, Tortora L. Sophy study group,
Clinical activity of plant extracts in intimate hygiene. 12th World Cong Hum Reprod, 10–13 March, Venice, Italy, 2005.
5.Benvenuti C, Camana MG, Mortara E et al. Natural compounds from plant extract in gynaecology. 12th World Cong Hum Reprod, 10–13 March,Venice, Italy, 2005.
6.Braga PC, Dal Sasso M, Culici M, Mucci M. Thymol: inhibitory activity on Escherichia coli and Staphylococcus aureus adhesion to human vaginal cells. 12th World Cong Hum Reprod, 10–13 March, Venice, Italy, 2005.
7.Mussida M, Rosa C, Infantino M, PIFAROTTI G. Importance of Salvia officinalis extract in intimate hygiene.
11th International Congress of Gynecological Endocrinology (ISGE), February 26–29, 2004 Florence, Italy.
8.Saller R, Buechi S, Meyrat R.. SCHMIDHAUSER C. Combined herbal preparation for topical treatment of herpes labialis. Forsch Komplementarmed K Natur 2001; 8: 373–82.
Подходы к рациональному выбору антибактериальной терапии воспалительных заболеваний органов малого таза у женщин
В.В.Рафальский, Е.В.Довгань, М.В.Остроумова ГОУ ВПО Смоленская государственная медицинская академия Росздрава (ректор – проф. И.В.Отвагин)
оспалительные заболевания ор- |
перитонита. ВЗОМТ представляют |
По данным российских исследовате- |
Вганов малого таза (ВЗОМТ) у |
собой одну из наиболее распростра- |
лей, ВЗОМТ выявляются у 60–65% |
женщин представляют собой группу |
ненных групп инфекционных забо- |
всех гинекологических больных, а |
инфекционно-воспалительных за- |
леваний, встречающихся среди жен- |
общее число пациенток с данным |
болеваний области верхних отделов |
щин репродуктивного возраста. В |
диагнозом достигает 1 млн ежегод- |
репродуктивного тракта, включаю- |
США в течение жизни 8–15% жен- |
но. Количество больных с сальпин- |
щих любую комбинацию эндомет- |
щин переносят хотя бы один эпизод |
гоофоритом увеличилось с 1206,1 в |
рита, сальпингита, оофорита, тубо- |
ВЗОМТ, в некоторых популяциях |
1997 г. до 1360,6 на 100 тыс. женщин |
овариального абсцесса и тазового |
данный показатель достигает 32% [1]. |
в 1999 г. |
6 ГИНЕКОЛОГИЯ | ТОМ 12 | №3
В О С П А Л И Т Е Л Ь Н Ы Е З А Б О Л Е В А Н И Я
Интерес к ВЗОМТ обусловлен прежде всего тем, что инфекции из данной группы сопровождаются рядом значимых для здоровья женщины отдаленных последствий. Среди женщин, которые перенесли эпизод острой ВЗОМТ, отмечается повышенный риск бесплодия, внематочной беременности, развития хронических тазовых болей и рецидива инфекции. Лечение и реабилитация пациенток, страдающих ВЗОМТ, сопровождаются значительными материальными затратами. Так, в США ежегодно на лечение ВЗОМТ и их осложнений тратится 1,8 млрд дол. [2].
щЪЛУОУ„Л˜ВТНЛВ УТУ·ВММУТЪЛ
Основным компонентом лекарственной терапии ВЗОМТ является использование антибактериальной терапии, рациональное назначение которой невозможно без учета этиологии этой группы инфекций. Несмотря на значительное количество информации, накопленной в мире по этому вопросу, данные по этиологии ВЗОМТ пересматриваются и в настоящее время являются поводом для обсуждения. Отправной точкой при выборе антимикробной терапии любой инфекции, в том числе и ВЗОМТ, является анализ типичных возбудителей инфекции и сопоставление его с активностью и фармакинетикой антимикробных препаратов.
Точно охарактеризовать этиологию ВЗОМТ крайне сложно, это связано с клиническими и микробиологическими особенностями ВЗОМТ – широким спектром потенциальных возбудителей, полиэтиологичностью, сложностью забора материала для микробиологического изучения и интерпретацией результатов исследования, наличием существенных географических различий в структуре возбудителей. С практической точки зрения при выборе антимикробной терапии целесообразно выделять четыре группы возбудителей ВЗОМТ: Neisseria gonorrhoeae, Chlamydia trachomatis, анаэробы и грамотрицательные аэробные палочки. Такая классификация, несмотря на определенную условность, позволяет учитывать принципиальные различия в природной и приобретенной устойчивости перечисленных микроорганизмов к антимикробным препаратам.
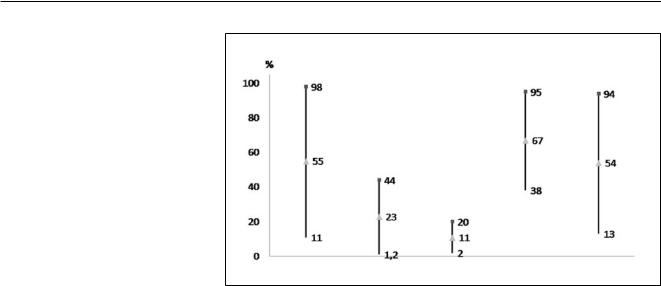
Частота выделения N. gonorrhoeae при ВЗОМТ варьирует от 11 до 98% [3]. Существуют исследования, в которых показана невысокая частота выделения N. gonorrhoeae при ВЗОМТ – 0–5%
[4].Сходные данные выявлены в работах отечественных ученых: распространенность штаммов N. gonorrhoeae при острых ВЗОМТ составляла 5,5%
[5].В то же время, по данным исследователей из США, роль гонококков в развитии ВЗОМТ является более весомой и составляет 33–81% [2]. Возможно, некоторое преувеличение роли
Частота выделения возбудителей острых ВЗОМТ (сводные данные).
N. gonorrhoeae |
C. trachomatis |
M. genitalium |
Аэробы |
Анаэробы |
|
|
|
|
|
N. gonorrhoeae в этиологии ВЗОМТ обусловлено тем, что в подавляющем большинстве исследований забор биообразцов осуществлялся из нижних отделов полового тракта (шейка матки), а не непосредственно из очага инфекции (эндометрий, фаллопиевы трубы). При таком подходе с большей вероятностью выделяются N. gonorrhoeae и C. trachomatis и одновременно может происходить недооценка роли анаэробных и аэробных микроорганизмов, более того, ряд авторов выделяют так называемые негонококковые ВЗОМТ. Еще одной возможной причиной неоднозначной интерпретации этиологии ВЗОМТ являются разные подходы к трактовке самого диагноза ВЗОМТ, сложившиеся в условиях разных систем здравоохранения. Если сравнить этиологию ВЗОМТ в Северной Америке и России, то очевидным становится преобладание гонококковой этиологии ВЗОМТ в США и Канаде, тогда как в России этот возбудитель выделяется относительно нечасто.
Необходимо отметить, что оценка места N. gonorrhoeae в структуре возбудителей ВЗОМТ является основополагающей для выбора схемы антимикробной терапии, прежде всего с точки зрения принятия решения о включении препарата с достаточной активностью в отношении гонококков. Этот вопрос стал особенно остро в последние 5–7 лет, когда в мире и в Российской Федерации резко увеличилась частота выделения резистентных к фторхинолонам штаммов N. gonorrhoeae: в России он достигает 49,1% [6]. Наиболее активными в отношении N. gonorrhoeae являются цефалоспорины ІІІ поколения (цефтриаксон, цефиксим), штаммов, устойчивых к этим антибиотикам, не выделяется [6].
Частота выделения C. trachomatis при ВЗОМТ колеблется от 1,2 до 44% (см. рисунок). Следует отметить, что в исследованиях, в которых забор материала для микробиологического исследования выполнялся лапароскопически, частота выделения C. trachoma-
tis была несколько меньше и варьировала от 9 до 30% [7]. Зарубежные данные вполне согласуются с результатами отечественных исследований, в которых показано, что C. trachomatis вызывает острые ВЗОМТ в 18,8% случаев [5]. Необходимо отметить, что до настоящего времени не показана зависимость между чувствительностью C. trachomatis к антибиотикам in vitro и клинической эффективностью препаратов, поэтому резистентность C. trachomatis к антимикробным препаратам не является ключевым фактором неэффективности терапии хламидийной инфекции и не оказывает существенного влияния на выбор антимикробной терапии ВЗОМТ.
Ведущая роль аэробных и анаэробных микроорганизмов в возникновении ВЗОМТ установлена еще в 1960–1970-е годы. Наиболее часто при острых ВЗОМТ выделяют ассоциации аэробных и анаэробных микроорганизмов, при этом следует отметить, что частота выделения ассоциаций аэробов и анаэробов, по данным разных исследований, значительно варьирует и составляет от 13 до 94%. По данным отечественных исследователей, наиболее распространенными представителями аэробных микроорганизмов при острых ВЗОМТ являются представители семейства Enterobacteriaceae (35,9%), такие как E. coli, Klebsiella spp. и Enterobacter aerogenes. Из числа анаэробов (20,2%) наиболее часто выделяются Fusobacterium spp., Bacteroides urealyticus и Prevotella spp.
Также в 11,4% случаев острые ВЗОМТ были вызваны штаммами Enterococcus faecalis [8].
Ксожалению, как в зарубежной, так
ив отечественной литературе существуют единичные публикации, посвященные исследованиям чувствительности возбудителей ВЗОМТ к антибиотикам. Известно, что штаммы E. coli, выделенные от пациенток с острыми ВЗОМТ, в 100% случаев чувствительны к эртапенему, цефтриаксону и в 84% к ко-амоксиклаву. Klebsiella pneumonia и Proteus mirabilis сохраняли
ГИНЕКОЛОГИЯ | ТОМ 12 | №3 7

В О С П А Л И Т Е Л Ь Н Ы Е З А Б О Л Е В А Н И Я
Таблица 1. Сравнительная микробиологическая активность антимикробных препаратов в отношении основных возбудителей ВЗОМТ
Препарат |
Основные возбудители ВЗОМТ |
|
|||
|
|
|
|
|
|
|
грамотрицательные |
анаэробы |
хламидии |
гонококки |
|
|
|
бактерии |
|
|
|
|
|
|
|
|
|
ИЗП (ко-амоксиклав) |
+++ |
+++ |
- |
+/- |
|
Цефамицины (цефотетан, цефокситин) |
++ |
+++ |
- |
+++ |
|
Цефалоспорины III поколения (цефтриаксон, цефотаксим, цефиксим) |
+++ |
- |
- |
+++ |
|
Классические фторхинолоны (ципро-, офло-, пефлоксацин) |
+++ |
- |
+/-1 |
+/-2 |
|
«Новые» фторхинолоны (левофлоксацин, моксифлоксацин) |
+++ |
-/++3 |
+++ |
+/-2 |
|
Макролиды |
- |
- |
+++ |
+/-4 |
|
Доксициклин |
- |
- |
+++ |
- |
|
Метронидазол |
- |
+++ |
- |
- |
|
Гентамицин |
+++ |
- |
- |
- |
|
Линкозамиды |
- |
+++ |
- |
- |
|
1Большей активностью обладает офлоксацин; 2в России уровень резистентности равен 49%; 3моксифлоксацин; 4в России уровень резистентности равен 14%.
чувствительность к цефтриаксону и ципрофлоксацину в 100% случаев, а к ко-амоксиклаву – в 95 и 100% случаев соответственно. Штаммы S. aureus и стрептококки группы В были чувствительны к ко-амоксиклаву и цефтриаксону в 100% случаев. Наряду с этим энтерококки сохраняли высокую чувствительность к ко-амоксиклаву и ципрофлоксацину (в 99 и 91% случаев соответственно) [9]. По данным отечественных авторов, представители семейства Enterobacteriaceae, выделенные при острых ВЗОМТ, сохраняют наибольшую чувствительность к аминогликозидам (87,8–97,6%), фторхинолонам (80,5%) и ко-амоксиклаву (65,8%). Наряду с этим к таким антибиотикам, как ампициллин, тетрациклин и доксициклин, резистентны более 50% выделенных штаммов [8].
Анаэробные микроорганизмы в 100% случаев чувствительны к метронидазолу [9]. К клиндамицину сохраняют чувствительность более 90% штаммов Fusobacterium spp., B. fragilis, Bacteroides ureolyticus, Porphyromonas spp., P. bivia, Prevotella spp. и Peptostreptococcus spp. [9]. Однако, по данным других авторов, чувствительность представителей анаэробов к клиндамицину составляет менее 90% [10].
ЗУБПУКМУТЪЛ ‡МЪЛПЛН У·М˚ı Ф ВФ‡ ‡ЪУ‚
В клинической практике для лечения ВЗОМТ используется несколько классов антимикробных препаратов, которые применяются, как правило, в комбинациях (табл. 1). Это β-лактамы (цефалоспорины, ингибиторозащищенные пенициллины – ИЗП), фторхинолоны, линкозамиды, аминогликозиды, тетрациклины, нитроимидазолы.
дУ-‡ПУНТЛНО‡‚
Из группы пенициллинов для терапии ВЗОМТ реальное клиническое значение сохраняют ИЗП, прежде всего ко-амоксиклав. Ко-амоксиклав обладает широким спектром антимикробного действия, позволяющим перекрыть две основные группы возбудителей ВЗОМТ – грамотрицательные
бактерии (E. coli, P. mirabilis, Klebsiella spp., P. vulgaris) и анаэробы (в том числе группы B. fragilis). ИЗП in vivo не обладают активностью в отношении внутриклеточных возбудителей (хламидии и микоплазмы) и в большинстве случаев не активны против пени- циллин-резистентных гонококков. Ко-амоксиклав обладает хорошими фармакокинетическими параметрами, при пероральном приеме препарата в дозе 1000 мг пиковая концентрация в плазме (Cmax) составляет 10,01±3,16 мг/л (амоксициллин) и 2,65±1,27 (клавулановая кислота), а в тканях органов репродуктивного тракта – 45–75% (амоксициллин) и 20–50% (клавулановая кислота) его пиковой концентрации в плазме [11]. Ко-амоксиклав создает высокие концентрации в перитонеальной жидкости полости малого таза, при внутривенном введении в дозе 1200 мг концентрация препарата через 60–75 мин после инфузии составляет 14,0±6,6 мг (амоксициллин) и 4,17±1,15 (клавулановая кислота) [12]. Клиническая эффективность ко-амок- сиклава, назначаемого внутривенно, в дозировке 1200 мг 3 раза в сутки с дальнейшим переходом на пероральный прием составляет 93–96% [3]. Существует опыт применения ко-амок- сиклава в комбинации с макролидом, в частности с рокситромицином, терапия с использованием такой схемы позволяла добиться излечения у 81,8% больных, а улучшения – у 18,2% [13]. Высокая клиническая и микробиологическая эффективность ко-амоксик- лава при лечении ВЗОМТ подтверждена в метаанализе клинических исследований. Так, клиническая эффективность препарата варьировала в пределах 93–100%, а микробиологическая достигала 100% [3].
сВЩ‡ОУТФУ ЛМ˚
Присутствие цефалоспоринов II–III поколения во всех рекомендациях по терапии ВЗОМТ объясняется высокой активностью препаратов данной группы в отношении основных возбудителей ВЗОМТ – прежде всего гонококков и грамотрицательных бактерий.
Некоторые цефалоспорины, такие как цефотетан, активны также в отношении анаэробных микроорганизмов. Необходимо подчеркнуть, что в настоящее время цефалоспорины III поколения (цефтриаксон, цефотаксим, цефиксим) остаются единственным классом антибактериальных препаратов, обладающих высокой активностью против гонококков. Цефалоспорины, в частности цефтриаксон, создают высокие концентрации как в плазме крови, так и в органах женской репродуктивной системы. При однократном внутривенном введении цефтриаксона в дозе 1000 мг Cmax в плазме крови достигает 150–160 мг/л, при этом он создает высокие концентрации в эндометрии (50 мг/кг), шейке матки (32 мг/кг), яичниках (30 мг/кг) и теле матки (23 мг/кг) [14]. По данным метаанализа исследований, комбинация цефалоспоринов с препаратами, обладающими активностью в отношении внутриклеточных возбудителей (доксициклин), клинически эффективна более чем в 90% случаев и приводит к эрадикации возбудителей инфекции более чем в 95% случаев [3].
оЪУ ıЛМУОУМ˚
В последние десятилетия для терапии ВЗОМТ активно используют препараты из группы фторхинолонов. Фторхинолоны обладают широким спектром антимикробного действия, включающим возбудителей ВЗОМТ, прежде всего грамотрицательных аэробных бактерий (E. coli, Klebsiella spp., Enterobacter spp., Proteus mirabilis, Proteus vulgaris). Представители «новых» фторхинолонов (левофлоксацин, моксифлоксацин) проявляют клинически значимую активность в отношении внутриклеточных возбудителей (Chlamydia spp., Mycoplasma spp.) и анаэробов (моксифлоксацин). Представители фторхинолонов, входящие в международные рекомендации по терапии ВЗОМТ (левофлоксацин, офлоксацин), отличаются от классических фторхинолонов (ципрофлоксацин) улучшенной фармакокинетикой и более широким спектром активности. В частности, левофлоксацин обладает
8 ГИНЕКОЛОГИЯ | ТОМ 12 | №3

В О С П А Л И Т Е Л Ь Н Ы Е З А Б О Л Е В А Н И Я
высокой биодоступностью, которая приближается к 100% и создает высокие концентрации в органах и тканях женской репродуктивной системы. При однократном пероральном приеме препарата в дозе 200 мг его концентрация в плазме через 3 ч составляет 2,33 мг/л, а в органах и тканях женской репродуктивной системы – 3,5 мг/кг [15]. В мире накоплен значительный клинический опыт использования фторхинолонов при ВЗОМТ как в режиме монотерапии, так и в комбинациях с другими антибиотиками, прежде всего с антианаэробными (метронидазол) и противохламидийными (доксициклин, макролиды). Данные метаанализа клинических исследований свидетельствуют о том, что клиническая эффективность применения фторхинолонов при ВЗОМТ превышает 90%, а микробиологическая – 95% [3]. Наибольший опыт использования накоплен для таких представителей фторхинолонов, как ципрофлоксацин, офлоксацин, левофлоксацин. В последние годы появляются работы о возможности использования для терапии ВЗОМТ моксифлоксацина. Новые фторхинолоны (левофлоксацин, моксифлоксацин) обладают рядом объективных преимуществ: высокой активностью против внутриклеточных возбудителей, возможностью приема 1 раз в сутки.
å‡Í ÓÎˉ˚
Макролиды обладают узким спектром антимикробного действия, клиническое значение для терапии ВЗОМТ имеет только активность в отношении C. trachomatis и микоплазм. Активность макролидов против анаэробов и грамотрицательных бактерий клинически не значима. В последние годы отмечается рост устойчивости N. gonorrhoeae к макролидам, которая в России в зависимости от региона варьирует в пределах 0–21% [6], в связи с чем они (чаще всего азитромицин) используются при ВЗОМТ только в комбинации с другими препаратами. Хорошо изучена способность азитромицина создавать высокие концентрации в органах репродуктивного тракта у женщин. При однократном пероральном приеме азитромицина в
дозе 500 мг его Cmax в плазме крови составляет 0,5 мг/л, а через 24 ч кон-
центрация препарата в тканях женских половых органов достигала 1,44 мг/кг [16]. Клиническая и микробиологическая эффективность азитромицина при ВЗОМТ в комбинации с метронидазолом составляет 98,1 и 95,5% соответственно [3].
СУНТЛˆЛНОЛМ
Доксициклин является обязательным компонентом подавляющего большинства схем терапии, входящих в международные и национальные рекомендации по лечению ВЗОМТ. Клиническое значение доксициклина в
терапии ВЗОМТ определяет его высокая активность в отношении хламидий. Особенности фармакокинетики доксициклина позволяют эффективно применять его для лечения инфекций репродуктивного тракта у женщин. При однократном пероральном приеме доксициклина в дозе 200 мг Cmax препарата в плазме крови достигает 5,9 мг/л. При приеме доксициклина в суточной дозе 100 мг концентрация препарата в слизистой оболочке фаллопиевых труб составляла 1,3 мг/кг. В связи с отсутствием активности тетрациклинов в отношении ряда возбудителей ВЗОМТ (грамотрицательные аэробы, анаэробы, гонококки) препараты из данной группы необходимо комбинировать с другими антибиотиками [17].
åÂÚ ÓÌˉ‡ÁÓÎ
Метронидазол, обладая высокой антианаэробной активностью, на протяжении длительного времени входит в состав схем антибактериальной терапии ВЗОМТ. Резистентность анаэробов к метронидазолу развивается крайне медленно и в настоящее время находится на низком уровне, что позволяет рассматривать метронидазол в качестве основного антианаэробного препарата. Метронидазол создает высокие концентрации в плазме крови. Так, после однократного перорального приема препарата в дозе 750 мг че-
рез 3,5 ч его Cmax достигала 8,7 мг/л. При этом метронидазол хорошо про-
никает в ткани и жидкости органов малого таза у женщин: при внутривенном введении метронидазола в дозе 500 мг концентрация препарата в перитонеальной жидкости малого таза через 1 ч достигает уровня 4,3–19,5 мг/л. Также было показано, что концентрация метронидазола в тканях матки составляет 8, 22,3 мг/кг (в шейке матки), 6,3 мг/кг (в фаллопиевых трубах) и 2,1 мг/кг (в яичниках) [18]. В связи с узким спектром антимикробного действия метронидазол при терапии ВЗОМТ рекомендуется комбинировать с антибиотиками из других групп – тетрациклинами, цефалоспоринами. Комбинация доксициклина с метронидазолом входит в большинство зарубежных рекомендаций по лечению ВЗОМТ на амбулаторном этапе. Это объясняется тем, что ее применение позволяет достичь эрадикации анаэробов и внутриклеточных возбудителей ВЗОМТ (хламидии, микоплазмы). В то же время эта комбинация не обладает достаточной активностью в отношении грамотрицательных аэробов и гонококков. Возможно, именно этим объясняется ее низкая эффективность, установленная в ряде клинических исследований.
гЛМНУБ‡ПЛ‰˚
Линкозамиды (линкомицин, клиндамицин) в течение последних десятилетий достаточно активно исполь-
зовались в гинекологии, однако в последние годы место этих антибиотиков в терапии ВЗОМТ пересматривается. Клиническое значение для терапии ВЗОМТ имеет активность линкозамидов против неспорообразующих анаэробов – пептококков, пептострептококков, фузобактерий, бактероидов (включая большинство штаммов B. fragilis). Линкозамиды не активны в отношении грамотрицательных аэробов, хламидий и гонококков, а по антианаэробной активности уступают имидазолам: частота выделения анаэробов, устойчивых к клиндамицину, варьирует в пределах 0–13%.
ДПЛМУ„ОЛНУБЛ‰˚
Представители аминогликозидов обладают относительно узким спектром активности, клиническое значение имеет активность в отношении грамотрицательных бактерий (E. coli, Proteus spp., Klebsiella spp., Enterobacter spp.). Аминогликозиды не активны в отношении гонококков, анаэробов и внутриклеточных возбудителей (хламидии, микоплазмы). В современных руководствах как одна из альтернативных схем рекомендуется использование клиндамицина в комбинации с аминогликозидами. Клиническая эффективность такой комбинации антимикробных препаратов составляет 92%, а микробиологическая достигает 97% [3]. Однако следует учитывать неблагоприятный профиль безопасности аминогликозидов, прежде всего ототоксичность, вестибулотоксичность и нефротоксичность, что требует назначения коротких курсов данных препаратов и ограничения их применения в амбулаторной практике. Линкозамиды в свою очередь достаточно часто вызывают развитие тяжелой нежелательной реакции – псевдомембранозного колита. Кроме того, схема линкозамид + гентамицин не обладает достаточной активностью в отношении хламидий и гонококков.
í ‡ÔËfl
Как уже обсуждалось выше, отличительными особенностями ВЗОМТ является полиэтиологичность, широкий спектр потенциальных возбудителей, что предопределяет две основных тенденции в проведении антибактериальной терапии: использование препаратов широкого спектра действия или комбинаций. Существует ряд авторитетных международных руководств по лечению ВЗОМТ, созданных учеными США, ВОЗ, странами Европейского содружества. Эти руководства практически полностью повторяют или в значительной степени базируются на руководстве Центра по контролю за инфекционными заболеваниями (CDC) США, последний пересмотр этого документа был опубликован в 2007 г. [19]. Позволим себе провести сравнительный анализ североамериканских и российских рекомендаций
ГИНЕКОЛОГИЯ | ТОМ 12 | №3 9

|
|
В О С П А Л И Т Е Л Ь Н Ы Е З А Б О Л Е В А Н И Я |
||
|
||||
Таблица 2. Рекомендуемые дозы и длительность применения антибиотиков при ВЗОМТ |
||||
|
|
|||
Название |
Доза, способ применения, длительность терапии |
|||
|
|
|||
Амоксициллин/клавуланат |
Внутривенно 1000 мг/200 мг 3–4 раза в сутки, внутрь 500 мг/125 мг 3 раза в сутки или 1000 мг/200 мг 2 раза |
|||
|
|
в сутки, до 14 сут |
|
|
Гентамицин |
Внутривенно или внутримышечно 5–6 мг/кг 1 раз в сутки |
|||
Доксициклин |
Внутривенно 100 мг 2 |
раза в сутки, внутрь 100 мг 2 раза в сутки, до 14 сут |
||
Клиндамицин |
Внутривенно 900 |
мг 3 |
раза в сутки, внутрь 300 мг 4 раза в сутки, до 14 сут |
|
Левофлоксацин |
Внутривенно 500 |
мг 1 |
раз в сутки, внутрь 500 мг 1 раз в сутки, до 14 сут |
|
Метронидазол |
Внутривенно 500 |
мг 3 |
раза в сутки, внутрь 500 мг 2 раза в сутки, до 14 сут |
|
Офлоксацин |
Внутривенно 400 |
мг 2 |
раза в сутки, 400 мг 2 раза в сутки |
|
Цефтриаксон |
Внутримышечно 0,25 г однократно |
|||
|
|
|
|
|
Таблица 3. Сравнительная характеристика режимов терапии ВЗОМТ, предлагаемых в зарубежных и российских рекомендациях
США (CDC, 2007 г. [19]) |
Россия [20] |
||
|
|
|
|
пероральные режимы |
парентеральные режимы |
пероральные режимы |
парентеральные режимы |
Цефтриаксон + доксициклин |
Цефтотетан (цефокситин) |
Ко-амоксиклав + доксициклин |
Ко-амоксиклав + доксициклин |
± метронидазол |
+ доксициклин |
|
|
Цефокситин/пробеницид |
Клиндамицин + гентамицин |
Клиндамицин |
Клиндамицин + гентамицин |
+ доксициклин ± метронидазол |
|
|
|
Цефалоспорин III поколения |
Ампициллин/сульбактам |
Левофлоксацин или |
Левофлоксацин или офлоксацин + |
внутримышечно + |
+ доксициклин |
офлоксацин + метронидазол |
метронидазол |
доксициклин ± метронидазол |
|
|
|
|
|
|
|
по терапии ВЗОМТ. Как CDC, так и российские руководства выделяют два варианта терапии – с использованием парентеральных и пероральных режимов терапии. Очевидно, что инъекционное введение антибиотиков должно использоваться при более тяжелых инфекциях у пациенток, требующих госпитализации. Парентеральный и пероральные режимы использования антибиотиков не являются взаимоисключающими и часто бывают последовательными этапами ступенчатой терапии, когда после нормализации температуры тела и при снижении выраженности признаков интоксикации возможен переход на прием антибиотиков внутрь.
Практически нет отличий в отечественных и зарубежных рекомендациях в дозировке, кратности и длительности применения отдельных антибиотиков (табл. 2).
Некоторые препараты, широко представленные на фармацевтическом рынке США, Канады, отсутствуют или ограничено присутствуют на рынке России. В частности, это цефамицины (цефотетан), ампициллин/сульбактам, пробеницид, поэтому прямой перенос рекомендаций CDC в клиническую практику России невозможен. Касаясь длительности терапии, следует обратить внимание на ограничение по длительности использования аминогликозидов (гентамицина): по современным представлениям эти препараты не следует назначать более чем на 5–7 дней. Напротив, использование доксициклина в схемах терапии ВЗОМТ предполагает достаточно длительное (по сравнению с терапий хламидийного уретрита или цервицита) назначение этого антибиотика – 14 дней.
Несмотря на наличие в обоих вариантах рекомендации сочетания клиндамицин + гентамицин (табл. 3), на се-
годняшний день применение этой комбинации необходимо ограничить в силу очевидных недостатков антибиотиков, входящих в ее состав, и неадекватной активностью в отношении хламидий и гонококков. При сравнении рекомендаций, просматриваются и существенные различия между североамериканскими и российскими рекомендациями: они касаются прежде всего выбора конкретных антибиотиков и их комбинаций. В российских рекомендациях предлагаются комбинации препаратов, потенциально активные против всех возбудителей ВЗОМТ (за исключением пенициллин- и фторхинолон-резистентных гонококков). Парентеральные и пероральные режимы терапии отличаются выбором пути ведения и набором антибиотиков, что позволяет проводить последовательную ступенчатую терапию. Очевидно, что выбор антибиотиков в рекомендациях CDC построен по другому принципу. Прежде всего обращает на себя внимание различие в наборе антибиотиков, рекомендуемых на стационарном и амбулаторном этапах лечения. Если комбинации парентеральных препаратов обладают спектром активности в отношении анаэробов, хламидий и в некоторой степени грамотрицательных бактерий, то сочетания пероральных препаратов в большей степени перекрывают активность в отношении гонококков, хламидий и анаэробов (необязательный компонент терапии).
Объяснение такого несоответствия отечественных и зарубежных рекомендаций, на наш взгляд, находится в нескольких плоскостях. Во-первых, существуют значительные отличия в трактовке понятия ВЗОМТ в России и за рубежом. Во-вторых, существуют различия в сложившейся практике оказания медицинской помощи: в Рос-
сии ВЗОМТ – это прерогатива в основном гинекологов, в Северной Америке лечением неосложненных ВЗОМТ, как правило, занимаются венерологи. В- третьих, как упоминалось выше, существуют значительные отличия в спектре возбудителей ВЗОМТ в США и России, в частности в России не наблюдается такого широкого распространения гонококков в этиологии ВЗОМТ, как в США и Канаде. С этих позиций режимы терапии ВЗОМТ, предлагаемые отечественными учеными, представляются более адаптированными под требования реальной российской клинической практики.
аТТОВ‰У‚‡МЛВ
Для того чтобы изучить сложившуюся практику терапии ВЗОМТ в Российской Федерации в 2008–2009 гг., нами проведено одномоментное многоцентровое ретроспективное фармакоэпидемиологическое исследование в 13 центрах разных регионов Российской Федерации (Брянск, Владивосток, Калининград, Калуга, Киров, Курск, Мирный, Москва, Смоленск, Тюмень, Челябинск, Энгельс, Якутск). Выполнен анализ 3786 первичных медицинских документов пациенток, обращавшихся за медицинской помощью в амбулаторные и стационарные учреждения акушерско-гинекологического профиля, при этом в анализ включили 1174 первичных медицинских документов пациенток с ВЗОМТ. В ходе исследования выявлено, что в Российской Федерации для лечения острых ВЗОМТ использовались 45 антимикробных препарата из 17 групп. Наиболее часто при острых ВЗОМТ назначались метронидазол (32,7%), гентамицин (13,1%), доксициклин (5,2%), цефазолин (5,1%), ципрофлоксацин (4,9%), ампициллин (4,8%), нистатин (4,5%), цефтриаксон (4,2%), цефотак-
10 ГИНЕКОЛОГИЯ | ТОМ 12 | №3
