
- •Функциональная диспепсия
- •Гастроэзофагеальная рефлюксная болезнь
- •Хронические гастриты
- •Пептическая язва желудка и 12-перстной кишки
- •Дискинезии желчного пузыря и желчевыводящих путей
- •Гипертоническая дискинезия желчного пузыря:
- •Гипотоническая дискинезия желчного пузыря:
- •Смешанная (гипотонически-гиперкинетическая) дискинезия желчного пузыря:
- •Хронический холецистит
- •Желчнокаменная болезнь
- •Хронический панкреатит
- •Хронические гепатиты
- •Циррозы печени
- •Цирроз печени компенсированный (класс а по Чайльд-Пью):
- •Воспалительные заболевания тонкой кишки
- •Неспецифические воспалительные заболевания кишечника
- •Бронхиальная астма
- •Идиопатический легочной фиброз
- •Определение
- •Эпидемиология иип
- •Классификация
- •Диагностика
- •Саркоидоз
- •Клиническая картина
- •Классификая и примеры формулировки диагноза
- •Диагностика
- •Лечение
- •Юридические аспекты
- •3. Этиологическое лечение
- •3.1. Антибиотики
- •3.2. Сульфаниламиды
- •3.3. Хинолоны
- •3.4. Нитрофурановые соединения
- •3.5. Хинолины (производные 8-оксихинолина)
- •4. Применение нпвс
- •5. Улучшение почечного кровотока
- •6. Функциональная пассивная гимнастика почек
- •7. Фитотерапия
- •1. Хронические кровопотери различной локализации:
- •I.Дефицит кобаламина:
- •II.Дефицит фолиевой кислоты:
- •III.Другие причины:
- •I. Нарушение образования импульса.
- •III. Комбинированные нарушения ритма:
- •1. Вирусы
- •8. Простейшие и гельминты
- •Ревматическая лихорадка
- •Патогенез.
- •II. Глюкокортикостероиды (преднизолон)
- •V.Физиотерапевтическоелечение
- •Дифференциально-диагностические характеристики болей в суставах
- •Изменения синовиальной жидкости при заболеваниях суставов
- •Этиология и патогенез.
- •Крестцово-подвздошные сочленения
- •Позвоночник
- •Связочный аппарат
- •Классификация
- •Диагностика.
- •I.Первичный
- •II.Вторичный
- •Системные васкулиты
- •Патогенез
- •Гранулематоз Вегенера
- •Геморрагический васкулит (болезнь Шенлейн - Геноха) - системное вос-палительное заболевание преимущественно капилляров, артериол и венул, с поражением кожи, суставов, брюшной полости и почек.
- •Узелковый периартериит (болезнь Кусмауля- Майера)
- •Синдром Чарга-Стросса
- •Лечение
- •Прогноз
I.Дефицит кобаламина:
1.пищевой;
2.при нарушениях всасывания витамина В12 (атрофический фундальный
гастрит, частичная резекция желудка и тотальная гастрэктомия, экзокринная недостаточность поджелудочной железы, синдром Золлингера-Эллисона, тонкокишечный дисбактериоз (дисбиоз);
3.заболевания терминального отдела подвздошной кишки (резекция,
шунтирование, лимфома, болезнь Крона, туберкулез);
4.врожденное отсутствие витамин В12-связывающих компонентов
(например, при синдроме Имерслунд-Гресбека);
5.дифиллоботриоз.
II.Дефицит фолиевой кислоты:
1.недостаточное поступление ее с пищей;
2.повышенное потребление при беременности и лактации, при гемолизе,
эксфолиативном дерматите, быстропрогрессирующей злокачественной опухоли, дифиллоботриозе;
3.нарушение всасывания фолиевои кислоты (спру, глютеновая энтеропатия,
болезнь Крона, синдром короткой тонкой кишки, амилоидоз кишечника);
4.при алкоголизме и наркомании.
III.Другие причины:
1.врожденные нарушения синтеза ДНК (оротовая ацидурия,
тиаминзависимая мегалобластная анемия; мегалобластная анемия, ассоциированная с врожденной дизэритропоэтической анемией;
2.приобретенные дефекты синтеза ДНК (заболевания печени,
сидероахрестические анемии, эритрелия, миелодисплазия);
3.индуцированные лекарственными средствами: противосудорожные
препараты, антиметаболиты (азатиоприн, метотрексат, цитозин-арабинозид, гидроксимочевина); противотуберкулезные средства (циклосерин, ПАСК); противовирусные (ацикловир, ламивудин), а также препараты разных групп (триамтерен, мышьяк, закись азота); алкоголь.
Клиническая картина мегалобластных анемий.
Гиповитаминоз проходит две стадии: субклиническую и клиническую.
В субклинической стадии явных признаков гиповитаминоза нет, они могут появиться при экстремальных условиях (стресс, болезни). Обнаружить субклиническую стадию можно с помощью лабораторных методов определения уровня витаминов в крови и других биологических жидкостях.
Во второй стадии имеются морфологические и функциональные изменения органов и тканей. Симптомы мегалобластных анемий обусловлены гипоксией тканей.
Больные предъявляют жалобы на общую слабость, вялость, головную боль, головокружение, одышку, общие отеки. Одновременно они жалуются на снижение аппетита, вплоть до анорексии, тошноту, болевые ощущения в языке, диарею, склонность к повторным инфекционным заболеваниям. У больных мегалобластной анемией, обусловленной дефицитом витамина В12, появляютсяпризнаки фуникулярного миелоза. При мегалобластной анемии учащаются приступы стенокардии, нарушения ритма сердца, отечный синдром. При отсутствии злокачественной опухоли и синдрома мальабсорбции, как причины мегалобластных анемий, масса тела больного не снижается. Весьма характерен цвет кожи - пергаментный с субиктеричным оттенком. Определяется умеренная спленомегалия. Субиктеричность кожи и склер, как и спленомегалия, обусловлены повышенным разрушением дефектных эритроцитов (мегалоцитов) в селезенке и нарастанием содержания свободного билирубина в сыворотке крови. Увеличенный и лакированный язык малинового цвета встречается не чаще, чем у 25 и 10% больных соответственно, поэтому их диагностическое значение невелико, тем более что глоссит наблюдается и при железодефицитных анемиях.
Неврологическое обследование обнаруживает признаки фуникулярного миелоза. При тщательном сборе анамнеза, физикальном обследовании в ряде случаев можно выявить причину мегалобластных анемий, а также установить врожденный или приобретенный ее характер.
Критерии диагноза. Клинический анализ крови выявляет анемию гиперхромного характера с высоким цветовым показателем (более 1,1), высоким содержанием гемоглобина в эритроцитах, их большие размеры (до 12-14мкм), яркую окраску, а также остатки ядерного вещества (тельца Жолли) и ядерной оболочки (кольца Кебота); реже встречаются «пылинки Вайденрейха». Количество ретикулоцитов уменьшено до 1-2%. В периферической крови могут встречаться мегалобласты. Наблюдается умеренная лейкопения за счет уменьшения количества нейтрофилов, большие размеры нейтрофилов с гиперсегментацией ядер. Уменьшено и количество тромбоцитов при их больших размерах. Таким образом, в периферической крови содержание всех клеток снижено, но их размеры увеличены.
В костномозговом пунктате мегалобластный тип кроветворения. Необходимо заметить, чтопункцию костного мозга следует делать до первой инъекции витамина В12,поскольку уже через 24 ч после его введения клетки теряют типичные черты мегалобластного кроветворения. Пунктат костного мозга, как правило, богат клетками, преобладают клетки красного ростка своеобразного строения (крупные клетки, ядро их нежное сетчатое). Различить по морфологическим признакам, какой конкретно дефицит лежал в основе мегалобластного кроветворения, невозможно. Необходимы данные анамнеза, клиники, специальных методов - определение концентрации витамина В12и фолиевой кислоты в крови и эритроцитах.
Биохимический анализ крови- умеренное повышение содержания свободного билирубина (объясняется разрушением эритрокариоцитов на уровне костного мозга и эритроцитов в селезенке), нормальное или умеренно повышенное содержание сывороточного железа. Часто повышается активность лактатдегидрогеназы (ЛДГ), которая высвобождается при разрушении эритроцитов.
Определение концентрации витамина В12и фолатов в сыворотке крови позволяет установить причину мегалобластных анемий.
Диета больного с бездефицитной мегалобластной анемиейдолжна содержать мясные продукты, печень, а фолиеводефицитной - листовые овощи, фрукты, печень.
Основу лечения мегалобластной анемии, обусловленной дефицитом витамина В12, составляет витамин В12(цианокобаламин и оксикобаламин).
При сочетанном дефиците фолиевой кислоты и витамина В12соответствующие препараты комбинируют.
Трансфузии эритроцитовпри мегалобластной анемии применяют лишь по жизненным показаниям: тяжелая степень анемии, нарушение гемодинамики.
Лечение фолиеводефицитной анемиипроводят фолиевой кислотой в дозе 1-5 мг/сут в течение 3-4 нед. и более. Фолиева кислота при В12-дефицитной анемии не приводит к коррекции анемии, не устраняет неврологическую симптоматику и даже может привести к летальному исходу. Поэтому в случаях неясного патогенеза мегалобластной анемии не следует начинать лечение с фолиевой кислоты.
Прогноз и профилактика. Профилактику рецидивов осуществляют проведением коротких курсов лечения - по 200 мкг оксикобаламина; на курс 5 инъекций 1 раз в полгода. Цианокобаламин вводят в той же дозе; на курс 8-10 инъекций.
В12 и фолиево-дефицитные анемии.
Пути поступления в организм витамина В12 и фолиевой кислоты.
Значение аутоиммунного механизма патогенеза.
Клиническая картина.
Основные клинические синдромы.
Критерии диагноза.
Лечение.
Исходы.
Профилактика рецидивов.
Диспансеризация.
В основе данного патогенетического варианта анемии лежит дефицит витамина В12, реже - фолиевой кислоты, возникающий вследствие различных причин. В результате дефицита происходит нарушение синтеза ДНК в кроветворных клетках, развивается неэффективный мегалобластический эритропоэз (в норме существующий только у плода) с продукцией нестойких мегалоцитов и макроцитов..
Пути поступления в организм витамина В12 и фолиевой кислоты.
Содержание витамина В12в организме составляет 2-5 мг при суточном поступлении с пищей 6-9 мкг; из этого количества выводится 2-5 мкг, задерживается в организме около 4 мкг. Запасы витамина В12в организме весьма велики, так что его дефицит развивается только спустя несколько лет после прекращения его поступления. В состав витамина В12входят два кофермента: метилкобаламин и дезоксиаденозилкобаламин. Первый из них принимает участие в кроветворении через синтез тимидина с последующим синтезом ДНК. Дефицит метилкобаламина приводит к мегалобластному типу кроветворения; одновременно нарушается созревание клеток лейкоцитарного и тромбоцитарного ростков. Дефицит дезоксиаденозилкобаламина, который участвует в обмене жирных кислот, обусловливает нарушение их обмена с накоплением пропионовой и метилмалоновой кислот, вызывающих токсическое поражение заднебоковых канатиков спинного мозга и развитие фуникулярного миелоза.
Витамин В12содержится в продуктах только животного происхождения: в мясе, печени, почках, яйцах, сыре, молоке. Он высвобождается при кулинарной обработке, а также под влиянием протеаз желудочного сока. Высвободившийся витамин В12связывается в желудке с двумя субстратами: с белками с быстрой электрофоретической подвижностью (Р-белки) и, в меньшей степени, с внутренним фактором - гликопротеином, который вырабатывается париетальными клетками фундального отдела желудка. Образующийся комплекс (витамин В12+ Р-белок) разрушается протеазами панкреатического сока с высвобождением витамина В12, который соединяется затем с внутренним фактором. Комплекс витамина В12 и внутреннего фактора взаимодействует в подвздошной кишке со специфическими рецепторами и расщепляется при рН 7,0 в присутствии ионов кальция, а затем в свободном состоянии проникает в митохондрии энтероцитов, откуда поступает в кровь, где соединяется в основном с транскобаламином-II и в меньшей степени с транскобаламином-I и -III, которые доставляют витамин В12в печень - к гепатоцитам и в костный мозг - к гемопоэтическим клеткам. Из комплекса витамина В12с транскобаламином-1 и -III он доставляется только в печень. При проникновении витамина В12в клетку сначала комплекс витамина В12 с транскобаламином-II связывается с рецепторами, затем подвергается гидролизу в ее лизосомах, после чего становится свободным.
Печень выделяет витамин В12с желчью, причем примерно 3/4 его вновь реабсорбируется в кишечнике. С мочой выводится лишь 2-5 мкг; небольшое количество удаляется с калом. В процессе синтеза ДНК витамин В12не расходуется, а выполняет роль катализатора реакции.
При дефиците витамина В12замедляется созревание гемопоэтических клеток, что морфологически выражается в отставании созревания ядра при нормальной гемоглобинизации, а также в больших размерах клеток крови и сохранении элементов ядра в зрелых (по цитоплазме) эритроцитах. Медленный темп созревания клеток гемопоэза ведет к развитию анемии с формированием общего анемического синдрома. Вместе с тем накопление токсической метилмалоновой кислоты обусловливает неврологическую симптоматику по типу фуникулярного миелоза. Одновременно страдает созревание и других быстро обновляющихся клеток, например эпителия ЖКТ, что проявляется желудочно-кишечной симптоматикой.
Фолиевая кислотапоступает в организм с пищей животного и растительного происхождения. Фолаты в значительном количестве содержатся в говяжьей и куриной печени, мясе, салате, томатах, спарже, дрожжах, коровьем и женском молоке, зеленых листовых овощах и фруктах. Суточная потребность в фолиевой кислоте колеблется от 25-100 мкг у детей до 200 мкг у взрослых. Запасы фолиевой кислоты составляют 5-10 мг, однако в отличие от витамина В12они быстро (через 3 нед.-4 мес.) истощаются, особенно в тех случаях, когда поступление фолатов нарушено. Всасывание фолатов происходит в двенадцатиперстной кишке и проксимальных отделах тощей кишки. Метаболиты фолиевой кислоты связываются в крови со специфическим белком - переносчиком фолатов, а также с альбумином и трансферрином. Соединения фолиевой кислоты являются донорами атома углерода в синтезе тимидина и, следовательно, в синтезе ДНК. Накопление фолатов в клетке, в частности в клетке гемопоэза, зависит от присутствия кобаламина: дефицит его сопровождается блокадой метаболизма фолатов и замедлением синтеза ДНК. Нарушение синтеза ДНК при дефиците фолатов сопровождается замедлением созревания клеток крови с развитием мегалобластных анемий. Однако фуникулярный миелоз не возникает, поскольку фолиевая кислота не принимает участия в обмене жирных кислот.
Значение аутоиммунного механизма патогенеза. Имеются данные, свидетельствующие о значении в патогенезе заболевания аутоиммунных механизмов. В сыворотке крови и желудочном соке больных обнаруживают антитела против париетальных клеток слизистой оболочки желудка и внутреннего фактора, которые могут быть ответственны за нарушение всасывания цианокобаламина и анатомическое повреждение слизистой оболочки желудка. Кроме того, заболевание достаточно часто сочетается с тиреотоксикозом, гипотиреозом и тиреоидитом Хашимото (заболеваниями аутоиммунного происхождения), сопровождается появлением аутоантител к тиреоглобулину, лимфоцитотоксинов и ревматоидного фактора. При лечении больных глюкокортикоиды могут привести к обратному развитию признаков болезни.
Основными причинами развития В12-дефицитной анемии являются следующие:
- нарушение всасывания витамина В12 (атрофический гастрит, рак желудка, гастрэктомия, резекция тонкой кишки, наложение кишечных анастомозов с формированием «слепой петли», энтериты с нарушением всасывания, целиакия;
- повышенная потребность в витамине В12(инвазия широким лентецом, дивертикулез толстой кишки, дисбактериоз кишечника, быстрый рост у детей, гипертиреоз, хронические заболевания печени);
- нарушение транспорта витамина В12(дефицит транскобаламина II (аутосомно-рециссивно наследуемый дефект, проявляющийся в раннем детском возрасте);
- нарушение использования при приеме некоторых медикаментов (неомицин, метформин и другие);
- алиментарная недостаточность (редкая причина) главным образом в детском возрасте, при длительном парентеральном питании без дополнительного введения витаминов.
Основными причинами дефицита фолатов могут быть: 1. Недостаточное поступление(скудный рацион;алкоголизм;нервно-психическая анорексия;парентеральное питание;несбалансированное питание у пожилых). 2. Нарушение всасывания(мальабсорбция;изменения слизистой оболочки кишечника;целиакия и спру;болезнь Крона; регионарный илеит; лимфома кишечника;уменьшение реабсорбирующей поверхности после резекции тощей кишки;прием антиконвульсантов). 3. Увеличение потребности(беременность; гемолитическая анемия; эксфолиативный дерматит и псориаз). 4. Нарушение утилизации(алкоголизм;антагонисты фолатов: триметоприм и метотрексат;врожденные нарушения метаболизма фолатов).
Клиническая картина. В12-дефицитная анемия развивается относительно медленно и может быть малосимптомной. Клинические признаки анемии неспецифичны: слабость, быстрая утомляемость, одышка, головокружение, сердцебиение. Кожные покровы бледные, склеры - субиктеричны. Есть признаки глоссита - язык с участками воспаления и атрофии сосочков, лакированный язык. Может быть увеличение селезенки и печени.
У больных мегалобластной анемией, обусловленной дефицитом витамина В12, появляютсяпризнаки фуникулярного миелоза:вялость в ногах, ощущение холода, чувство ползания мурашек, онемение конечностей, нарушение чувствительности; при тщательном опросе эти симптомы выявляются практически у всех больных. Изредка нарушается функция тазовых органов, развивается атрофия мышц, изменения обоняния и вкуса. Фуникулярный миелоз возможен уже при В12-дефицитной анемии легкой степени, что затрудняет его диагностику. Тяжелая В12-дефицитная анемия сопровождается галлюцинациями, судорожными припадками, коматозным состоянием.
Клиническая картина фолиеводефицитной анемиипрактически не имеет характерных особенностей - больных беспокоит быстрая утомляемость, сердцебиение. При осмотре обнаруживают бледность кожи и слизистых оболочек, ногтей, ярко-красный язык. Признаки поражения желудочно-кишечного тракта и нервной системы отсутствуют.
Основными критериямимиВ12-дефицитной анемии являютсяследующие:
- высокий цветовой показатель;
- макроцитоз, мегалоцитоз;
- эритроциты с остатками ядер (тельца Жолли, кольца Кэбота);
- ретикулоцитопения;
- гиперсегментация нейтрофилов;
- лейкопения (нейтропения);
- тромбоцитопения;
- повышение содержания железа в сыворотке;
- мегалобластическое кроветворение в костном мозге;
- неврологические нарушения и психические расстройства.
Подозрение на дефицит фолиевой кислоты возникает при выявлении в гемограмме гиперхромной (макроцитарной) анемии с нормальным или низким количеством ретикулоцитов при отсутствии изменений в количестве гранулоцитов и тромбоцитов. Выявление характерной картины мегалобластного кроветворения позволяет с 50% степенью вероятности говорить о дефиците фолиевой кислоты. Решающий метод диагностики - определение фолиевой кислоты в эритроцитах. В норме ее содержание колеблется от 100 до 450 нг/л. При фолиеводефицитной анемии содержание фолиевой кислоты в эритроцитах снижается.
На этапе синдромной диагностики основным методом является исследование костного мозга, при котором выявляется мегалобластический эритропоэз. Данное исследование должно проводиться до назначения цианокобаламина. При невозможности выполнить диагностическое исследование костного мозга (отказ больных и др.) допустимо пробное назначение цианокобаламина с последующим обязательным исследованием количества ретикулоцитов через 3-5 дней (не позже), приобретающим диагностическое значение. Если анемия связана с дефицитом витамина В12, то под влиянием нескольких инъекций препарата происходит трансформация мегалобластического кроветворения в нормобластическое, что отражается в периферической крови значительным увеличением количества ретикулоцитов по сравнению с исходным (ретикулоцитарный криз).
Лечение.Терапия В12- и фолиеводефицитной анемии направлена на устранение причины, вызвавшей развитие мегалобластной анемии. Это прежде всего коррекция питания, отмена препаратов, «виновных» в развитии мегалобластной анемии, дегельминтизация, лечение других заболеваний, явившихся причиной мегалобластной анемии. Доза витамина В12составляет 400-500 мкг/сут; введение одномоментно ударных доз (1000 мкг и более) неэффективно, так как большое количество витамина В12не может связаться с белками крови и выводится с мочой. Для восстановления запасов витамина В12(5мг) необходимо ввести 6-10 мг оксикобаламина или 15-30 мг цианокобаламина; для оксикобаламина курс лечения составляет 2 нед., для цианокобаламина - 4 нед. Эквивалентная доза оксикобаламина задерживается в организме на 70-80%, цианокобаламина - на 30 %. Терапия витамином В12может быть проведена в виде однократного курса до коррекции анемии, а затем прекращена, если устранен этиологический фактор. Во всех случаях дозы и длительность курса подбираются индивидуально и зависят от причины и выраженности клинических проявлений. Неэффективность терапии витамином В12 - свидетельство неправильного диагноза и сигнал к продолжению диагностического поиска. В процессе лечения оценивают его эффективность. Развитие ретикулоцитарного криза на 3-4 день лечения с максимальными цифрами на 6-10 день, а также нормализация количества ретикулоцитов к 20 дню свидетельствуют об эффективности терапии. Улучшение показателей крови с конца первой недели, нормализация костномозгового кроветворения к 4 дню, уменьшение неврологической симптоматики с 3-го дня терапии тоже могут служить критерием эффективности терапии.
Лечение фолиеводефицитной анемиипроводят фолиевой кислотой в дозе 1-5 мг/сут внутрь в течение 3-4 нед. и более; при синдроме мальабсорбции доза увеличивается до 15 мг/сут. Критерии эффективности: увеличение количества ретикулоцитов на 2-4 день с максимальным повышением на 7 день; нормализация уровня гемоглобина после 2-6 нед. лечения. Нормализация костно-мозгового кроветворения и переход на нормобластный тип происходит уже через 24-48ч от начала терапии.
При условии своевременного начала адекватного лечения исход при обоих видах мегалобластной анемии (В12, и фолиеводефицитной) благоприятный.
Профилактика рецидивов. Существуют и другие рекомендации по профилактике рецидивов В12-дефицитной анемии. Так, консолидацию ремиссии проводят введением витамина В12в суточной дозе, которая использовалась ранее во время курса лечения, на протяжении 2 мес. 1 раз в неделю, а затем пожизненно (или в течение нескольких лет) 1 раз в полгода при сохраняющейся причине анемии.
Впрофилактике дефицита фолиевой кислотынуждаются беременные женщины, а также пациенты, принимающие препараты, способные нарушать метаболизм фолиевой кислоты. Для профилактики фолиеводефицитной анемии используют препараты фолиевой кислоты в дозе 5 мг/сут.
Острый коронарный синдром
(Материал подготовил доц. Фоменко П. Г.)
Теоретические вопросы темы:
Определение понятия,номенклатура.
Этиология, патогенез.
Клиническая картина в зависимости от варианта.
Осложнения.
Диагностика.
Роль ЭКГ в выявлении нарушения ритма сердца, инфаркта миокарда и его разновидности, нестабильной стенокардии.
Дифференцированное лечение в зависимости от клинических проявлений.
Прогноз для жизни, выздоровления и трудоспособности.
Первичная и вторичная профилактика.
Содержание темы
Понятием острый коронарный синдром (ОКС) эксперты ACC (American College of Cardiology)/AHA (American Heart Association) и ESC (European Society of Cardiology) обозначают «группу состояний, развивающихся при острой ишемии миокарда». ОКС обычно (но не всегда) причинно связан с атеросклеротическим поражением коронарных артерий, часто обусловлен процессом разрушения атеросклеротической бляшки с последующим каскадом патологических процессов, уменьшающих коронарный кровоток.
Номенклатура ОКС. Пациенты с ОКС могут иметь элевацию сегмента ST на ЭКГ, либо не иметь ее. Большинство больных с ОКС с элевацией сегмента ST в последующем имеют инфаркт миокарда (ИМ) с зубцом Q (широкая стрелка), меньшая часть может иметь ИМ без зубца Q (узкая стрелка). Лица с ОКС без элевации ST могут иметь либо нестабильную стенокардию, либо ИМ без зубца Q (широкие стрелки), лишь небольшая часть из них имеет ИМ с зубцом Q (узкая стрелка) (адаптировано из АСС/АНА, 2007) (рис. 1).
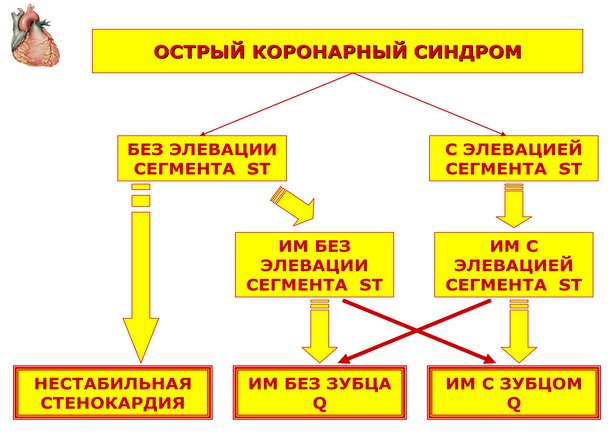
Рис. 1. Номенклатура ОКС.
ОКС не является окончательным нозологическим диагнозом, он служит диагнозом первого контакта врача с пациентом, имеющим клиническую и ЭКГ-картину острой коронарной недостаточности. В связи с этим диагноз «ОКС» правомочен для врача скорой помощи, врача приемного отделения стационара и для врача отделения неотложной кардиологии в первые часы госпитализации.
В дальнейшем по мере накопления информации (как клинической, так и лабораторно-инструментальной) диагноз «ОКС» должен трансформироваться в диагноз «нестабильная стенокардия» (НС), «ИМ без подъема сегмента ST», «ИМ с подъемом сегмента ST» или в какой-либо другой нозологический диагноз, отражающий имеющуюся сердечно-сосудистую патологию (рис. 1).
Этиология и патогенез.
Причиной возникновения ОКС служит атеротромбоз в коронарном бассейне вследствие разрыва, трещины или эрозии нестабильной атеросклеротической бляшки.
Это повреждение атеросклеротической большинства больных в основе ОКС как с подъемом сегмента ST, так и без подъема сегмента ST лежат общие патофизиологические процессы, являющиеся проявлением атеротромбоза в коронарном бассейне вследствие разрыва, трещины или эрозии нестабильной атеросклеротической бляшки. Это повреждение атеросклеротической бляшки приводит к активации тромбоцитов и запускает каскад коагуляции, в результате чего в месте поврежденной атеромы образуется тромб, при этом размеры тромба могут быть различными.
Четыре этапа интракоронарного тромбообразования.
1.Высвобождение тканевого фактора из места повреждения сосуда.
2.Каскадная активация факторов коагуляции (VII, VIIa, X, IX, Xa, IXa) образование тромбина из протромбина образование фибрина из фибриногена. Тромбин, кроме стимуляции образования фибрина, является мощным фактором активации, агрегации и адгезии тромбоцитов.
3.Адгезия, активация и агрегация тромбоцитов. Первичный тромбоцитарный тромб. Тромбоциты высвобождают биологически активные субстанции, в еще большей степени усиливающие активность тромбоцитов, препятствующие лизису тромба (ингибитор активатора плазминогена -- PAI-1), а также способствующие вазоконстрикции (тромбоксан А2).
4.Окончательное формирование фибриново-тромбоцитарного тромба. Дистальная эмболизация. Образующиеся под действием тромбина фибриновые нити формируют сетевидную структуру, укрепляющую исходно рыхлый первичный тромбоцитарный тромб. Фрагменты тромба и тромбоцитарные агрегаты могут отделяться от основной его структуры и эмболизировать.
У больных с ОКС без подъема сегмента ST (ОКС ST(-)) тромб носит характер пристеночного, не окклюзирующего полностью просвет коронарной артерии и состоящий преимущественно из тромбоцитов, связанных между собою нитями фибрина, так называемый «белый тромб». Поэтому при возникновении ОКС ST(-) развивается ишемия в основном субэндокардиальных зон миокарда левого желудочка, что отражается на ЭКГ в виде депрессии сегмента ST. В последующем в этих зонах субэндокардиальной ишемии миокарда может развиваться некроз, что отражается на ЭКГ формированием характерного негативного равнобедренного зубца Т (так называемого «коронарного»), т. е. формируется ИМ без зубца Q.
У больных с ОКС и с подъемом сегмента ST (ОКС ST(+)) тромб полностью окклюзирует просвет коронарной артерии, при этом в состав тромба входит большое количество эритроцитов, так называемый «красный тромб». Вследствие этого при возникновении ОКС ST(+), развивается трансмуральная ишемия обширных зон миокарда левого желудочка, что отражается на ЭКГ в виде подъема сегмента ST. В дальнейшем в этих зонах развивается необратимое повреждение кардиомиоцитов (некроз), что проявляется на ЭКГ появлением патологических зубцов Q или QS, т. е. формируется ИМ с зубцом Q.
Клиническая картина в зависимости от варианта.
ОКС без подъема сегмента ST(ОКС ST(-)) включает две нозологические формы:
1.Нестабильную стенокардию (НС);
2.ИМ без подъема сегмента ST (ИМ ST(-)).
НС -- это одна из клинических форм ИБС, характеризующаяся развитием острой ишемии миокарда, тяжесть и продолжительность которой недостаточна для возникновения некроза миокарда. Нестабильная стенокардия проявляется типичными болями в грудной клетке, во время которых на ЭКГ отмечают признаки ишемии миокарда в виде стойкой либо преходящей депрессии сегмента ST, инверсии, сглаженности или псевдонормализации зубца Т, однако в плазме крови отсутствует повышение уровня биохимических маркеров некроза миокарда (сердечных тропонинов I или Т либо МВ-КФК). Необходимо подчеркнуть, что вне приступа болей ЭКГ может быть нормальной.
Основной жалобой больных с НС являются типичные ангинозные боли в грудной клетке, локализующиеся чаще всего в области сердца. В соответствии с клинической картиной нестабильной стенокардии, выделяют следующие ее клинические варианты:
1. Впервые возникшая стенокардия напряжения. Под этим термином понимают стенокардию напряжения, возникшую в течение последнего 1 месяца и имеющую тяжесть не ниже III ФК по классификации Канадского сердечно-сосудистого общества.
2. Прогрессирующая стенокардия напряжения, т. е. прогрессирование ранее существовавшей стабильной стенокардии напряжения как минимум на 1 класс (по классификации Канадского сердечно-сосудистого общества) с достижением как минимум III ФК. Ангинозные боли становятся более частыми, более продолжительными, возникают при более низких физических нагрузках.
3. Стенокардия покоя, возникшая в течение последних 7 дней, с длительностью приступов до 20-30 мин., в том числе и стенокардия покоя, трансформировавшаяся из стенокардии напряжения.
4. Ранняя постинфарктная стенокардия. Стенокардия напряжения или покоя, возникшая в ближайшие дни после перенесенного ИМ, особенно после успешной тромболитической терапии у больных с ИМ с подъемом сегмента ST.
ИМ ST(-), так же как и НС, проявляется типичными болями в грудной клетке, во время которых на ЭКГ могут отмечаться признаки ишемии субэндокардиальных слоев миокарда в виде стойкой либо преходящей депрессии сегмента ST, инверсии, сглаженности или псевдонормализации зубца Т. Однако, в отличие от больных с НС, у больных с ИМ без подъема сегмента ST в плазме крови выявляют повышение уровня биохимических маркеров некроза миокарда (тропонинов I или Т либо МВ-КФК), что свидетельствует о возникновении ИМ. Обычно это повреждение (некроз) миокарда локализуется в тех же субэндокардиальных зонах, которые подвергались ишемии. Развитие некроза миокарда отражается на ЭКГ формированием характерного негативного равнобедренного (так называемого «коронарного») зубца Т, т. е. образуется ИМ без зубца Q (ранее он носил название субэндокардиального, мелкоочагового ИМ).
ОКС с подъемом сегмента ST(ОКС ST(+)) характеризуется типичными болями в грудной клетке, во время которых на ЭКГ регистрируют стойкий (более 20 мин) подъем сегмента ST (либо вновь возникшая полная блокада левой ножки пучка Гиса). Стойкий подъем сегмента ST на ЭКГ отражает возникновение обширной трансмуральной ишемии миокарда левого желудочка, обусловленной полной тромботической окклюзией крупной эпикардиально расположенной коронарной артерии. Как правило, в дальнейшем в этих зонах ишемии развивается обширный (часто трансмуральный) некроз миокарда, т. е. ОКС ST(+) трансформируется в ИМ с подъемом сегмента ST (ИМ ST(+)). На ЭКГ это проявляется появлением патологических зубцов Q, или QS, т. е. формируется ИМ с зубцом Q. Ранее такой ИМ носил называние крупноочагового (зубец Q на ЭКГ) либо трансмурального (зубец QS на ЭКГ) ИМ.
Клиническая картина ИМ ST(+) определяется вариантом его начала, характером течения и развитием тех или иных осложнений.
1. Классический (типичный) или ангинозный вариант начала ИМ ST(+) наблюдается примерно в 70-80% случаев. Клиническая картина характеризуется типичным интенсивным ангинозным болевым синдромом с локализацией боли за грудиной (реже -- в области сердца), часто иррадиирующей в левую руку, плечо, лопатку, нижнюю челюсть и т. д. Боли по характеру обычно носят давящий, сжимающий, жгущий характер. В отличие от стенокардии, боль длительная, более 20 мин., не купируется нитроглицерином, сопровождается холодным потом, страхом смерти.
2. Помимо типичной формы начала болезни, выделяют ряд других, атипичных вариантов начала ИМ ST(+):
• астматический -- начало болезни проявляется одышкой, удушьем, приступами отека легких; болевой синдром отсутствует либо выражен не резко (этот вариант развивается обычно при повторном ИМ у пожилых больных на фоне уже существовавшей ранее хронической сердечной недостаточности);
• абдоминальный (гастралгический) -- боли в животе, чаще в подложечной области, диспептические расстройства, чаще возникает при нижнем (диафрагмальном) ИМ;
• аритмический -- заболевание проявляется нарушениями ритма или проводимости, чаще в виде АВ блокады III степени либо желудочковой тахикардией, при этом болевой синдром отсутствует либо выражен слабо;
• церебральный (цереброваскулярный) -- проявляется неврологическими расстройствами: головокружением, обмороками, симптомами, напоминающими клиническую картину инсульта. Чаще встречается у пожилых больных, имеющих поражения интра- и экстракраниальных артерий, перенесших ранее нарушения мозгового кровообращения;
• бессимптомный (безболевой) -- симптомы общего недомогания, немотивированной слабости, адинамии; особенно часто встречается у пожилых лиц, у больных сахарным диабетом, перенесших ранее нарушение мозгового кровообращения; часто диагноз ставится ретроспективно, после случайной регистрации ЭКГ.
В зависимости от клинического течения выделяют:
1.Первичный ИМ -- это впервые развившийся ИМ.
2.Повторный ИМ -- возникновение нового ИМ в сроки, превышающие 29 дней от начала предыдущего.
3.Рецидивирующий ИМ -- новый ИМ возникает в первые 4 недели после развития предыдущего, т. е. до окончания основных процессов рубцевания. Для повторного некроза миокарда характерно повышение уровня сердечных тропонинов во втором анализе >20% по сравнению с предыдущим.
В течении ИМ выделяют несколько периодов.
1. Острейший период (ишемическая стадия) -- от 30 минут до 2 часов. Болевой синдром: сильные давящие, сжимающие, интенсивные жгучие или «кинжальные» боли. Как правило, боль иррадиирует в левую кисть, может появляться ощущение сильной сжимающей боли в области запястий. Может отдавать в левое плечо, левую лопатку, шею, нижнюю челюсть, ухо. Характерна волнообразность боли. Она постепенно нарастает, становится интенсивной, а затем несколько снижается, но вскоре возобновляется с большей силой.
Применение нитроглицерина в любых формах, под язык или в виде спрея, не купирует болевой синдром.
Во время приступа боли люди испытывают чувство страха смерти, тоски, обреченности, иногда возбуждены и беспокойны, могут ощущать чувство нехватки воздуха.
При осмотре: бледность, нередко повышенная влажность кожи, синюшность губ, носа, ушей, подногтевых пространств.
При пальпации области сердца: у больных с обширным трансмуральным ИМ можно обнаружить пресистолическую пульсацию, синхронную с IV тоном. Также может обнаруживаться систолическая пульсация в III, IV, V межреберьях слева от грудины.
Частота пульса при неосложненном течении заболевания нормальная, но пульс иногда аритмичен за счет экстрасистол.
Артериальное давление (АД) может незначительно повыситься, но затем быстро нормализуется. Но при обширном ИМ наблюдается его снижение, преимущественно систолического.
Границы сердца лишь иногда незначительно увеличиваются за счет левой. Увеличение размеров может быть связано с обширным ИМ.
При аускультации: у больных не осложненным, но обширным ИМ определяется приглушенный 1 тон и негромкий систолический шум на верхушке. При обширном трансмуральном ИМ может выслушиваться ритм галопа. В некоторых случаях выслушивается систолическое «кошачье мурлыканье».
2. Острый период -- до 7 дней -- формируется очаг некроза и в нем происходит миомаляция. Боль исчезает.
Определяется учащение пульса, тенденция к снижению АД, сохранятся приглушенность тонов и негромкий систолический шум на верхушке сердца.
На 2-й, реже 3-й день отмечается подъем температуры тела до 37,1-37,9°C, в редких случаях превышает 38°C. Длится повышение температуры около 3-7 дней, возможно и до 10 дней.
ОАК: повышается количество лейкоцитов уже на 2-4 день и сохраняется до 3-7 дня. Обычно их количество достигает 10-12 Г/л, при распространенном трансмуральном ИМ -- до 15 Г/л. Лейкоцитоз сопровождается сдвигом лейкоцитарной формулы влево. Отмечается также увеличение СОЭ со 2-3 дня заболевания, которое достигает максимума между 8-12 днем, а затем медленно снижается, нормализуясь через 3-4 недели.
Биохимический анализ крови: возрастает содержание фибриногена, серомукоида, сиаловых кислот, -глобулина, С-реактивного белка. Определяются маркеры гибели кардиомиоцитов, такие, как АСТ, ЛДГ КФК, миоглобин, миозин (в настоящее время потеряли свое значение и практически не применяются), кардиотропонины Т и I, гликогенфосфорилаза.
3. Подострый период -- от 7 до 28 дней -- формируется и уплотняется рубец.
В прогностическом плане этот период является более благоприятным, так как наиболее опасные для жизни больного осложнения чаще всего развиваются в первые дни от начала заболевания.
При осмотре состояние удовлетворительное, болевой синдром отсутствует. Частота сердечных сокращений нормализовалась, систолический шум в области верхушки сердца не выслушивается. АД обычно нормальное, если до развития ИМ была артериальная гипертензия, то в этом периоде АД начинает снова повышаться. В подостром периоде температура тела нормализуется, изменения со стороны крови исчезают.
4. Постинфарктный период (постинфарктный кардиосклероз) -- с 29 дня -- период полной адаптации сердечно-сосудистой системы к новым условиям функционирования, т. е. выключению сократительной функции участка миокарда.
Осложнения.
В период острого ИМ ST(+):
1.Нарушения ритма и проводимости (желудочковая пароксизмальная тахикардия, фибрилляция желудочков, предсердно-желудочковые блокады, мерцание и трепетание предсердий и др.).
2.Острая левожелудочковая недостаточность -- сердечная астма, отек легких, шок (рефлекторный, кардиогенный или аритмический).
3.Острая аневризма сердца.
4.Эпистенокардитический перикардит.
5.Разрывы миокарда как внутренние, так и наружные (в том числе перфорация межжелудочковой перегородки и отрыв сосочковых мышц).
6.Тромбоэмболические осложнения (в большом и малом круге кровообращения).
7.Парез желудка и кишечника, эрозивный гастрит с желудочным кровотечением, панкреатит.
В период заживающего (рубцующегося) ИМ ST(+):
1.Тромбоэндокардит с тромбоэмболическим синдромом (чаще - эмболия мелких сосудов большого круга кровообращения).
2.Пневмония.
3.Постинфарктный синдром (синдром Дресслера, синдром передней грудной стенки, синдром плеча) развивается обычно на 2-6-й нед. после ИМ, характеризуется перикардитом, плевритом, пневмонитом; иногда в воспалительный процесс вовлекаются синовиальные оболочки суставов (одновременно все симптомы встречаются редко, чаще наблюдается сочетание перикардита с плевритом или пневмонитом; иногда каждый из этих симптомов может встречаться изолированно, затрудняя диагностику постинфарктного синдрома).
4.Психические изменения (чаще неврозоподобные симптомы).
5.Хроническая левожелудочковая сердечная недостаточность.
6.Начало формирования хронической аневризмы сердца.
7.Правожелудочковая недостаточность развивается редко; при ее наличии следует думать о тромбоэмболии ветвей легочной артерии, разрыве межжелудочковой перегородки и крайне редко -- об инфаркте правого желудочка.
В периоде зажившего ИМ ST(+):
1.Продолжается ремоделирование левого желудочка, может идти формирование хронической аневризмы.
2.Развитие симптомов хронической сердечной недостаточности.
3.Могут также возникнуть новые нарушения ритма сердца (мерцательная аритмия).
В целом, для данного периода развитие тяжелых осложнений нехарактерно.
Диагностика.
Диагноз НС либо ИМ без зубца Q устанавливают в процессе наблюдения и обследования больного с ОКС ST(-) в течение первых 24-72 ч. госпитализации на основании как клинической картины заболевания, так и результатов лабораторно-инструментальных методов диагностики.
Этапы диагностики.
На первом этапе:
1. Заподозрить развитие ИМ.
2. Высказать предположения о клиническом варианте болезни.
3. Получить сведения о тех или иных осложнениях.
При наличии длительного приступа нестерпимых болей за грудиной и в области сердца с характерной иррадиацией, не купирующихся нитроглицерином, следует, прежде всего, предположить развитие ИМ.
Остро возникший приступ удушья, особенно у лиц пожилого возраста, прежде всего, наводит на мысль об астматическом варианте ИМ и требует обязательной регистрации ЭКГ.
Наличие резких болей в эпигастральной области, особенно у больных с хронической ИБС, позволяет заподозрить абдоминальный (гастралгический) вариант ИМ и требует регистрации ЭКГ.
Жалобы больного на приступы сердцебиений или резкого урежения ритма, появление аритмий, обмороков могут указывать на начало ИМ или его осложнений.
Внезапное немотивированное развитие кардиогенного шока, когда больной заторможен, вял, сознание его спутано, также должно вызвать у врача подозрение в отношении ИМ.
На втором этапе:
1. Сведения, косвенно указывающие на развитие ИМ (прямых признаков не существует).
2. Сведения, позволяющие выявить осложнения.
При соответствующем анамнезе такие симптомы, как повышение температуры тела, тахикардия, артериальная гипотензия, особенно развившаяся на фоне предшествующей гипертензии, глухость тонов сердца и кратковременно выслушиваемый шум трения перикарда, позволяют высказаться в пользу диагноза ИМ.
Физикальное обследование помогает выявить симптомы возможных осложнений.
Для кардиогенного шока характерны: холодная кожа серо-бледного цвета, покрытая липким потом (нарушение периферической циркуляции); олигоанурия (уменьшение мочеобразования); нитевидный пульс; уменьшение пульсового давления (менее 20-30 мм рт.ст.); снижение систолического АД (ниже 80 мм рт.ст.).
Могут наблюдаться симптомы острой левожелудочковой недостаточности: одышка, ортопноэ, влажные незвонкие мелкопузырчатые хрипы в легких.
Увеличенная печень, периферические отеки -- симптомы недостаточности кровообращения в большом круге.
При физикальном обследовании представляется возможным обнаружить бради-, тахикардию, экстрасистолию, мерцательную аритмию, пароксизмальную тахикардию.
Большое диагностическое значение приобретает выявление острой аневризмы (патологическая пульсация в прекардиальной области в четвертом межреберье слева от грудины), разрыва межжелудочковой перегородки (интенсивный систолический шум в нижней трети грудины с симптомами быстро нарастающей недостаточности кровообращения в малом и большом круге), разрыва или отрыва сосочковой мышцы (дующий систолический шум на верхушке сердца, иногда определяемый пальпаторно, в сочетании с нарастающим застоем в малом круге кровообращения).
На третьем этапе можно:
1. Поставить окончательный диагноз ИМ.
2. Уточнить его локализацию и распространенность (степень поражения миокарда).
3. Подтвердить или выявить нарушения ритма и проводимости.
4. Выявить новые осложнения (аневризма сердца, очаговое поражение почек при тромбоэмболии).
Поставить окончательный диагноз ИМ можно на основании сочетания признаков резорбционно-некротического синдрома и данных ЭКГ.
Резорбционно-некротический синдром выявляют по результатам общеклинического и биохимического исследований крови: лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилия (не всегда) с первых часов заболевания; увеличение СОЭ с 3-5-го дня.
В настоящее время самым информативными методом диагностики ИМ служит определение в плазме крови сердечных тропонинов Т или I. При возникновении некроза миокарда уровень сердечных тропонинов повышается до диагностически значимого уровня не ранее, чем через 6 ч, поэтому для диагностики ИМ рекомендуется двукратное определение сердечных тропонинов: при поступлении больного в стационар и повторно через 6-9 ч.
Допустимо использование MB-КФК. Диагностически значимого уровня в плазме крови MB-КФК достигает через 6-9 ч после возникновения некроза миокарда, однако сохраняет повышенное значение только около 2-3 суток.
Еще одним биохимическим маркером некроза миокарда, используемым для диагностики инфаркта, служит миоглобин. Его преимущество -- быстрое повышение концентрации в плазме крови, которая достигает диагностического значения уже через 2 ч после возникновения ангинозного приступа. Однако миоглобин имеет существенный недостаток -- при высокой чувствительности он обладает низкой специфичностью.
ЭКГ.
У больных с ОКС ST (+) и у больных с ИМ ST(+) в период развивающегося ИМ и в начальный период острого ИМ (первые 6-12 ч заболевания) отмечают подъем сегмента ST в так называемых «прямых» отведениях (в этих отведениях в последующем будет формироваться патологический зубец Q) и реципрокное снижение ST в отведениях, при этом изменений комплекса QRS и формирования патологических зубцов Q пока еще не будет. Диагностически значимым считают подъем сегмента ST в точке J в 2 последовательных отведениях и более 0,2 мм (0,2 мВ) для мужчин и более 0,15 мм (0,15 мВ) для женщин в отведениях V2-V3 и более 0,1 мм (0,1 мВ) в других отведениях.
• В период острого ИМ в «прямых» отведениях ЭКГ резко снижается амплитуда зубца R и формируется патологический зубец Q, по амплитуде равный не менее 1/3 зубца R, а по длительности -- равный 0,04 с и более (ранее называвшийся «крупноочаговым» ИМ). Либо зубец R исчезает полностью и формируется патологический комплекс QS (ранее называвшийся трансмуральным ИМ; рис. 2).

Рис. 2. Острый передний ИМ ST(+).
• Последующая эволюция ЭКГ при ИМ ST(+) сводится к возвращению сегмента ST к изоэлектрической линии и формированию в «прямых» отведениях отрицательного («коронарного») зубца Т.
• Для распространенного ИМ передней стенки левого желудочка, включая область верхушки, межжелудочковой перегородки и боковой стенки, характерны изменения ЭКГ в отведениях I, II, aVL и с V2 по V6; для инфаркта в области верхушки левого желудочка -- в отведениях V3-V4; при поражениях области межжелудочковой перегородки выявляют изменения в отведениях V1-V3; при инфаркте боковой стенки -- в отведениях I, aVL и V5, V6; для инфаркта нижней стенки характерны изменения -- в отведениях II, III и aVF.
На ЭКГ могут выявлять самые разнообразные нарушения ритма, встречающиеся при ИМ. По ЭКГ можно узнать впервые о нарушениях предсердно-желудочковой проводимости и проводимости по ножкам пучка Гиса, определить характер блокады.
Признаком, позволяющим предположить аневризму, является так называемая «застывшая» ЭКГ -- сохранение подъема сегмента ST в сочетании с комплексом QS в «прямых» отведениях, при этом может отмечаться «коронарный» зубец Т.
Ультразвуковое исследование (УЗИ) сердца -- важный дополнительный метод исследования у больных с ИМ. УЗИ позволяет выявить участки нарушения локальной сократимости миокарда левого желудочка (гипокинезия, акинезия), соответствующие зоне поражения, а также состояние сосочковых мышц и межжелудочковой перегородки, которые также могут поражаться при ИМ. Велико значение УЗИ сердца в оценке глобальной сократимости левого желудочка (величина фракции выброса левого желудочка), в оценке его формы, размеров, в распознавании таких осложнений, как образование тромбов в полостях сердца, разрывов миокарда, возникновении перикардита.
Рентгеноскопию органов грудной клетки рекомендуется проводить у всех больных с подозрением на ИМ либо с уже установленным диагнозом инфаркта. Рентгенография органов грудной клетки позволяет уточнить состояние легких, сердца. Особенно велико ее значение в диагностики начальных признаков застоя в малом круге кровообращения, которые еще не проявляются клинически.
Специальные методы диагностики.
1. Визуализация ИМ с помощью радиоактивных изотопов. Этот метод применяют, если затруднена диагностика ИМ с помощью ЭКГ, а исследование активности ферментов сыворотки крови невозможно или малоинформативно.
2. Селективная коронарография в остром периоде ИМ применяется, если планируется выполнение первичной ангиопластики и стентирования коронарных артерий.
Формулировка развернутого клинического диагноза ИМ должна отражать:
1. Характер течения (первичный, рецидивирующий, повторный).
2. Глубину некроза (ИМ с зубцом Q, или ИМ без зубца Q).
3. Локализацию ИМ.
4. Дату возникновения ИМ.
5. Осложнения (если они имелись): нарушения ритма и проводимости, острая сердечная недостаточность и др.
6. Фоновые заболевания -- атеросклероз коронарных артерий (если выполнялась коронароангиография, то указывается его тяжесть, распространенность и локализация), гипертоническая болезнь (при ее наличии) и ее стадия, сахарный диабет и др.
Начало формы
Нарушения ритма и проводимости
(Материал подготовила доц. Шалаева И. В.)
Под термином «нарушения ритма сердца» понимают аритмии и блокады сердца.Аритмии - это нарушение частоты, регулярности и последовательности сердечных сокращений. Нарушения проведения возбуждения вызывают развитие блокад сердца.
Актуальность темы.
Нарушения сердечного ритма являются одним из наиболее распространенных видов нарушений, их частота не поддается точной оценке. Преходящие нарушения ритма встречаются у большинства здоровых людей. При возникновении болезней внутренних органов возникают условия для развития нарушений сердечного ритма. При ряде патологий нарушения ритма становятся иногда основным проявлением в клинической картине заболевания, например, при тиреотоксикозе, ИБС. Аритмии так же являются осложнением течения многих сердечно-сосудистых заболеваний.
Современные представления о патогенезе аритмии.
Все аритмии являются результатом изменения основных функций сердца: автоматизма, возбудимости и проводимости. Они развиваются при нарушении формирования потенциала действия клетки и изменении скорости его проведения в результате изменения калиевых, натриевых и кальциевых каналов. Нарушение активности калиевых, натриевых и кальциевых каналов зависит от симпатической активности, уровня ацетилхолина, мускариноподобных М2-рецепторов, АТФ.
Механизмы нарушения ритма сердца:
1.Нарушения образования импульса:
- нарушения автоматизма синусового узла (СУ);
- аномальный автоматизм и триггерная активность (ранняя и поздняя деполяризация).
Эктопические очаги автоматической активности (аномальный автоматизм) могут находиться в предсердиях, коронарном синусе, по периметру атриовентрикулярных клапанов, в АВ-узле, в системе пучка Гиса и волокон Пуркинье. Возникновению эктопической активности способствует снижение автоматизма СУ (брадикардия, дисфункция, синдром слабости синусового узла (СССУ)).
2. Нарушения проведения импульса. Нарушения проведения импульса могут возникнуть на любых участках проводящей системы сердца. Блокада на пути проведения импульса проявляется асистолией, брадикардией, синоатриальной, АВ- и внутрижелудочковыми блокадами. При этом создаются условия для кругового движенияre-entry.
3. Циркуляция волны возбуждения (re-entry). Для формированияre-entryнеобходимо наличие замкнутого контура проведения, однонаправленной блокады в одном из участков контура и замедленное распространение возбуждения в другом участке контура. Импульс медленно распространяется по колену контура с сохраненной проводимостью, совершает поворот и входит в колено, где имелась блокада проведения. Если проводимость восстановлена, то импульс, двигаясь по замкнутому кругу, возвращается к месту своего возникновения и вновь повторяет свое движение. Волныre-entryмогут возникать в синусовом и АВ-узлах, предсердиях и желудочках, при наличии дополнительных проводящих путей и в любом участке проводящей системы сердца, где может появиться диссоциация проведения возбуждения. Этот механизм играет важную роль в развитии пароксизмальных тахикардий, трепетания и мерцания предсердий.
4. Сочетания этих изменений.
Триггерная активность. При триггерной активности происходит развитие следовой деполяризации в конце реполяризации или начале фазы покоя. Это связано с нарушением трансмембранных ионных каналов.
В развитии аритмий, возникающих при различных заболеваниях и состояниях, важную роль играют экзогенные и эндогенные факторы:
1.психосоциальный стресс,
2.нейровегетативный дисбаланс, с преобладанием активности симпатического или парасимпатического отделов вегетативной нервной системы,
3.токсические воздействия (алкоголь, никотин, наркотические вещества, лекарственные препараты, промышленные яды и др.),
4.заболевания внутренних органов.
Этиология нарушений ритма сердца.
1.Поражения миокарда любой этиологии: атеросклероз коронарных артерий, миокардиты, дилатационная и гипертрофическая кардиомиопатии, пороки сердца, сахарный диабет, заболевания щитовидной железы, климакс, амилоидоз, саркоидоз, гемохроматоз, гипертрофии миокарда при артериальной гипертензии и хроническом легочном сердце, интоксикации (алкоголем, никотином, лекарственными препаратами, промышленными веществами (ртуть, мышьяк, кобальт, хлор- и фосфорорганические соединения), закрытые травмы сердца, инволютивные процессы при старении.
2.Поражения СУ и проводящей системы сердца врожденного и приобретенного генезов.
3.Пролапс клапанов сердца.
4.Опухоли сердца (миксомы и др.).
5.Заболевания перикарда: перикардиты, плевроперикардиальные спайки, метастазы в перикард и др.
6.Электролитные нарушения (нарушения баланса калия, кальция, натрия, магния).
7.Механические раздражения сердца (катетеризация, ангиография, операции на сердце).
8.Рефлекторные влияния со стороны внутренних органов при глотании, натуживании, перемене положения тела и т.д.
9.Нарушения нервной регуляции сердца (синдром вегетативной дистонии, органические поражения ЦНС)
10.При стрессе (с развитием гиперадреналинемии, гипокалиемии, стресс-ишемии).
11.Идиопатические нарушения сердечного ритма.
Классификация аритмий.
Аритмии делятся на наджелудочковые и желудочковые. Существует большое количество классификаций нарушений сердечного ритма. Наиболее удобной в практическом применении является классификация, предложенная М.С. Кушаковским, Н.Б. Журавлевой в модификации А.В. Струтынского и соавт:
