
- •Аннотация
- •Краткое описание структуры, свойств и применения соединения
- •2. Нахождение константы равновесия основного процесса и построение её зависимости от температуры
- •3. Анализ процессов сублимации и испарения исходных компонентов
- •Анализ процесса испарения ртути Hg.
- •Анализ процесса сублимации серы s2.
- •3.3. Оценка погрешности определения температуры кипения
- •Построение р-т-диаграмм
- •Определение термодинамических условий проведения процесса
- •Оценка возможности окисления ртути
- •Заключение
- •Список использованных источников
- •Приложение а
Определение термодинамических условий проведения процесса
При рабочей температуре (Траб = 800К) для HgS получаем:
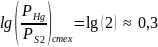
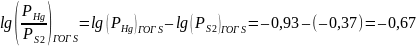
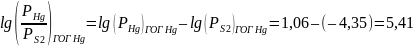
Нас интересует p-тип
полупроводника, соответственно
рассматриваем интервал
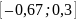 .
Возьмём в этом интервале точку {–0,6}.
.
Возьмём в этом интервале точку {–0,6}.
Составим соответствующую систему уравнений, обеспечивающую одновременно и протекание реакции в прямом направлении, и нужный тип электронной проводимости.
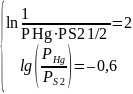
После логарифмирования получаем систему линейных уравнений:

Решением этой системы является:
Вспомним графики температурной зависимости равновесных давлений компонентов и обозначим на них точку, в которой натуральные логарифмы принимают значения, найденные выше:
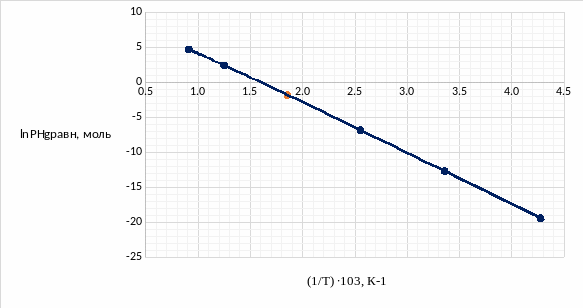
Рис.5.1 Температурная зависимость натурального логарифма равновесного давления ртути
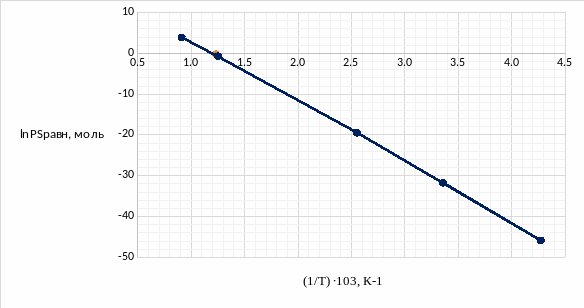
Рис.5.2 Температурная зависимость натурального логарифма равновесного давления серы
По отмеченной точке можно найти значение рабочих температур ртути и серы:
1/ТHg = 1,9059∙103 К-1 ТHg = 539,8К |
1/ТS = 1,2573∙103 К-1 ТS = 813,1К |
Так как получившаяся рабочая температура серы больше рабочей температуры соединения, необходимо что-то изменить, так как в таком случае соединение образовываться не будет.
Попробуем по тем же соображениям найти
данные для сульфида ртути n-типа.
Рассматривать будем интервал
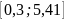 .
Возьмём в этом интервале точку {2}.
.
Возьмём в этом интервале точку {2}.
Составим соответствующую систему уравнений, обеспечивающую одновременно и протекание реакции в прямом направлении, и нужный тип электронной проводимости.
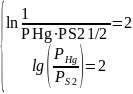
После логарифмирования получаем систему линейных уравнений:
Решением этой системы является:
Вспомним графики температурной зависимости равновесных давлений компонентов и обозначим на них точку, в которой натуральные логарифмы принимают значения, найденные выше:
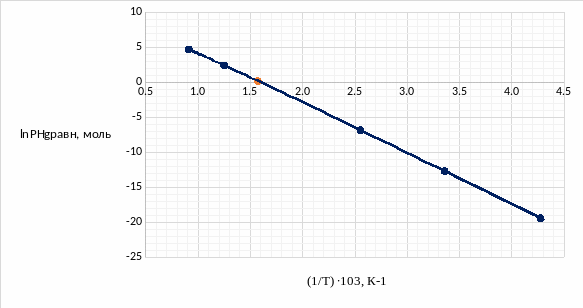
Рис.5.1 Температурная зависимость натурального логарифма равновесного давления ртути
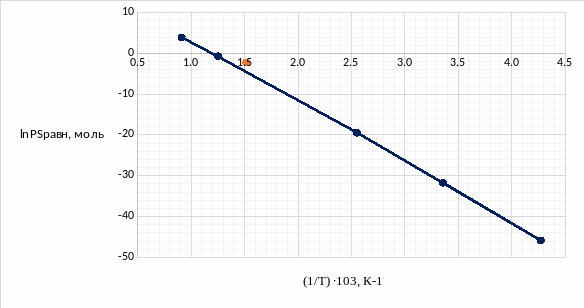
Рис.5.2 Температурная зависимость натурального логарифма равновесного давления серы
По отмеченной точке можно найти значение рабочих температур ртути и серы:
1/ТHg = 1,5704∙103 К-1 ТHg = 636,8К |
1/ТS = 1,5146∙103 К-1 ТS = 660,25К |
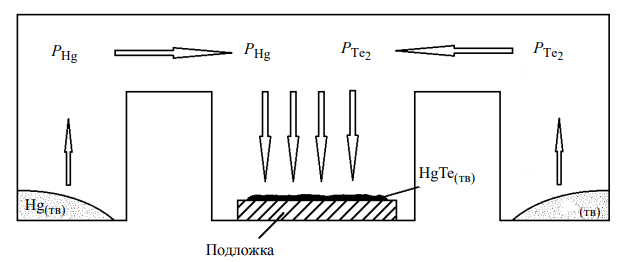
Теперь можем рассмотреть распределение температур в реакторе:
 Р
Р

S2
S2
S
S(тв)
ис.5.3. Принципиальная схема реактораУсловная схема реактора для осуществления процесса приведена на рис.5.3. Используется кварцевый реактор с тремя независимыми температурными зонами.
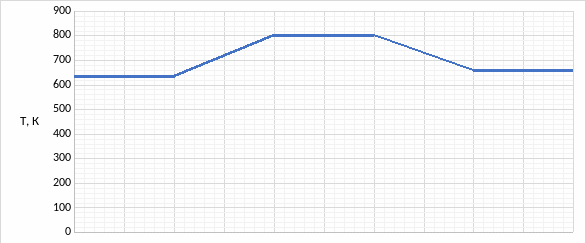
Рис. 5.3. Распределение температур в реакторе
Для того, чтобы обеспечить синтез соединения, необходимо поддерживать температуры областей реактора постоянными.
Оценка возможности окисления ртути
В атмосфере реактора неизбежно будет присутствовать кислород, который окислит вещества, участвующие в реакции. Рассмотрим окисление ртути, которое соответствует следующей химической реакции:
Hg(ж) + 0,5 O2(газ)
 HgO(кр)
HgO(кр)
Рассчитываем термодинамические функции по уже известной методике
Таблица 5. Параметры реакции окисления |
||||
|
H0T, Дж |
S0T, Дж/К |
G0T, Дж |
lnКр4, моль |
Тст.у. = 298К |
-90 370,0 |
-105,53 |
-58 922,06 |
23,78 |
Тпл(Hg) = 234К |
-90 576,72 |
-106,31 |
-65 699,96 |
33,77 |
Тпл(S) = 392К |
-90 066,38 |
-104,64 |
-49 045,76 |
15,05 |
Траб(HgS) = 800К |
-88 748,54 |
-102,34 |
-6 876,29 |
1,03 |
Тпл(HgS) = 1098К |
-87 786,0 |
-101,32 |
23 460,71 |
-2,57 |
Вычислим по формуле, аналогичной формуле (6), изменения теплоёмкостей системы после фазового перехода и рассчитаем нужные параметры реакции по формулам (1)-(2) при температуре Т=298К:
Cp0 = Cp0(Hg жид)∙(–1)+ Cp0(O2 газ)∙(–½) +Cp0(HgO тв)= –28 – 0,5∙29 + 46=3,23 Дж/К
H0298 реак = –H0f 298 (Hg жид) –H0f 298 (O2 газ)∙½ +H0f 298 (HgO тв)= –90 370 Дж
S0298 реак = –S0298 (Hg жид) –S0298 (O2 газ)∙½ +S0298 (HgO тв)= –76,1 –0,5∙205,3+73,22 = = –105,53 Дж/К
По формулам (13)-(15), (7), (9) найдём параметры реакции с фазовым переходом. Полученные данные занесём в таблицу 5.
Пример расчёта при Т=392К:
H0392 = H0298 + С0Р dT = –90 370 +3,23∙(392 – 298) = –90 066,38Дж
S0392 = S0298 + (С0Р/Т) dT = –105,53 +3,23∙ln(392/298) = –104,64Дж/K
G0392 = H0392 – 392∙S0392 = –90 066,38– 392∙(–104,64) = –49 045,76Дж
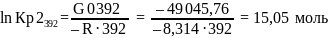
Учтём, что при максимальной откачке давление кислорода в реакторе PO2 = 0,21∙10–10 атм, при атмосферных условиях давление кислорода в реакторе составляет 0,21 атм.
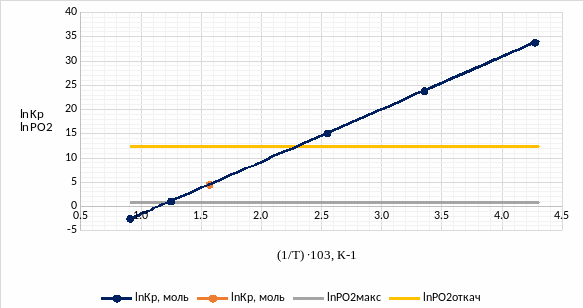
Рис. 6.1. Температурная зависимость константы равновесия процесса окисления
Дополнительно на рисунке 6.1. отмечена точка, соответствующая рабочей температуре металлического компонента (при Т=636,8К). Как видно, эта точка попадает в диапазон, который ограничивается прямыми, указывающими давление кислорода. Соответственно, мы можем предотвратить окисление и в таких условиях будут происходить только нужные нам процессы. Дополнительные манипуляции не требуются.
