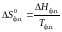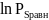- •Аннотация
- •Краткое описание структуры, свойств и применения соединения
- •2. Нахождение константы равновесия основного процесса и построение её зависимости от температуры
- •3. Анализ процессов сублимации и испарения исходных компонентов
- •Анализ процесса испарения ртути Hg.
- •Анализ процесса сублимации серы s2.
- •3.3. Оценка погрешности определения температуры кипения
- •Построение р-т-диаграмм
- •Определение термодинамических условий проведения процесса
- •Оценка возможности окисления ртути
- •Заключение
- •Список использованных источников
- •Приложение а
3. Анализ процессов сублимации и испарения исходных компонентов
Поддержание в системе в течение всего технологического процесса необходимых давлений паров PHg и PS2 возможно путём сублимации (или испарения) этих компонентов в независимых температурных зонах реактора. Чтобы определить температуры в зонах сублимации (испарения) компонентов Hg и S2, необходимо провести термодинамический анализ процессов сублимации (испарения):
Hg(ж)
 Hg(пар)
, S(тв)
Hg(пар)
, S(тв)
 ½
S2
(пар).
½
S2
(пар).
Анализ процесса испарения ртути Hg.
Испарение Hg рассматривается при температуре от 298 К до температуры Т, ограничивающейся температурой плавления соединения HgS. На этом промежутке Hg не испытывает полиморфное превращение (не плавится), поэтому при расчёте изменения свободной энергии Гиббса для любой температуры Т достаточно использовать полученные выше формулы для случая системы, не испытывающей фазовый переход:
Hg(ж)
 Hg(пар)
Hg(пар)
Запишем общий вид константы равновесия:
KP2 PHg1
Значение логарифма равновесных давлений находится по формуле (13)
ln Piνi равн = lnKp |
|
lnPiгаз
равн =
|
(13) |
В формуле (13) учтено, что давления конденсированных веществ принимаем за единицу.
При подсчёте получаются следующие данные, которые сведены для удобства в таблицу 3.1.
Таблица 3.1 Параметры реакции |
|||||
|
H0T, Дж |
S0T, Дж/К |
G0T, Дж |
lnКр2, моль |
|
Тст.у. = 298К |
60 830,0 |
98,80 |
31 387,60 |
-12,67 |
-12,67 |
Тпл(Hg) = 234К |
61 279,92 |
100,50 |
37 763,00 |
-19,41 |
-19,41 |
Тпл(S) = 392К |
60 169,18 |
96,87 |
22 195,12 |
-6,81 |
-6,81 |
Траб(HgS) = 800К |
57 300,94 |
91,86 |
-16 185,26 |
2,43 |
2,43 |
Тпл(HgS) = 1098К |
55 206,0 |
89,63 |
-43 209,73 |
4,73 |
4,73 |
Пример расчёта для Т=392К:
Cp0 = Cp0(Hg ж)∙(–1)+ Cp0(Hg газ)∙1 = –27,82 + 20,79 = –7,03 Дж/К
H0392 = H0298
+
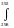 С0Р
dT = 60 830,0 – 7,03∙(392 – 298) = 60
169,18Дж
С0Р
dT = 60 830,0 – 7,03∙(392 – 298) = 60
169,18Дж
S0392 = S0298 + (С0Р/Т) dT = 98,8 – 7,03∙ln(392/298) = 96,87Дж/K
G0392 = H0392 – 392∙S0392 = 60 169,18 – 392 ∙ 96,87 = 22 195,12Дж
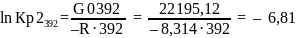
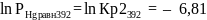
Построим зависимость lnPHg равн= f (1/T) по данным из таблицы 3. Причём дополнительно обозначим точку, в которой наш график пересекает ось (1/T), т.е. в которой lnPHg равн= 0.
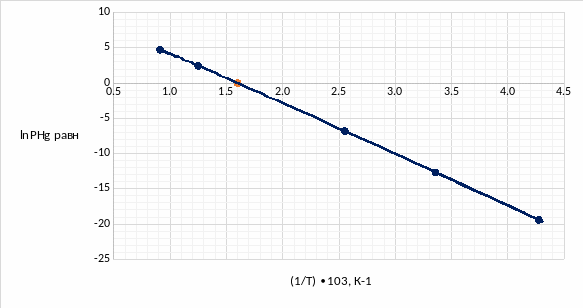
Рис.3.1 Температурная зависимость натурального логарифма равновесного давления ртути
По отмеченной точке можно найти значение температуры кипения ртути:
1/ТкипHg = 1,6∙103 К-1
ТкипHg = 625,5 К
Таким образом, экспериментально рассчитанное значение температуры кипения ртути, которое было определено из температурной зависимости (рисунок 3.1) составило – 625,5К.
Анализ процесса сублимации серы s2.
Если при нагревании до температуры Т в системе имеет место фазовый переход, то изменения энтальпии и энтропии вычисляются по выражениям (14) и (15):
H0T = H0298
+
|
(14) |
S0T
= S0298
+
(С0Р/T)
dT + νi
S0ф.п.i
+
|
(15) |
|
(16) |
Сублимация S рассматривается при температуре от 298 К до температуры 1098К. На этом промежутке S испытывает фазовый переход первого рода (плавится), поэтому при расчёте изменения свободной энергии Гиббса для любой температуры Т необходимо использовать приведённые выше формулы.
S(тв) ½ S2(газ)
Общий вид константы равновесия для этой реакции:
KP2 PS21/2
Теплоёмкость системы до фазового перехода:
Cp0 = Cp0(S тв)∙(–1)+ Cp0(S2 газ)∙½ = (14,98+26,11∙10-3Т)∙(–1) + 32,467∙½ = =(1,254 – 0,02611∙Т) Дж/К
Вычислим по формуле, аналогичной формуле (6), изменения теплоёмкостей системы после фазового перехода и рассчитаем нужные параметры реакции по формулам (1)-(2) при температуре Т=298К:
Cp0` =
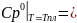 Cp0(S
тв)∙(–1)+ Cp0(S2
газ)∙½ = (1,254 – 0,02611∙392)
= = –8,98Дж/К
Cp0(S
тв)∙(–1)+ Cp0(S2
газ)∙½ = (1,254 – 0,02611∙392)
= = –8,98Дж/К
H0298 реак = H0f 298 (S тв)∙(–1)+H0f 298 (S2 газ)∙½ = 0∙(–1) + 127 515∙½= 63 757,5 Дж
S0298 реак = S0298 (S тв)∙(–1)+S0298 (S2 газ)∙½ = 31,93∙(–1)+228,028∙½ = 82,08 Дж/К
Далее, по формуле (15) найдём энтропию фазового перехода плавления серы:
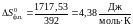
По формулам (13)-(15), (7), (9) найдём параметры реакции с фазовым переходом. Полученные данные занесём в таблицу 3.2.
Таблица 3.2 Параметры реакции с фазовым переходом |
|||||
|
H0T, Дж |
S0T, Дж/К |
G0T, Дж |
lnКр3 |
|
Тст.у. = 298К |
63 757,5 |
82,08 |
39 296,47 |
-15,86 |
-31,72 |
Тпл(Hg) = 234К |
64 121,77 |
83,45 |
44 594,01 |
-22,92 |
-45,84 |
Тпл(S) = 392К |
61 311,05 |
75,59 |
31 679,04 |
-9,72 |
-19,44 |
Траб(HgS) = 800К |
57 646,55 |
69,18 |
2 298,68 |
-0,35 |
-0,69 |
Тпл(HgS) = 1098К |
54 970,03 |
66,34 |
-17 872,34 |
1,96 |
3,92 |
Пример расчётов для T=234К (Т<Тпл):
H0234=H0298+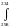 С0Р
dT=63 757,5
+1,254∙(234–298)–1/2∙0,02611(2342–2982)=64 121,77Дж
С0Р
dT=63 757,5
+1,254∙(234–298)–1/2∙0,02611(2342–2982)=64 121,77Дж
S0234
= S0298
+
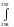 (С0Р/Т)
dT
= 82,08 +1,254∙ln(234/298)
–0,02611∙(234-298)= 83,45 Дж/K
(С0Р/Т)
dT
= 82,08 +1,254∙ln(234/298)
–0,02611∙(234-298)= 83,45 Дж/K
G0234 = H0234 – 234∙S0234 = 64 121,77–234∙83,45= 44 594,01 Дж
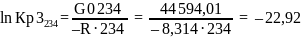
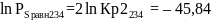
Пример расчётов для T=800К (Т>Тпл):
H0800
=H0298+
С0Р
dT+νS
Н0пл.S+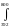 С0`Р
dT=63 757,5
+1,254∙(392–298) – –1/2∙0,02611∙(3922–2982)
– 1 717,53 – 8,98∙(800–392)=57 646,55 Дж
С0`Р
dT=63 757,5
+1,254∙(392–298) – –1/2∙0,02611∙(3922–2982)
– 1 717,53 – 8,98∙(800–392)=57 646,55 Дж
S0800
= S0298
+
(С0Р/Т)
dT
+ νS
S0пл.S
+
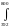 (С0`Р/T)
dT
= 82,08 +1,254∙ln(392/298)
– –0,02611∙(392-298) – 4,38 – 8,98∙ln(800/392)=
69,18 Дж/K
(С0`Р/T)
dT
= 82,08 +1,254∙ln(392/298)
– –0,02611∙(392-298) – 4,38 – 8,98∙ln(800/392)=
69,18 Дж/K
G0800 = H0800 – 800∙S0800 = 57 646,55–800∙69,18 = 2 298,68Дж

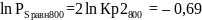
Построим зависимость
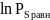 =
f (1/T) по данным из таблицы 3. Причём
дополнительно обозначим точку, в которой
наш график пересекает ось (1/T),
т.е. в которой
= 0.
=
f (1/T) по данным из таблицы 3. Причём
дополнительно обозначим точку, в которой
наш график пересекает ось (1/T),
т.е. в которой
= 0.
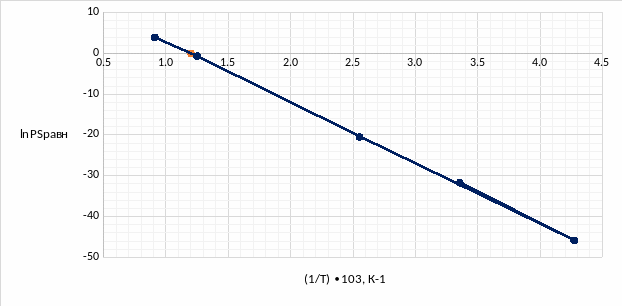
Рис.3.2 Температурная зависимость натурального логарифма равновесного давления серы
По отмеченной точке можно найти значение температуры кипения серы:
1/ТкипS = 1,2∙103 К-1
ТкипS = 833,5К
Таким образом, экспериментально рассчитанное значение температуры кипения серы, которое было определено из температурной зависимости (рисунок 3.1) составило – 833,5К.

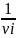 lnKp
lnKp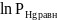
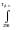 С0Р
dT + νi
Н0ф.п.i
+
С0Р
dT + νi
Н0ф.п.i
+
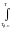 С0`Р
dT;
С0`Р
dT;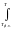 (С0`Р/T)
dT;
(С0`Р/T)
dT;