
Тесты рус
.docСвойства элементов и их соединений находятся в периодической зависимости от возрастания.В)заряда ядра;
Элемент, способный образовывать ковалентные, ионные и водородные связи — это.А)F;
При взаимодействии разбавленной азотной кислоты с медью образуется:D)NO;
В какой группе находится элемент, электронная формула которого 4s24p3?D)4;
Какое количество вещества содержится в 26 г цинкаВ)0,4моля;
какую отрицательную степень окисления может проявить атом, имеющий внешний энергетический уровень: 3s23p4 -С)2;
Укажите максимальное число “f” орбиталей на данном уровне.С)7;
Укажите валентность фосфора в нормальном состоянии, если электронная формула s2p3.В)3;
Число нейтронов в
атоме магния (![]() )
равно:Е)12.
)
равно:Е)12.
Какая электронная формула соответствует иону S2-?D)3s23p6;
Какой подуровень заполняется в атоме электронами после заполнения подуровня 4р?Е)5s.
Атомный радиус в третьем периоде от натрия до хлора.D) уменьшается слева направо;
Какой массы хлорид калия содержится в его растворе молярной концентрации 0,3 моль/л и объёмом 400 мл В)8,94 г;
Электролитическая диссоциация это:Е) процесс распада веществ на ионы при расплавлении или растворении в воде.
В воде имеется химическая связь. А) ковалентная полярная, водородная и ионная;
Связь, образованная общей парой электронов называется:В) ковалентной;
Укажите тип химической связи в молекуле Hcl. С)ковалентная, полярная;
Квантовое число, определяющее форму электронного облака в пространстве называется: А)орбитальным;
Массовое число элемента отражает: D)массу нейтронов и протонов;
Общее число протонов в АI и Са равноА) 33;
Укажите максимальную степень окисления хлора.В)+7;
В максимально-возбужденном атоме кремния 14Si имеются неспаренных электронов:В)2;
В каком периоде и группе находится элемент, если его электронная формула заканчивается так 4d105s2
С)4 и 2;
Какую форму имеют гибридные облака? С)
![]()
Ковалентная связь, возникающая при перекрывании атомных орбиталей вдоль оси, соединяющей ядра взаимодействующих атомов, называется:Е)s-связью.
Какая из молекул типа АВ2 имеет линейную форму?D)CaCl2;
Какой из указанных способов перекрывания электронных облаков соответствует образованию p-связи.
D)
![]()
Назовите какой элемент в следующем ряду электронных формул находится в 7 группе? С)5s24d105p5;
Какой ион имеет наименьший радиус? E) Mg2+.
Укажите min и max степени окисления элемента, электронная формула валентных электронов которого имеет вид:…s2p5 В)(-1)-(+7);
Укажите min
и max
степени окисления сурьмы.
![]() D)
(-3)-(+5);
D)
(-3)-(+5);
Молекула SiH4 имеет форму тетраэдра, какой тип гибридизации осуществляется? С)sp3;
Укажите величину, характеризующую массу электрона. Е) me=9,110-31кг.
Укажите число валентных электронов в атомах фосфора и серы. D)5 и 6;
Укажите ряд элементов, расположенных в порядке возрастания электроотрицательности. В)Na, H, N, F;
Количественная характеристика способности атома в молекуле притягивать к себе электроны называется: С)электроотрицательностью;
Реакция ионного обмена идет до конца при взаимодействии D) HCI и Na2CO3;
Какая из приведенных электронных формул соответствует иону хлора Cl1-. В)3s23p5;
При сжигании 2 моль водорода образуется вода в количестве (моль) С) 2;
Квантовое число, определяющее ориентацию электронного облака в пространстве называется: D)орбитальным;
В 100 мл раствора содержится 4,9 г Н2SO4 (M(Н2SO4)=98 г/моль). Какова нормальность раствора? А)1н;
Определите эквивалентную концентрацию раствора HNO3, содержащего 6,3 г HNO3 в 100 мл раствора. В)1,0;
Определите объём (при н.у.), занимаемый 6,8 г сероводорода. Е)4,48л.
Вычислите рОН 0,01М раствора HNO3. В)12;
Вычислите рН 0,01М раствора КОН. Е)12.
Укажите соль, раствор которой имеет щелочную среду. В)K2CO3;
Укажите соль, не подвергающуюся гидролизу. А)KNO3;
В результате гидролиза какой соли образуется основная соль С)FeCl3;
Определите титр 0,25Н раствора NaOH. А)0,01;
Укажите слабый электролит. С)Al(OH)3;
Раствор, содержащий 8 г некоторого вещества в 100 г диэтилового эфира, кипит при 36,860С, тогда как чистый эфир кипит при 35,600С. Определить молекулярную массу растворенного вещества. Е(эфира)=2,020С. А)128,2 г/моль;
При полной диссоциации Na3PO4 образуется ионов: В)3;
В результате гидролиза какой соли образуется кислая соль? D)K2S;
Вычислите массовую долю (%) соли в растворе, содержащем 50 г соли и 200 г воды. В)20;
Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор?
D)100 г;
Укажите раствор какой соли при гидролизе имеет щелочную среду рН>7 Е)Na2SO4+HOH®
В 100 мл раствора содержится 49 г H2SO4. Какова нормальность раствора? А)10;
Гидролиз какой соли идет в три ступени? А)CrCl3;
Укажите раствор какой соли при гидролизе имеет кислую среду (рН<7). С)CuCl2;
Если рОН раствора равен 3, то чему равна концентрация ионов водорода? А)10-3;
Определить
температуру кипения раствора (0С),
содержащего 3,46 г мочевины CO(NH2)2
(![]() =
60г/моль) в 100 г воды. Эбулиоскопическая
константа воды равна 0,520.
А)100,8;
=
60г/моль) в 100 г воды. Эбулиоскопическая
константа воды равна 0,520.
А)100,8;
В 100 мл раствора содержится 3,4 г AgNO3. M(AgNO3)=170 г/моль. Какова нормальность раствора? А)0,2н;
Какой газ выделяется при совместном конечном гидролизе солей в реакции: AlCl3+Na2CO3+HOH®… Е)CO2.
В растворе какой соли рН будет наибольшим?
А)K2CO3;
Рассчитать, при какой температуре должен кристаллизоваться раствор, содержащий в 250 г воды 54 г глюкозы С6Н12О6. Криоскопическая константа воды равна 1,860. Е)-2,230С.
Азот объемом 11,2 л имеет массу: С)14 г;
Каково математическое выражение ПР сульфата кальция?
А)![]()
Ca2+][SO42-];
Ca2+][SO42-];
Раствор массой 120 г содержит 24 г гидроксида калия (КОН). Какова массовая доля вещества в растворе (w, %)? С)20;
Нормальная концентрация раствора, содержащего 10,5 г фтористого натрия (M(NaF)= 42 г/моль) в 250 мл водного раствора равна: С)1;
Укажите сильный электролит. С)NaNO3;
Из 400 г 50%-ного (по массе) раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля (%) H2SO4 в оставшемся растворе? В)66,7;
При какой температуре должен кипеть раствор, содержащий растворенный неэлектролит количеством вещества 0,062 моль в воде объёмом 200 мл Эбулиоскопическая константа воды равна 0,520.
А)100,160С;
В)90,90С;
С)1500С;
D)123,40С;
Е)0,980С.
Раствор массой 125 г содержит 25 г гидроксида натрия (NaOH). Какова массовая доля вещества в растворе (w, %)? Е)20.
Если рН раствора равен 6, то чему равна концентрация ионов водорода в этом растворе? D)10-8;
Вычислить осмотическое давление раствора, содержащего 16 г сахарозы (С12Н22О11) в 350 г Н2О при 293 К. Плотность раствора считать равной единице. В)311кПа;
Какой массы сахароза (С12Н22О11) находится в растворе объёмом 200 мл, если осмотическое давление этого раствора при 00С равно 6,61105 Па
А)169,7г;
В)19,93г;
С)12,34г;
D)23,45г;
Е)34,56г.
В 1 л раствора содержится 5,85 г NaCI (М(NaCI)=58,5 г/моль). Чему равна молярная концентрация раствора? В)0,1;
При растворении 5,0 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при –1,450С. Определить молекулярную массу растворенного вещества (г/моль). Криоскопическая константа воды равна 1,860. D)32;
Отношение количества растворенного вещества к массе растворителя называется: С)моляльная концентрация.
Отношение числа эквивалентов растворенного вещества к объему раствора называется: В)нормальная концентрация;
Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора увеличился на единицу? D)уменьшить в 10 раз;
В растворе какого электролита можно обнаружить хлорид ион? В)NaCl;
При диссоциации какого электролита получается гидроксокатион? D)CuOHCl;
При диссоциации какого электролита получается гидроанион? Е)Na2HPO4.
На сколько градусов повысится температура кипения раствора сахара, если в 200 г Н2О растворить 40 г сахара (С12Н22О11). (М(С12H22O11)=342 г/моль). Е(Н2О)=0,520.
А)0,30С;
На сколько градусов понизится температура замерзания раствора глицерина, если в 100 г Н2О растворить 10 г глицерина (С3Н8О3). (М(С3Н8O3)=92 г/моль). К(Н2О)=1,860С. В)2,020С;
Какая из солей не подвергается гидролизу? С)Na2SO4;
Укажите раствор какой соли при гидролизе имеет нейтральную реакцию среды, т.е. РН=7? В)NH4CN;
Укажите вещество электролит. D)CuSO4;
Укажите вещество неэлектролит. D)MnO;
Какая из указанных кислот в равных условиях, дает наименьшую концентрацию ионов водорода Н+. В) HclO Kд=2,9510-8;
Укажите сильный электролит. А)HNO3 a=94 %;
Какой электролит диссоциирует ступенчато? В)H2SO4;
Какая реакция идет с образованием нерастворимого соединения? D)FeCl3+NaOH®…
Какая реакция имеет краткое ионное уравнение Н++ОН-=Н2О? С)HNO3+NaOH®…
Какая реакция идет с образованием газообразного вещества?
А)CaCO3+HCl®…
В растворе какого вещества ионов серебра (Ag) больше, если произведение растворимости (ПР) их соответственно равны: В)AgCl 1,710-10;
Какое вещество проявляет только окислительные свойства? D)KMnO4;
Какое вещество проявляет только восстановительные свойства? С)H2S;
Укажите соединение, содержащее ион в степени окисления “+4”. D)Na2SO3;
Среди приведенных уравнений, укажите процесс окисления. А)NO2-®NO3-;
Среди приведенных уравнений, укажите процесс восстановления. С)MnO4-®MnO2;
Чему равен эквивалент восстановителя в реакции:
K2Cr2O7+SnCl2+H2SO4®Sn(SO4)2+CrCl3+K2SO4.
M(K2Cr2O7)=294 г/моль; M(SnCl2)=190 г/моль. D)190/2;
Низшая и высшая степень окисления азота равна: А)-3; +5
Число моль Н+, участвующих в восстановлении иона ClO3- в ион Cl- равно: Е)6.
Чему равен эквивалент окислителя в реакции:
HNO3+H2S®NO+S+H2SО4; M(HNO3)=63 г/моль; M(H2S)=34 г/моль. С)63/3;
Укажите соединение, в котором степень окисления центрального иона равна “+6”. С)K2Cr2O7;
К какому типу реакции относится: P+H2O®H3PO3+PH3; D)диспропорционирования;
Закончите уравнение реакции. Укажите коэффициент перед восстановителем: Mg+HNO3®Mg(NO3)2+NH4NO3+H2O
В)4;
Укажите процесс окисления. А)H3AsO3®H3AsO4;
Укажите процесс восстановления.
А)MnO4-®MnO2;
Определите число электронов, участвующих в данной ОВР:
KMnO4+NaNO2+H2SO4®MnSO4+NaNO3+K2SO4+H2O А)10;
Определите число молей восстановителя в следующей ОВР.
NaCrO2+PbO2+NaOH®Na2PbO2+Na2CrO4+H2O В)2;
Какое соединение хлора проявляет только окислительные свойства? С)HClO4;
Укажите вещество с нулевой степенью окисления атома. А)Al;
Укажите соединение, в котором кислород имеет положительную степень окисления +2. А)OF2;
Укажите элемент с постоянной степенью окисления. А)K;
Какое соединение серы проявляет одновременно и окислительные и восстановительные свойства? Е)K2SO3.
Какой силы ток должен быть использован для того, чтобы выделить из раствора AgNO3 cеребро массой 108 г за 6 мин В)268А;
Рассчитайте стандартную ЭДС (В) цинково-серебряного гальванического элемента. Е0(Zn2+/Zn)=-0,76B. E0(Ag+/Ag)=+0,80B. А)+1,56;
Какая масса нитрата серебра находилась в растворе, если из него при действии ВаСI2 получен осадок AgCI массой 0,287 г. А)0,340г;
Укажите вещество, которое будет выделяться на аноде при электролизе соли Mg(NO3)2. В)O2;
Стандартный потенциал какого электрода принят равным 0? С)водородного;
Определите электродный потенциал (В) цинка в 0,01М растворе соли ZnSO4.
E0(Zn2+/Zn)=-0,76B. С)-0,82;
Электродвижущая сила (В) гальванического элемента Zn0/Zn2+//Mg2+/Mg равна (где E0(Zn/Zn2+)=-0,76B; E0(Mg/Mg2+)=-2,37B): В)1,607;
По закону Фарадея, масса веществ при электролизе определяется по формуле: В)m=It;
Определите силу тока, при которой на катоде выделилось 0,5 г Au в течение 30 минут из раствора AuCl3. С)0,4А;
На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы (С6Н12О6) Эбулиоскопическая константа воды равна 0,520 С)на 0,26 градуса;
Какой катион вытеснится из раствора его соли алюминием В)Cu2+;
Чему равна масса алюминия, полученного за один час при электролизе расплава АICI3 током силой 10,0 А. Е)3,36г.
Укажите возможную реакцию. В)Cu+AgNO3®…
Значение электродных потенциалов в гальваническом элементе соответственно равны: jок-ля=+0,54 В, jв-ля= -0,73 В. Рассчитать ЭДС системы. А) 1,27 В;
Какой из указанных металлов вытесняет водород из воды? А)Ca;
На железной пластинке, опущенной в раствор сульфата меди, выделилось 1,5 г меди. На сколько грамм растворилась железная пластинка? АFe=55,84 г/моль, АCu=63,54 г/моль. А)1,32 г;
Сколько граммов сахарозы (С12Н22О11) надо растворить в 100 г воды, чтобы понизить температуру кристаллизации на 1 градус К(Н2О)=1,860С. С)18,4г;
Какое количество вещества и какую массу составляют 1,12 м3 аммиака (при н.у.)
А)0,9 кг; 0,9 кмоль;
В)0,85 кг; 0.05 кмоль;
С)1,0 кг; 1,0 кмоль;
D)10 кг; 0,7 кмоль;
Е)1,23 кг; 3 кмоль.
При электролизе раствора какой соли будет выделяться на аноде О2. Е) K2SO4.
Ток силой 2,5 А, проходя через раствор электролита, за 30мин выделяет из раствора 2,77 г металла. Найдите эквивалентную массу металла. С)59,4 г/моль;
Укажите тип кристаллической решетки вещества и вид связи, образованные элементами с сокращенными электронными конфигурациями атомов - …3s1 и 3s23p5: Е) ионная решетка, ионная связь.
Какой металл не подвергается коррозии? Е)Au
Определить ЭДС гальванического элемента состоящего из магниевой и медной пластинок, опущенных в растворы соответственных солей, если [Mg2+]=[Cu2+]=0,01моль/л. E0(Mg2+/Mg)=-2,34 B; E0(Cu2+/Cu)=+0,34 B. Е)+2,68 В;
При электролизе раствора CuSO4 на электродах (катоде и аноде) выделяются вещества: В)Cu и O2;
При электролизе водного раствора какой соли на катоде выделяется только металл? С)Hg(NO3)2;
Чему равна эквивалентная масса кадмия, если для выделения 1 г кадмия из раствора его соли надо пропустить через раствор 1717 Кл электричества С)56,2г/моль;
Катализаторы – вещества, которые: С)увеличивают скорость химической реакции, участвуют в ней, но после реакции остаются в неизменной форме;
В строении атома алюминия и кремния одинаковое: Е)количество электронов на внешнем энергетическом уровне.
Определить выход по току кадмия, если при электролизе в течение 1 часа на катоде выделился кадмий массой 5,62 г, а ток был равен 5,36 А.D)50%;
Какой из металлов не растворяется в серной кислоте? D)Au;
В каких единицах измеряется ЭДС (Е) гальванического элемента? Е)вольтах.
Какая реакция замещения будет протекать? D)Zn+FeCl2®
Рассчитайте массу 3,011023 молекул сульфата меди СuSO4. В)80г;
У какого элемента металлические свойства выражены сильнее? С)Na; j0=-2,71 B;
В результате окисления ОН--гидроксид-ионов, какой газ выделяется на аноде? А)О2;
У какого из металлов образуется на поверхности плотная оксидная защитная пленка? А)Al;
В каких массовых отношениях надо смешать два раствора с массовой долей растворенного вещества 10 и 40%, чтобы получить 20% раствор C)2:1;
Ток силой 6 А пропускали через водный раствор серной кислоты в течение 1,5ч. Вычислить массу разложившейся воды. А)3,02г;
В кристаллическом состоянии атомы металлов связаны… В)металлической связью;
В каком ряду записаны только амфотерные гидроксиды? В)Be(OH)2, Zn(OH)2, Cr(OH)3;
Какое уравнение соответствует образованию основной соли? А)Zn(OH)2+HNO3®
Какое уравнение соответствует образованию кислой соли D)NaOH+H2SO3®
Укажите вещество, взаимодействующее с NaOH с образованием воды: В)HCl;
Укажите вещество, с которым будет взаимодействовать гидроксид натрия: В)SO3;
Укажите реакцию образования гидроксида бериллия: С)Be(NO3)2+Ca(OH)2®
Какая из перечисленных солей основная?
Е)MgOHCl.
В каком ряду увеличивается основной характер оксидов:
С)CaO®SrO®BaO;
Какой оксид при взаимодействии с водой образует кислоту?А)SO2;
Какой оксид растворяется в воде с образованием основания В)Na2O;
Какая из перечисленных солей называется дигидроортофосфат калия? D)KH2PO4;
Как называется соль (MnOH)2SO3? Е)дигидроксосульфит марганца;
Какую плотность по воздуху имеет газовая смесь, состоящая из азота, водорода и аммиака, если объёмные доли этих газов соответственно равны 30, 10, и 60%
А)0,65;
В)0,32;
С)0,98;
D)0,01;
Е)3,87.
Какое взаимодействие приведет к получению нормальной соли из гидроксохлорида магния? В)MgOHCl+HCl®
Докажите амфотерность свинца, дописав уравнение реакции:
Pb(OH)2+2KOH=…+2H2O В)K2PbO2;
Укажите основной оксид. А)BaO;
Укажите кислотный оксид. А)Cr2O3;
Укажите амфотерный оксид. В)Al2O3;
Укажите реакцию образования силиката кальция.
В)Ca(OH)2+SiO2®…
Укажите реакцию образования угольной кислоты.
D)CaCO3+HCl®…
Укажите реакцию
образования оксида железа (III).
С)Fe(OH)3![]() …
…
Укажите ряд веществ, с которыми реагируют основания.
А)SO3, H2SO4, Zn(OH)2;
В результате какой из реакций нельзя получить соль? D)кислотный оксид+вода®…
Укажите формулу, с помощью которой можно привести объем газа к нормальным условиям.
Е)![]() .
.
Объем (л), занимаемый 0,5 моль водорода при н.у.: В)11,2;
Какая формула выражает закон эквивалентов?
С)![]() ;
;
Какое количество вещества (моль) находится в 11,2 л оксида углерода (IV) CO2 при нормальных условиях? Е)0,5.
Укажите формулу, с помощью которой можно определить молярный объем: D)V=Vm;.
Для обнаружения ионов Fe2+ и Fe3+ используют: С)гидроксид калия;
Какова молярная масса газа, если его относительная плотность по воздуху равна 1,5, если Мвозд.=29 г/моль B)43,5;
Какое выражение,
соответствующее уравнению скорости
для гомогенной реакции 2NO(г)+O2(г)=2NO2(г)
является правильным? В)
= k
![]()
![]() ;
;
Какое выражение
соответствующее уравнению скорости
для гетерогенной реакции S(к)+O2(г)=SO2(г)
является
верным? D)
= k ![]() ;
;
Чему равна молярная масса эквивалента (г/моль) фосфорной кислоты (М(Н3РО4)=98г/моль) в реакции: Н3РО4+Са(ОН)2=СаНРО4+2Н2О? А)49;
Плотность газа по воздуху равна 2,2. Какова относительная молекулярная масса газа? Мвозд=29 г/моль.
С)64;
Что принимается за единицу количества вещества в системе СИ? С)моль;
Как правильно сказать: “1 моль вещества содержит”:
В) 6,021023 структурных единиц;
Какова размерность
молярной массы эквивалента вещества Х
(![]() ).
D)г/моль;
).
D)г/моль;
Укажите значения эквивалентных объемов водорода и кислорода при н.у. А)11,2 л/моль и 5,6 л/моль;
Определите количество молей в 56 г N2 при н.у. А)2,0;
Укажите, в каком случае содержится больше молекул при н.у. D)10 г NH3;
Укажите значение универсальной газовой постоянной. В) 8,314 Дж/мольК;
Укажите молярный объем газа при нормальных условиях. В)22,4 л;
Укажите значение
молярной массы эквивалента гидроксида
кальция Са(ОН)2.
D)M(![]() Ca(OH)2)=37
г/моль;
Ca(OH)2)=37
г/моль;
Укажите какое вещество имеет наименьший эквивалент.
С)O2;
Укажите какое вещество имеет наибольший эквивалент.
С)Н3РО4;;
Укажите массу (г) серной кислоты количеством 0,5 моль. М(H2SO4)=98 г/моль. В)49 г;
Какой объем (л) при нормальных условиях займет аммиак (NH3) массой 34 г. В)22,4 л;
Укажите формулу, выражающую закон эквивалентов.
А)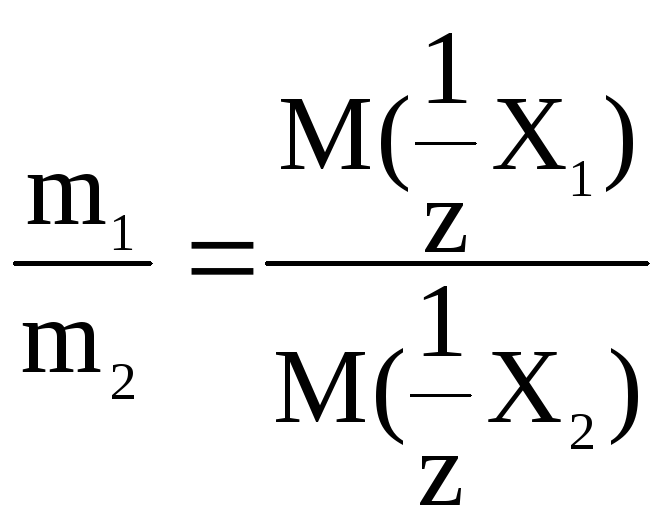 ;
;
Укажите число молекул в 3,4 г сероводорода (Н2S). А)6,021023;
Укажите молярную массу газа (г/моль), если 11 г этого газа занимает объем 5,6 л при н.у. А)44;
Укажите массу (г) и число молекул, содержащихся в 2 молях фтороводорода. С) 40 г и 12,041023 молекул;
Укажите значение постоянной Авогадро. В) 6,021023 моль-1;
Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 400С скорость возрастает в 81 раз? С)3;
Для какой из обратимых реакций повышение давления сместит равновесие в направлении прямой реакции: D)N2+3H2Û2NH3;
Как изменится скорость реакции 2NO(г)+O2(г)=2NO2(г), если уменьшить объем реакционного сосуда в 3 раза? D)возрастает в 27 раз;
Как изменится скорость реакции N2(г)+3Н2(г) Û2NН3(г), если увеличить давление в системе в 3 раза? С)81;
В каком направлении сместится равновесие реакции А2(г)+В2(г)Û2АВ(г), если давление увеличить в 2 раза и одновременно повысить температуру на 10 градусов? Температурные коэффициенты скоростей прямой и обратной реакций равны соответственно 2 и 3. А)влево;
Значение константы скорости реакции зависит: В)от природы реагирующих веществ;
Во сколько раз изменится скорость реакции 2А+В®А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза? А)возрастает в 2 раза;
