
Тесты рус
.docТемпературный коэффициент скорости реакции равен 2. Во сколько раз возрастет скорость реакции при повышении температуры от 200 до 700С
А)в10 раз;
В)в 15 раз;
С)в 32 раза;
D)в 16 раз;
Е)в 30 раз.
Математическое выражение скорости прямой реакции N2+3Н22NН3 соответствует уравнению: А) =k1C(N2)C3(H2)
Катализатор ускоряет химическую реакцию благодаря:
В)снижению энергии активации;
При увеличении концентрации реагирующих веществ, скорость химической реакции: А)увеличивается;
Как сместить равновесие реакции 2NO+O2®2NO2+Q влево? В) повысить температуру;
Согласно правилу Вант-Гоффа как изменится скорость реакции при повышении температуры на 100С? В)растет в 2-4 раза;
Укажите гомогенную реакцию. D) N2(г)+3Н2(г) 2NН3(г)
Во сколько раз увеличится скорость химической реакции: 4HCl(г)+O2(г)®2H2O(г)+2Cl2(г) при увеличении концентрации HCl в 2 раза? D)16;
Во сколько раз увеличится скорость химической реакции, протекающей в газовой фазе, при повышении температуры от 320 до 340 К, если g=3? В)9;
Как надо изменить давление, чтобы скорость реакции СО(г)+Н2О(г)=СО2(г)+Н2(г) увеличить соответственно в 36 раз Е)9.
На сколько градусов надо понизить температуру, чтобы уменьшить скорость реакции в 81 раз, если g=3? D)400;
При повышении давления равновесие реакции: Fe3O4(тв)+4CO(г)Û3Fe(тв)+4CO2(г) D)не сместится;
Для смещения равновесия системы вправо, т.е. в сторону образования аммиака в реакции: N2(г)+3H2(г)Û2NH3(г), необходимо: Е)увеличить объем газов.
Чтобы сместить равновесие системы 2CO(г)+O2(г) Û 2CO2(г)+Q влево (в сторону исходных веществ) необходимо:; D)увеличить температуру;
Водородная связь может образоваться между молекулами:
А)фтороводорода
При увеличении концентрации реагирующих веществ скорость химической реакции: В)увеличивается;
Какое выражение закона действующих масс справедливо для гетерогенной реакции С(тв)+СО2(г)=2СО(г)?
) = k C2(CO).
Ковалентная неполярная связь присутствует в D)H2;
Единица измерения скорости химической реакции В)моль/сек;.
Используя закон действия масс, определите скорость реакции 2A + B C: D) = k [A]2 [B];
Из ниже перечисленных реакций к окислительно-восстановительным относится:
А) 5Na2SO3+ 2KMnO4 + 3H2SO4 5Na2SO4 + K2SO4 + 2MnSO4 +3H2O;
Какая соль подвергается гидролизу? А) (NH4 )2S;
Определите рН раствора, если концентрация Н+ ионов равна 10-4 моль/л? D) 4;
Используя закон действия масс, определите скорость реакции A +3D 2C: D) = k [A] [D]3;
Чему равно ионное произведение для Mg(OH)2? C) [Mg2+][OH-]2;
В приведенной реакции 5Na2SO3+2KMnO4+3H2SO4 ® 5Na2SO4+K2SO4+3H2O+2MnSO4 определите окислитель:
B) KMnO4;
Чему равно ионное произведение воды?
D)
![]()
Выразите константу
равновесия для реакции: 2Н2
+ СО
![]() СН3ОН;
СН3ОН;
В)
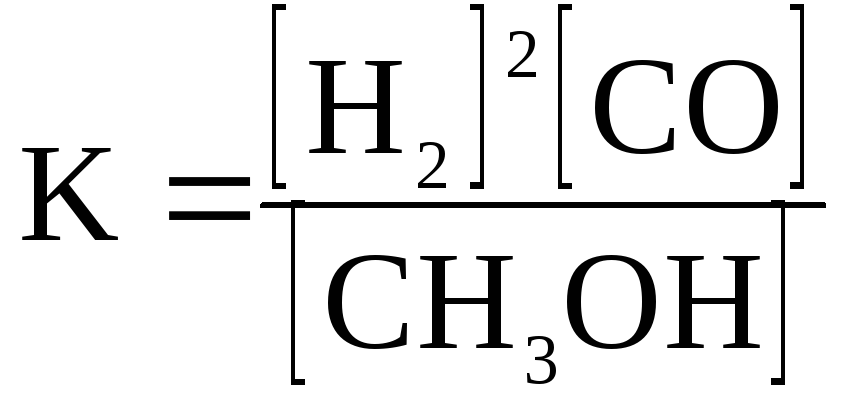 ;
;
Для какой реакции используют электронный баланс? В) окислительно-восстановительной;
Как называется частица, присоединяющая электрон? А) окислителем;
Каким из ниже перечисленных гидроксидов характерны амфотерные свойства? А) Al(OH)3, Cr(OH)3;
Укажите правильное выражение рН раствора: pH = -lg[H+];
Определите эквивалентную массу соли Fe2(SO4)3: A) 66,7;
Дайте точное определение массовой доле:
C) отношение массы растворенного вещества к общей массе раствора;
По какой формуле определяется титр раствора: Е) Т = С∙М(1/z)/1000
По какой формуле определяется молярная концентрация:
C) C = n/V;
Чему равна нормальность растворов HCI и H2SO4, если их титры соответственно равны 0,00359 г/мл и 0,004805 г/мл?
А) HCI = 0,0985; H2SO4 = 0,09806;
Какое количество электронов получает молекула K2Cr2O7 в реакции:
KJ + K2Cr2O7 + H2SO4 ® J2 + K2SO4 + Cr2 (SO4)3 + H2O В) 3е;
Какая масса растворенного вещества содержится в растворе массой 1,8 кг, где его массовая доля составляет 20% А)0,36кг;
Титром раствора называется С) количество молей вещества в 1 л раствора;
К 1000 г 80%-ной уксусной кислоты прибавлено 3 л воды. Найти процентную концентрацию полученного раствора. В) 20%
Определите эквивалент окислителя в уравнении:
2KMnO4 + 3H2SO4 + 5H2C2O4 = 2MnSO4 +K2SO4 + 10CO2 + 8H2O
A) 158 г;
В) 31,6 г;
С) 10,0 г;
D) 15,8 г;
Е) 3,16 г.
$$$ 259
Вычислите тепловой эффект реакции горения этилена С2Н4(г), учитывая, что ее продуктами являются СО2(г) и Н2О(ж).
Теплоты образования СО2(г), Н2О(ж) и С2Н4(г) равны соответственно -393,51, -285,84 и 52,28 кДж/моль.
А)-46,2кДж/моль;
В)-1410,9кДж/моль;
С) 0;
D) 123кДжмоль;
Е)-705кДж/моль.
Найдите стандартную теплоту образования NH3(г), зная, что окисление NH3 протекает по термохимическому уравнению:
4NH3(г)+3О2(г)=2N2(г)+6Н2О(ж); ∆Н0r,298 = -1530кДж, ∆Н0f,298(Н2О(ж)) = -285,84кДж. С)-46,2кДж/моль;
Исходя из теплового эффекта реакции Fe2O3(к) +3CO(г)=2Fe(к)+3CO2(г), равного -26,8 кДж, вычислите теплоту образования (∆Н0f,298) оксида железа(III). ∆Н0f,298(CO)=-110,5 кДж, ∆Н0f,298(CO2)=-393,51 кДж.
А) 60кДж/моль;
В) -822,2 кДж/моль;
С)55,1 кДж/моль;
D)-16,5 кДж/моль;
Е)65,5 кДж/моль.
$$$ 262
Под энтальпией образования понимают…
Е)тепловой эффект реакции образования 1 моль вещества из простых веществ.
Какой закон является основным законом термохимии? А) Бойля-Мариотта;
Укажите значение молярной массы гидроксида кальция M(Ca(OH)2) А) 74 г;
При сжигании графита образовался оксид углерода (IV) массой 8,86 г. Тепловой эффект реакции ∆Нr=-79,2кДж. Вычислите теплоту образования 1 моль СО2 из простых элементов. В) 393,3 кДж/моль;
