
- •Газовые законы. I начало термодинамики и его применение к идеальному
- •Газовые законы. I начало термодинамики и его применение к идеальному
- •1. 2) Основное уравнение молекулярно-кинетической теории идеального газа
- •1) Распределение по вектору скорости
- •[Править]Уравнение среднеквадратичной скорости молекулы
- •5Далее показаны, в качестве иллюстрации, формы нормальных колебаний некоторых молекул.
Газовые законы. I начало термодинамики и его применение к идеальному
Понятие идеального газа. Основное уравнение кинетической теории идеального газа.
Уравнение Менделеева-Клапейрона. Различие формы записи уравнения. Физический смысл и численное значение универсальной газовой постоянной. Константа Больцмана.
Изопроцессы идеального газа. Каким законам они подчиняются? Графическое изображение этих законов в осях (P,V), (V,T), (P,T). Физический смысл абсолютной температуры.
Адиабатический процесс. Уравнение Пуассона.
сопоставить ход адиабаты и изотермы в системе координат (P,V). Почему адиабата идет круче изотермы?
Внутренняя энергия идеального газа и ее выражение через число степеней свободы его молекул.
Теплоемкость идеального газа. Что называется удельной теплоемкостью? Молярной теплоемкостью? Соотношение между ними.
Что такое CV и CP? Почему CP>CV?
Связь между молекулярными теплоемкостями CP и CV . Как эти теплоемкости выражаются через число степеней свободы молекул газа?
Определение отношения CP/CV методом Клемана и Дезорма. Какие процессы имели место в данной работе? Иллюстрируйте их соответствующими графиками и поясните вывод расчетной формулы.
Первое начало термодинамики для идеального газа и его применение к различным изопроцессам.
Распределение молекул во внешнем потенциальном поле сил. Барометрическая формула.
Распределение молекул идеального газа по скоростям (распределение Максвелла). Вычисление средней арифметической, средней квадратичной и наиболее вероятной скоростей.
Основное уравнение молекулярно- кинетической теории газа.
Теорема Больцмана о равномерном распределении энергии по степеням свободы молекулы. Вычисление внутренней энергии идеального газа и его теплоемкостей через число степеней свободы. Недостатки классической теории теплоемкостей идеального газа.
Средняя длина свободного пробега и среднее число столкновений молекул идеального газа в единицу времени.
Газовые законы. I начало термодинамики и его применение к идеальному
1. 2) Основное уравнение молекулярно-кинетической теории идеального газа
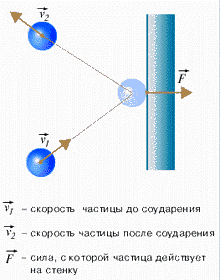
Основное уравнение молекулярно-кинетической теории идеального газа устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
можно записать:
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
1)Идеальный газ - модель реального газа, которая удовлетворяет следующим требованиям:
- Расстояние между молекулами гораздо больше их размеров (молекулы можно считать материальными точками);
- Силами взаимодействия, кроме моментов соударения, можно пренебречь (потенциальная энергия взаимодействия молекул по сравнению с кинетической энергией хаотического движения пренебрежимо мала);
- Столкновение молекул друг с другом и со стенками абсолютно упругое;
- Движение каждой молекулы подчиняется классическим законам динамики Ньютона.
- Реальный разреженный газ приблизительно ведет себя как идеальный газ.
P=(1/3)· n· mo· V2.




2.
1) Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малогоколичества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
![]()
Единица измерения теплоёмкости в системе СИ — Дж/К.
2) Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
3) Молярная теплоёмкость (Сμ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
Массовая теплоёмкость (С) — это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1).
Объёмная теплоёмкость (С′) — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1).
4) Удельная измеряется в Дж/(кг*К), молярная в Дж/(моль*К). Очевидно, чтобы получить из удельной теплоёмкости молярную - нужно разделить её на молярную массу в-ва (в случае системы СИ - обязательно выраженной в кг/моль! вообще, никогда не забывайте соотносить единицы измерения)
1) Сp = Cv + R Cp = Cv + l(dV/dT)p = Cv + l(R/P) но для идеальных газов l=P отсюда Cp= Cv + (P*R)/P = Cv + R где R - универсальная газовая постоянная, l - теплота расширения газа на единицу объема, (dV/dT)p - производная от V по T при постоянном давлении. Короче говоря при постоянном давлении газ не только поглощает теплоту но и выполняет работу расширения поэтому Cp>Cv - которое выражено при постоянном объеме (изохорный процесс), а Cp выполняет работу которая равна: dA=PdV
2) Cp-Cv=R Cv -Молярная теплоемкость при постоянном объеме Cp – молярная теплоемкость в изобарном процессе R=8,31 Дж/моль*К
Вывод формулы Майера Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. c = Q / (mΔT). Во многих случаях удобно использовать молярную теплоемкость C: C = M · c, где M – молярная масса вещества. Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры. Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const). В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует QV = CVΔT = ΔU. Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры. Для процесса при постоянном давлении первый закон термодинамики дает: Qp = ΔU + p(V2 – V1) = CVΔT + pΔV, где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует: Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля: pV = RT, где R – универсальная газовая постоянная. При p = const Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера): Cp = CV + R.
Закон Грюнaйзена, установленный чисто эмпирическим путем, был затем
обоснован методами статистической физики. Следует подчеркнуть, что этот
закон имеет совершенно ясный термодинамический смысл. В самом деле,
в соответствии с уравнением (4.55)
Пусть ТДС рассматривается при двух параметрах давления и объема, имеется два состояния системы I и II. Нужно перевести систему из состояния I в состояние II либо по пути А, либо по пути В (рис. 3).
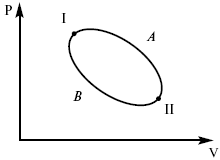
Рис. 3
Предположим, что по пути А изменение энергии будет ΔUA, а по пути В – ΔUB. Внутренняя энергия зависит от пути процесса
ΔUA = ΔUB,
ΔUA – ΔUB ≠ 0.
Согласно пункту 1 из формулировок первого закона термодинамики, общий запас энергии в изолированной системе остается постоянным
ΔUA = ΔUB ,
U вн – функция состояния не зависит от пути процесса, а зависит от состояния системы I или II. U вн – функция состояния, является полным дифференциалом
Q = ΔU + А –
интегральная форма уравнения первого закона термодинамики.
δQ = dU + δA–
для бесконечно малого процесса, δA– сумма всех элементарных работ.
Калорические коэффициенты

Теплота изотермического расширения:

Уравнение первого закона термодинамики в калорических коэффициентах
δQ = ldv + CvdT,
где l – коэффициент изотермического расширения;
Сv– теплоемкость при постоянном объеме.

теплоемкость при const давлении,
δQ = hdp + СpdT,
δQ = χdP + ψpdv.
Связь между функциями CP и Cv
δQ = hdp + СpdT = ldv + CvdT,

для реального газа.
Для идеального газа l= р
Ср– СV= R,
к = ( δQ/дv)ρ– теплота изохорного расширения;
m = ( δQ/дP)v– теплота изобарного сжатия.
Смотреть лабораторную работу по определению отношения теплоемкости по методу Клемана и Дезорма.
Первое начало термодинамики. Формула (13.1) является выражением закона сохранения энергии. Действительно, исходя из опыта, для любого способа перехода ТС из состояния 1 в состояние 2 изменение внутренней энергии не зависит от способа такого перехода. Для бесконечно малых приращений параметров состояния первое начало термодинамики можно сформулировать, исходя из формулы (13.3):
элементарное количество теплоты, сообщенное термодинамической системе, идет на изменение ее внутренней энергии и совершение системой работы.
Количество теплоты, как следует из первого начала термодинамики, измеряется в тех же единицах, что работа или энергия, т.е. в Джоулях. Существует механический эквивалент теплоты, определенный экспериментально.
1 Дж = 4.19 кал.
В случае совершения термодинамического цикла приращение внутренней энергии равняется нулю и, исходя из первого начала термодинамики, получим, что:
A = Q.
Другими словами, для циклического процесса работа, совершаемая ТС, не может быть больше количества теплоты, сообщенного ей, т.е.
невозможно создание вечного двигателя первого родаили невозможносоздать периодически действующий двигатель, который бы совершал большую работу, чем полученная извне энергия.
Если в изолированной ТС не происходит никаких превращений энергии, кроме теплообмена между телами, входящими в эту систему, то количество теплоты, отданное охлаждающимися при этом телами, равно количеству теплоты, полученному телами, которые нагреваются. Суммарная внутренняя энергия системы при этом не меняется, т.е.DU1-2 = 0. Это выражение называетсяуравнением теплового баланса.
С учетом вышеизложенного, для конечных величин изменения параметров ТС, т.е. для случая перехода системы из состояния 1 в состояние 2 можно записать следующее равенство, позволяющее рассчитать изменение внутренней энергии DU1-2:
DU1-2 = Q1-2 + A1-2' = Q1-2 - A1-2 (13.1) или Q1-2 = DU1-2 + A1-2, (13.2) где A1-2 - работа, совершаемая системой против действия внешних сил; A1-2' - работа, совершаемая внешними силами над системой Q1-2 - количество теплоты, сообщенное системе.
При переходе к бесконечно малым изменениям будет справедливо следующее равенство:
dQ = dU + dA, (13.3) где величины элементарного количества теплоты dQ и работы и dAположительны, если теплота подводится к системе и система совершает работу над внешними силами.
Работа и количество теплоты не являются функциями состояния, но их элементарные количества определяют изменение внутренней энергии системы, что и отражено в уравнении (13.3).
http://solidstate.karelia.ru/~KOF/OLD/mathemat/lectures/lecture13_a.html
Барометрическая формула. Распределение Больцмана.
При выводе основного уравнения МКТ газов и максвелловского распределения молекул по скоростям предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Однако молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение и тепловое движение молекул приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает. Больцман обобщил распределение Максвелла на случай поведения частиц в произвольном силовом поле.
Гидростатическое
давление столба жидкости или газа: ![]() ,
где
,
где ![]() .
.
![]() ,
тогда
,
тогда ![]() =>
=> ![]() =>
=> ![]() ;
;
В
итоге мы получаем:![]() − барометрическая формула.
Барометрическую формулу можно
преобразовать, если воспользоваться
выражением
− барометрическая формула.
Барометрическую формулу можно
преобразовать, если воспользоваться
выражением![]() :
:
![]() −распределение
Больцмана во внешнем потенциальном
поле. Из нее следует, что при постоянной
температуре плотность газа больше там,
где меньше потенциальная энергия его
молекул. Если частицы имеют одинаковую
массу и находятся в состоянии хаотического
теплового движения, то распределение
Больцмана справедливо в любом внешнем
потенциальном поле, а не только в поле
сил тяжести.
−распределение
Больцмана во внешнем потенциальном
поле. Из нее следует, что при постоянной
температуре плотность газа больше там,
где меньше потенциальная энергия его
молекул. Если частицы имеют одинаковую
массу и находятся в состоянии хаотического
теплового движения, то распределение
Больцмана справедливо в любом внешнем
потенциальном поле, а не только в поле
сил тяжести.
График зависимости давления от высоты:
Реальная
зависимость более сложная, т. к. ![]() .
.![]()
