
Khimicheskaya_kinetika2
.docxХимическая кинетика : При рассмотрении вопроса о скорости химических реакций необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции протекающие в гетерогенной системе (гетерогенные реакции). Системой принято называть рассматриваемое вещество или совокупность веществ. Гомогенной называется система, состоящая из одной фазы, гетерогенной – система состоящая из нескольких фаз. Фазой называется часть системы, отдельная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком. Примером гомогенной системы может служить любая газовая смесь, р-р нескольких в-в в одном растворителе. Система состоит только из одной фазы газовой или из водного р-ра. Примером гетерогенных систем: вода со льдом, уголь и сера в атмосфере воздуха. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы. vгомог= n/(V t) Скоростью гетерогенной реакции называется ко-во вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы. Vгетер= n/( S t) Скоростью реакции в гомогенной системе называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее за единицу времени. К важным факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрация, температура, присутствие в системе катализаторов. Скорость некоторых гетерогенных реакций зависит также от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция. Скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ. Число соударений тем выше, чем больше концентрация каждого из исходных веществ. v=k[A][B] k – коэффициент пропорциональности - константа скорости. Полученное соотношение выражает закон действующих масс для химической реакции, протекающей при столкновении двух частиц: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрацией реагирующих веществ. В случае гетерогенных реакций в уравнения закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, обычно представляет собою постоянную величину и поэтому входит в константу скорости v=k`const[O2], k=k`const. Для того, чтобы произошла реакция, необходимо сначала разорвать или ослабить связи между атомами молекул исходных веществ. избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества называется энергией активации данной реакции. Энергия активации выражается в кДж/моль. Молекулы обладающие такой энергией называются активными. Сростом температуры число активных молекул возрастает. Скорость химической реакции возрастает с повышением температуры. Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции – числом, показывающим во сколько раз возрастает скорость данной реакции при повышении температуры на 10 градусов. При обычных температурах значение коэффициента для большинства реакций лежит в пределах от 2 до 4.

Правило Вант-Гоффа: при повышении температуры на каждые 10 К скорость реакции увеличивается в 2-4 раза.(см.выше) Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Действие катализатора объясняется тем, что он снижает энергию активации реакции.
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор участвует в реакции. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Гомогенный катализ [править]
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ [править]
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
-
Диффузия реагирующих веществ к поверхности твердого вещества
-
Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
-
Химическая реакция между реагирующими молекулами
-
Десорбция продуктов с поверхности катализатора
-
Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу или р-р. в случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазе. Гетерогенные реакции имеют большое значение в технике. Рассматривая гетерогенные реакции, нетрудно заметить, что они тесно связаны с процессами переноса вещества. В ходе гетерогенной реакции можно выделить три стадии:
-
подвод реагирующего вещества к поверхности
-
химическая реакция на поверхности
-
отвод продукта реакции от поверхности
при
установившемся режиме все три стадии
проходят с равными скоростями. Во всех
случаях скорость гетерогенных реакций
определяется скоростью переноса
вещества.
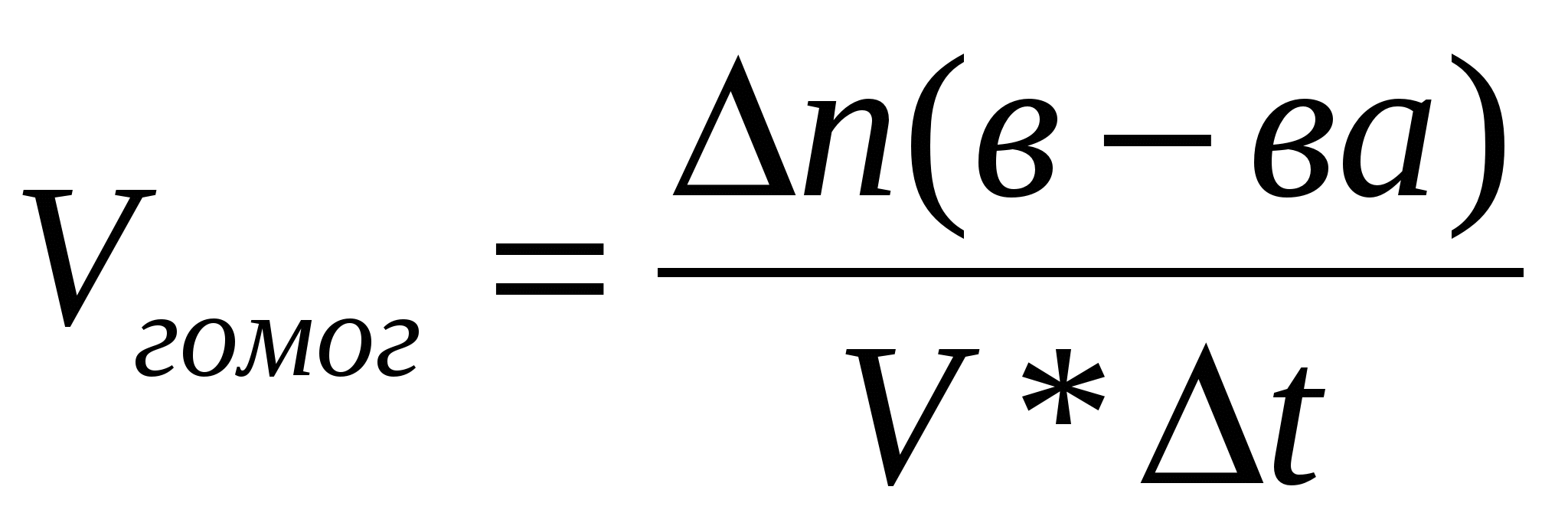
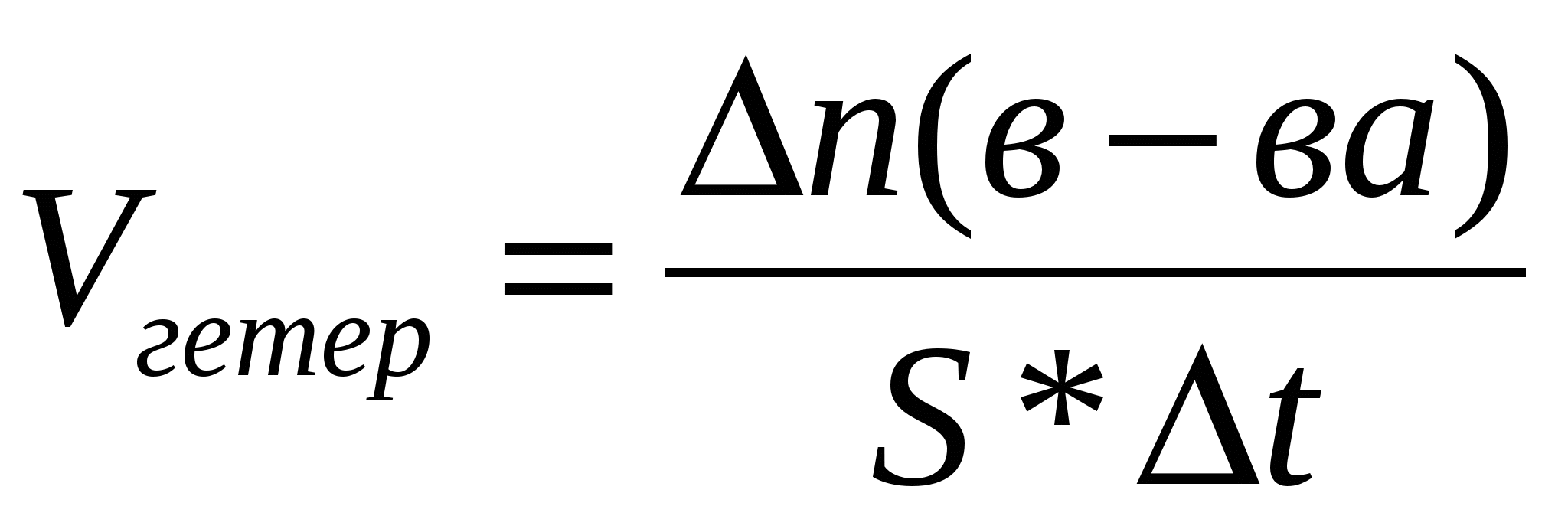 Заменив
Заменив ![]()
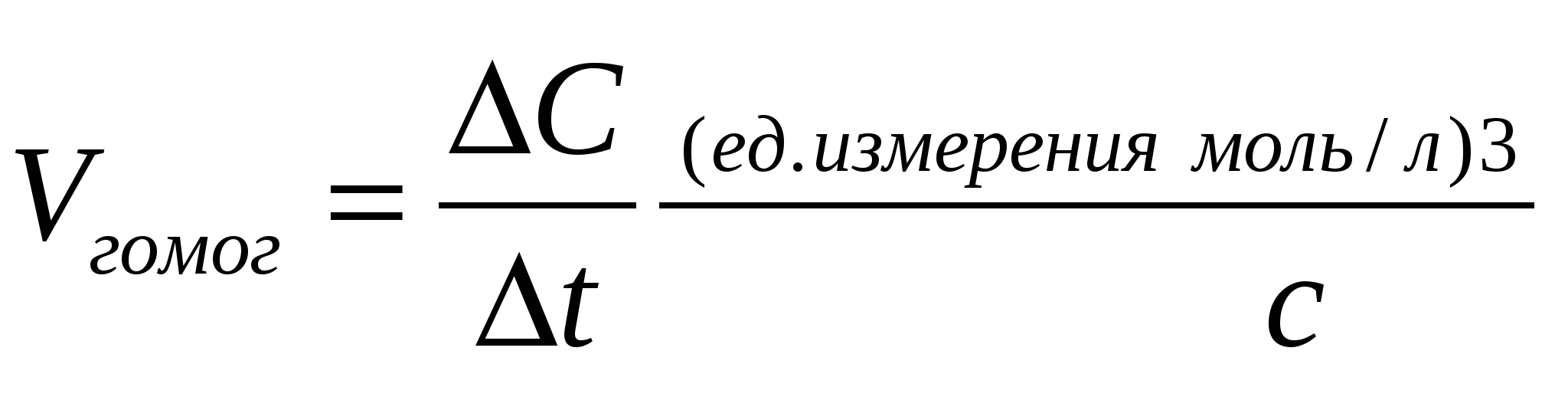
Энергия активации в химии и биологии — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea.
Ea=-ln(k\A)RT k=A*e(-Ea\RT) Уравнение Аррениуса. K-константа скорости, А-предэкспоненциальный множитель, определяющий долю столкновения молекул,обладающих достаточной энергией, Т-температура, R=8.31 Дж*(К*моль)-1
Энергия активации различных реакций различна. Ее величина является тем фактором, посредством которого связывается влияние природы реагирующих в-в на скорость реакции. Если ЭА очень мала (меньше 40), то значит, что значительная часть столкновений между частицами реагирующих веществ приводит к реакции. Скорость таких реакций велика. Если ЭА очень велика (больше 120), то значит что лишь малая часть столкновений приводит к протеканию реакции. Скорость подобной реакции очень мала.
В химической модели, известной как Теория активных соударений (ТАС), есть три условия, необходимых для того, чтобы произошла реакция:
-
Молекулы должны столкнуться. Это важное условие, однако его не достаточно, так как при столкновении не обязательно произойдёт реакция.
-
Молекулы должны обладать необходимой энергией (энергией активации). В процессе химической реакции взаимодействующие молекулы должны пройти через промежуточное состояние, которое может обладать большей энергией. То есть молекулы должны преодолеть энергетический барьер; если этого не произойдёт, реакция не начнётся.
-
Молекулы должны быть правильно ориентированы относительно друг друга.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇌ 2NH3.
Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрациях азота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция
N2O4 ⇌ 2NO2
складывается из элементарных реакций
N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4.
Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии.
Особенность обратимых реакций состоит в том что они не идут до конца,в системе всегда остается каждое из исходных веществ например : Н2 + I2= 2HI
Реакцию образования йодида водорода называют прямой, реакцию образования водорода и йода обратной. Скорость прямой реакции V1 скорость обратной V2
Если в системе скорость прямой реакции равна скорости обратной , то состояние это называют химическим равновесием. Согласно закону действующих масс : V1=k1[H2][I2] | V2=k2[HI]2
Тк V1=V2 k1\k2=[HI]2\[h2][I2] k1\k2=K-константа равновесия
В состоянии равновесия концентрации компонентов реакции остаются неизменными и называются равновесными концентрациями.
В общем виде:
aA+bB=cC+dD K=[C]c*[D]d\[A]a*[B]b K зависит от природы реагентов, температуры, и не зависит от концентрации реагирующих веществ в системе.
Значение К может быть определено из уравнения : дельта G0 = -RTlnKp G-стандартное значение энергии Гиббса
В гетерогенных системах вещества находятся различных фазах. Если вещества химически не взаимодействуют, то такую систему называют химически нереагирующей системой. В гетерогенных химически реагирующих системах вещества чаще всего взаимодействуют на границе раздела фаз. Равновесие, устанавливающееся в таких системах, называют гетерогенным химическим равновесием.
Для гетерогенных процессов:
- конденсированные фазы (жидкие и твердые), не улетучивающиеся в ходе реакции и не переходящие полностью в раствор и их количества не оказывают влияния на равновесие;
-в выражение константы равновесия обратимых гетерогенных реакций входят только парциальные равновесные давления газообразных веществ, взятых в степенях стехиометрических коэффициентов. Для уравнения: Ст + СО2 г «2СОг Кр = р2равнСО/ рравнСО2
-константы равновесия Кр и Кр0 и Кс и Кс0 зависят от свойств всех веществ, реагирующих в гетерогенной реакции, а не только газов.
-для обратимых гетерогенных реакций введение дополнительного количества жидких или твердых компонентов (реагентов, продуктов) в реакционную смесь или их выведение из нее не влечет за собой изменения состава и, следовательно, не нарушает состояния равновесия, т.е. не смещает его положения;
-смещение положения равновесия в обратимых гетерогенных реакциях при изменении температуры вне зависимости от агрегатного состояния реагентов и продуктов подчиняется общим закономерностям.
Перевод равновесной химической системы из одного состояния равновесия в другое называется смещением (сдвигом) химического равновесия, которое осуществляется изменением термодинамических параметров системы - температуры, концентрации, давления При смещении равновесия в прямом направлении достигается увеличение выхода продуктов, а при смещении в обратном направлении - уменьшение степени превращения реагента. И то, и другое может оказаться полезным в химической технологии.
Направление сдвига химического равновесия определяется принципом Ле-Шателье: если на систему в состоянии истинного равновесия воздействовать извне, изменяя термодинамические параметры, то равновесие сместится в том направлении, которое ослабит эффект внешнего воздействия.
Влияние температуры на состояние равновесия различно для эндотермических (DН° > 0) и экзотермических (DН°< 0) реакций. В соответствии с принципом Ле-Шателье изменение температуры смещает направление этих реакций (показано стрелкой), тем самым уменьшая эффект внешнего воздействия на систему:
повышение температуры А D В; DН° > 0 (®)
(нагревание) В D А; DН° < 0 (¬)
понижение температуры А D В; DН° > 0 (¬)
(охлаждение) В D А; DН° < 0 (®)
Например, смещение равновесия в реакции
СО2(г) + Н2(г) D СО(г) + Н2О(г); DН° = + 41 кДж
При повышении температуры будет осуществляться в прямом так как реакция эндотермическая), а при понижении температуры - в обратном направлении. Этот фактор смещения равновесия применим ко всем химическим системам вне зависимости от агрегатного состояния реагентов и продуктов.
Влияние концентрации на состояние равновесия ограничено изменением содержания только тех веществ, равновесные концентрации которых входят в выражение для константы равновесия.
Для гомогенных реакций (5.1) в соответствии с принципом Ле-Шателье введение избытка одного из реагентов вызовет смещение равновесия в прямом, а введение избытка одного из продуктов - в обратном направлении, тем самым ослабляя эффект внешнего воздействия на систему:
избыток реагента (А или В) (®)
избыток продукта (С или D) (¬)
Для гетерогенных реакций введение дополнительного количества жидкого или твердого вещества (реагента или продукта) не влияет на состояние равновесия. Например, для гетерогенной реакции
Cu2O(т) + 2 HCl(г) D 2 CuCl(ж) + H2O(г)
Добавление в систему избытка хлороводорода сместит равновесие в прямом направлении, а ввдение избытка твердого оксида меди(I) на состояние равновесия не повлияет.
Влияние давления на состояние равновесия проявляется только при наличии в системе газов. В соответствии с принципом Ле-Шателье увеличения давления смещает равновесие в сторону той (прямой или обратной) реакции, которая сопровождается уменьшением объема (газообразных продуктов или реагентов соответственно). А уменьшение давления - в противоположную сторону. Поскольку объем газообразных реагентов и продуктов пропорционален сумме их стехиометрических коэффициентов (обозначенной ånреаг. и ånпрод.), то изменение давления в гомогенных реакциях (5.1) сместит равновесие в следующем направлении, тем самым уменьшая эффект внешнего воздействия на систему:
увеличение ånреаг > ånпрод (®)
давления ånреаг < ånпрод (¬)
уменьшение ånреаг > ånпрод (¬)
давления ånреаг < ånпрод (®)
При равенстве ånреаг = ånпрод изменение давления не повлияет на состояние равновесия. Для гетерогенных реакций коэффициенты при формулах жидких и твердых веществ во внимание не принимаются. Например, при увеличении давления направление смещения равновесия в следующих реакциях таково:
а) 2 СО2(г) + 2 Н2О(г) + 2 НСl(г) D 2 СН3Сl(г) + 3 О2(г)
{nСО2 + n(Н2О) + n(НСl)} > {n(СН3Сl) + n(О2)} (®)
б) 2 N2O(г) + S(т) D 2 N2(г) + SO2(г)
{n(N2O)} < {n(N2) + n(SО2)} (¬)
в) N2(г) + H2(г) + 2 C(т) D 2 HCN(г)
{n(N2) + n(H2)} = n(HCN) (смещения нет)
При решении расчетных задач данного раздела следует иметь ввиду, что при переходе из одного состояния равновесия (исходного по условию) к другому (конечному) под влиянием внешних воздействий начальные концентрации продуктов уже не равны нулю. То же наблюдается и для реакций, которые еще не пришли к состоянию равновесия, но уже протекают.
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Анри Ле Шателье (Франция) сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый Карлом Брауном[1].
Принцип применим к равновесию любой природы: механическому, тепловому, химическому, электрическому (эффект Ленца, явление Пельтье)[2].
|
|
Влияние температуры[править]
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:

в системах с газовой фазой — уравнением изохоры Вант-Гоффа

В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:

Например, в реакции синтеза аммиака
N2 + 3H2 ⇄ 2NH3 + Q
тепловой эффект в стандартных условиях составляет -92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта.
Влияние давления[править]
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При понижении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
|
давление, МПа |
0,1 |
10 |
20 |
30 |
60 |
100 |
|
объемная доля NH3, % |
0,4 |
26 |
36 |
46 |
66 |
80 |
Влияние инертных газов[править]
Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов.
Влияние концентрации[править]
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
-
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
-
При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
