
Строение атома
.doc1)Строение атома : атом – электронейтральная частица, главным составными частями которой являются положительно заряженное ядро и отрицательно заряженные электроны. В 1911 году английский физик Э.Резерфорд предложил планетарную мадель атома : в центре атома расположено заряженное ядро, вокруг которого вращаются электроны, подобно планетам вокруг Солнца.
Квантовые числа как характеристики состояния электронов в атоме :
Главное квантовое число n служит для отнесения состояния электрона к тому или иному энергетическому уровню, под которым понимается набор орбиталей с близкими значениями энер-гии. Главное квантовое число может принимать любое значение из области натуральных чисел, т.е.n=1, 2…. При переходе электрона с одного энергетического уровня на другой главное квантовое число изменяется.
Энергетический уровень включает в себя несколько орбиталей. Орбитали с одинаковой энергией, принадлежащие одному энергетическому уровню, образуют энергетический подуровень. Отнесение орбитали к какому-либо подуровню производится при помощи побочного (орбитального) квантового числа l. Оно может принимать целочисленные значения от 0 до n-1. Т.е. для электрона с главным квантовым числом n орбитальное квантовое число l может принимать n значений от l=0 до l=n-1. Так, при n=1, l=0; при n=2, l=0 и l=1, при n=3, l=0, 1, 2.
Орбитальное
квантовое число показывает, какому
подуровню данного энергетического
уровня соответствует характер движения
рассматриваемого электрона. Орбитальное
квантовое число характеризует форму
атомной орбитали. Очень часто состояния
электрона обозначают латинскими буквами,
при этом состояние с l=0 называют
s-орбиталью, l=1 — р-орбиталью, l=2 —
d-орбиталью l=3 — f-орбиталью, l=4 —
g-орбиталью и т.д.
Электронные
облака орбиталей с разными значениями
l имеют разную конфигурацию, а с одинаковыми
l похожую.
 Так, при l=0 (s-орбиталь) для электрона с
любым значением главного квантового
числа n электронное облако ограничено
сферой (рис. 2), и чем больше n, тем больше
ее радиус. Электронные облака p-орбиталей
(l=1) имеют форму «вращающейся восьмерки»
(рис. 3). При увеличении значения числа
l формы электронных облаков усложняются.
Соответственно увеличивается энергия
электрона, который занимает данную
орбиталь.
Как
видно из рисунка 3, орбитальному квантовому
числу l=1 соответствуют три различным
образом ориентированных в пространстве,
но одинаковых по форме электронных
облака (они называются рx, рy, рz-орбитали
в соответствии с их расположением в
пространстве). Вообще, на подуровне с
орбитальным числом l находится 2l+1
орбиталь с одинаковой энергией.
Для
того, чтобы различать электроны,
занимающие одинаковые по энергии
орбитали, введено магнитное квантовое
число ml. Его квантово-механический смысл
в том, что ml выражает проекцию орбитального
момента импульса на направление
магнитного поля. Именно магнитное
квантовое число отражает пространственную
ориентацию орбиталей с одинаковым
числом l. Соответственно, для электрона
с орбитальным квантовым числом l возможны
2l+1 различных значений магнитного
квантового числа ml, от -l до +l, включая
0. Это значит, что, например, на третьем
энергетическом уровне (n=3, l=0,1,2), при l=2
(d-подуровень) электрон может находиться
на 2 • 2 + 1 = 5 различных орбиталях с
одинаковой энергией.
Так, при l=0 (s-орбиталь) для электрона с
любым значением главного квантового
числа n электронное облако ограничено
сферой (рис. 2), и чем больше n, тем больше
ее радиус. Электронные облака p-орбиталей
(l=1) имеют форму «вращающейся восьмерки»
(рис. 3). При увеличении значения числа
l формы электронных облаков усложняются.
Соответственно увеличивается энергия
электрона, который занимает данную
орбиталь.
Как
видно из рисунка 3, орбитальному квантовому
числу l=1 соответствуют три различным
образом ориентированных в пространстве,
но одинаковых по форме электронных
облака (они называются рx, рy, рz-орбитали
в соответствии с их расположением в
пространстве). Вообще, на подуровне с
орбитальным числом l находится 2l+1
орбиталь с одинаковой энергией.
Для
того, чтобы различать электроны,
занимающие одинаковые по энергии
орбитали, введено магнитное квантовое
число ml. Его квантово-механический смысл
в том, что ml выражает проекцию орбитального
момента импульса на направление
магнитного поля. Именно магнитное
квантовое число отражает пространственную
ориентацию орбиталей с одинаковым
числом l. Соответственно, для электрона
с орбитальным квантовым числом l возможны
2l+1 различных значений магнитного
квантового числа ml, от -l до +l, включая
0. Это значит, что, например, на третьем
энергетическом уровне (n=3, l=0,1,2), при l=2
(d-подуровень) электрон может находиться
на 2 • 2 + 1 = 5 различных орбиталях с
одинаковой энергией. Четвертое
квантовое число называется магнитным
спиновым числом ms (или просто спином s)
и характеризует чисто квантовое свойство
электрона — спин. Спин электрона есть
собственный момент количества движения.
Хотя интерпретация этого свойства
сложна, его можно уподобить вращению
электрона вокруг своей воображаемой
оси. Магнитное спиновое число ms может
быть равно либо (-1/2), либо (+1/2)1.
Электрон
располагается так, чтобы его энергия
была минимальной.
Состояние
атома, в котором все электроны имеют
минимальную энергию, называются основным,
или невозбужденным, состоянием. Согласно
принципу наименьшей энергии, сначала
заполняется энергетический уровень с
n=1, затем, после заполнения первого
уровня, с n=2 и т.д. Всего на первом уровне
(n=1) может находиться только два электрона,
на втором (n=2) восемь, на третьем (га = 3)
восемнадцать, т.е. на уровне с номером
n может находиться не более 2n2 электронов.
Это следует из другого правила, которое
выполняется при построении электронной
оболочки атома и называется принципом
Паули.
В
атоме не может быть электронов, у которых
бы совпадал весь набор из четырех
квантовых чисел.
Поэтому
на первом уровне (n=1,l=n-1=0, орбиталь s-типа)
электроны могут различаться только
значением спинового числа ns, а поскольку
для него возможны только два значения
(-1/2 и +1/2), то первый энергетический
уровень может быть занят не более чем
двумя электронами. Заполнение этого
уровня происходит в невозбужденных
атомах водорода и гелия. Схематично это
можно представить следующим образом:
Четвертое
квантовое число называется магнитным
спиновым числом ms (или просто спином s)
и характеризует чисто квантовое свойство
электрона — спин. Спин электрона есть
собственный момент количества движения.
Хотя интерпретация этого свойства
сложна, его можно уподобить вращению
электрона вокруг своей воображаемой
оси. Магнитное спиновое число ms может
быть равно либо (-1/2), либо (+1/2)1.
Электрон
располагается так, чтобы его энергия
была минимальной.
Состояние
атома, в котором все электроны имеют
минимальную энергию, называются основным,
или невозбужденным, состоянием. Согласно
принципу наименьшей энергии, сначала
заполняется энергетический уровень с
n=1, затем, после заполнения первого
уровня, с n=2 и т.д. Всего на первом уровне
(n=1) может находиться только два электрона,
на втором (n=2) восемь, на третьем (га = 3)
восемнадцать, т.е. на уровне с номером
n может находиться не более 2n2 электронов.
Это следует из другого правила, которое
выполняется при построении электронной
оболочки атома и называется принципом
Паули.
В
атоме не может быть электронов, у которых
бы совпадал весь набор из четырех
квантовых чисел.
Поэтому
на первом уровне (n=1,l=n-1=0, орбиталь s-типа)
электроны могут различаться только
значением спинового числа ns, а поскольку
для него возможны только два значения
(-1/2 и +1/2), то первый энергетический
уровень может быть занят не более чем
двумя электронами. Заполнение этого
уровня происходит в невозбужденных
атомах водорода и гелия. Схематично это
можно представить следующим образом:
Клеточка обозначает орбиталь, а стрелки — электроны, при этом направление стрелки указывает спин. Если две стрелки имеют одинаковое направление, то это значит, что эти два электрона имеют одинаковые спины (магнитное спиновое число ms для обоих электронов имеет значение либо -1/2, либо +1/2). Разнонаправленными стрелками обозначают электроны, у одного из которых ms=-1/2, а у другого ms = +1/2. Символами 1s1 и 1s2 обозначена электронная конфигурация атомов, которая показывает, что в атоме водорода единственный электрон занимает 1s-орбиталь, а в атоме гелия на 1s-орбитали располагаются два электрона. Когда мы переходим на второй электронный уровень (главное квантовое число 2), или, что то же самое, к элементам второго периода, появляется возможность размещения электронов не только на s , но и на р -орбиталях (квантовое число 1 может принимать значение 0 и 1). Электронные оболочки лития и бериллия заполняются так же, как для водорода и гелия
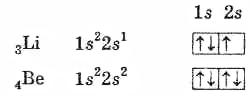
В
атоме бора появляется первый электрон
на р-орбитали.![]()
Следующий электрон (в атоме углерода) можно разместить на той же px-орбитали (его спин будет противоположным, и принцип Паули не будет нарушен), но можно и на другой (py-орбиталь), поскольку их энергия одинакова. Реально в атоме углерода электрон размещается именно на py-орбитали. Размещение электронов на орбиталях с одинаковой энергией определяется правилом Гунда: В пределах одного подуровня электроны размещаются так, чтобы их суммарный спин был максимальным. Это правило по другому — на орбиталях с одинаковой энергией электроны размещаются так, чтобы имелось максимальное число неспаренных электронов. В соответствии с этим правилом в атоме углерода и в атомах следующих элементов второго периода:

При
переходе к третьему уровню (к элементам
третьего периода) появляются три типа
орбиталей s, p, и d-орбитали. Заполнение
орбиталей первых восьми элементов
происходит так же, как в случае второго
периода. Далее можно было бы ожидать
заполнения d-орбиталей, однако после
аргона появляется калий — элемент
четвертого периода. Энергия электрона
на орбитали определяется как главным
квантовым числом n, так и побочным l.
Соответственно работает следствие из
принципа наименьшей энергии, называемое
правилом Клечковского:
В
основном состоянии атома электрон
занимает положение с минимальным
значением (n+l).
Если
бы в атоме калия последний электрон
занял 3d-орбиталь, то значение указанной
суммы было бы 3(n=3)+2(l=2)=5, но он занимает
4s-орбиталь, и сумма составляет 4(n=4)+0(l=0)
= 4. То же происходит со следующим
электроном в атоме кальция. Однако далее
более выгодным становится заполнение
3d-орбиталей, и атом скандия открывает
ряд переходных элементов 4-го периода,
в которых заполняются 10 вакансий
Sd-орбиталей. Схема заполнения орбиталей
отражена на рис. 4.
Правило
Клечковского не абсолютно, так как не
учитывает, что спаренные электроны
имеют большую энергию, чем неспаренные
(что составляет основу правила Гунда).
Так, в атоме хрома, кроме появления
очередного электрона на 3d-орбитали, на
ту же орбиталь переходит один из
4s-электронов (так называемый «проскок
электрона»). В следующем атоме марганца
этот электрон возвращается
обратно.
Напоминаем,
что все сказанное относится к основному
состоянию атома. В возбужденном состоянии
(когда атому придана дополнительная
энергия) работает только принцип
Паули.
Используя
изложенные выше правила, вы всегда
сможете составить электронную
формулу
любого элемента в его основном
состоянии.
Электронные
формулы
Рис.4. Схема заполнения электронами энергетических уровней и подуровней. элементов периодической системы. Этот ряд, в котором вертикальными линейками отделены периоды, обозначенные сверху цифрами, имеет вид (см. рис, 4).
 Распределение
электронов в атоме по энергетическим
уровням и подуровням изображают в виде
электронных формул. Рассмотрим, как они
составляются.
Напоминаем!
Каждый электрон в атоме занимает
свободную орбиталь с наиболее низкой
энергией, отвечающей его прочной связи
с ядром, — принцип наименьшей энергии.
С ростом порядкового номера элемента
электроны заполняют орбитали и уровни
в порядке возрастания их энергии, а
подуровни — в последовательности
s-p-d-f. Последовательность возрастания
энергии называется шкалой энергии. В
соответствии с ней составляют ряд
последовательного заполнения электронами
орбиталей атомов
Распределение
электронов в атоме по энергетическим
уровням и подуровням изображают в виде
электронных формул. Рассмотрим, как они
составляются.
Напоминаем!
Каждый электрон в атоме занимает
свободную орбиталь с наиболее низкой
энергией, отвечающей его прочной связи
с ядром, — принцип наименьшей энергии.
С ростом порядкового номера элемента
электроны заполняют орбитали и уровни
в порядке возрастания их энергии, а
подуровни — в последовательности
s-p-d-f. Последовательность возрастания
энергии называется шкалой энергии. В
соответствии с ней составляют ряд
последовательного заполнения электронами
орбиталей атомов
Орбиталь
с минимальной энергией — это 1s-орбиталь.
У атома водорода она занята его
единственным электроном. Поэтому
электронная формула (или электронная
конфигурация) атома водорода имеет
вид: Так как на одной орбитали могут находиться
два электрона, то оба электрона атома
гелия размещаются на 1s-орбитали.
Следовательно, электронная формула
атома гелия 1s2 . Электронная оболочка
Не завершена и очень устойчива, это
благородный газ.
У
атомов элементов второго периода
заполняется L-уровень (n=2), причем вначале
орбиталь s-подуровня, а затем три орбитали
р-подуровня. Электронная формула атома
лития 3Li: 1s22s1 Электрон 2s1 намного слабее
связан с ядром атома, чем 1s-электроны,
поэтому атом лития может легко терять
его, образуя ион Li+.
Так как на одной орбитали могут находиться
два электрона, то оба электрона атома
гелия размещаются на 1s-орбитали.
Следовательно, электронная формула
атома гелия 1s2 . Электронная оболочка
Не завершена и очень устойчива, это
благородный газ.
У
атомов элементов второго периода
заполняется L-уровень (n=2), причем вначале
орбиталь s-подуровня, а затем три орбитали
р-подуровня. Электронная формула атома
лития 3Li: 1s22s1 Электрон 2s1 намного слабее
связан с ядром атома, чем 1s-электроны,
поэтому атом лития может легко терять
его, образуя ион Li+.
Часто
структуру электронных оболочек изображают
с помощью энергетических, или квантовых,
ячеек — это так называемые графические
электронные формулы (ячейки Гунда).
В
качестве примера рассмотрим схему
распределения электронов по квантовым
ячейкам в атоме углерода: (возбуждённое
состояние)
(возбуждённое
состояние)
Энергия ионизации — количество энергии, необходимое для отрыва электрона от невозбужденного атома.
Энергия ионизации атома выражается в килоджоулях на моль (кДж/моль); допускается внесистемная единица электрон-вольт на моль (эВ/моль).
Для многоэлектронных атомов рассматриваются разные энергии ионизации, которые соответствуют отрыву первого, второго и так далее электронов. Чем больше число оторванных электронов, тем выше положительный заряд иона, и тем труднее их отрывать, поэтому энергия ионизации для каждого последующего электрона в этом случае возрастает.Энергия ионизации атома зависит от его электронной конфигурации. В частности, завершенные электронные слои обнаруживают повышенную устойчивость. Поскольку электронная конфигурация изменяется периодически, энергия ионизации также изменяется периодически
Чем ниже энергия ионизации тем выше восстановительная способность атома.
Энергия ионизации возрастает в периодах от щелочных металлов к благородным газам и уменьшается в группах сверху вниз. Наименьшие энергии ионизации имеют щелочные металлы, начинающие периоды, а наибольшие – благородные газы, заканчивающие периоды. Энергии ионизации элементов, находящихся в главной подгруппе одной и той же группы уменьшаются с увеличением порядкового номера элемента. Для d- и f-элементов закономерности более сложные.
Сродство к электрону : атомы могут не только отдавать, но и присоединять электроны. Например, Cl + e = Cl- ,при этом образуется отрицательно заряженный ион . Энергия выделяющаяся или поглощающаяся при присоединении электрона к нейтральному атому называется сродством к электрону. Чем больше эта величина, тем выше окислительные свойства атома.
