
- •2. Для умягчения 300 л воды потребовалось 15 г гашеной извести. Чему была равна временная жесткость воды?
- •3. Приведите формулы двух веществ, в одном из которых азот может быть только восстановителем, а в другом — только окислителем.
- •4. Уравняйте реакции, укажите окислитель и восстановитель:
- •5. Закончить уравнения реакций:
- •5. Получить вторичный пропиловый спирт из галогеналкила.
- •Контрольная работа № 3
- •Контрольная работа № 4
- •Библиографический список
КОНТРОЛЬНАЯ РАБОТА №3
1. В воде содержатся катионы и анионы в следующих концентрациях (мэкв/л): Ca2+ — 2,5; Na+ — 1,8; Mg2+ — 0,7; HCO3─ — 2,9; Cl─ — 1,5; SO42─ — 0,6. Рассчитайте величины общей, временной и постоянной жесткости воды.
Решение: Ионы натрия не обуславливают жесткость воды, тогда по определению жесткости общая жесткость равна:
Жо = [Ca2+] + [Mg2+] = 2,5 + 0,7 = 3,2 ммоль-экв/л.
Карбонатная жесткость — часть общей жесткости, эквивалентная содержанию HCO3─, т.е. Жк = 2,9 ммоль-экв/л.
Постоянную жесткость можно вычислить, зная общую и карбонатную жесткость:
Жп = Жо – Жк = 3,2 – 2,9 = 0,3 ммоль-экв/л.
2. Для умягчения 300 л воды потребовалось 15 г гашеной извести. Чему была равна временная жесткость воды?
Решение: Формула для расчета жесткости воды:
Ж = (m(Ca(OH)2), г ×1000)/(MЭ(Ca(OH)2)×Vводы, л), где
Мэ(Ca(OH)2) = М(Ca(OH)2)/2 = 74/2 = 37 г/экв, тогда
Ж = (15×1000)/(37×300) = 1,35 ммоль-экв/л.
3. Приведите формулы двух веществ, в одном из которых азот может быть только восстановителем, а в другом — только окислителем.
Решение: В соединении NH3 азот имеет минимальную степень окисления (─3) и не может ее больше понижать. Он может только отдавать электроны, а значит, NH3 может быть только восстановителем.
В соединении HNO3 азот имеет максимальную степень окисления (+5) и не может ее больше повышать. Он может только принимать электроны, а значит, HNO3 может быть только окислителем.
4. Уравняйте реакции, укажите окислитель и восстановитель:
а) H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2SO4
Решение: Покажем изменение степеней окисления атомов до и после реакции:
-2 +7 0 +2
H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2SO4
Изменяются степени окисления у атомов серы и марганца (H2S — восстановитель, KMnO4 — окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
 5×
S─2
─ 2ē → S0
— окисление
5×
S─2
─ 2ē → S0
— окисление
восст.
2× Mn+7 + 5ē → Mn2+ — восстановление
ок.
Далее находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Окончательное уравнение реакции будет иметь вид:
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + 8H2SO4
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2×4 + 3×4 = 20 и в правой части 2×4 + 4 + 8 = 20.
б) K2MnO4 + H2O → KMnO4 + MnO2 + KOH
Решение: Покажем изменение степеней окисления атомов до и после реакции:
+6 +7 +4
K2MnO4 + H2O → KMnO4 + MnO2 + KOH
Изменяются степени окисления только атомов марганца (K2MnO4 — восстановитель и окислитель). Реакции, протекание которых сопровождается одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, называются реакциями диспропорционирования.
Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
 2×
Mn+6
─ 1ē → Mn+7
— окисление
2×
Mn+6
─ 1ē → Mn+7
— окисление
восст.
1× Mn+6 + 2ē → Mn+4 — восстановление
ок.
Окончательное уравнение реакции будет иметь вид:
3K2MnO4 + 2H2O → 2KMnO4 + MnO2 + 4KOH
5. Закончить уравнения реакций:
а) Cr + HCl →
Решение: Металлы, расположенные в ряду стандартных электродных потенциалов леве водорода, вытесняют водород из кислот, за исключением азотной и концентрированной серной кислот.
Хром расположен в ряду стандартных электродных потенциалов до водорода, поэтому:
Cr + 2HCl → CrCl2 + H2↑
б) Cu + HNO3 (конц.) →
Решение: При взаимодействии металлов с азотной кислотой в роли окислителя выступает анион NO3─. Состав продуктов восстановления зависит от активности металла, концентрации кислоты, температуры.
Металлы с положительным значением стандартного электродного потенциала (Cu, Ag и др.) растворяются в концентрированной азотной кислоте с выделением оксида азота (IV) — NO2, поэтому получаем:
Cu + 4HNO3 (конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O
6. Технический цинк массой 1,32 г обработали избытком раствора разбавленной серной кислоты. Выделившийся водород занял при нормальных условиях объем 448 мл. Определите массовую долю цинка в техническом металле.
Решение: Запишем уравнение реакции:
Zn + H2SO4 (разб.) → ZnSO4 + H2↑
х г Zn расходуется на получение 0,448 л H2
65 г/моль Zn расходуется на получение 22,4 л/моль H2
m(Zn) = x = 65×0,448/22,4 = 1,30 г.
Определим массовую долю цинка:
ω(Zn) = (m(Zn)/mцинк техн.)×100% = 98,5%
КОНТРОЛЬНАЯ РАБОТА №4
1. Какой металл будет разрушаться при нарушении целостности покрытия оцинкованного железа? Дайте схему протекающих процессов в среде с pH=8.
Решение:
Оцинкованное железо:
Fe│Zn
Т.к. E0Fe2+/Fe= ─0,44 В; E0Zn2+/Zn= ─0,76 В и E0Fe2+/Fe > E0Zn2+/Zn, то
А: (Fe): Zn0 – 2ē → Zn2+
K: (Sn): O2 + 4ē + 2H2O → 4OH─
2. Приведите схему протекторной защиты. Какие материалы используются в качестве протекторов?
Решение:
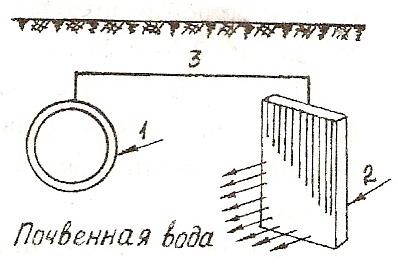
Рис. 1. Схема протекторной защиты:
1 – защищаемая конструкция; 2 – протектор; 3 – проводник
В качестве протекторов используют сплавы на основе магния, алюминия, цинка.
3. Какое количество строительного гипса можно получить при обжиге 15 кг природного гипса, содержащего 10 % примесей?
Решение:
Реакция получения строительного гипса:
120…170 °C
CaSO4·2H2O → CaSO4·0,5H2O + 1,5H2O
Масса чистого CaSO4·2H2O:
m(CaSO4·2H2O) = (90 % × 15 кг)/100 % = 13,5 кг.
Из 13,5 кг CaSO4·2H2O образуется х кг CaSO4·0,5H2O
Из 172 кг/моль CaSO4·2H2O образуется 145 кг/моль CaSO4·0,5H2O
х = 13,5×145/172 = 11,38 кг.
m(CaSO4·0,5H2O) = 11,38 кг.
4. В грунтовых водах содержатся соли магния. Напишите химические реакции, протекающие при контакте бетона с такой водой. Почему при этом происходит разрушение бетона?
Решение:
При действии морской воды на бетон происходят следующие реакции:
Ca(OH)2 + MgCl2 = CaCl2 + Mg(OH)2↓
Ca(OH)2 + MgSO4 = CaSO4·2H2O + Mg(OH)2↓
Mg(OH)2↓ — (рыхлая объемная масса) выпадает в осадок в виде пленки, проницаемой для воды; CaCl2 и CaSO4·2H2O вымываются.
Соли магния могут взаимодействовать с составными частями цементного камня:
2CaO·SiO2·nH2O + MgCl2 + 2H2O = 2CaCl2 + 2Mg(OH)2↓+ SiO2·nH2O
3CaO·Al2O3·6H2O + 3MgCl2 = 3CaCl2 + 3Mg(OH)2↓+ 2Al(OH)3↓
В результате цементный камень превращается в рыхлую массу.
