
- •Лекция № 2 Химия белков
- •Лекция №3 Физико – химическое свойства белков
- •Лекция №4 Классификация белков. Простые и сложные белки. Нуклеопротеиды. Хромопротеиды.
- •Свойства днк
- •Лекция №5 Сложные белки. Гликопротеиды (углеводнобелковые комплексы), липопротеды (липид-белковые комплексы) и фосфопротеиды.
- •Гликолипиды
- •Строение мембран
- •Белки мембран
- •Общие свойства мембран
- •Функция мембран
- •Лекция 6: Ферменты, их роль в обмене веществ
- •Лекция№7 Механизм ферментативного катализа.
- •Лекция 8 Витамины – как коферменты
- •Лекция 9
- •Лекция 10:
- •Гипофиз,
- •Эндокринные железы
- •Лекция № 12. Биологическое окисление.
- •Лекция 13 Окислительное фосфорилирование. Хемиоосмотическая теория окислительного фосфорилирования
- •Лекция №14 Обмен и функции углеводов. Общая схема источников и путей расходования глюкозы. Анаэробный распад углеводов, судьба молочной кислоты
- •3 Фаза обмена углеводов- Метаболизм.
- •Лекция №15
- •Синтез гликогена
- •Лекция № 16 Прямое окисление углеводов. Нарушения углеводного обмена. Сахарный диабет. Гликогенозы
Лекция №3 Физико – химическое свойства белков
План:
Цель лекции: Обучать студентов физическим и химическим свойствам белков.
Белки имеют большой молекулярный вес, благодаря большим размерам молекул, белки образуют коллоидные растворы обладают растворимостью или гидрофильностью.
С коллоидным характером раствора белка связан ряд их особых свойств. Луч света проходит через истинный раствор и остается невидимым. Если же свет проходит через раствор белка, то луч света становится хорошо заметным, вследствие рассеивания света частицами растворенного вещества . Этот эффект носит название явления Тиндаля.
Молекулы белка вследствие своего большого размера неспособны проникать через поры животных и растительных мембран. В то время как молекулы низкомолекулярных веществ свободно проходят через такие перепонки.
Поэтому, если мешочек, сделанный из пергамента, целлофана, наполнить раствором, содержащим смесь высокомолекулярных веществ, поместить в чистый растворитель (например воду ), то они останутся внутри мешочка. Это метод назван диализом и часто применяют для очистки белковых препаратов от низкомолекулярных веществ.
Белки хорошо растворяются в воде. Растворение белка в воде связано с гидратацией каждой его молекулы, т.е образованием вокруг частиц белка особого рода водных или гидратных оболочек.
Гидрофильность белка зависит от групп , растворимых в воде расположенных на поверхности белковой молекулы.
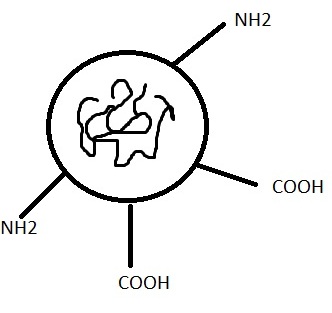
Белковая молекула строится так, что на поверхности белковой молекулы оказываются группы ОН, СООН, NH2 , растворяются в воде, притягивают к себе воду и образуют гидратную оболочку.
 Чем
больше гидрофильных групп на поверхности
белковой молекулы, тем лучше растворимость
белка.
Чем
больше гидрофильных групп на поверхности
белковой молекулы, тем лучше растворимость
белка.
Белки – полиэлектролиты имеют много групп, которые диссоциируются. Благодаря наличию этих группировок белковая молекула имеет заряд
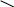 COOH
COO -
COOH
COO -
R R + H+,
NH2 NH2
Карбоксильная группа, способная к диссоциации с образованием Н ионов , придает белку характер слабой органической кислоты. Наличие в молекуле белка NH2 - группы определяет основные свойства белка , поскольку к аминогруппе может присоединится протон ( Н – и ОН ) с образованием иона R-NH3+
COOH +Н COOH
R R +
NH2 NH3
При растворении белков в воде протоны, появляющиеся в результате диссоциации СООН – группы тотчас присоединяются к NН2 группам, и группы переходят в ионизированную форму.

 COOH
COO -
COOH
COO -
R

 R
+
R
+
NH2 NH3
Получающиеся при этом частицы белка несут одновременно положительные и отрицательные заряды и называются амфионами.
Суммарный заряд их равен нулю. Это состояние называется изоэлектрическим. Достигается это состояние при определенном значении РН.
То значение РН, при котором белок находится в изоэлектрическом состоянии, называется изоточкой белка. Каждый белок имеет свою изоточку. У альбумина изоточка равна 4,3 .
Если белок имеет больше дикарбоновых кислот, его изоточка будет в кислой среде. Изоточка зависит от аминокислотного состава белка .
В кислой среде белок имеет положительный заряд.
 COO
-
COO
-
 COO
- +Н+
NH3
COO
- +Н+
NH3
R
NH3 + СООН
В щелочной среде заряжается отрицательно.
 COO - +OН-
COO -
COO - +OН-
COO -
R
 R + H2O
R + H2O
NH3 NH2+
Во взвешенном состоянии белковая молекула должна иметь заряд и гидратную оболочку.
Факторами устойчивости белковой молекулы являются: заряд и гидратная обалочка.
Для осаждении белка необходимо снять заряд и гидратную оболочку.
При добавлении ( NН4)2 SO4 к белку – белок теряет водную оболочку и выпадает осадок, но белок не изменяется. При добавлении концентрированных кислот и щелочей разрушается не только водная оболочка , но и снимается заряд, разрушается водородная связь нарушается третичная и даже вторичная структура происходит денатурация белка , т.е. потеря способности белка растворяться в воде.
При денатурации белков наблюдается:
уменьшение или потеря специфической активности
уменьшение растворимости
изменение формы или размера молекулы
изменение удельной активности.
При денатурации происходит раскручивание свернутых полипептидных цепей с обнаружением ранее демоскированных реактивных групп.
Денатурацию можно вызвать 1) химическим и 2) физическим воздействием, ( облучение, радиация, тепловая).
Денатурацией белков называется такое изменение белков, при котором он утрачивает свои естественные биологические физические и химические свойства, становится мене гидрофильным и теряет способность растворяться в воде.
При денатурации изменяется третичная и четвертичная структура белка.
Реакция осаждения белков в зависимости от применяемого осадителя могут быть обратимыми и необротимыми.
В случае обратимих реакции осаждений, белок не подвергается глубоким изменениям и полученные осадки могут быть растворимы в воде .
Белки при этом сохроняют свои нативные свойства. При необротимых реакциях осаждения белки подвергаются глубоким изменениям, получаемые осадки не растворяются в воде, т.е. наступает денатурация.
К необратимым реакциям осаждения относятся кипячение , действие кислотами , щелочами и осаждения солями тяжелых металлов.
Обратимые реакции осаждения можно получить путем высаливания при помощи NaCe, ( NH4 ) SO4, MgSO4 и действием органических растворителей, спирта и ацетона.
Физические способы : ультразвук , кипячение, центрифугирование .
Химические способы : действия кислот и щелочей.
Способы выделение и очистки белки.
Высаливание
Электрофорез
Центрифугирование
Адсорбция
Диализ.
Литература:
А. Основные: 1. Биохимия. Т.Т.Берёзов, Б.Ф.Коровкин. 2010
2. Биохимия. Б.А.Строев. 1986
Б. Дополнительные:
1. Медицинская биохимия. С.М.Рапапорта. 1976
2.Биохимия. Р.Страер. 1985
3.Северин. 2003
