- •Температуры начала и конца кристаллизации сплавов
- •Тут получается вроде лол какой-то
- •Диаграмма Fe - Fe3c
- •1. Общие сведения
- •Процессы при структурообразовании железоуглеродистых сплавов
- •Компоненты и фазы железоуглеродистых сплавов
- •Правило фаз
- •3. Характеристика металлических сплавов.
- •Структуры железоуглеродистых сплавов
- •Диаграмма состояния железо – графит.
- •Процесс графитизации.
Атомно-кристаллическое строение металлов. Основные типы кристаллических решеток и их параметры.
Металлы – один из классов конструкционных материалов, характеризующийся определённым набором свойств:
– «металлический блеск» (хорошая отражательная способность);
– пластичность;
– высокая теплопроводность;
– высокая электропроводность.
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объёму металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решётка.
Другими словами кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объёма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
– размеры рёбер элементарной ячейки. a, b, c – периоды решётки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определёнными;
– углы между осями ( ).
– координационное число (К), указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
– базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки.
– плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74).
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
– примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
– базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
– объемно-центрированный – атомы занимают вершины ячеек и ее центр;
– гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней.
Основными типами кристаллических решёток являются:
1) Объемно-центрированная кубическая (ОЦК) - атомы располагаются в вершинах куба и в его центре;
2) Гранецентрированная кубическая (ГЦК) - атомы располагаются в вершинах куба и по центру каждой из 6 граней;
3) Гексагональная, в основании которой лежит шестиугольник:
а) простая – атомы располагаются в вершинах ячейки и по центру двух оснований (углерод в виде графита);
б) плотноупакованная (ГПУ) – имеются 3 дополнительных атома в средней плоскости (цинк).
Понятие об изотропии и анизотропии
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах, с хаотическим расположением атомов в пространстве, расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны.
В кристаллических телах атомы правильно располагаются в пространстве, при-чем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и в конечном ре-зультате разные свойства. Зависимость свойств от направления называется анизотропией
Чтобы понять явление анизотропии необходимо выделить кристаллографические плоскости и кристаллографические направления в кристалле.
Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью.
Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Для обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку вписывают в пространственную систему координат (оси X ,Y, Z – кристаллографические оси). За единицу измерения принимается период решетки.
Для определения индексов кристаллографической кристаллографической плоскости необходимо:
– установить координаты точек пересечения плоскости с осями координат в единицах периода решетки;
– взять обратные значения этих величин;
– привести их к наименьшему целому кратному, каждому из полученных чисел.
Полученные значения простых целых чисел, не имеющие общего множителя, являются индексами Миллера для плоскости, указываются в круглых скобках.
Другими словами, индекс по оси показывает на сколько частей плоскость делит осевую единицу по данной оси. Плоскости ,параллельные оси, имеют по ней индекс 0 (110)
Ориентация прямой определяется координатами двух точек. Для определения индексов кристаллографического направления необходимо:
– одну точку направления совместить с началом координат;
– установить координаты любой другой точки, лежащей на прямой, в единицах периода решетки
– привести отношение этих координат к отношению трех наименьших целых чисел.
Индексы кристаллографических направлений указываются в квадратных скобках [111]. В кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют те же индексы [hkl].
Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Fe: – ОЦК — ;
– ГЦК — ;
– ОЦК — ; (высокотемпературное )
Превращение одной модификации в другую протекает при постоянной темпера-туре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Магнитные превращения
Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. Это явление впервые обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам относятся железо, кобальт, никель и некоторые другие металлы.
При нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо, затем резко и при определённой температуре (точка Кюри) исчезают (точка Кюри для железа – ). Выше этой температуры металлы становятся парамагнетиками. Магнитные превращения не связаны с изменением кристаллической решетки или микроструктуры, они обусловлены изменениями в характере межэлектронного взаимодействия.
ИЛИ ЭТО
Все металлы в твердом состоянии имеют кристаллическое строение, те атомы расположены упорядоченно и образуют кристаллическую решетку. Различают 3 типа решеток:
1) простая кубическая (куб). Плотность упаковки 8*1/8=1; Координационное Число=6.
2) объемно – центрированная кубическая (оцк) (калий, натрий, литий). Куб, в котором атомы расположены по углам +1 в центре. Плотность 8*1/8+1=2; КЧ=8, коэффициент заполнености 68%. Пример: Fea; Feδ; Tiβ; Wo; Mo; Cr.
3) Кубическая гранецентрированная (гцк) (свинец, никель, золото, марганец). Куб, в котором атомы расп. по углам + по серединам граней. КЧ=12, плотность 8*1/8+6*1/2=4, коэф=74%.
4) Гексагональная плотноупакованная (ГПУ) (цинк), шесть боковых и верхняя и нижняя грани, на которых тоже атом.
Чем больше плотность упаковки, тем выше пластичность.
Свойство металла изменять кристаллическую решетку с изменением температур – полиморфизм (много форм). Полиморфные модификации обозначают α, β, и т д.
Анизотропия - зависимость физических свойств вещества от направления. Естественная А. — наиболее характерная особенность кристаллов. Именно потому, что скорости роста кристаллов в разных направлениях различны, кристаллы вырастают в виде правильных многогранников.
Квазиизотропия – почти одинаковые свойства в различных направлениях.
Маркировка легированной конструкционной и инструментальной стали.
В основу классификации легированных сталей заложены четыре признака:
− равновесная структура;
− структура охлаждения на воздухе;
− химсостав;
− назначение.
По равновесной структуре легированные стали подразделяются на доэвтектоидные, эвтектоидные, заэвтектоидные и ледебуритные и, следоватнльно, ферритные, феррито – перлитные, перлитные, перлито-цементитные. В ледебуритных сталях присутствует эвтектика (ледебурит), которая характерна для чугунов. Стали, легированные сильными аустенизаторами (C, Mn, Ni, Co, Cu), имеют расширенную γ -область и относятся к аустенитному классу. Стали, легированные сильными ферритообразующими элементами, относятся к ферритному классу (Cr, Mo, W, Ti и др.)
После нормализации (нагрев выше Асз и охлаждение на воздухе) легированные стали имеют следующие основные классы: ферритный, перлитный, мартенситный и аустенитный. Перлит может иметь структуру сорбита, тростита, бейнита в малолегированных сталях, мартенсита в легированных и аустенита (в высоколегированных).
По химсоставу стали классифицируются в зависимости от легирующих элементов: хромистые, марганцовистые, хромоникелевые, хромоникельмолибденовые и многие другие. Легированные стали могут быть низколегированные (до 3% легирующих элементов), среднелегированные (от 3 до 10%), высоколегированные (от 10 до 50%).
Легированные стали, как и углеродистые, делятся по качеству в зависимости от содержания вредных примесей (S и P), газов (H, N, O), неметаллических включений, способа выплавки, мехсвойств.
Стали обычного качества (общего назначения) содержат фосфора и серы ~ до 0,035 и 0,04 %; качественные до 0,025% каждого элемента, высококачественные (до 0,015% и до 0,025%) и особовысококачественные ( до 0,01% каждого элемента).
По назначению стали классифицируются на:
а) конструкционные;
б) инструментальные;
в) стали и сплавы с особыми свойствами.
Маркировка легированных сталей осуществляется следующим образом. Первые одна, две, три цифры в начале марки обозначает содержание углерода (18Х2Н2 МФА, 110Г13ЧТЛА, 9ХВГСА). В конструкционных сталях углерод находится в сотых долях процента, в инструментальных – десятых долях про- центов. Буквы правее цифр углерода обозначают легирующие элементы: А – азот, Б – ниобий, В – вольфрам, Г – марганец, Д – медь, Е – селен, К – кобальт, Н – никель, М – молибден, П – фосфор, Р- бор, С – кремний, Т – титан, Ф – ва- надий, Х – хром, Ц – цирконий, Ч – редкоземельные металлы, Ю – алюминий. Цифра стоящая после буквы указывает содержание элемента в процентах. Если цифры не стоит, то это говорит о том, что содержание соответствующего легирующего элемента составляет приблизительно 0,9 – 1,5 %. Если цифры не стоит после Mo, V, N, P3M, Ti, Ta, Nb, Zn, то это означает, что этого элемента содержится 0,2 – 0,5%; после перечисленных элементов в других случаях ставится цифра, в том числе «1». Высококачественные стали в конце марки обозначаются буквой «А» (т.е. содержание S, P, H, N, O – регламентировано). Особовысококачественные стали в конце обозначаются буквой «Ш», что говорит о выплавке стали электрошлаковым переплавом. Буква «А» в середине марки стали свидетельствует о легированности стали азотом. Если буква «А» стоит в начале марки, то это обозначает, что сталь «автоматная», с повышенным S и P, для лучшей обрабатываемости на автоматических станках.
Качество этих «так называемых автоматных» сталей низкое. Если сталь легирована свинцом, то ее обозначают, например, АС35Г2, где А – «автоматная», С – легирована Рb, 35 – содержание углерода 0,35%, 2% – марганца. Шарикоподшипниковые стали (ШХ9, ШХ12, ШХ15…) маркируются бук- вой «Ш», Х – хром, цифры обозначают содержание хрома в десятых долях про- цента, т.е. 0,9; 1,2; 1,5. Содержание углерода равно 0,9 – 1,1%. К ним предъяв- ляются высокие требования по количеству неметаллических включений. Быстрорежущие стали, содержащие большое количество вольфрама, молибдена, ванадия, обозначаются буквой «Р», следующая цифра отражает содержание вольфрама. Например: Р18 – быстрорез, содержащий 18% вольфрама, Р9М3Ф3Т3А – быстрорез, содержащий 9% W, 3% Mo, 3% V, 3% Ti, A – высококачественная сталь.
Конструкционные стали составляют самую обширную группу материалов, которые идут на изготовление деталей машин, строительных конструкций. Они должны иметь высокие мехсвойства, быть долговечными, надежными. Высокие мехсвойства достигаются у «улучшенных» сталей (закалка с отпуском). Для повышения мехсвойств, увеличения закаливаемости и прокаливаемости стали легируют, микролегируют. Существенно сказывается на повышение мех-свойств измельченное зерно. Уменьшение содержания вредных приме- сей стали (S, P, N, H, O, Sb, As и др.) очень сильно влияет на повышение мех- свойств, эффективное средство против отпускной хрупкости 1 рода (~ 270 – 330°С) и 2 рода (~470 – 520°С). Во избежание охрупчивания при отпуске сталей необходимо предусмотреть быстрое охлаждение после отпуска в интервалах этих температур.
Полиморфизм металлов, его сущность и значения (на примере железа).
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как их называют, в разных полиморфных модификациях. В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа. Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать α, а при более высокой – β, затем γ и т.д.
При полиморфном превращении кристаллы (зерна) новой полиморфной формы растут в результате неупорядоченных, взаимно связанных переходов атомов через границу фаз. Отрываясь от решетки исходной фазы (например, β), атомы по одиночке или группами присоединяются к решетке новой фазы (α), и, как следствие этого, граница зерна α-модификации передвигается в сторону зерна β-модификации, «поедая» исходную фазу. Зародыши новой модификации наиболее часто возникают на границах зерен исходных кристаллитов. Вновь образующиеся кристаллы закономерно ориентированы по отношению к кристаллам исходной модификации.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Покажем на примере железа. Железо имеет две полиморфные модификации α и γ. Модификация α-железа существует при температурах ниже 910°С и выше 1392°С. В интервале температур 1392–1539°С α-железо нередко обозначают как δ-железо.
Кристаллическая решетка α-железа – объемно центрированный куб с периодом решетки 0,28606 нм. До температуры 768°С α-железо магнитно (ферромагнитно). γ-железо существует при температуре 910–1392°С; оно парамагнитно. Кристаллическая решетка γ-железа гранецентрированная кубическая (а = 0,3645 нм при 910°С).
Дефекты атомно-кристаллического строения металлов, их классификация и значение.
Из жидкого расплава можно вырастить монокристалл. Их обычно используют в лабораториях для изучения свойств того или иного вещества. Металлы и сплавы, полученные в обычных условиях, состоят из большого количества кристаллов, то есть, имеют поликристаллическое строение. Эти кристаллы называются зернами. Они имеют неправильную форму и различно ориентированы в пространстве. Каждое зерно имеет свою ориентировку кристаллической решетки, отличную от ориентировки соседних зерен, вследствие чего свойства реальных металлов усредняются, и явления анизотропии не наблюдается В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают следующие структурные несовершенства:
• точечные – малые во всех трех измерениях;
• линейные – малые в двух измерениях и сколь угодно протяженные в третьем;
• поверхностные – малые в одном измерении.
Точеные дефекты Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей. (рис. 2.1.)

Вакансия – отсутствие атомов в узлах кристаллической решетки, «дырки», которые образовались в результате различных причин. Образуется при переходе атомов с поверхности в окружающую среду или из узлов решетки на поверхность (границы зерен, пустоты, трещины и т. д. ), в результате пластической деформации, при бомбардировке тела атомами или частицами высоких энергий (облучение в циклотроне или нейтронной облучение в ядерном реакторе). Концентрация вакансий в значительной степени определяется температурой тела. Перемещаясь по кристаллу, одиночные вакансии могут встречаться. И объединяться в дивакансии. Скопление многих вакансий может привести к образованию пор и пустот. Дислоцированный атом – это атом, вышедший из узла решетки и занявший место в междоузлие. Концентрация дислоцированных атомов значительно меньше, чем вакансий, так как для их образования требуются существенные затраты энергии. При этом на месте переместившегося атома образуется вакансия. Примесные атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Они могут иметь размеры больше или меньше размеров основных атомов и располагаются в узлах решетки или междоузлиях. Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать.
Линейные дефекты. Основными линейными дефектами являются дислокации. Априорное представление о дислокациях впервые использовано в 1934 году Орованом и Тейлером при исследовании пластической деформации кристаллических материалов, для объяснения большой разницы между практической и теоретической прочностью металла. Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые Краевая дислокация представляет собой линию, вдоль которой обрывается внутри кристалла край “лишней“ полуплоскости (рис. 2.2)

Неполная
плоскость называется экстраплоскостью.
Большинство дислокаций образуются
путем сдвигового механизма. Ее образование
можно описать при помощи следующей
операции. Надрезать кристалл по плоскости
АВСD, сдвинуть нижнюю часть относительно
верхней на один период решетки в
направлении, перпендикулярном АВ, а
затем вновь сблизить атомы на краях
разреза внизу. Наибольшие искажения в
расположении атомов в кристалле имеют
место вблизи нижнего края экстраплоскости.
Вправо и влево от края экстраплоскости
эти искажения малы (несколько периодов
решетки), а вдоль края экстраплоскости
искажения простираются через весь
кристалл и могут быть очень велики
(тысячи периодов решетки) (рис. 2.3). Если
экстраплоскость находится в верхней
части кристалла, то краевая дислокация
– положительная (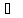 ),
если в нижней, то – отрицательная (Т).
Дислокации одного знака отталкиваются,
а противоположные притягиваются.
),
если в нижней, то – отрицательная (Т).
Дислокации одного знака отталкиваются,
а противоположные притягиваются.
Другой тип дислокаций был описан Бюргерсом, и получил название винтовая дислокация Винтовая дислокация получена при помощи частичного сдвига по плоскости Q вокруг линии EF (рис. 2.4) На поверхности кристалла образуется ступенька, проходящая от точки Е до края кристалла. Такой частичный сдвиг нарушает параллельность атомных слоев, кристалл превращается в одну атомную плоскость, закрученную по винту в виде полого геликоида вокруг линии EF, которая представляет границу, отделяющую часть плоскости скольжения, где сдвиг уже произошел, от части, где сдвиг не начинался. Вдоль линии EF наблюдается макроскопический характер области несовершенства, в других направлениях ее размеры составляют несколько периодов. Если переход от верхних горизонтов к нижним осуществляется поворотом по часовой стрелке, то дислокация правая, а если поворотом против часовой стрелки – левая.
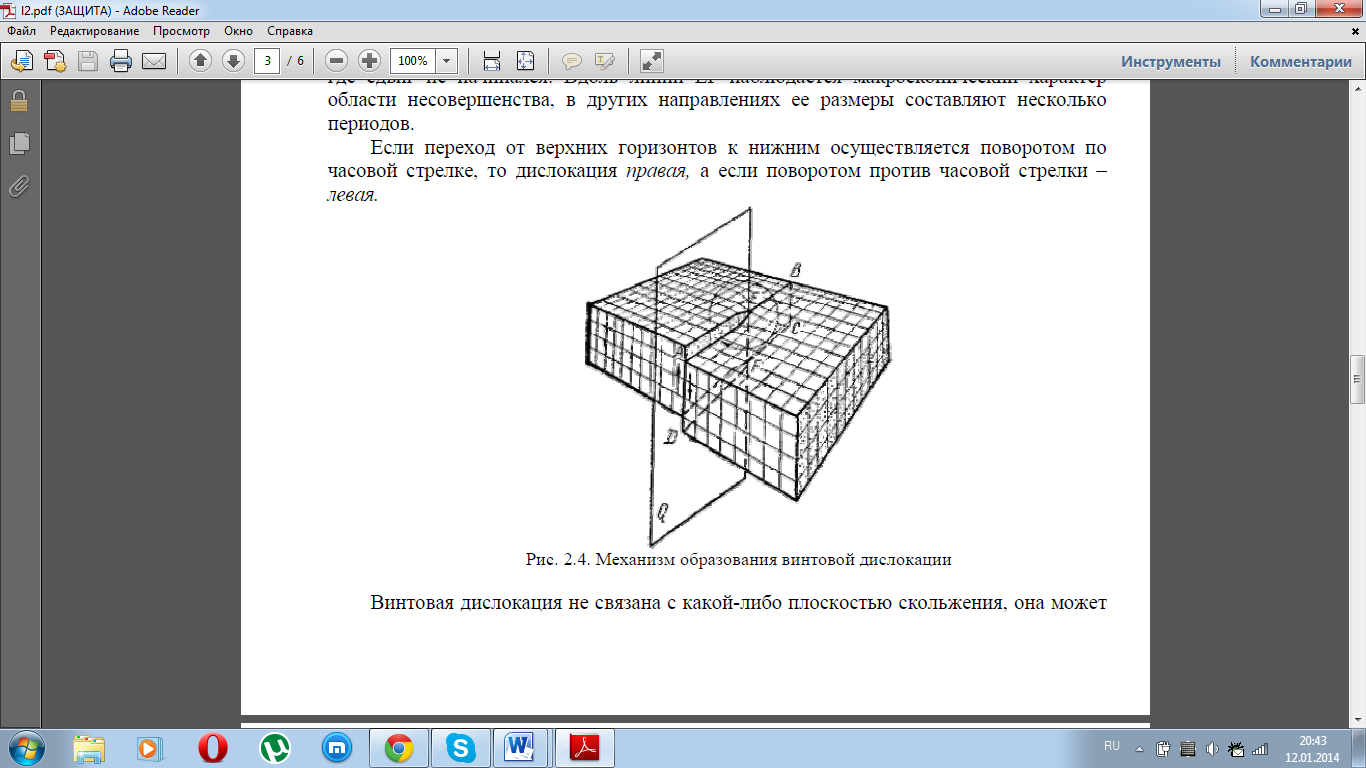
Винтовая
дислокация не связана с какой-либо
плоскостью скольжения, она может
перемещаться по любой плоскости,
проходящей через линию дислокации.
Вакансии и дислоцированные атомы к
винтовой дислокации не стекают. В
процессе кристаллизации атомы вещества,
выпадающие из пара или раствора, легко
присоединяются к ступеньке, что приводит
к спиральному механизму роста кристалла.
Линии дислокаций не могут обрываться
внутри кристалла, они должны либо быть
замкнутыми, образуя петлю, либо
разветвляться на несколько дислокаций,
либо выходить на поверхность кристалла.
Дислокационная структура материала
характеризуется плотностью дислокаций.
Плотность дислокаций в кристалле
определяется как среднее число линий
дислокаций, пересекающих внутри тела
площадку площадью 1 м2, или как суммарная
длина линий дислокаций в объеме 1 м3![]()
Плотность дислокаций изменяется в широких пределах и зависит от состояния материала. После тщательного отжига плотность дислокаций составляет 105…107 м-2, в кристаллах с сильно деформированной кристаллической решеткой плотность дислокаций достигает 1015…10 16 м –2. Плотность дислокации в значительной мере определяет пластичность и прочность материала (рис. 2.5)

Минимальная прочность определяется критической плотностью дислокаций.
![]()
Если плотность меньше значения а, то сопротивление деформированию резко возрастает, а прочность приближается к теоретической. Повышение прочности достигается созданием металла с бездефектной структурой, а также повышением плотности дислокаций, затрудняющим их движение. В настоящее время созданы кристаллы без дефектов – нитевидные кристаллы длиной до 2 мм, толщиной 0,5…20 мкм - “усы“ с прочностью, близкой к теоретической: для железа= 13000 МПа, для меди =30000 МПа. При упрочнении металлов увеличением плотности дислокаций, она не должна превышать значений 1015…10 16 м –2. В противном случае образуются трещины. Дислокации влияют не только на прочность и пластичность, но и на другие свойства кристаллов. С увеличением плотности дислокаций возрастает внутреннее, изменяются оптические свойства, повышается электросопротивление металла. Дислокации увеличивают среднюю скорость диффузии в кристалле, ускоряют старение и другие процессы, уменьшают химическую стойкость, поэтому в результате обработки поверхности кристалла специальными веществами в местах выхода дислокаций образуются ямки. Дислокации образуются при образовании кристаллов из расплава или газообразной фазы, при срастании блоков с малыми углами разориентировки. При перемещении вакансий внутри кристалла, они концентрируются, образуя полости в виде дисков. Если такие диски велики, то энергетически выгодно “захлопывание” их с образованием по краю диска краевой дислокации. Образуются дислокации при деформации, в процессе кристаллизации, при термической обработке.
Поверхностные дефекты – границы зерен, фрагментов и блоков (рис. 2.6).
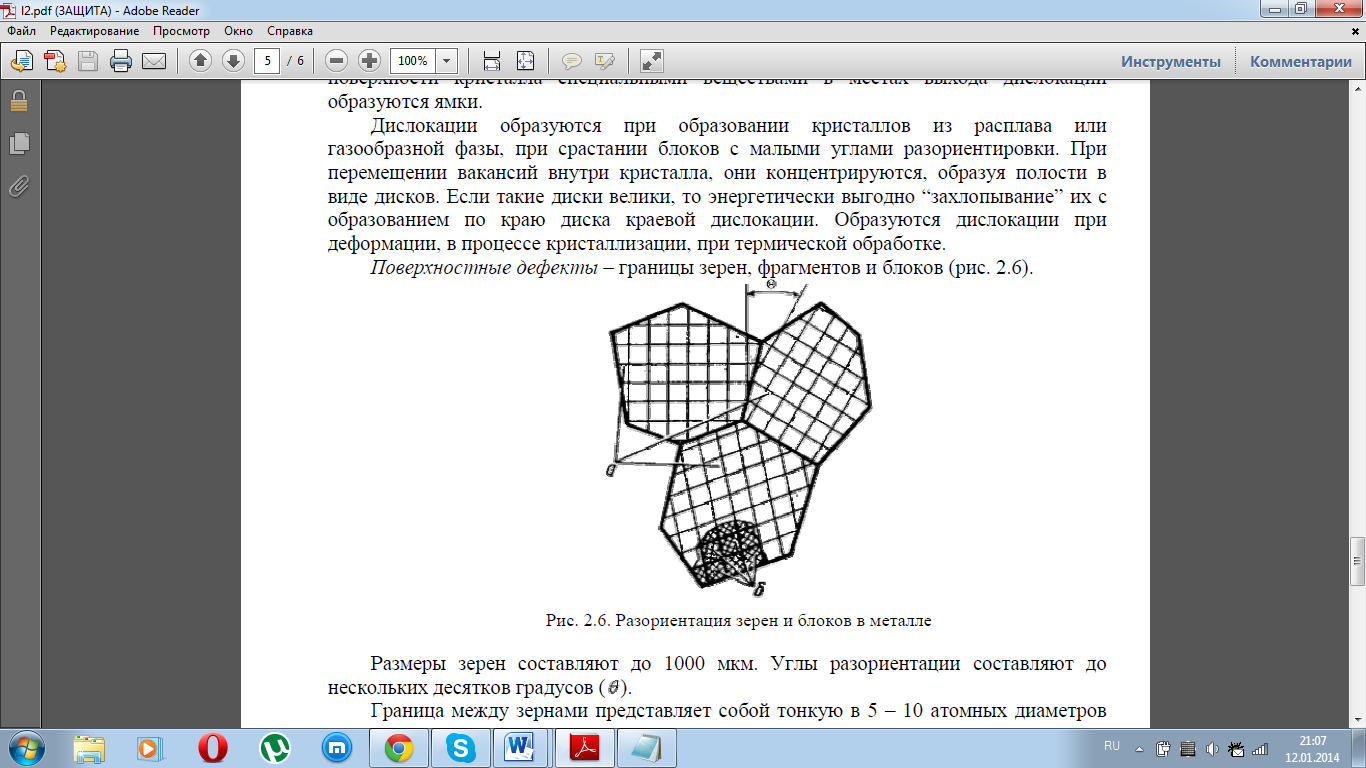
Размеры зерен составляют до 1000 мкм. Углы разориентации составляют до нескольких десятков градусов. Граница между зернами представляет собой тонкую в 5 – 10 атомных диаметров поверхностную зону с максимальным нарушением порядка в расположении атомов. Строение переходного слоя способствует скоплению в нем дислокаций. На границах зерен повышена концентрация примесей, которые понижают поверхностную энергию. Однако и внутри зерна никогда не наблюдается идеального строения кристаллической решетки. Имеются участки, разориентированные один относительно другого на несколько градусов. Эти участки называются фрагментами. Процесс деления зерен на фрагменты называется фрагментацией или полигонизацией. В свою очередь каждый фрагмент состоит из блоков, размерами менее 10 мкм, разориентированных на угол менее одного градуса. Такую структуру называют блочной или мозаичной.
Механические свойства металлов, их характеристики и методы определения.
Механические свойства характеризуют способность металлов и сплавов сопротивляться действию приложенных к ним нагрузок, а механические характеристики выражают эти свойства количественно. Основными свойствами металлических материалов являются; прочность, пластичность (или вязкость), твердость, ударная вязкость, износоустойчивость, ползучесть и др.
Механические характеристики материалов определяются при механических испытаниях, которые в зависимости от характера действия нагрузки во времени делятся на статические, динамические и повторно-переменные.
В зависимости от способа приложения внешних сил (нагрузок) различают испытания на растяжение, сжатие, изгиб, кручение, ударный изгиб и т. п.
Основные механические характеристики металлов и сплавов.
Временное сопротивление (предел прочности, предел прочности при растяжении— условное напряжение, соответствующее наибольшей нагрузке, предшествующей разрушению образца.
Истинное сопротивление разрыву (действительное напряжение) — напряжение, определяемое отношением нагрузки в момент разрыва к площади поперечного сечения образца в месте разрыва.
Предел текучести (физический) — наименьшее напряжение, при котором образец деформируется без заметного увеличения растягивающей нагрузки.
Предел текучести (условный) — напряжение, при котором остаточное удлинение достигает 0,2% длины участка образца, удлинение которого принимается в расчет при определении указанной характеристики.
Предел пропорциональности (условный)— напряжение, при котором отклонение от линейной зависимости между нагрузкой и удлинением достигает такой величины, что тангенс угла наклона, образованного касательной к кривой деформации (в рассматриваемой точке), с осью нагрузок увеличивается на 50% своего значения на линейном упругом участке. Допускается увеличение тангенса угла наклона на 10 или 25%.
Предел упругости— условное напряжение, соответствующее появлению остаточной деформации. Допускается определение предела упругости с допусками до 0,005%, тогда соответственно будет обозначаться.
Относительное удлинение после разрыва— отношение приращения длины образца после разрыва к его первоначальной расчетной длине. Различают относительные удлинения, полученные при испытании на образцах с пятикратным и десятикратным отношением длины к диаметру. Допускаются и другие отношения, например 2,5, при испытании отливок.
Относительное сужение после разрыва — отношение площади поперечного сечения образца в месте разрыва к начальной площади его поперечного сечения.
Указанные характеристики механических свойств определяются при испытании материалов на растяжение по методам, изложенным в ГОСТ 1497—61, на цилиндрических и плоских образцах, формы и размеры которых установлены тем же стандартом. Испытания на растяжение при повышенных температурах (до 1200°С) установлены ГОСТ 9651—73, на дли-тельную прочность— ГОСТ 10145—62.
Модуль нормальной упругости— отношение напряжения к соответствующему ему относительному удлинению при растяжении (сжатии) в пределах упругих деформаций (закон Гука).
Ударная вязкость— механическая характеристика вязкости металла — определяется работой, расходуемой для ударного излома на маятниковом копре образца данного типа и отнесенной к рабочей площади поперечного сечения образца в месте надреза. Испытания при нормальной температуре проводятся по ГОСТ 9454—60, при пониженных — по ГОСТ 9455—60 и при повышенных — по ГОСТ 9656—61.
Предел выносливости (усталости) —максимальное напряжение, при котором материалы образца выдерживают без разрушения заданное количество симметричных циклов (от +Р до — Р), принимаемое за базу. Количество циклов задается техническими условиями и представляет большое число. Методы испытания металлов на выносливость регламентируются по ГОСТ 2860—65.
Предел прочности при сжатии — отношение разрушающей нагрузки к площади поперечного сечения образца до испытания.
Условный предел ползучести— напряжение, вызывающее заданное удлинение образца (суммарное или остаточное) за установленный промежуток времени при заданной температуре.
Твердость по Бринелю - определяется на твердомере ТШ путем вдавливания стального закаленного шарика р. испытуемый металл или сплав.
Твердость по Роквеллу HRA, HRB и HRC определяется вдавливанием в металл стального шарика диаметром ~ 1,6мм или конуса.(алмазно или твердосплавного) с утлом при вершине 120° на твердомере ТК. В зависимости от условий определения, которые стандартизованы ГОСТ 9013—68, различают три значения HR: HRA — для очень твердых материалов (шкала А) — испытание производится вдавливанием алмазного конуса; HRB — для мягкой стали (шкала В) — стального шарика; HRC — для закаленной стали (шкала С) — твердосплавного или алмазного конуса.
Глубина проникновения алмазного конуса при испытаниях в металле небольшая, что позволяет испытывать более тонкие изделия, чем при определении твердости по Бринелю, Твердость но Роквеллу является условной характеристикой, значение которой отсчитывается по шкале прибора.
Твердость по Виккерсу HV определяется вдавливанием алмазной стандартной правильной четырехгранной пирамиды. Определение числа твердости производится путем измерения длины диагоналей (среднее арифметическое суммы двух диагоналей) и пересчета по формуле
Стандартными нагрузками в зависимости от толщины образца приняты 5, 10, 20, 30, 50 и 100 кгс. Выдержка времени под нагрузкой берется для черных металлов 10—15 секунд, для цветных — 28—32. Соответственно символ HV 10/30-500 означает: 500 — число твердости; 10 — нагрузку и 30 — время выдержки.
Метод Виккерса применяется для измерений твердости деталей малых сечений и твердых тонких поверхностных слоев цементированных, азотированных или цианированных изделий.
Взаимодействие компонентов сплава в жидком и твердом состоянии и основные виды структур металлических сплавов – механические смеси, твердые растворы и химические соединения.
Металлическим сплавом называется вещество, состоящее из двух более элементов (металлов или металлов с металлоидами), или обладающее металлическими свойствами. Обычным способом приготовление сплавов является сплавление, но иногда применяют спекание, электролиз или возгонку.)
В большинстве случаев входящие в сплав элементы в жидком состоянии полностью растворимы друг в друге, т. е. представляют собой жидкий раствор, в котором атомы различных элементов более или менее равномерно перемешаны друг с другом. В твердом виде сплавы способны образовывать твердые растворы, химические соединения, механические смеси.
Сплавы
Твердый раствор. Во многих сплавах при переходе в твердое состояние (при кристаллизации) сохраняется однородность распределения атомов различных элементов и, следовательно, сохраняется и растворимость. Образовавшийся в этом случае кристалл (зерно) называется твердым раствором.
Микроструктура твердого раствора в условиях равновесия представляет собой совершенно однородные и одинаковые по составу зерна и похожа на структуру чистого металла. Твердый раствор, как и чистый металл, имеет одну кристаллическую решетку. Различие состоит только в том, что в кристаллической решетке чистого металла все узлы заняты атомами одного элемента, а в твердом растворе — атомами различных элементов, образующих этот твердый раствор.
Растворимость в твердом состоянии может быть неограниченной и ограниченной. Растворимость твердого раствора, полученного при любом количественном соотношении элементов, называется неограниченной. Растворимость твердого раствора, полученного при определенном количественном соотношении элементов, называется ограниченной.
По расположению атомов в кристаллической решетке различают твердые растворы замещения и твердые растворы внедрения. Расположение атомов в твердых растворах.
В твердом растворе замещения атомы растворенного элемента занимают узлы атомов элемента растворителя, т. е. расположены в узлах общей кристаллической решетки.
В твердом растворе внедрения атомы растворенного элемента располагаются внутри кристаллической решетки элемента растворителя между атомами металла-растворителя.
При образовании твердых растворов свойства сплавов изменяются плавно и отличаются от свойств элементов, из которых они состоят.
Химическое соединение. Особый характер металлической связи в сплавах приводит к образованию особого вида химических соединений. В отличие от обычных химических соединений многие металлические соединения имеют переменный состав, который может изменяться в широких пределах. Характерной особенностью металлического химического соединения является образование кристаллической решетки, отличной от решеток образующих элементов, и существенное изменение всех свойств. Иногда в металлических сплавах образуются также химические соединения с нормальной валентностью, например оксиды, сульфиды, а также соединения металлов с резко отличным электронным строением атомов (Mg2Sn, Mg2Pb и др.).
Механическая смесь. Если элементы, входящие в состав сплава, не растворяются друг в друге в твердом состоянии и не вступают в химическую реакцию с образованием соединения, то при этих условиях из атомов каждого элемента образуется отдельная кристаллическая решетка, и кристаллы (зерна) элементов, входящие в сплав, образуют механическую смес. При образовании механической смеси, когда каждый элемент кристаллизуется самостоятельно, свойства сплава получаются средними между свойствами элементов, которые его образуют.
Механические смеси образуются также в случаях, когда элементы обладают ограниченной растворимостью, а также когда образуют химическое соединение. Если в сплаве количество элементов превышает их предельную растворимость, то возникает механическая смесь двух насыщенных твердых растворов. При наличии в сплаве химического соединения образуется механическая смесь из зерен твердого раствора и химического соединения и т. д.
При изучении процессов, происходящих в металлах и сплавах при их превращениях, и описании их строения в металловедении пользуются следующими понятиями: система, фаза, компонент.
Системой называется совокупность фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении). Система может быть простой, если она состоит из одного элемента, и сложной, если она состоит из нескольких элементов.
Фазой называется однородная по химическому составу и кристаллическому строению часть системы, отделенная от других частей системы поверхностью раздела. Фазами могут быть металлы и неметаллы, жидкие и твердые растворы, химические соединения. Однофазной системой является, например, однородная жидкость, двухфазной — механическая смесь кристаллов двух металлов.
Компонентами называют вещества, образующие систему. Компонентами могут быть элементы (металлы и неметаллы) или устойчивые химические соединения.
Диаграммы состояния металлических сплавов и их построение.
При установлении режимов горячей обработки сплавов (прокатки, ковки, штамповки, прессования и др.), термической обработки (отжига, закалки, нормализации и др.) необходимы сведения о превращениях структуры, ее количественных и качественных изменениях при изменении температуры. Для оценки свойств сплава важно знать не только структуру фаз, но и доли массы, которую они занимают.
Если в твердом состоянии при изменении температуры не происходит изменений в строении сплава, то термическая обработка в большинстве случаев теряет смысл.
Графическую зависимость состояния сплавов определенной системы от концентрации компонентов (химического состава) и температуры устанавливают диаграммы состояний.
По диаграмме можно определить, при какой температуре происходит затвердевание сплава, какие превращения происходят при нагреве и охлаждении, количественный и качественный состав фаз и др.
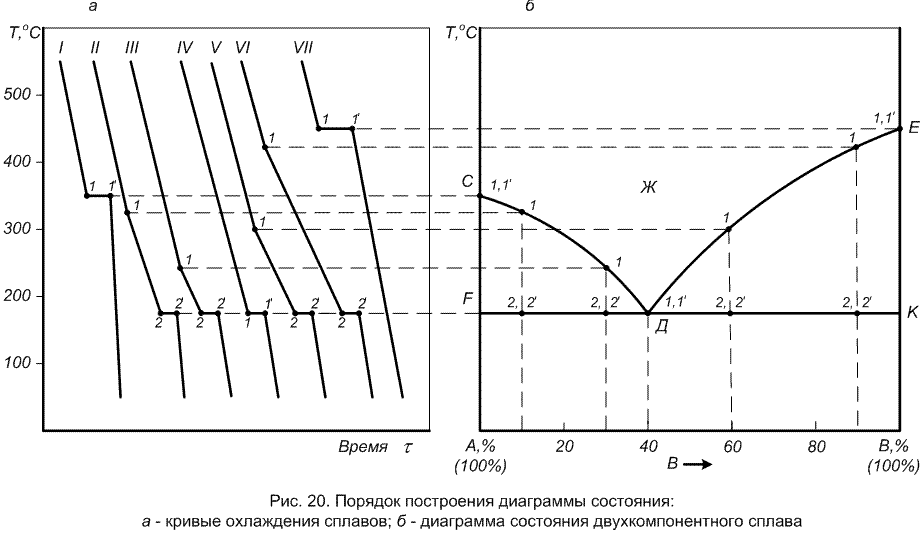
Диаграмма двухкомпонентного сплава строится в двух измерениях: температура – концентрация (рис. 17). По оси ординат откладывается температура, а по оси абсцисс – концентрация. Общее содержание компонентов в любом сплаве составляет 100 %. Левая крайняя точка А по оси концентраций соответствует 100 % содержанию компонента А. Процентное содержание второго компонента откладывается по этой оси слева направо. Правая крайняя точка В соответствует 100 % содержанию второго компонента В. Каждая промежуточная точка на оси абсцисс соответствует определенному содержанию сплава. Например, в точке С сплав состоит из 40 % компонента В и 60 % компонента А. В точке Д – 80 % компонента В и 20 % компонента А, и т.д. Следовательно, по мере удаления от точки А увеличивается количество компонента В и наоборот.
Ось ординат показывает изменение температуры и каждая точка на оси (например, точка Е) соответствует определенному фазовому состоянию рассматриваемого сплава при определенной температуре (ТЕ).
Порядок построения диаграмм
Диаграммы состояния обычно строятся по экспериментальным данным термического анализа и исследованию структур сплавов в твердом состоянии.
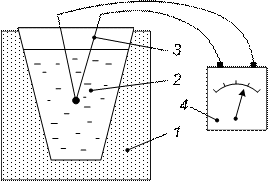
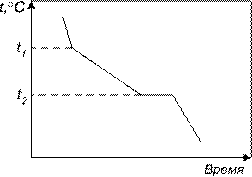
Из исследуемых компонентов изготавливается серия сплавов разного химического состава и для каждого из них строится кривая охлаждения. Температура измеряется обычно термопарой (рис. 18). В нагревательное устройство 1 помещается тигель 2, в котором находится исследуемый сплав. После его расплавления в тигель погружается горячий спай термопары 3 и производится медленное охлаждение. Через определенные промежутки времени производится фиксация температуры и строится кривая охлаждения (рис. 19). Из рисунка видно, что на кривой имеется две характерные точки: t1 и t2. При t1 падение температуры сплава замедляется. Это свидетельствует о том, что начался процесс с выделением такого количество тепла, которое частично компенсирует тепло, отводимое в окружающую среду. При температуре t2 выделение тепла идет настолько интенсивно, что компенсирует потери в окружающее пространство полностью. В данном случае при температуре t1 начинается кристаллизация сплава, а при температуре t2 заканчивается. Эти температуры называются критическими температурами или критическими точками.
|
|
|
|
Рис. 18. Схема установки для построения кривых охлаждения: 1 – нагревательное устройство; 2 – тигель;3 – термопара; 4 – гальванометр |
Рис. 19. Кривая охлаждения сплава |
Рассмотрим построение диаграммы на конкретном примере. Пусть имеется сплав состоящий из двух компонентов А и В, которые неограниченно растворимы в жидком состоянии, но в твердом взаимно не растворимы и не образуют друг с другом химических соединений. Из этих двух компонентов создана серия сплавов различного химического состава и для них получены критические температуры начала (t1) и конца (t2) кристаллизации (табл. 1).
По данным табл. 1 строятся кривые охлаждения каждого сплава (рис. 20, а). Верхние точки кривых (1,1') соответствуют температурам начала затвердевания сплавов и называются температурами ликвидуса. Нижние точки (2,2') соответствуют температурам конца затвердевания и носят название температур солидуса.
При построении диаграммы состояния сплавов на планшет в координатах «температура – концентрация» наносятся значения критических температур для каждого исследуемого сплава (рис. 20, б). Затем соединяя точки начала кристаллизации получают линию ликвидус (СДЕ), а при соединении точек конца кристаллизации – линию солидус (FДК). Таким образом, линии ликвидус и солидус представляют собой семейство точек соответствующих началу и концу кристаллизации многочисленных сплавов с различным содержанием компонентов. Выше температур, образующих линию ликвидус все сплавы данной системы находятся в жидком состоянии, а ниже линии солидус – в твердом. При температурах между этими линиями сплавы находятся в полужидком состоянии, т.е. в жидком расплаве находятся твердые фазы.
Таблица 1
Температуры начала и конца кристаллизации сплавов
|
Номер сплава |
Состав сплава |
Температура кристаллизации | |
|
Начала t1, °С |
Конца t2, °С | ||
|
I |
100 % А |
350 |
350 |
|
II |
90 % А + 10 % В |
325 |
170 |
|
III |
70 % А + 30 % В |
240 |
170 |
|
IV |
60 % А + 40 % В |
170 |
170 |
|
V |
40 % А + 60 % В |
300 |
170 |
|
VI |
10 % А + 90 % В |
420 |
170 |
|
VII |
100 % В |
450 |
450 |
Следовательно, диаграмма показывает состояние сплава при любом соотношении содержания компонентов А и В и при любой температуре.
Диаграммы
дают возможность определять, какую
структуру будут иметь медленно охлажденные
сплавы, а также решать вопросы термической
обработки, выясняя возможно ли при ее
выполнении изменение микроструктуры.
А поскольку технологические и
эксплуатационные свойства сплавов
тесно связаны с их микроструктурой, то
для практического металловедения
диаграммы играют очень большую роль.
Диаграммы состояния системы Fe-Fe3C, анализ, изотермические процессы в системе.
Тут получается вроде лол какой-то
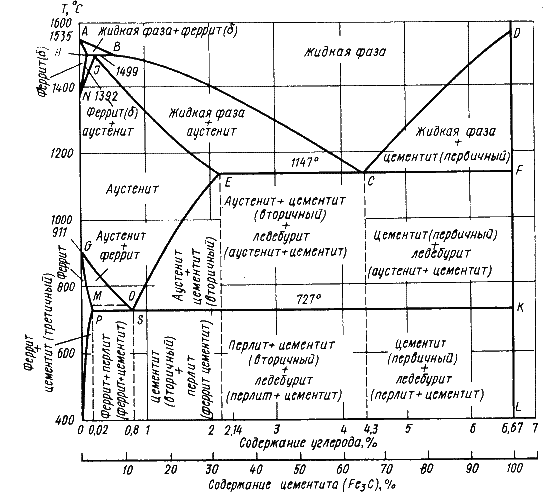
Железо с углеродом образует химическое соединение: Fe3C – цементит, очень твердое, но хрупкое. Рассматривается лишь часть – до 6,67%С.
Технически чистое железо полиморфно, 4 крит точки: 1539 – кристаллизация и 3 перекристаллизации. Плотность упаковки Fey > чем Fea => превращение Fev > Fea происходит с увеличением объёма, возникновенииe внутренних структурных напряжений.
Феррит – тв. р-р внедрения углерода в альфа-железо. Макс. раств-ть С в альфа-железе 0,02%.
Аустенит – тв. р-р внедрения углерода в гамма-железе. Предельная раств-ть 2,14%
Цементит – хим. с-е железа и углерода FeзC. 6,67% С. Цементит имеет высокую твердость, но чрезвычайно низкую, практически нулевую, пластичность.
В сплавах железа и углерода существуют 2 высокоугл. фазы графит и менее устойч. – цементит.
AECF – солидус, PSK – линия эвтектоидного превращения, ECF – линия эвтектического превращения
Перлит – феррит + цементит
Ледебурит – эвтектика системы. Механическая смесь аустенита и цементита.
Это из методы
Диаграмма Fe - Fe3c
1. Общие сведения
Между составом, структурой и свойствами сплавов имеется определенная зависимость. Поэтому важно знать закономерности изменения структуры сплавов с изменением химического состава и температуря. Для этого строят диаграммы состояния сплавов.
Диаграмма состоянии представляет собой графическую зависимость сплавов данной, системы от их концентрации (химического состояния) и температуры. Диаграммы состояний называют диаграммами фазового равновесия сплавов.
Диаграмма состояний позволяет проследить за процессами, происходящими в конкретном сплаве при нагревании и охлаждении; определить сплавы, которые обладают хорошими литейными свойствами, а также сплавы, изменяющие физико-механические свойства путем термической обработки; правильно установить режимы термической и химико-термической обработки; указать, какую структуру будут иметь сплавы в равновесном состоянии медленное охлаждение), по микроструктуре в некоторых случаях рассчитать химический состав сплава; правильно выбрать состав сплава, обладающий необходимыми свойствами, т.д.
Диаграмма состояний строится в координатах: температура – концентрация. По вертикальной оси откладывается температура в градусах Цельсия; по горизонтальной – концентрация элементов в весовых или атомных процентах. Таким образом, каждая точка диаграммы состояний отвечает определенному составу сплава при определенной температуре в условиях равновесия.
Существуют различные физические методы построения диаграмм состояний, однако сущность любого из них сводится к определению критических точек при нагревании и охлаждении металлов и сплавов. КРИТИЧЕСКИМИ ТОЧКАМИ – называется температуры, соответствующие фазовым превращениям или каким-либо другим превращениям в сплаве или металле.
Наиболее простым и удобным методом, позволяющим проследить за процессами кристаллизации металла или сплава из жидкого состояния, является метод ТЕРМИЧЕСКОГО АНАЛИЗА, так как процесс кристаллизации при этом сопровождается значительным тепловым эффектом. Фазовые превращения в сплавах, пример появления твердой фазы в начале кристаллизации (или плавление при нагревании), переход металла в твердом состоянии из одной формы кристаллического строения в другую, растворение или выделение избыточной фазы и т.д., сопровождается тепловым эффектом. В соответствии с этим на кривых измерений, построенных в координатных осях температура – время, при температурах фазовых превращений наблюдаются точки перегиба или температурные остановки. Перегибы на кривой нагрева или охлаждения наблюдаются в том случае, если превращение происходит в интервале температур.
При превращение в твердом состоянии тепловой эффект бывает менее значительным, чем изменение таких свойств, как объем, электропроводность, магнитные свойства, твердость и другие. Поэтому при определении критических точек в твердом состоянии применяются методы, основанные на изменении вышеуказанных свойств: дилатометрический, электрический, магнитометрический и другие.
ДИЛАТОМЕТРИЧЕСКИЙ МЕТОД основан на определении критических точек по перегибам на кривых, характеризующих объемные (или линейные) изменения исследуемого металла или сплава в результате разовых или структурных превращений при нагревании или охлаждении. При нагреве металлов и сплавов происходит изменение объема и линейных размеров тела - тепловое расширение. Если эти изменения обусловлены только увеличением энергии колебаний атомов за счет повышения температуры, то при возвращении температуры к прежнему уровню восстанавливаются и исходные размеры тела. Если же в теле при нагреве (или охлаждении) происходят разовые превращения, то изменения размеров могут быть необратимыми.
Изменения размеров тел, связанные с нагревом и охлаждением изучают на специальных приборах - дилатометрах.
Дилатометрический метод позволяет определять критические точки металлов и сплавов, изучать процессы распада твердых растворов, а также дает возможность установить температурные интервалы существования упрочняющих фаз и т.п. Достоинство этих приборов - высокая чувствительность и независимость показаний от скорости изменения температуры.
Высокую чувствительность электрических методов измерения также широко используют при исследовании фазовых превращений, дефектов тонкой структуры и других явлений, происходящих в металлах и сплавах, которые невозможно изучать другими методами исследования. Суть методов заключается в изменении электросопротивления (или электропроводности) при нагревании или охлаждении, выражающегося в перегибах правых, по которым находят критические точки. Электрическое сопротивление измеряют с помощью различных мостовых схем, а также компенсационными методами. Этот метод впервые бил предложен Н. С. Курнаковым.
Различные способы магнитного анализа используют при исследовании процессов, связанных с переходом из парамагнитного состояния в ферромагнитное (или наоборот), причем возможна количественная опенка этих процессов. Магнитометрические методы широко применяют при решении задач практического металловедения, например таких, кок исследование влияния на структуру режимов термической обработки, деформации, легирования и т.д.
МЕТОД ВНУТРЕННЕГО ТРЕНИЯ основан на изучении необратимых потерь энергии механических колебаний внутри твердого тела.
Используя этот метод, можно определять изменение концентрации твердых растворов; распределение примесей; получить информацию о фазовых и полиморфных превращениях к изменениях дислокационной структуры; можно рассчитать коэффициенты диффузии с высокой точностью, в том числе и при низких температурах, где никакой другой метод неприменим.