
- •В. Н. Седалищев Физические основы получения измерительной информации с использованием генераторных и параметрических первичных преобразователей Учебное пособие
- •Введение
- •Глава 1
- •1. Информационно-энергетические основы теории измерений
- •1.1 Понятие информации. Разновидности информации
- •1.2 Количественная оценка информации
- •1.3 Связь понятий энергии и информации Информационный подход к анализу физических процессов
- •1.4 Применение энерго-информационного подхода к анализу физических процессов
- •Аномалии физических и химических свойств воды
- •1.5 Связь теории информации с теорией измерений
- •Количественная оценка измерительной информации
- •Естественные пределы измерений
- •1.6 Причины наличия ограничений количества информации, получаемой при измерениях
- •Разновидности шумов и причины их появления
- •1.7 Способы повышения информативности измерительного процесса
- •1.8 Общая характеристика этапов измерительного преобразования
- •Метрологические характеристики измерительных преобразователей
- •1.2 Классификация физических эффектов и областей их применения в измерительной технике
- •«Фундаментальное единство» природы. Метод электромеханических аналогий
- •Физические основы построения измерительных преобразователей генераторного типа
- •Физические основы создания электромеханических измерительных преобразователей генераторного типа
- •2.3 Пьезоэффект и его применение в измерительной технике
- •2.3.1 Теоретические основы построения пьезоэлектрических измерительных преобразователей генераторного типа
- •2.3.3 Ээсз пьезоэлектрического преобразователя генераторного типа
- •2.3.4 Физические основы работы пьезорезонансных измерительных преобразователей
- •2.3.2 Электрострикция и области применения ее в измерительной технике
- •2.4 Физические основы создания термоэлектрических измерительных преобразователей
- •2.4.1 Пироэффект и применение его в измерительных устройствах
- •2.4.2 Термоэлектрические эффекты в проводниках и полупроводниках
- •2.4.3 Особенности практической реализации термоэлектрических эффектов в измерительных устройствах
- •2.5 Гальваномагнитные эффекты и применение их в измерительных устройствах
- •2.5.1 Эффект Холла и применение его в измерительных устройствах
- •3. Физические эффекты, связанные с модуляцией активного сопротивления ээсз измерительного преобразователя
- •3.1 Принципы построения и разновидности резистивных измерительных преобразователей
- •3. 2 Физические основы создания пьезорезистивных преобразователей контактного сопротивления
- •3.3 Физические основы создания тензорезистивных проводниковых измерительных преобразователей
- •3.4 Физические основы полупроводниковых тензорезистивных преобразователей
- •3.6 Физические основы магниторезистивных измерительных преобразователей
- •3.7 Физические основы работы проводниковых терморезистивных измерительных преобразователей
- •3.8 Физические основы создания полупроводниковых терморезистивных измерительных преобразователей
- •3.9 Физические основы создания фоторезистивных измерительных преобразователей
- •3.10 Физические основы применения явления сверхпроводимости в измерительных устройствах
- •3.10.1 Свойства сверхпроводников
- •3.10.2 Квантово-механическая теория сверхпроводимости
- •Объяснение понятий экситона и поляритона
- •3.10.3 Применение явления сверхпроводимости в измерительной технике
- •3.10.4 Эффект Мейснера и его практическое применение
- •3.10.5 Стационарный и нестационарный эффекты Джозефсона и применение их в измерительной технике
- •4. Физические основы создания электрохимических измерительных преобразователей
- •4.1 Полярографический эффект в растворах и применение его в измерительных устройствах
- •4.2 Физические основы работы кондуктометрических измерительных преобразователей
- •4.3 Применение в измерительной технике электрокинетических явлений в растворах
- •4.4 Принципы работы гальванических измерительных преобразователей
- •5. Физические основы создания первичных преобразователей, основанных на модуляции магнитных параметров измерительной цепи
- •5.1 Принцип работы магнитоиндукционных измерительных преобразователей генераторного типа
- •5.2 Теоретические основы создания индуктивных измерительных преобразователей
- •5.3 Принцип работы вихретоковых измерительных устройств
- •5.4 Физические основы магнитомодуляционных измерительных преобразователей
- •Эффект Виганда
- •5.5 Физические эффекты, связанные с модуляцией магнитных характеристик материалов
- •Пример реализации магнитострикционного эффекта в датчиках линейных перемещений
- •Принцип работы устройства
- •Дополнительные эффекты, возникающие в магнитомодуляционных преобразователях
- •5.6 Физические основы создания магнитоупругих измерительных преобразователей
- •5.7 Зависимость магнитной проницаемости ферромагнетиков от влияющих факторов
- •6. Физические основы создания емкостных измерительных преобразователей
- •6.1 Модуляция геометрических размеров емкостных преобразователей
- •Принципы работы емкостных измерительных преобразователей
- •Емкостной преобразователь с переменной площадью обкладок
- •6.2 Физические основы емкостных измерительных устройств, основанных на модуляции диэлектрических свойств веществ
- •6.2.1 Строение материалов
- •6.2.2 Виды связей и механизмы поляризации диэлектриков
- •6.2.3 Влияние агрегатного состояния вещества на его диэлектрические свойства
- •6.2.4 Примеры практической реализация емкостных измерительных устройств, основанных на управлении диэлектрической проницаемостью веществ
- •7. Физические основы создания биодатчиков генераторного и параметрического типов
- •Глава 1. Информационно-энергетические основы теории измерений
- •Глава 2. Физические основы построения измерительных преобразователей генераторного типа
- •Глава 3. Физические эффекты, связанные с модуляцией активного сопротивления ээсз измерительного преобразователя
- •Глава 4. Физические основы создания электрохимических измерительных преобразователей
- •Глава 5. Физические основы создания первичных преобразователей, основанных на модуляции магнитных параметров измерительной цепи
- •Глава 6. Физические основы создания емкостных измерительных преобразователей
- •Глава 7. Физические основы создания биодатчиков генераторного и параметрического типов
- •Перечень физических эффектов
4. Физические основы создания электрохимических измерительных преобразователей
В общем случае электрохимический первичный измерительный преобразователь представляет собой ячейку, заполненную электролитом и систему из двух и более электродов, включенных в измерительную цепь. Растворы (в том числе и твердые), расплавы являются проводниками 2-го рода, перенос зарядов в которых осуществляется в основном ионами.
ЭЭСЗ электрохимического
преобразователя можно представить в
виде электрической цепи, содержащей
эквивалентные параметры (ЭДС;![]() L;
С) зависящие от природы, состава электродов
и электролита, типа химических превращений
в ячейке, температуры, скорости перемещения
раствора и других физических величин.
Принципы работы разнообразных типов
электрохимических измерительных
преобразователей основаны на реализации
соответствующих законов электрохимии.
L;
С) зависящие от природы, состава электродов
и электролита, типа химических превращений
в ячейке, температуры, скорости перемещения
раствора и других физических величин.
Принципы работы разнообразных типов
электрохимических измерительных
преобразователей основаны на реализации
соответствующих законов электрохимии.
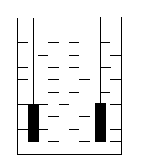

Рис. 4.1 Общий вид
электрохимической ячейки и ее ЭЭСЗ:
![]() - электрическая емкость, образованная
наличием объемных зарядов в растворе;R
– сопротивление канала проводимости
через электролит;
- электрическая емкость, образованная
наличием объемных зарядов в растворе;R
– сопротивление канала проводимости
через электролит;
Е – генерируемая разность потенциалов.
Известно, что при растворении солей, кислот, щелочей в воде происходит диссоциация, т.е. расщепление молекул на анионы (-) и катионы (+). Перемещение ионов в растворе происходит за счет диффузии, обусловленной различной концентрацией ионов в отдельных частях электролита, конвекции их за счет увлечения потоком движущейся жидкости, миграции ионов под действием электрического поля и т.п. Для электролитов применим закон Ома. Растворы характеризуются весовой и объемной (молярной) концентрацией. Нормальный раствор содержит один моль вещества в одном литре. Химическая активность раствора (а) равна произведению эквивалентной концентрации (с) на коэффициент активности (f):
а = f∙c (4.1)
Для бесконечно разбавленного раствора: f = 1. При повышении концентрации раствора его активность снижается.
Удельная проводимость раствора пропорциональна его химической активности:
![]() ,
(4.2)
,
(4.2)
где:
![]() - эквивалентная электропроводность
раствора.
- эквивалентная электропроводность
раствора.
Проводимость электролита нелинейно зависит от концентрации и температуры .
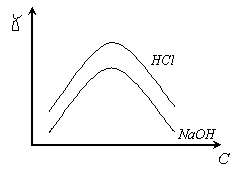
Рис. 4.2 Зависимость проводимости электролита от его концентрации.
При нагревании раствора его электропроводность возрастает:
 (4.3)
(4.3)
Действие всех гальванических преобразователей основано на измерении разности потенциалов между электродами, помещенными в исследуемый раствор. При этом металлический электрод, находящийся в растворе, заряжается отрицательно (электродный потенциал), а раствор – положительно (с электрода в электролит уходят положительно заряженные ионы металла). Измерить можно только разность потенциалов, поэтому за начало отсчета в электрохимии принят потенциал «водородного электрода». Для этого используют платиновый электрод, помещенный в нормальный раствор, при этом на его поверхности адсорбируют ионы водорода. Потенциалы материалов относительно «водородного электрода» имеют значения:
K
![]() ;
;
Zn
![]() ;
;
Cu
![]() .
.
Соответственно, разность потенциалов, например, между медным и цинковым электродом будет равна:
![]() (4.4)
(4.4)
При изменении температуры и концентрации электролита изменяется и потенциал на электроде. Согласно уравнению Нернста можно записать:
![]() ,
(4.5)
,
(4.5)
где: F - число Фарадея (F = 96522 Кл/г-экв.);
Z – валентность материала электрода;
R – универсальная газовая постоянная.
Для ЭДС между двумя элементами из разнородных материалов, находящихся в электролитах с отличающейся активностью, получим:
![]() .
(4.6)
.
(4.6)
Если два одинаковых электрода находятся в растворах с отличающейся концентрацией, то:
![]() .
(4.7)
.
(4.7)
Кроме потенциалов на электродах образуется разность потенциалов на границах двух растворов с разной концентрацией (граничный потенциал). Градиент потенциалов может возникнуть и в результате разной подвижности ионов в растворах (диффузный потенциал). На границе двух растворов, разделенных полунепроницаемой перегородкой (мембраной), пропускающей одни и не пропускающей другие ионы, образуется мембранная разность потенциалов.
