
- •Влияние температуры на скорость химической реакции.
- •(Интегральная форма уравнения Аррениуса)
- •Катализ. Общие сведения.
- •Гомогенный катализ
- •Ферментативный катализ
- •1 Молекула фермента каталазы при 00с в 1 мин обеспечивает разложения молекул н2о2 (на определенной стадии метаболизма н2о2 образуется в живых клетках и губительно влияет на них)
Влияние температуры на скорость химической реакции.
Обобщив обширный экспериментальный материал и собственные опытные данные Вант-Гофф пришел к количественной зависимости скорости реакции от температуры: при повышении температуры на 100С (в пределах температур до 1000С) скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа).
С учетом того, что концентрации практически не зависят от температуры, правило Вант-Гоффа записывают относительно константы скорости реакции:
 (эмпирическое правило Вант-Гоффа)
(эмпирическое правило Вант-Гоффа)
Отношение константы скорости при температуре (Т+10) к константе скорости при температуре Т называется температурным коэффициентом ρ.
Пользуясь этим правилом Вант-Гоффа можно оценить изменение скорости реакции для любого интервала изменения температуры. Например, при повышении температуры на 1000С при ρ=2.
 где
где
 =
1000С, ρ = 2, следовательно, скорость
возрастает в 210, т.е.
=
1000С, ρ = 2, следовательно, скорость
возрастает в 210, т.е.
 в
1000 раз. Теоретического обоснования
этому правилу нет. В ряде случаев оно
оказывается полезным для ориентировочных
расчетов.
в
1000 раз. Теоретического обоснования
этому правилу нет. В ряде случаев оно
оказывается полезным для ориентировочных
расчетов.
Уравнение Аррениуса
В современных кинетических теориях зависимость константы скорости реакции от температуры представляется уравнением Аррениуса:

где постоянные А и В находят эмпирически.

В соответствии с уравнением изобары Вант-Гоффа для обратимой реакции

где
 – тепловой эффект реакции.
– тепловой эффект реакции.
Гипотеза
Аррениуса в том, что тепловой эффект
реакции
 можно представить в виде разности двух
величин:
можно представить в виде разности двух
величин:

причем
 относится к прямой реакции,
относится к прямой реакции,
 – к обратной.
– к обратной.
Тогда уравнение изобары можно представить в виде:
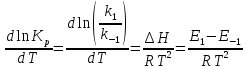 или
или

Поскольку прямая и обратная реакции протекают независимо друг от друга, то уравнение можно рассматривать как разность двух независимых уравнений:

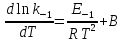
Аррениус
предположил в согласии с экспериментальными
данными, что постоянная В = 0, с учетом
этого для любой частной реакции можно
записать обобщенную форму уравнения:

Это уравнение Аррениуса в дифференциальной форме (величина Е измеряется в единицах энергии (на 1 моль вещества) и называется энергией активации).
Для простых реакций и элементарных стадий сложных реакций физический смысл энергии активации состоит в том, что скорость этих реакций определяют молекулы, энергия которых больше некоторой определенной величины.
Энергия активации – это избыток энергии, которым должны обладать реагирующие частицы, чтобы вступить в химическую реакцию, т.е. стать активными.

Физический смысл энергии активации иллюстрирует рисунок, на котором химическая реакция представлена как переход системы из энергетического состояния I через энергетический барьер в состояние II.
Этот
энергетический барьер соответствует
энергии активации прямой реакции
 ,
а обратная реакция характеризуется
энергией активации
,
а обратная реакция характеризуется
энергией активации
 (переход из состояния II
в состояние I). Теплота
процесса
(переход из состояния II
в состояние I). Теплота
процесса
 .
.
В соответствии
с законом Гесса теплота процесса также
равна разности энтальпий продуктов
реакции и исходных реагентов
 ,
отсчитанных от значения, принятого за
нулевое
,
отсчитанных от значения, принятого за
нулевое
 .
.
Для
большинства реакций
 ,
вместе с тем возможны реакции, для
которых
,
вместе с тем возможны реакции, для
которых
 и даже
и даже
 .
.
Уравнения
можно проинтегрировать, приняв, что
 не зависит от температуры:
не зависит от температуры:

где const
обозначают
 и называют предэкспоненциальным
множителем.
и называют предэкспоненциальным
множителем.

