
Химия и жизнь 2014 №7
.pdf
7
2014


Химия и жизнь
Ежемесячный научно-популярный журнал
7 2014
Зарегистрирован в Комитете РФ по печати
19 ноября 2003 г., рег.№ 014823
НОМЕР ПОДГОТОВИЛИ:
Главный редактор
Л.Н.Стрельникова
Заместитель главного редактора
Е.В.Клещенко
Главный художник
А.В.Астрин
Редакторы и обозреватели
Б.А.Альтшулер,
Л.А.Ашкинази,
В.В.Благутина,
Ю.И.Зварич,
С.М.Комаров,
Н.Л.Резник,
О.В.Рындина
Технические рисунки
Р.Г.Бикмухаметова
Подписано в печать 26.06.2014
Адрес редакции
19991, Москва, Ленинский просп., 29, стр. 8
Телефон для справок:
8 (495) 722-09-46 e-mail: redaktor@hij.ru
http://www.hij.ru
При перепечатке материалов ссылка
на «Химию и жизнь — XXI век» обязательна.
© АНО Центр «НаукаПресс»
На обложке — рисунок А.Кукушкина
На второй странице обложки —
картинаКенаНолтона«БаракОбама». Важно не только то, что написано, но и то, что выделено в тексте, — это верно
идля генома. О современных методах работы с нуклеотидными текстами читайте в статьях «Вид с вершины»
и«Умные ножницы для ДНК».
Мозг — орган, приспособленный для выживания, а не для познания мира.
Альберт Сент-Дьёрди
Содержание
Репортаж
вид с вершины. Е.Клещенко ................................................................................. |
|
|
2 |
|
Проблемы и методы науки |
|
|
|
|
умные ножницы для ДНК. Д.Э.Джагаров |
............................................................. |
6 |
||
Технологии и природа |
|
|
|
|
Восстание сорняков. С.М.Комаров.................................................................... |
|
12 |
||
Фотоинформация |
|
|
|
|
сорняк в кукурузе. С.М.Комаров......................................................................... |
|
17 |
||
Тематический поиск |
|
|
|
|
твари из лабораторий. Е.Клещенко .................................................................. |
|
18 |
||
Прогулки по истории химии |
|
|
|
|
манфред эйген: измерение неизмеримого. И.А.Леенсон............................ |
20 |
|||
Научный комментатор |
|
|
|
|
Защита томатов. Н.Л.Резник............................................................................... |
|
|
21 |
|
Нанофантастика |
|
|
|
|
ограниченное вмешательство. Алексей Лисаченко....................................... |
23 |
|||
Научный комментатор |
|
|
|
|
зачем лягушке микробный токсин. Н.Л.Резник............................................. |
24 |
|||
Элемент №... |
|
|
|
|
бериллий: факты и фактики. А.Мотыляев......................................................... |
26 |
|||
Вещи и вещества |
|
|
|
|
загадка папиршпата. Б.З.Кантор....................................................................... |
|
30 |
||
Еда по-научному |
|
|
|
|
как пахнет жареным. А.А.Бондарев................................................................... |
|
32 |
||
Проблемы и методы науки |
|
|
|
|
человеческий мозг и социальное неравенство. А.В.ќкурко..................... |
36 |
|||
Проблемы и методы науки |
|
|
|
|
антиподы: другая земля. Г.Ю.Любарский......................................................... |
40 |
|||
Земля и ее обитатели |
|
|
|
|
исключительная гиена. Н.Анина....................................................................... |
|
45 |
||
Земля и ее обитатели |
|
|
|
|
Мужская доля Н.А.Паравян................................................................................. |
|
|
48 |
|
Что мы едим |
|
|
|
|
кальмары, осьминоги, каракатицы. Н.Ручкина.............................................. |
50 |
|||
Фантастика |
|
|
|
|
Правда железной дороги. Юлия Сиромолот.................................................... |
52 |
|||
Радости жизни |
|
|
|
|
феномен палиндрома. Б.Я.Бейнфест............................................................... |
|
56 |
||
Расследование |
|
|
|
|
была корона у гиерона Ю.Б.Цаплев... ............................................................... |
|
60 |
||
в зарубежных лабораториях |
10 |
короткие заметки |
62 |
|
|
|
|
|
|
книги |
11 |
пишут, что |
62 |
|
|
|
|||
информация |
64, 65 |
переписка |
64 |
|
|
|
|
|
|
|
|
|
|
|

Вид с вершины
Фото предоставлено пресс-службой фонда Сколково.
Слева направо: руководитель професcорско-преподавательского состава совместной программы МТИ-Сколтех Брюс Тидор, Синъя Яманака, Филипп Шарп
Е.Клещенко
Что делают лауреаты Нобелевской премии после того, как становятся лауреатами? После церемонии награждения, банкета, Нобелевской лекции, после публичных выступлений, пресс-конференций, интервью — всего того, что один из наших лауреатов иронично назвал «годом болтовни»,
— как жить дальше и чем заниматься, когда самая высокая вершина позади?
В конце мая Сколковский институт науки и технологий провел международную биомедицинскую конференцию «Терапия будущего». В первый день на ней выступили Филипп Шарп (Нобелевская премия по физиологии или медицине 1993 года) и Синъя Яманака (Нобелевская премия по физиологии или медицине 2012 года). В зале было много молодежи. Никто из юношей и девушек не брал радиопереводчики, свободное владение английским здесь само собой разумеется. Некоторые — видимо, студенты биомедицинского направления Сколтеха — во время кофебрейка после выступления Яманаки жаловались друг другу, что лекция слишком элементарна, они, мол, надеялись, что будут обсуждаться более сложные вопросы. В самом деле, обе лекции были скорее обзорными, с акцентом на то, как научное открытие превращается в «пользу для человечества».
Перепрограммировать клетку
Кратко напомним, что открыл Синъя Яманака (подробнее см.
в«Химии и жизни», 2012, № 11). Интерес к починке человеческого организма возник у него давно: сперва как у пациента (в колледже, занимаясь дзюдо и регби, он очень много узнал о переломах и разрывах связок), а потом как у начинающего хирурга. К экспериментальной биологии Яманака обратился
в1993 году, когда решил, что у него нет таланта к хирургии,
но есть желание искать решения задач, которые практическая медицина считает неразрешимыми. Руководителем лаборатории он впервые стал в 1999 году в Институте науки и технологии в Нара — будущему нобелиату тогда было 37 лет. В 2004 году Яманака вместе с несколькими сотрудниками той лаборатории перешел в Институт передовых медицинских наук Университета Киото, где и состоялось открытие.
Группа Синъя Яманаки показала, что зрелую клетку мыши или человека можно превратить в плюрипотентную — способную размножаться и превращаться в клетку любого типа, необходимую пациенту. Например, если в клетку кожи — фибробласт ввести копии всего четырех генов (это делается с помощью специальных конструкций на основе вирусов), то фибробласты изменяют свой вид и характер роста, становятся похожими на эмбриональные стволовые клетки. Такие перепрограммированные клетки получили название iPSC (induced pluripotent stem cells). Примерно то же самое можно делать и с клетками периферической крови. Нобелевский лауреат всегда подчеркивает, что это достижение — заслуга его одаренных и трудолюбивых сотрудников, и особо отмечает троих молодых специалистов: своих первых аспирантов Кадзутоси Такахаси, Ёсими Токудзаву и лаборанта Томоко Итисаку.
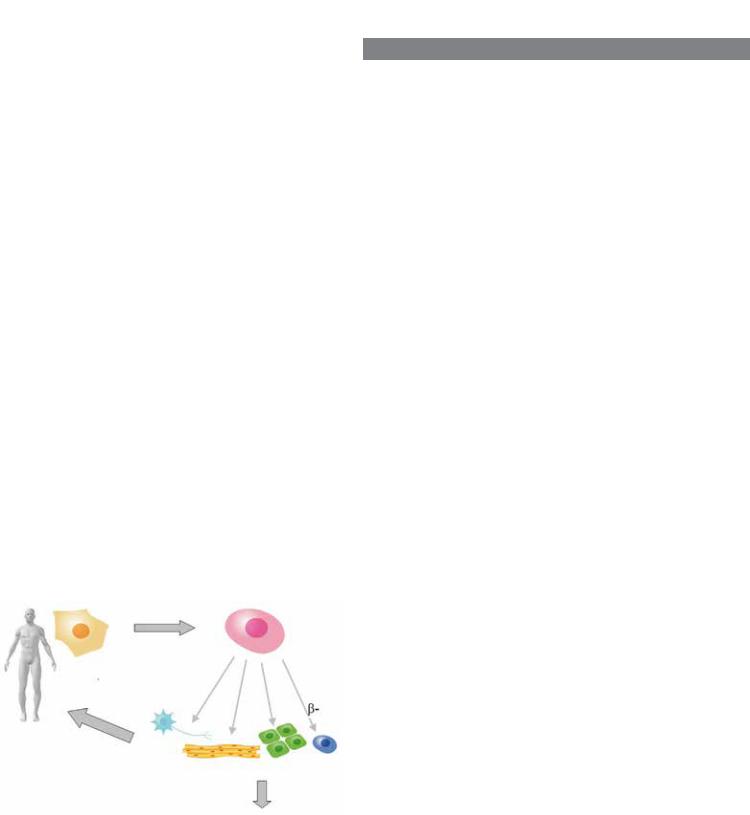
Перспективыбылиочевидны,недаромиНобелевскойпремии пришлось ждать всего несколько лет. «Запчасти для человека», замена изношенных и поврежденных тканей; при этом ни иммунных конфликтов — ведь донором клеток будет сам пациент, ни этических проблем, осложняющих использование эмбриональных стволовых клеток. Дофаминергические нейроны, выращенные в пробирке, помогут вылечить болезнь Паркинсона, клетки-предшественники нейронов — травмы спинного мозга, клетки сердечной мышцы — инфаркты, клетки поджелудочной железы — диабет, гепатоциты — заболевания печени...
Но если ученый не отдаст практическую реализацию своего открытия в чужие руки, ему придется стать менеджером и ломать голову уже не только над тем, как получить деньги на
2
собственные исследования. В январе 2008 года, через два месяца после публикации статьи о получении человеческих iPSC («Cell», 2007,131, 861—872), Киотский университет при поддержке японского правительства основал Центр по исследованию и применению индуцированных плюрипотентных стволовых клеток — Center for iPS Cell Research and Application, или CiRA. (В 2010 году центр стал независимым и переехал в собственное здание.) Яманака занял в нем пост директора, и, помимо фундаментальных научных проблем, перед ним встала задача организации и финансового обеспечения работы двух с лишним сотен человек. Специально для тех, кто позавидовал отношению японского государства к науке: в 2012 году 50-летний доктор Яманака принял участие в Киотском марафонском забеге, чтобы привлечь внимание публики к CiRA и получить пожертвования от частных лиц — у нас это называют «донейтом» или «краудфандингом» и обычно добавляют, что «это не работает». Тогда удалось собрать 10 миллионов иен (более 120 000 долларов).
Чем занимаются в CiRA сегодня? Пересадка человеку клеток, полученных из его собственных iPSC, — это красиво, но есть и другие, не менее важные применения. Например, тестирование лекарств (см. статью «Человек на чипе», «Химия и жизнь», 2012, № 12). Можно вырастить in vitro кардиомиоциты, заставить искусственную сердечную ткань сокращаться, как настоящее сердце, и проверять на такой модели безопасность сердечных препаратов. Это позволит, в частности, сразу отсеять те, что вызывают аритмию. В CiRA такими разработками занимается доктор Ёсинори Йосида, и некоторые биотехнологические компании уже производят и продают «подопытный миокард»: совсем как настоящий, с ЭКГ-подобным ритмом электрической активности и ионными каналами — мишенями лекарств.
Конечно, опыты in vitro никогда не заменят полноценных клинических испытаний, но помогут их лучше планировать. Головная боль врачей — индивидуальная чувствительность пациентов к лекарствам. В тех случаях, когда первые опыты показывают, что новый препарат не на всех пациентов действует одинаково, возможно, имеет смысл взять iPSC потенциальных добровольцев, заставить их дифференцироваться в клетки — мишени лекарства, на которых и провести предварительные опыты. Если с клетками того или иного добровольца что-то пойдет не так, то, видимо, этого человека не стоит привлекать к испытаниям. Таким же путем можно было бы подбирать оптимальное лечение для каждого пациента — метод проб и ошибок гораздо безопаснее, когда применяется вне организма. Это был бы важный шаг к «персональной медицине».
Есть и еще один аспект: бывало, что лекарства, потенциально полезные, не проходили клинических испытаний из-за побочных эффектов. Однако не исключено, что подобным
|
|
iPS |
Пациент |
|
|
|
Нейроны |
клетки |
|
|
|
Клеточная |
|
|
терапия |
Клетки миокарда |
Гепатоциты |
|
||
Применения |
|
|
индуцированных |
Токсикология, моделирование |
|
плюрипотентных |
заболеваний, скрининг |
|
тволовых клеток |
лекарственных препаратов |
|
Репортаж
эффектам подвержена лишь часть людей, а другим лекарство могло бы помочь. Такие невезучие препараты тоже могла бы реабилитировать проверка на клетках, выращенных из iPSC.
Интересный пример подобного применения индуцированных стволовых клеток — исследования болезни Альцгеймера в CiRA. Этотяжелоенейродегенеративноезаболеваниенасегодняшний день неизлечимо, но плохо еще и то, что пациенты со сходными симптомами могут по-разному «откликаться» на терапию. Доктор Харухиса Иноуэ с сотрудниками получили iPSC от четырех пациентов—двухсмутациямипредрасположенностикболезни и еще двух, у которых известных мутаций не было, но болезнь была. Из клеток вырастили нейроны и астроциты (клетки, питающие и поддерживающие нейроны). И получили удивительную возможность — исследовать образцы нервных тканей живых людей,любымиметодамиибезвредадляпациентов.Оказалось, чтоамилоидныебета-олигомерыобразуютсявклеткахносителя одной из мутаций (а у носителя другой не образуются) и в одном издвухспорадическихслучаев.Противодействовалаэтомупроцессу и последующему угнетению нейронов докозагексаеновая кислота—ноопять-такитольковклеткахтехпациентов,укоторых агрегаты были. У двух других пациентов, очевидно, заболевание развиваетсяпоиномумеханизму,илечениеимнеобходимоиное (Kondoetal.,«CellStemCell»,2013,12,4,487—496).Этотрезультат вноситнекоторуюясностьвдавнообсуждаемыйвопрос:замедляют ли развитие болезни Альцгеймера морепродукты, богатые докозагексаеновой кислотой?
Аналогичным способом группа Иноуэ изучает боковой амиотрофический склероз — прогрессирующее неизлечимое заболевание, при котором атрофируются и погибают двигательные нейроны и мышцы, развиваются параличи. Наверное, самый известныйчеловек,страдающийэтойболезнью,—физикСтивен Хокинг,ионжеодинизредких«счастливчиков»,укоторыхболезнь стабилизировалась, не приведя к смерти. В CiRA выращивают из iPSC мотонейроны пациентов и проверяют, насколько то или иное лекарство способствует отрастанию нервных окончаний у клеток конкретного человека (Egawa et al., «Science Translational Medicine», 2012, 4, 145, 145ra104).
Еще одно удивительное направление исследований — лечение травм спинного мозга. Эти работы CiRA ведет совместно
стокийским университетом Кейо. Из мышиных фибробластов получают iPSC, из тех — стволовые клетки нейронов, которые и пересаживают подопытным мышам с разрывом спинного мозга (Tsuji et al., «Proceedings of the National Academy of Sciences USA», 2010, 107, 28, 12704—12709). Доктор Яманака показал во время лекции короткие видеоролики — «контрольная» мышь
спарализованными лапками и такая же, но после лечения, передвигается на всех четырех.
Перечислим еще несколько заболеваний, которые японские исследователи в CiRA и других научных центрах пытаются лечить с помощью iPSC. Макулодистрофия — поражение сетчатки глаза, приводящее к слепоте. Болезнь Паркинсона (новые нейроны вводят непосредственно в мозг, правда, пока только обезьянам, на которых моделируют заболевание). Травматические и иные поражения хрящевых тканей — интересно, что фибробласты могут напрямую дифференцироваться в клетки хряща, минуя «стволовую» стадию, если правильно подобрать
«Химия и жизнь», 2014, № 7, www.hij.ru
3
генные сигналы, и это можно проделать даже in vivo, прямо в организме «научить» клетки, как ликвидировать дефект... Из индуцированных стволовых клеток можно также выращивать эритроциты и тромбоциты для переливания.
Однако у получения индивидуальных индуцированных плюрипотентных клеток как метода лечения есть важный недостаток: оно требует времени и денег. Мало сделать лечение «технически возможным», оно должно быть доступным для каждого, в идеале — сразу, как только понадобится, а не через месяц. По мнению доктора Яманаки, этого помогут достичь банки iPSC. Проект по созданию такого банка для нужд регенеративной медицины осуществляют в CiRA совместно с больницей Киотского университета. Первая фаза, которая завершится уже около 2018 года, должна собрать генные варианты половины популяции Японии (это можно сделать, и не беря кровь у каждого японца, если грамотно подойти к вопросу). На второй фазе, к 2023 году, предполагается охватить 80—90% японской популяции и создать банк пуповинной крови.
Новый уровень регуляции
Второй доклад охватывал значительно более обширный промежуток времени. Это и понятно: Филипп Шарп (Институт интегративных исследований рака им. Коха при Массачусетском технологическом институте) получил докторскую степень по химии, когда Синъя Яманаке было семь лет. Он работал в лаборатории Колд-Спрингс-Харбор у Джеймса Уотсона, а в МТИ его пригласил Сальвадор Лурия. Иными словами, он был в числе создателей молекулярной биологии. Зато и главное его открытие от главной награды отделяют почти два десятка лет: Филипп Шарп и Ричард Робертс получили Нобелевскую премию 1993 года по физиологии или медицине «за открытие, независимо друг от друга, прерывистой структуры гена» (1977).
Оказалось, что гены эукариот — организмов, имеющих ядро,
—устроеныстранноинелогично.ПоследовательностьДНК,коди- рующаяодинбелок,прерывается«бессмысленными»вставками, которые копируются и в матричную РНК (мРНК), приходится их оттуда вырезать и сшивать осмысленные куски, прежде чем синтезировать на ней белок. Кодирующие участки называются экзонами, некодирующие вставки — интронами. У прокариот (бактерий и архей) такого не бывает: их гены — сплошные, не содержащие интронов. Да и расположены они в геноме гораздо компактнее, идут друг за другом, без всякой «мусорной» ДНК.
Отдельный вопрос — как эукариоты дошли до такой жизни и почему эти вредные, портящие ген вставки не были удалены естественным отбором? Интересные новые данные об этом можно найти в книге Евгения Кунина «Логика случая», которую мы уже рекомендовали нашим читателям. Есть, например, обоснованное мнение, что интроны появились в результате бомбардировки генома древней клетки обрывками генов симбиотических бактерий, от которых произошли митохондрии. Они жили в хозяйской клетке, в ней же и умирали, их ДНК попадала в цитоплазму... Если это предположение верно, то основные признаки эукариотической клетки — митохондрии, прерывистая структура генов, а затем и само ядро — защита от генной бомбардировки — возникли в тесной связи друг с другом, как фрагменты одной истории.
Так или иначе, современные эукариоты научились извлекать пользу из экзон-интронного строения генов, вставки оказались не столь уж бессмысленными. Кодирующие участки могут соединяться разными способами (альтернативный сплайсинг), и благодаря этому, например, у человека 23 000 генов кодируют 100 000 белков. Внутри интрона может находиться ген другого белка. Кроме того, если участок ДНК не кодирует белок, это не значит, что он бесполезен. На матрице ДНК синтезируется РНК, которая, в свою очередь, становится матрицей для белка, но из «ненужных» участков мРНК, соответствующих интронам, могут выщепляться так называемые некодирующие РНК — важные сигнальные молекулы.
В своей лекции Филипп Шарп рассказал о «Биогене» (сегодня «Biogen Idec») — одной из старейших в мире биотехнологических компаний. Она основана в 1978 году, причем Шарп был одним из сооснователей, а до 2009 года — одним из директоров. Во второй половине ХХ века, когда появились методы, позволяющие манипулировать «самой главной молекулой» — разрезать в определенных местах и ковалентно сшивать фрагменты ДНК, внедрять новые гены в клетки бактерий (а потом и эукариот), секвенировать, то есть «читать» последовательности ДНК, а при необходимости и синтезировать новые молекулы ДНК, — появилось и понятие биотехнологии, перепрограммирования живого. Как обычно бывает, фантасты
ифутурологи летели далеко впереди эксперимента — и ген- но-модифицированных людей с неограниченными возможностями, и монстров-мутантов обсудили еще тогда, когда в реальности подавляющее большинство экспериментальных объектов составляли бактерии и клетки в культуре. Но этого хватило, чтобы изменить облик медицины.
Сегодня в компании работают около 8000 человек. Она разрабатывает и производит препараты для лечения гепатитов В
иС, рассеянного склероза, ревматоидного артрита, онкологических заболеваний, гемофилии. Штаб-квартира «Biogen Idec» в США находится недалеко от МТИ, в кластере хайтековских компаний, среди не менее выдающихся соседей — от лидеров фармацевтики «Glaxo» и «Pfizer» до «Yahoo» и «Google».
Филипп Шарп рассказал слушателям о трех революциях в биологии. Первая, молекулярно-биологическая, началась
siРНК
Конъюгат
двухцепочечной
Лиганд РНК и лиганда к рецепторам
на поверхности гепатоцитов
Рецепторы
Белокмишень
Рецепторы
возвращаются на мембрану
Эндосома
мРНК
Ядро
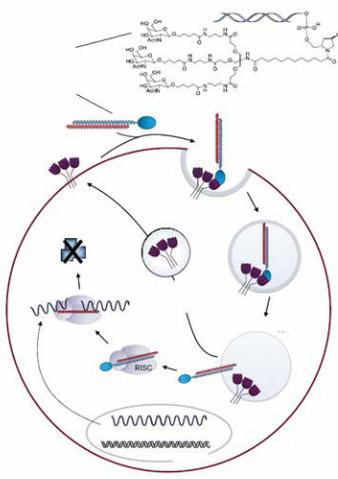
Чтобы малая интерферирующая РНК попала в клетки печени, ее сшивают со специально сконструированным лигандом, который избирательно связываетсясрецепторамигепатоцитов.Клеткапоглощаетэтуконструкцию и высвобождает РНК. Белковый комплекс RISC выделяет из двухцепочечной РНК одноцепочечный участок, который связывается с мишенью — мРНК. Синтез вредного белка прекращается
4

открытием двойной спирали в 1953 году. Второй революцией стало рождение геномики (или появление методов секвенирования ДНК — это именно тот случай, когда новую науку породили новые методы). Стартовой точкой тут можно считать конец 80-х, когда началась подготовка к проекту «Геном человека». И наконец, середина 2000-х — революция конвергенции, как назвал ее докладчик: объединение биологии с инженерией, математикой, физикой. Геномы живых организмов — это огромные объемы данных, и, чтобы извлечь из них пользу, нужно было научиться с ними работать; так появились на свет биоинформатика, системная биология. Новые технологии позволяют манипулировать объектами на клеточном и молекулярном масштабах. Математические методы приносят новые знания о структуре и функции биомолекул. Создаются новые орудия для исследований, такие, как флуоресцентные белки (GFP и его многочисленные родственники), а эти орудия, в свою очередь, позволяют делать то, что ранее считалось невозможным. Филипп Шарп привел слова нейрофизиолога Сюзан Хокфилд, шестнадцатого президента МТИ: «Физики дали инженерам электрон, и они сделали IT-революцию. Биологи дали инженерам ген, и вместе они создадут будущее».
Очередным шагом в будущее стало открытие РНКинтерференции в 1998 году (Нобелевская премия по физиологии или медицине 2006 года, Эндрю Файр и Крейг Мелло). Можно сказать, что оно перевернуло наши представления о месте РНК в живой клетке. Точно так же, как помимо белковферментов были найдены РНК-ферменты, или рибозимы, — сигнальные молекулы, регулирующие активность генов, тоже могут иметь РНК-природу. В частности, специальные малые РНК могут взаимодействовать с матричной РНК, образовывать с ней двухцепочечный участок и вызывать ее деградацию. Нет матрицы — нет и белка, который с нее считывается, даже если ген активен (см. «Убить почтальона» в «Химии и жизни», 2006, № 11,). Подобный метод регуляции называют генным нокдауном, по аналогии с генным нокаутом, при котором изменяется сама последовательность гена. Как и в боксе, в молекулярной генетике нокдаун послабее нокаута (активность гена может быть выключена не полностью), и после исчезновения моле- кулы-регулятора ген «очнется».
За последние десятилетия произошел настоящий взрыв в мире РНК. Когда мы учились в школе, то могли назвать три основных вида РНК в клетке — матричные, рибосомные и транспортные, а отличники, хорошо подумав, вспоминали еще про удаленные интронные участки. Сегодня некодирующие РНК (их больше не называют «малыми», потому что среди них обнаружились очень даже большие; эпитет «малые» сохранили за собой только некоторые разновидности) — это обширная группа, включающая около десятка различных классов молекул. И у каждого класса, у каждой молекулы — своя роль. Действительно, без компьютеров в этом лабиринте взаимодействий не разобраться.
Открытие РНК-интерференции вызвало к жизни новые подходы в терапии. Мишенью фармпрепаратов могут быть не белки, а инструкции по их «приготовлению», активными же веществами, выключающими вредные для больного гены, — молекулы РНК.
Есть заболевания, которые объединяют под общим названием амилоидоз, или амилоидная дистрофиия; они сопровождаются образованием и накоплением специфических белково-полисахаридных комплексов — амилоидов. Наиболее известный амилоидоз связан с болезнью Альцгеймера, но есть и другие. Например, амилоидоз TTR (ATTR) вызван мутациями в гене транстиретина — белка, транспортирующего гормон тироксин и ретинол (витамин А). Это заболевание наследственное и возрастное (проявляется в 40—60 лет); различными формами ATTR страдают «всего» около 50 000 человек в мире. Болезнь поражает нервную систему и сердце и обычно приводит к летальному исходу. Транстиретин синтезируется в печени, поэтому один из возможных способов
Репортаж
спасти пациента — пересадка печени донора. Метод, мягко говоря, радикальный, на его фоне почти любая альтернатива будет иметь успех.
Подходы к лечению ATTR ищет американская компания «Alnylam Pharmaceuticals», основанная в 2002 году (Филипп Шарп входит в ее совет директоров). Это компания сделала ставкувпоискахновыхлекарствименнонаРНК-интерференцию. Патизиран (ALN-TTR02) — препарат для лечения семейной амилоидной полиневропатии, одной из форм ATTR — содержит малые интерферирующие РНК (small interfering RNA, или siRNA) кмРНКтранстиретина.Вконце2013годаонпрошелвторуюфазу клинических испытаний, теперь началась третья.
Терапевтическую РНК вводят в организм не в чистом виде. РНК — полярная молекула, несущая отрицательный заряд, и, чтобы она могла преодолеть мембрану клетки, ее упаковывают
влипидные наночастицы (как раз таков патизиран). Состав упаковки обеспечивает адресную доставку. Скажем, при лечении ATTR нужно, чтобы siРНК попадала в клетки печени — гепатоциты. В большинстве других тканей ген транстиретина не активен, иными словами, нет мРНК транстиретина, а значит, и препарат там бесполезен. Другой вариант обеспечения адресности — siРНК соединяют с молекулой, которую распознают рецепторы, характерные для гепатоцитов. Такой препарат можно будет вводить даже подкожно!
Среди других болезней, РНК-препараты против которых разрабатывает «Alnylam», — гемофилия, бета-талассемия, инфекция вирусом гепатита В. Перспективная тема — участие некодирующих РНК в развитии онкологических заболеваний. Известно, например, что при раке зачастую ослабевает регуляция с участием микроРНК (miRNA).
Нельзя сказать, что будущее биологии и медицины видится докладчику безоблачным. Он привел оценку венчурной компании «The Burrill & Co.», которая активно инвестирует в науки о жизни. Время, затраченное на исследование и разработку лекарства, по сравнению с 80-ми годами ХХ века в 2010 году увеличилось вдвое, с семи до 15 лет в среднем, а затраты — впятеро, с 200 миллионов долларов до примерно миллиарда. Приходится повышать цену на лекарство, чтобы успеть окупить затраты и получить прибыль, пока эксклюзивные права на препарат еще у разработчика. Кому приходилось искать в Интернете новейшие лекарства от тяжелой болезни, тот знает: вслед за эйфорией («Надо же, лекарство существует!») часто приходит разочарование («...Но оно по карману не каждому миллионеру»). Есть ли выход из этой ситуации? Возможно, он
всовершенствовании методов исследования. Подешевело же секвенирование ДНК: еще совсем недавно геном человека читали усилиями всей мировой науки, а теперь реклама в социальных сетях предлагает любому желающему «исследовать ваш геном».
Таким образом, оба доклада подтверждают: не стоит беспокоиться, что после нобелевского открытия вам нечем будет заняться. Настоящая работа только тогда и начнется.
«Химия и жизнь», 2014, № 7, www.hij.ru
5

Умные ножницы для ДНК
Кандидат биологических наук
Д.Э.Джагаров
Бактерии и археи не имеют такой иммунной системы, как мы с вами,
— это в принципе невозможно, у нас за иммунитет отвечает множество клеток, а бактерия существо одноклеточное. Однако бактерии не беззащитны против вирусов-бакте- риофагов и других патогенов. Система элементов геномной последовательности, называемая CRISPR, и ассоциированные с ней белки Cas помогают им распознавать и уничтожать чужеродный генетический материал.
В 1987 году в геноме кишечной палочки Escherichia coli
был обнаружен загадочный участок, состоящий из многочисленных повторов (A.Nakata et al., «Journal of Bacteriology», 1989, 171, 3553—3556). Функция этого участка, названного CRISPR-локусом (произносится «криспер»), долгое время оставалась загадочной. Но в 2005 году сразу три группы сообщили, что разделяющие эти повторы промежуточные последовательности зачастую бывают идентичны последовательностям, найденным в геномах бактериофагов и в плазмидах. (Плазмиды — кольцевые молекулы ДНК, путешествующие из одной бактериальной клетки в другую. С их помощью бактерии обмениваются полезными генами, например устойчивости к антибиотикам, но, с другой стороны, некоторые плазмиды обладают чертами «комплекса эгоистичных генов» — используют бактериальную клетку как копирующее устройство, фактически паразитируя на ней.)
Эти данные позволили предположить, что локус CRISPR — часть ранее не известного механизма, который предназначен для защиты бактерий и архей от инфекций. Дальнейшая судьба защитной системы CRISPR/Cas еще интереснее — в 2012—2013 годы на ее основе были изобретены высокоточные инструменты для редактирования генов, а также для управления их активностью. И, судя по всему, это только начало ее карьеры в современной биотехнологии.
Коллекция трофеев
Название локуса CRISPR — фактически его словесный портрет: «скопление разделенных регулярными промежутками коротких симметричных повторов» (clustered regularly interspaced short palindromic repeats). Описание абсолютно верное: короткие повторы чередуются с неповторяющимися последовательностями, как в детском стишке Даниила Хармса: «Чиж-судомойка, чиж-поломойка, чиж-огородник, чижводовоз...» — только вместо «чижа» палиндром, одинаково читающийся с обоих концов. (О палиндромах в поэзии и в ДНК см. статью Б.Я.Бейнфеста в этом же номере). В каждом конкретном локусе все повторы практически одинаковы и имеют длину от 24 до 48 пар нуклеотидов. Промежутки также примерно одинаковы по длине (21—72 п. н.), но весьма вариабельны по последовательности.
Так вот, эти промежуточные последовательности, или спейсеры, часто происходят из плазмид и фагов. Бактерии, выжившие после атаки фага, в результате так называемой адаптации пополняют свой CRISPR за счет спейсеров, идентичных небольшим «трофейным» участкам ДНК фага (R.Barrangou et al. & P.Horvath, «Science», 2007, 315, 1709—1712). А значит, спейсерные последовательности массива CRISPR — это
Фото: Андрей Константинов
6
а |
Повтор |
Спейсер Повтор |
ДНК
б |
Лидирующая |
|
последовательность |
||
|
||
|
Массив CRISPR |
|
в |
Гены, кодирующие |
|
белки семейства Cas |
||
|
Ген tracr |
|
|
РНК |
|
|
г |
1
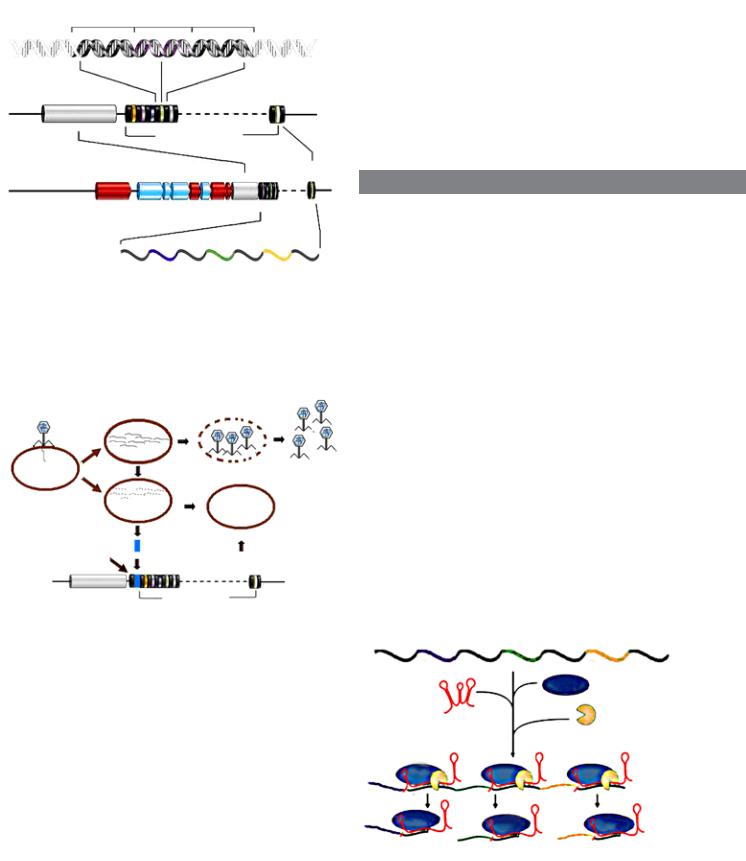
Структура локуса CRISPR):
а — строение участка CRISPR; б — массив CRISPR и лидерная последовательность; в — те же и «соседи» — гены, кодирующие tracrРНК, и гены белков семейства Cas; в — молекула РНК, возникшая при транскрипции массива CRISPR; как и в самом CRISPR, в ней чередуются повторы и разнообразные участки, комплементарные участкам геномов, нападавших на бактерию плазмид и фагов (по: «Molecular Сell», 2010, 37, 7—19)
Размножение фагов Гибель клетки
Клетка
инфицирована
фагом
|
Деградация |
Клетка |
|
|
|
с новым |
|
||
|
ДНК фага |
|
||
|
спейсером |
|||
|
|
|
||
|
|
|
|
Клетка осталась |
Образование нового |
|
Фрагмент ДНК фага |
жива и защищена |
|
повтора удвоением |
|
Вставка нового |
|
CRISPR |
старого |
|
|
|
|
|
спейсера |
|
|
|
|
|
|
|
|
Лидирующая |
Массив CRISPR |
|
||
последовательность |
|
|||
|
|
|
||
2
Пополнение коллекции фрагментов чужеродной ДНК в системе CRISPR-Cas. После расщепления ДНК фага или плазмиды «трофейный» фрагмент вставляется в локус CRISPR в качестве спейсера. Затем он будет использован как шаблон для создания малых молекул crРНК. С помощью комплексов crРНК и белка Cas9 бактерия защищается от инфекций
память бактерии-хозяина о вирусных инфекциях и встречах
синородным генетическим материалом.
Клокусу CRISPR примыкает лидерная последовательность (длиной до 550 п. н.), а также CRISPR-ассоциированные гены (CAS), кодирующие белки семейства Cas. Лидерная последовательность играет роль промотора — стартовой площадки,
скоторой начинается транскрипция массива CRISPR, то есть «переписывание» последовательности на РНК (рис. 1). Кроме того, возможно, что лидерная последовательность узнает белки, участвующие во встраивании новых спейсеров: как новые участки ДНК от нападавших микроорганизмов, так и новые повторы обычно встраиваются на границе между ней и CRISPR (рис. 2).
Длинная молекула РНК, которая образуется после транскрипции CRISPR, разрезается на фрагменты. Они называются CRISPR РНК (crРНК), причем каждый содержит спейсер и часть повтора. В процессе нарезки участвует небольшая РНК, комплементарная повторам, — tracrРНК: она служит «наводчицей» для белка Cas9, к которому подсоединяется фермент
Проблемы и методы науки
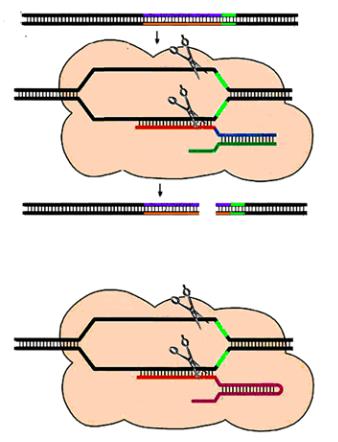
РНКаза III, нарезающий длинную молекулу РНК. Исполнив свою роль, РНКаза III уходит. Остается комплекс двух молекул crРНК и tracrРНК с белком Cas9. Этот белок — нуклеаза, то есть фермент, разрезающий ДНК. Сам по себе Cas9 неактивен, но при связывании с tracrРНК его трехмерная структура изменяется, и он приобретает способность взаимодействовать с ДНК-мишенью — защелкивается на ее двух нитях, превращаясь в нечто подобное замку застежки-«молнии».
А затем комплекс crРНК/tracrРНК-Cas9 начинает расправу с врагом: спейсерные участки crРНК находят комплементарные им участки вражеских нуклеиновых кислот и приносят к ним активированные Cas-белки, те вызывают их расщепление и последующую деградацию. (Этот механизм отчасти напоминает РНК-интерференцию эукариот, см. статью «Вид с вершины» в этом же номере.) Таким образом, crРНК выполняет роль проводника, направляющего нуклеазу к цели, за что она и получила свое другое название: «РНК-гид» (рис. 3).
Чтобы белки Cas узнали и затем расщепили опознанную РНК-гидом последовательность ДНК, непосредственно после сайта-мишени должна находиться короткая (от трех до девяти нуклеотидов) последовательность, называемая PAM — protospacer adjacent motif. Таким образом, атакуются только те участки вражеской ДНК, рядом с которыми находятся эти короткие последовательности. У разных видов бактерий РАМ различаются. Если участок ДНК комплементарен crРНК, но рядом с ним нет РАМ, то комплекс crРНК/tracrРНК-Cas9 его не распознает. У этой особенности есть биологическое объяснение,покаэкспериментальнонеподтвержденное.Деловтом, что в локусе CRISPR наряду со спейсерами, комплементарны-
Молекула РНК-предшественника (pre-crРНК)
|
|
Cas9 |
|
tracrРНК |
|
РНКаза III |
|
|
|
||
Расщепляющий |
|
|
|
комплекс |
|
tracrРНК |
|
|
|
||
Cas9 |
|
|
|
Cas9 |
|
tracrРНК |
|
Cas9 |
Cas9 |
||
|
|||
crРНК |
crРНК |
crРНК |
|
|
3
ТакобразуютсякомплексыcrРНК/tracrРНК-Cas9—оружиеиммуннойсистемы прокариот(по:«Nature»,2011,471,7340,602—607).ФерментРНКазаIIIибелок Cas9распознаютtracrРНК,комплементарнуюпоследовательностямповторов в цельной молекуле РНК-предшественника (pre-cr РНК). Расщепление, по всей видимости,происходитвсерединеповтора.ОбразуютсяcrРНК,каждаяиз42-ну- клеотидов: 22 «хвостовых» — остаток повтора, остальные 20 — уникальный спейсерный фрагмент, который помогает белку Cas9 искать инородную ДНК
«Химия и жизнь», 2014, № 7, www.hij.ru
7
ми инородной ДНК, встречаются и спейсеры, нацеленные на собственную ДНК бактерии. И таких спейсеров-«самоубийц» немало—порядка20%.Геныэти,однако,неразрушаются,воз- можно, из-за отсутствия рядом с ними PAM («PLoS Genetics», 2013, 9(9), e1003742, doi: 10.1371/journal.pgen.1003742). Роль спейсеров, комплементарных «своей» ДНК, предстоит еще выяснить.Возможно,бактериясихпомощьюрегулируетнерасщепление генов, а их транскрипцию, используя другие белки.
Интересно, что если заразить клетки неизвестным им фагом, то лишь три процента выживших бактерий удлиняют свою CRISPR-кассету на один спейсер, соответствующий новому фагу. Если же клетки заразить фагом, ДНК которого хотя бы отчасти сходна с каким-либо спейсером в CRISPR-кассете, то адаптация идет гораздо активнее. От 50% до 90% популяции пополняет свои CRISPR участками генома этого фага, и выживаемость возрастает в десятки раз. Этот процесс был назван праймингом(«NatureCommunications»,2012,3,945,doi:10.1038/ ncomms1937; не столь уж частый случай, когда в примечаниях к статье можно увидеть московские институты и российские гранты: один из ведущих авторов этой и предыдущей публикации — доктор биологических наук К.В.Северинов). Возможная причина в том, что после опознания белком Cas9 стартовой площадки—PAM—сДНК-мишеньюсначаласвязываетсялишь небольшойучастокспейсера(6—12нуклеотидов),называемый затравкой, и лишь затем остальная часть спейсера. Если на участке затравки комплементарность строго соблюдается, то на остальной части спейсера возможны отклонения, иногда до 3—5 п. н. Бактерии эта неточность на пользу, благодаря ей она может успешно опознать фаги-мутанты и быстро настроиться напоражениеновыхцелей.Авотученымпредстоитразработать методы, повышающие точность распознавания, — в работе «генного скальпеля», о котором пойдет речь дальше, всякую приблизительность необходимо исключить. Возможным выходомможетстатьиспользованиеcrРНКсусеченнойспейсерной частью («Nature Biotechnology», 2014, doi:10.1038/nbt.2808).
Напоследок отметим, что у некоторых фагов найдены гены, способные ингибировать систему CRISPR-Cas, и они также весьма интересны в плане практического применения.
Для чего и как используют технологии CRISPR-Cas9
Использование адаптирующейся иммунной системы бактерий началось еще в 2007 году, когда фирма «Дюпон» создала устойчивые к вирусной инфекции бактериальные штаммы для производства продуктов питания (в этих опытах бактерий вакцинировали разрушенными вирусами). Однако подлинный бум начался в конце 2012 года, после того, как Мартин Джинек сумел объединить tracrРНК и crРНК в одну цельную молекулу РНК — теперь ее называют РНК гидом, или sgРНК, от англ. single-guide RNA — и изобрел вектор для клонирования этой РНК (M.Jinek, K.Chylinski, I.Fonfara et al. «Science», 2012, 337, 816—821, doi: 10.1126/science.1225829).
Оказалось, что такая синтетическая sgРНК образует комплекс с белком Cas9 ничуть не хуже, чем tracrРНК и crРНК, а затем находит комплементарные ДНК и правильно ориентирует Cas9, чтобы создавать в них двухцепочечные разрывы (рис. 4). Причем может сделать это именно в том участке, в каком поже- лаетисследователь,—достаточновключитьвsgРНКфрагмент, комплементарный этому участку. Конечно, выбрать надо такую последовательность, которая встречается только в нужном вам месте и не повторяется там, где разрезы не нужны. Иначе экспериментатор окажется в положении неумелого пользователя, который скомандовал текстовому редактору найти и удалить из рассказа имя «Оля» и с удивлением увидел, что пострадали также «Коля», «поля» и «тополя». После того, как разрез в нужном месте сделан, клетка сама стремится его ликвидировать с помощью процесса, называемого репарацией.
5’ |
|
|
|
3’ |
3’ |
|
|
РАМ |
5’ |
а |
|
|
|
|
Cas9 |
|
|
|
|
|
RuvC |
|
|
|
|
|
|
|
|
ДНК-мишень |
|
|
РАМ |
|
5’ |
|
|
|
3’ |
3’ |
|
HNH |
|
5’ |
б |
|
РАМ |
|
|
|
|
|
||
|
5’ |
Спейсер |
crРНК |
|
|
|
|
|
|
|
|
|
tracrРНК |
|
|
|
|
3’ |
|
5’ |
|
|
|
3’ |
|
|
|
5’ |
|
3’ |
|
|
|
|
в |
|
|
|
|
|
Cas9 |
RuvC |
|
|
|
|
|
|
|
ДНК-мишень |
|
|
РАМ |
|
5’ |
|
|
|
3’ |
3’ |
|
HNH |
|
5’ |
г |
|
РАМ |
|
5’
Цельная молекула РНК-гида
3’
4
Принцип работы Cas9 в природе (с участием crРНК и tracrРНК) и в составе искусственной конструкции, где одна молекула sgРНК заменяет две.Вверху: двухцепочечная ДНК-мишень подвергается точному разрезанию: Cas9 распознает мишень с помощью crРНК, а та удерживается в молекуле Cas9 благодаря посредничествуtracrРНК.Местаразрезовобозначеныножницами.RuvCиHNH
— домены (части) Cas9; оба они обладают нуклеазной активностью, каждый разрезаетодну издвухнитейДНК.Внизу—тотжепроцесссучастиемцельной молекулы sgРНК, созданной усилиями ученых; она взаимодействует и с Cas9, и с ДНК-мишенью
Как внедрить в клетку высокоточный генный скальпель, состоящий из sgРНК и Cas9? Для этого можно использовать так называемый all-in-one CRISPR-Cas9 cloning vector — кольцевую молекулу ДНК, которая кодирует sgРНК и матричную РНК белка Cas9. Такие векторы, с возможностью вставить в нужное место участок, комплементарный вашей мишени, уже предлагают биотехнологические фирмы. Естественно, кроме кодирующих последовательностей, там будут и управляющие, которые подскажут клетке, откуда надо считывать РНК.
Купив такой вектор и вставив в него «свою» последовательность, исследователь нарабатывает его в необходимом количестве методом молекулярного клонирования. Вектор внедряют в клетки специального лабораторного штамма кишечной палочки, затем растят бактерий на питательной среде, причем они многократно копируют вектор (это и называют молекулярным клонированием). Копируют, но «не читают», sgРНК и Cas9 в бактериальных клетках не синтезируются — командные сигналы в векторе адресованы другому организму. Потом вектор выделяют из бактерий и трансформируют им клетки, геном которых мы хотим отредактировать. Вот в них-то и начнут синтезироваться РНК-гид и Cas9.
Это изобретение генных инженеров еще в начале 2013 года доказалосвоюэффективностьначеловеческихклеткахвкультуре. После инфицирования клетки CRISPR-Cas9-вектором в ней действительно появился комплекс Cas9-sgРНК, который затем проникал в ядро и находил соответствующие последовательности ДНК (eLife; 2:e00471, doi: 10.7554/eLife.00471, «Nature Biotechnology», 2013, 31, 230—232).
8
