
- •VII группа – в главной – инертные газы; побочная – триады элементов.
- •Химическая связь и строение молекул. Типы кристаллических решёток.
- •Химическая кинетика. Скорость химических реакций. Энергия активации, активные молекулы. Закон действующих масс, закон Ван-Гоффа, катализ.
- •Химическое равновесие: кинетический и термодинамический подход. Константа равновесия. Принцип Ле-Шателье.
- •Свойства разбавленных растворов неэлектролитов. Законы Вант-Гоффа и Рауля.
- •Электролиз растворов солей:
- •1.Катодные правила:
Электролиз растворов солей:
1.Катодные правила:
а). если Ме в ряду напряжения Ме находится правее Н2, то на Катоде(-) происходит восстановление катиона Ме до свободного состояния.
б). если Ме в ряду напряжения находится левее Al включительно, то на К. происходит восстановление молекулы воды с выделением водорода и гидрокси-группы: (рН>7)
K(-) 2H2O + 2e-> Н2 + 2OH-
в).Если Ме в ряду напряжения находится между Al и Н2, то сравниваются стандартные электродные потенциалы Ме с СЭП водорода, который в кислой среде равен 0 В, а при нейтральной среде – -0,41 В.
-если СЭП Ме меньше СЭП водорода, то на К. происходит восстановление Н2 до свободного состояния. K(-) 2Н+ + 2е -> Н2
-Если СЭП Ме больше СЭП водорода, то на К. происходит восстановление катиона Ме о свободного состояния. K(-) Ме+ +е ->Ме0
2.Анодные правила.
а). Если соль бескислородсодержащая, то на А. происходит окисление аниона до свободного состояния.
б).Если соль кислородсодержащая, то на на А. происходит окисление молекулы воды с выделением кислорода O2 и катиона Н+ : А(+) 2H2O - 4e -> O2 + 4Н+
Электролиз расплавов солей.
1.Катодные правила:
Вне зависимости от расположения Ме в электрохимическом ряду напряжения на К. происходит восстановление катиона Ме до свободного состояния. K(-) Ме+ +е ->Ме0
2.Анодные правила:
а). Если соль без кислорода, то на А. будет окисляться анион до свободного состояния.
б). Если соль с кислородом, то на А. происходит окисление аниона до соответствующего оксида с выделением O2.
Коллоидные растворы.
Понятие дисперсной системы, классификация и виды дисперсных систем. Коллоидные растворы. Золи, гели. Получение коллоидных растворов. Устойчивость коллоидных растворов. Строение мицеллы. Свойства коллоидных растворов. Коагуляция.
Дисперсные системы – это системы, в которых одно вещество в виде мельчайших частиц распределено в другом веществе.
В котором распределено – дисперсная среда. Которое в мельчайших частицах – дисперсная фаза.
По размерам дисперсной фазы различают:
1.грубодисперсные – 10-5см < a
Д (степень дисперсности) = 1/a см-1
Смысл: сколько частиц может уместиться в единице длины.
Д < 10-5см
2.Коллоидные – 10-7 < a < 10-5см
10-7 < Д < 10-5
3.истинные растворы – a < 10-7 см
Д < 10-7 см
К дисперсным системам относятся обычные (истинные) растворы, коллоидные растворы, а также суспензии и эмульсии. Они отличаются друг от друга, прежде всего размерами частиц, т.е. степенью дисперсности, а также состояниями дисперсионной среды и дисперсионной фазы.
Суспензия (взвесь) – это дисперсная система, в которой дисперсной фазой является твёрдое вещество, а дисперсионной средой – жидкость, причём твёрдое вещество практически нерастворимо в жидкости. Например, масляные краски, взвесь гидроксида кальция.
Эмульсии – это дисперсные системы, в которых и ДФ и ДС являются жидкостями, взаимно не смешивающимися. Например, молоко, водоэмульсионная краска, майонез.
Коллоидные растворы – это высокодисперсные системы (диаметр частиц от 1 до 500нм) с жидкой дисперсной средой. Коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.
Коллоидные растворы = золи
Гель – ДС твёрдая, а ДФ жидкая. Например, желе, желатин, косметические гели. Гели – связанная коллоидная система.
При определённых условиях (понижение температуры) золи утрачивают текучесть и переходят (тиксотропия) в гели. При повышении температуры гели становятся золями (синерезис).
Лиофильные – обратимые коллоиды.
Лиофобные – необратимые коллоиды.
Получение коллоидных растворов.
Методы основаны либо на дроблении крупных (методы диспергирования), либо на укрупнении мелких (методы конденсации) частиц. И диспергирование, и конденсация могут протекать как без участия химических или физико-химических процессов, так и с их участием, поэтому условно выделяют физические и химические методы получения дисперсных систем.
Диспергирование проводят с использованием коллоидных и шаровых мельниц, с помощью электричества, ультразвука, вибрации (физические методы) и пептизации (химический метод). Пептизация – переход частиц осадка снова в раствор.
Физические конденсационные методы основаны на создании в гомогенной системе пересыщения путём изменения температуры или состава растворителя. Химические конденсационные методы заключаются в проведении реакций, заканчивающихся образованием нерастворимых веществ. Реакции проводят таким образом, чтобы скорость образования частиц дисперсной фазы превышала скорость их роста, так как от соотношения скоростей этих процессов зависит степень дисперсности получаемой системы. Такое условие достигается подбором концентраций реагентов, температурного режима, введением ингибиторов роста кристаллов. Для получения золей методом химической конденсации можно использовать ОВР и обменные реакции.
Коллоидные растворы, полученные одним из таких способов, содержат примеси растворённых низкомолекулярных веществ и грубодисперсных частиц, наличие которых может отрицательно сказываться на свойствах золей, снижая их устойчивость.
Для очистки коллоидных растворов от примесей используют фильтрацию, диализ, электродиализ, ультрафильтрацию.
Фильтрация основана на способности коллоидных частиц проходить через поры обычных фильтров. При этом более крупные частицы задерживаются. Фильтрацию используют для очистки коллоидных растворов от примесей грубодисперсных частиц.
Диализ – удаление с помощью мембран низкомолекулярных соединений из коллоидных растворов и растворов высокомолекулярных соединений. При этом используют свойства мембран пропускать молекулы и ионы малого размера и задерживать коллоидные частицы и макромолекулы. Малые молекулы и ионы диффундируют через мембрану в растворитель и при его достаточно частой замене почти нацело удаляются из диализуемой жидкости. В качестве мембран для диализа применяют различные плёнки: естественные (бычий или свиной мочевой пузырь, плавательный пузырь рыб) и искусственные (из целлофана, желатина и других материалов).
Электродиализ используют для увеличения скорости диализа низкомолекулярных электролитов. С этой целью в диализаторе создают постоянное электрическое поле с разностью потенциалов. Проведение диализа в электрическом поле позволяет ускорить очистку коллоидного раствора в несколько десятков раз.
Ультрафильтрацию применяют для очистки систем, содержащих частицы коллоидных размеров (золи, взвеси бактерий и вирусов) . В основе метода лежит продавливание разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы низкомолекулярных веществ. В определённой степени ультрафильтрацию можно рассматривать как диализ под давлением. Ультрафильтрацию широко используют для очистки воды, белков, НК, ферментов, а также в микробиологии для определения размеров вирусов и бактериофагов.
Устойчивость коллоидных растворов.
Различают седиментационную и агрегативную устойчивость.
Седиментационная устойчивость – это устойчивость частиц к оседанию под действием силы тяжести; седиментационно неустойчивые системы с течением времени расслаиваются: легкие частицы всплывают на поверхность, а тяжелые – оседают на дно.
Агрегативная устойчивость – это способность дисперсных систем сохранять размер частиц и их индивидуальность. В агрегативно неустойчивых системах проходят процессы укрупнения частиц.
Коллоидные растворы являются седиментационно устойчивыми, т.к. частицы их дисперсных фаз принимают участие в броуновском движении. Однако они являются агрегативно неустойчивыми. Это связано с большой удельной поверхностью дисперсной фазы, и, как следствие, большим избытком энергии Гиббса на границе раздела фаз.
Потеря коллоидным раствором агрегативной устойчивости называется коагуляцией. Коагуляция – это процесс укрупнения коллоидных частиц, приводящий к разрушению коллоидного раствора.
До тех пор, пока процессы агрегации не приводят к нарушению седиментационной устойчивости (частицы становятся крупнее, но по размерам не выходят за границу коллоидно-дисперсного состояния), внешне коагуляция может проявляться только в изменении цвета золя. По мере укрупнения частиц система начинает постепенно терять и седиментационную устойчивость – появлявляется помутнение, а затем выпадает осадок.
Особенно золи чувствительны к добавлению электролитов, которые уменьшают заряд коллоидных частиц за счёт сжатия диффузного слоя. Электролитическая коагуляция золей проявляется только при достижении некоторой критической концентрации ионов в золе, называемой порогом коагуляции. Величину, обратную порогу коагуляции, называют коагулирующей способностью.
γ = 1/ n6 – порог коагуляции обратно пропорционален заряду иона, имеющего противоположный знак по сравнению с коллоидной частицей в шестой степени.
Процесс дезагрегации частиц, обратный процессу коагуляции называют пептизацией. Пептизация тем более вероятна, чем меньше времени прошло с момента коагуляции. Это объясняется тем, что коагулят (осадок) «стареет», частицы фазы срастаются и коагуляция принимает необратимый характер.
Строение мицелл.
Структурную единицу коллоидного раствора называют мицеллой. Множество формульных единиц (до нескольких тысяч), соединяясь вместе образуют агрегат. Ионы, сообщающие поверхности агрегата определённый заряд, называют потенциалопределяющими ионами. ПИ удерживаются на поверхности агрегата за счёт межмолекулярных взаимодействий. Агрегат вместе со слоем ПИ принято называть ядром коллоидной частицы. Противоионы имеют знак заряда, противоположный ПИ.
На противоионы со стороны ядер коллоидных частиц действует электростатическое притяжение. В то же время противоионы могут принимать участие в тепловом движении как кинетически самостоятельные единицы.
Таким образом, одни противоионы достаточно прочно связаны с поверхностью ядер, вместе с ПИ они образуют адсорбционный слой. Другие противоионы образуют диффузный слой. Агрегат вместе с адсорбционным слоем образует гранулу мицеллы. Знак заряда гранулы определяется знаком заряда ПИ, а размер заряда – толщиной диффузного слоя. Гранула и противоионы диффузного слоя образуют мицеллу. Мицелла электронейтральна.
Свойства коллоидных растворов.
Золи обладают рядом специфических свойств, так, золи в зависимости от размеров частиц могут иметь различную окраску. Например, золи золота могут быть синими, фиолетовыми, вишнёвыми, рубиново-красными.
В отличии от истинных растворов для золей характерен эффект Тиндаля, т.е. рассеяние света коллоидными частицами. При пропускании через золь пучка света появляется светлый конус, видимый в затемнённом помещении. Так можно распознать, является данный раствор коллоидным или истинным.
Одно из важных свойств золей является то, что их частицы имеют электрические заряды одного знака. Благодаря этому они не соединяются в более крупные частицы и не осаждаются. При этом частицы одних золей имеют отрицательный заряд (металлов, кремниевой кислоты - силикагель), а других положительный (оксидов металлов). Возникновение заряда объясняется адсорбцией коллоидными частицами ионов из раствора.
Комплексные соединения.
Координационная теория Вернера. Центральный ион, лиганды, внутренняя и внешняя координационные сферы, координационное число. Диссоциация комплексных соединений, константа нестойкости. Классификация комплексных соединений, номенклатура.
Комплексные соединения - …
- наличие центрального иона;
- наличие донорно-акцепторной связи;
- устойчивость комплексного иона (как в кристалле, так и в растворе).
Координационная теория Вернера (1893г.).
1.«О наличии побочной валентности»: коль скоро насыщенные молекулы соединятся друг с другом, то у них появляется дополнительная валентность.
2.Полодение о координации: Атом стремится реализовать все свои соединительные способности (окружить себя другими частицами) – это свойство – координация.
Согласно теории Вернера есть какой-либо центральный атом, или ион (чаще всего он имеет + заряд) – комплексообразователь, который координирует вокруг себя другие частицы.
Лиганды – определённое число частиц (либо 0, либо + или – заряд - ионов или нейтральных молекул), которые прочно связаны с комплексообразователем.
Комплексообразователь и лиганды образуют внутреннюю координационную сферу. Наиболее типичными комплексообразователями являются катионы d-элементов.
Внешняя координационная сфера – либо анион, либо катион.
Эти сферы вместе и образуют комплексное соединение.
Число лигандов,
непосредственно связанных с
комплексообразующим ионом, называется
координационным числом.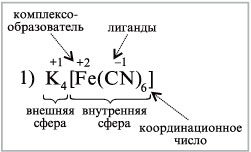
КЧ – чётные значения (не больше 10!).
Между центральным атомом и лигандами донорно-акцепторная связь; между сферами – ионная. Дентантность – это количество донорных атомов, входящих в состав лигандов (неподелённые электронные пары): монодентантные (1 донорный атом) и полидентантные (более 1 донорного атома).
В состав комплексных солей входят сложные (комплексные) ионы (в формулах они заключаются в квадратные скобки), которые и отщепляются при диссоциации. В свою очередь сложные (комплексные) ионы в очень малой степени подвергаются дальнейшей диссоциации. Таким образом, комплексные соли при диссоциации сначала отщепляют комплексные ионы, которые затем подвергаются вторичной диссоциации как слабые электролиты.
Прочность
комплексного иона характеризуется его
константой диссоциации, называемой
константой нестойкости.
Чем меньше константа нестойкости, тем
более устойчив комплексный ион.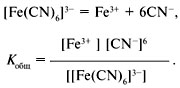
Классификация комплексных соединений.
- по природе или виду лигандов:
1.Аммиакаты (NH3)
2.Аква-комплексы (H2O)
3.Ацидо – остатки кислот
4.Хелаты - также внутрикомплексные или циклические комплексные соединения — клешневидные комплексные соединения, образуются при взаимодействии ионов металлов с полидентатными (то есть имеющими несколько донорных центров) лигандами.
5.Двойные соли – это кристаллические комплексные соединения, образованные из простых солей и имеющие малоустойчивую внутреннюю сферу. Часто формулу двойной соли обозначают перечислением формул простых солей, разделяя их точкой. Например, соль К2[CuCl4] представляют формулой CuCl2•2KCl. Такая формула не означает смеси двух солей! Двойные соли образуют отдельную область среди комплексных соединений (квасцы - двойными солями сульфатов калия, натрия, алюминия, железа, хрома и аммония).
6.Полиядерные (несколько центральных атомов) – кластеры (связь Ме-Ме).
{Mn2(CO)10} -> (CO)5Mn-Mn(CO)5
7.Гидроксокомплексы (гидраты) (ОН-)
8.Смешанные комплексы – Co{(NH3)5Cl}Cl
9.Карбонилы (СО)
-по заряду внутренней сферы:
1.полоительно заряженные комплексы {CoCl2H2O(NH3)3}+
2.Отрицательно заряженные комплексы {PtCl4(OH)2}-
3.Нейтрально заряженные комплексы {Co(NO2)3(NH3)3}0
Номенклатура комплексных соединений:
1.Сначала называют анион, потом катион.
2.если комплекс заряжен нейтрально, то комплексообразователь называют по-русски в И.п.
3.если комплекс заряжен положительно, то комплексообразователь называют по-русски в Р.п., с указанием степени окисления комплексообразователя в круглых скобках римскими цифрами.
4.Если комплекс заряжен отрицательно, то комплексообразователь называют по-латыни в Р.п. с добавлением окончания –ат, с указанием степени окисления КО в круглых скобках римскими цифрами.
5.В названии координационной сферы перечисляют все её составные части (с права на лево); сначала называют кол-во лигандов, сами лиганды и КО.
6.Если комплексная соль содержит разные лиганды в своём составе, то сначала называют (с права на лево) отриц., нейтральные , потом положительно заряженные лиганды. Количество лигандов перечисляется с использованием греческих приставок.
K4[Fe(CN)6] – гексацианоферрат(II) калия;
[Zn(NH3)4Cl2] – дихлоротетраамминцинк;
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди(II).
Химия элементов.
(Электронное строение атома элемента, валентные возможности, положение в таблице элементов. Простые вещества, их физические и химические свойства. Важнейшие соединения, их свойства.)
Водород.
Первый элемент периодической системы – водород. Электронная конфигурация 1s1. Существует в виде трёх изотопов: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T). Возможные степени окисления (СО): -1, 0, +1. Он имеет в большинстве соединений степень окисления +1, но это единственное, что он имеет общего с щелочными металлами, образующими IA группу. В соединениях с щелочными и щелочно-земельными металлами степень окисления водорода равна -1, но это, пожалуй, тоже единственное свойство, которое сближает его с галогенами. Особые свойства водорода связаны с тем, что при ионизации атома водорода образуется элементарная частица - протон.
Простое вещество представлено двухатомной молекулой Н2 (атомы соединены ковалентной неполярной связью), устойчивой во всех агрегатных состояниях водорода. Молекулы водорода удерживаются в твердом и жидком состояниях только за счет слабых дисперсионных взаимодействий, поэтому водород имеет очень низкие температуры плавления и кипения. Простое вещество водород бесцветный газ, гораздо легче воздуха. В смеси с воздухом или кислородом горюч и взрывоопасен. Малорастворим как в полярных, так и в неполярных растворителях. Водород растворяется в некоторых металлах. Палладий и ванадий поглощают водород при комнатной температуре. Остальные металлы поглощают водород при нагревании.
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия. Поэтому при обычных температурах водород реагирует только с очень активными металлами, образуя гидриды:
2Na + H2 → 2NaH Ca + H2 → CaH2 Mg + H2 → MgH2
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 + 2Н2 = 2Н2О N2 + 3H2 → 2NH3 (t, p., кат.)
Взаимодействие с серой - обратимый процесс; при температуре около 200 0С (водород пропускается в расплавленную серу) образуется преимущественно сероводород, при более высокой температуре идет заметное разложение сероводорода:
![]()
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании: C + 2H2 → CH4
Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O Fe2O3 + 3H2 → 2Fe + 3H2O WO3 + 3H2 → W + 3H2O
Восстанавливает металлы из растворов солей:
2AgNO3 + H2 -> 2Ag + 2HNO3
Водород образует множество соединений, химия которых обычно рассматривается в разделах, посвященных элементам, образующим эти соединения. Одним из важнейших соединений водорода является вода H2O.
Молекула имеет угловое строение с валентным углов в 104,50. Атомы в молекуле связаны ковалентными полярными связями. Молекула в целом полярна – диполь. Вода – жидкость без цвета, вкуса и запаха. В природе встречается в 3х агрегатным состояниях. У воды очень высокая теплоёмкость. Вода – универсальный растворитель.
Взаимодействие с активными Ме:
Взаимодействие а менее активными Ме при нагревании:
Вода – амфотерный, очень слабый электролит, поэтому она не проявляет выраженных кислотных или основных свойств, но оказывает сильное ионизирующее действие на растворённые в ней электролиты. Н2О <-> H+ + OH-
Гидратация основных и кислотных оксидов:
Гидратация органических соединений: Вода присоединяется к непредельным углеводородам по месту разрыва кратной связи. Для несимметричных молекул этот процесс подчиняется правилу Марковникова.
Гидролиз солей:
Гидролиз карбидов, нитрилов, гидридов:
Пероксид водорода.
Пероксид водорода, H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается: 2H2O2 → 2H2O + O2
Однако очень чистый пероксид водорода устойчив.
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
Н2O2 + 2NaOH → Na2O2 + 2H2O
H2O2 + Ba(OH)2 → BaO2↓ + 2H2O
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
![]()
В реакции с нитритом калия соединение служит окислителем:
![]()
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например: Н2О2 + 2KI + H2SO4 = I2 + K2SO4 + 2H2O
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2O
Кислород.
Кислород — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O (лат. Oxygenium). Электронная конфигурация: [He] 2s2 2p4. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета. Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода в форме равнобедренного треугольника (формула O3). Кислород способен образовывать две ковалентные связи с атомами других элементов. Наличие неподелённых пар электронов позволяет образовывать связи по донорно-акцептороному механизму.
Химические свойства кислорода и озона.
Взаимодействие с Ме:
С щелочными Ме (кроме Li) образует пероксиды и надпероксиды:
Непосредственно не реагирует с серебром, золотом, платиной.
С мение активными Ме образует оксиды:
Взаимодействие с неМе:
Экзотермические реакции сопровождаются выделением тепла и света. Это реакции горения:
Взаимодействие со сложными веществами:
Сгорают практически все органические в-ва –
При реакции с водородными соединениями неМе продукты реакции зависят от условий проведения реакции:
Под действием кислорода низшие оксиды и гидроксиды переходят в соответствующие соединения с более высокой степенью окисления:
Озон более сильный окислитель, чем кислород.
Качественная реакция для обнаружения озона:
Признак реакции- в раствор добавляют крахмал, который даёт комплексное соединение синего цвета.
Сера.
СЕРА (лат. Sulfur), S, химический элемент с атомным номером 16. Сера расположена в VIA группе периодической системы Д. И. Менделеева, в 3-м периоде, и принадлежит к числу халькогенов. Конфигурация внешнего электронного слоя 3s23p4. Наиболее характерны степени окисления в соединениях –2, +4, +6 (валентности соответственно II, IV и VI). Сера относится к числу неметаллов. В свободном виде сера представляет собой желтые хрупкие кристаллы или желтый порошок.
Сера имеет способность образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде, скипидаре.
Галогены.
Химические элементы главной подгруппы VII группы таблицы Менделеева. Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. Высшая валентностьVII. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I− уменьшается. К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At.
Фтор — зеленовато-жёлтый газ, очень ядовит и реакционноспособен, попытка получить в свободном виде в больших количествах чревата последствиями.
Хлор — зеленоватый газ. Тяжёлый, также очень ядовитый, имеет характерный неприятный запах (запах хлорки).
Бром — красно-бурая жидкость. Ядовита. Поражает обонятельный нерв. Очень летуч, поэтому содержится в запаянных ампулах.
Иод — фиолетово-чёрные кристаллы. Очень легко возгоняется (пары фиолетового цвета). Ядовит.
Астат — сине-чёрные кристаллы. Очень радиоактивен, поэтому о нём сравнительно мало известно.
7 группа А. Неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. Могут быть и восстановителями (кроме F) при взаимодействии с более электроотрицательными элементами.
Азот.
Азот — элемент главной подгруппы пятой группы второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 7. Обозначается символом N (лат. Nitrogenium). Простое вещество азот — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2). Азот в свободном состоянии существует в форме двухатомных молекул N2, с тройной связью между молекулами азота N≡N. Степени окисления азота в соединениях −3, −2, −1, +1, +2, +3, +4, +5. Валентные возможности – III и IV.
Фосфор.
ФОСФОР (лат. Phosphorus) P, хим. элемент V гр. периодической системы; ат. номер 15, Конфигурация внеш. электронной оболочки атома 3s23p3; степени окисления -3, +3 и +5. Является окислителем, но может быть и восстановителем. Высшая валентность V. Известно св. 10 модификаций фосфора, из них важнейшие - белый, красный и черный фосфор. Красный фосфор: твёрдое вещество, без запаха, не ядовитое, устойчивое. Белый фосфор: имеет чесночный запах, летуч, в темноте светится, ядовит. Чёрный фосфор: имеет запах, похож на графит, устойчив. Все модификации не растворяются в воде и органических растворителях.
Углерод (неорганические соединения).
Углерод (химический символ — C) — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6. Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Алмаз: очень твёрдое прозрачное кристаллическое вещество. Атомная кристаллическая решётка тетраэдрического строения. Атомы углерода находятся в состоянии sp3-гибридизации, все связи С-С равны.
Графит: мягкое темно-серое вещество с металлическим блеском. Атомная кристаллическая решётка имеет слоистое строение. Высокая электро- и теплопроводность. Слои графита слабо связаны между собой за счёт межмолекулярных сил и легко отделяются друг от друга.
При обычное температуре углерод проявляет малую химическую активность, которая увеличивается при нагревании. Для углерода характерна ОВ двойственность, но за счёт невысокой электроотрицательности окислительные свойства выражены значительно слабее.
