
- •Ферменты.
- •Основные вопросы лекции:
- •Ферменты (энзимы) – биологические катализаторы белковой природы
- •Области применения ферментов в биологии, медицине
- •Катализаторы –
- •Энергетические кривые для химических реакций в присутствие и отсутствие катализатора.
- •Особенности ферментативного катализа:
- •Молекулярная масса ферментов
- •Активный центр фермента
- •Биологическая функция фермента обусловлена наличием в его структуре активного центра.
- •Функциональная значимость отдельных участков активного центра.
- •Виды субстратной специфичности
- •Наличие субстратной специфичности объясняют
- •Модель индуцированного соответствия
- •Специфичностью пути превращения субстрата.
- •Этапы катализа
- •Активность ферментов.
- •Номенклатура ферментов.
- •Международный союз биохимии и молекулярной биологии в 1961 г. разработал систематическую номенклатуру, согласно
- •Шифр фермента
- •Класс I. Оксидоредуктазы.
- •Подкласс Оксигеназы (гидроксилазы).
- •Класс II. Трансферазы
- •Класс III. Гидролазы
- •Класс IV. Лиазы
- •Класс V. Изомеразы
- •Класс VI. Лигазы (синтетазы)
- •Ферменты – сложные белки.
- •Фермент
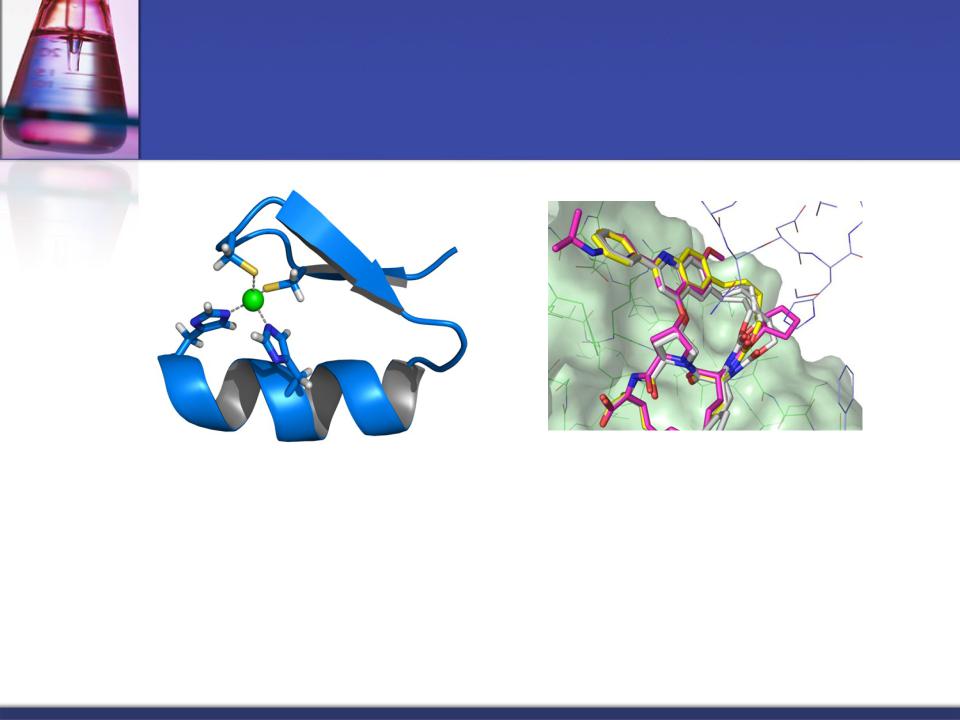
- •Роль металлов
- •Ионы металлов в работе ферментов
- •Роль Zn в стабилизации четвертичной структуры алкогольдегидрогеназы -
- •Ионы металлов с переменной валентностью участвуют в переносе электронов.
- •Ферменты, активируемые металлами
- •Коферменты
- •Химическая природа коферментов чрезвычайно разнообразна:
- •Некоторые коферменты и их функции
- •Никотинамидадениндинуклеотид НАД никотинамидадениндинуклеотидфосфат НАДФ
- •Биохимические функции коферментов НАД, НАДФ
- •Флавинадениндинуклеотид ФАД флавинмононуклеотид ФМН
- •Биохимические функции ФАД, ФМН -
- •Кофермент А (коэнзим А, КоА, СоА, HSKoA)
- •Роль водорастворимых витаминов в функционировании ферментов.
- •Основы кинетики ферментативного катализа.
- •Основы кинетики ферментативного катализа Термолабильность –
- •Зависимость скорости ферментативной реакции от рН среды
- •Зависимость скорости ферментативной реакции от концентрации (количества) фермента
- •Влияние концентрации S
- •Изоферменты -
- •Лактатдегидрогеназа ( ЛДГ )
- •Локализация изоферментов ЛДГ в органах. Диагностическое значение определения в крови.
- •Локализация изоферментов ЛДГ в органах. Диагностическое значение
- •Заключение
- •Благодарю за внимание!

Ферменты.
Строение ферментов, кофакторы и коферменты. Роль витаминов и биоэлементов. Изоферменты.
Лекция для специальности 31.05.01. Лечебное дело подготовлена доцентом кафедры общей и биологической химии ТГМУ О. А. Артюковой
2017 – 2018 учебный год

Основные вопросы лекции:
Строение и функции ферментов.
Специфичность действия ферментов.
Общие представления о катализе. Механизм ферментативного катализа.
Единицы активности ферментов.
Классификация и номенклатура ферментов.
Металлоферменты и ферменты, активируемые металлами.
Кофакторы и коферменты. Водорастворимые витамины (тиамин, рибофлавин, никотинамид, пиридоксин, пантотеновая кислота, кобаламины, фолиевая кислота, биотин) как предшественники коферментов.
Зависимость активности ферментов от температуры и рН среды, количества фермента и субстрата.
Кинетика ферментативных реакций. Уравнение и график Михаэлиса- Ментен.
Изоферменты. Органоспецифические ферменты.

Ферменты (энзимы) – биологические катализаторы белковой природы
лат. Fermentum – брожение греч. En zyme - в дрожжах
Термины «фермент» и «энзим» давно используют как синонимы Наука о ферментах называется энзимологией, а не ферментологией.
Поскольку ферменты - белковые молекулы, следовательно, они обладают всеми свойствами, характерными для белков.

Области применения ферментов в биологии, медицине

Катализаторы –
это вещества, которые ускоряют скорость химической реакции, снижая энергию активации, участвуют в реакции, но сами при этом не расходуются.
Неорганическая химия: |
Биологическая химия: |
Металлы (Fe, Cu, Pt и др.) |
Ферменты (энзимы) |
Сущность действия ферментов заключается:
-в активации молекул реагирующих веществ;
-в разделении реакции на несколько стадий, энергетический барьер каждой из которых ниже такового общей реакции.

Энергетические кривые для химических реакций в присутствие и отсутствие катализатора.
Для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции.
Для характеристики величины энергетического барьера С. Аррениус ввел понятие энергии активации.
Преодоление энергии активации в химической реакции достигается:
-либо увеличением энергии взаимодействующих молекул
(нагревание, облучение, давление)
-либо снижением энергии активации при помощи катализаторов.

Особенности ферментативного катализа:
Все ферменты представляют собой глобулярные белки.
Увеличивают скорость реакции, но сами в этой реакции не расходуются.
Фермент не влияет ни на природу, ни на свойства конечного продукта.
Катализируемая реакция обратима.
Реакции протекают в мягких условиях организма (давление, t, pH)
Чувствительны к денатурирующим агентам
Высокая эффективность действия
Контроль регуляции активности
Специфичность действия
Катализируемые ферментами реакций протекают в 108 - 1014 раз быстрее. Молекула фермента способна трансформировать 100 - 1000 молекул/сек.
Ворганизме человека распадается около 0,5 кг глюкозы/сут до С02 и Н20;
вотсутствие катализатора для этого при тех же физических условиях потребовалось бы ~ 10 000 лет.
Молекулярная масса ферментов
Ферменты – крупные молекулы,
их ММ лежат в диапазоне от 10 000 до 1 000 000 Да.
Для сравнения ММ веществ:
глюкоза – 180 Да, СО2 – 44 Да,
аминокислоты – 75 - 204 Да.
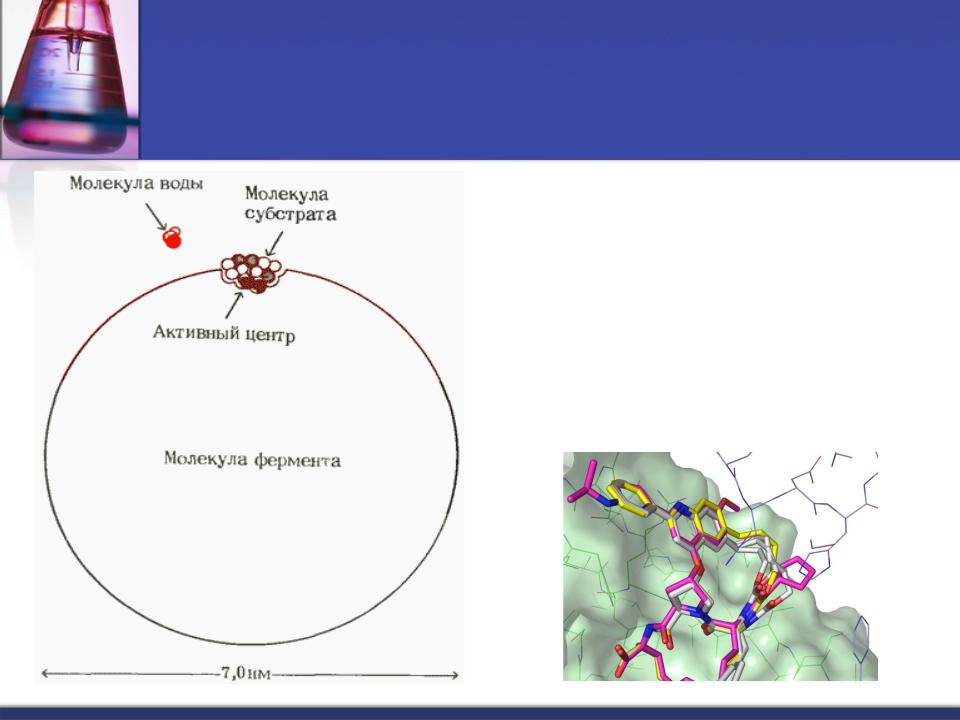
Активный центр фермента
Активный центр — это относительно небольшой участок, расположенный в узком гидрофобном углублении (щели) поверхности молекулы фермента, непосредственно участвующий в катализе.
Активный центр фермента образуется на уровне третичной структуры.
Катализ требует точной пространственной организации активного центра, построенного из аминокислот (радикалов), расположенных в разных участках полипептидной цепи.

Биологическая функция фермента обусловлена наличием в его структуре активного центра.
Лиганд, взаимодействующий с активным центром фермента, называется субстрат (S).
В активном центре фермента есть аминокислотные остатки,
функциональные группы которых обеспечивают связывание S
(участок связывания S).
и аминокислотные остатки,
функциональные группы которых осуществляют химическое превращение S (каталитический участок ).
