
- •Лабораторная работа
- •2.2. Химическая связь в комплексных соединениях.
- •2.3 Номенклатура комплексных соединений.
- •Свойства комплексных соединений и реакции обмена с участием комплексных ионов.
- •2.5. Получение и разрушение комплексных соединений.
- •2.6.Окислительно-восстановительные реакции с участием комплексных соединений.
- •Порядок выполнения работы.
- •Различие между двойной и комплексной солью.
- •Образование и разрушение комплексных ионов.
- •3.3. Окислительно – восстановительные реакции с участием комплексных соединений.
- •Влияние концентрации раствора на комплексообразование.
- •Содержание отчёта.
2.3 Номенклатура комплексных соединений.
Названия комплексных соединений, применяемые в настоящее время, утверждены комиссией по номенклатуре неорганических соединений Международного Союза по теоретической и прикладной химии (IUPAC). Ниже приведены некоторые правила, заимствованные из материалов этой комиссии.
Порядок перечисления ионов. Первым называют катион, затем – анион.
Окончания координационных групп.Нейтральные группы называются также, как и молекулы. Исключениями являютсяакво(Н2О) иамин(NH3). К отрицательно заряженным ионам прибавляют окончания «о».
Окончания названий комплексов.Характерным окончанием для анионных комплексов является «ат» или «овая», если называется кислота. Для катионных и нейтральных комплексов типичных окончаний нет.
Степень окислениякомплексообразователя обозначается арабской цифрой в скобках после его названия.
[Ag(NH3)2]Cl– диаминаргенто (1+) хлорид
K2[CuCl3] – калия трихлоркупрат (1+)
H2[Pt(CN)6] – гексацианоплатиновая кислота или водорода гексацианоплатинат (4+)
[Al(H2O)6]Cl3гексааквоалюминий хлорид
[Cu(NH3)2]OH– диаминмедь (1+) гидроксид
K4[SnF8] – калия октафторстаннат (4+)
Свойства комплексных соединений и реакции обмена с участием комплексных ионов.
Для комплексных соединений характерна первичная и вторичная диссоциация.
Первичная диссоциация комплексных соединений на комплексный ион и противоположно заряженные ионы внешней сферы протекает полностью, как у сильных электролитов.
K2[Zn(CN)4] = 2K+ +[Zn(CN)4]2-
[Co(NH3)6](NO3)2 = [Co(NH3)6]2+ +2NO3-
Поэтому, соединения, содержащие комплексные ионы, могут вступать в реакции обмена с электролитами с образованием малорастворимых веществ.
2 CuSO4
+ K4[Fe(CN)6]
= Cu2[Fe(CN)6]
+ 2K2SO4;
CuSO4
+ K4[Fe(CN)6]
= Cu2[Fe(CN)6]
+ 2K2SO4;
2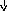 Cu2+
+ [Fe(CN)6]4-
= Cu2[Fe(CN)6]
Cu2+
+ [Fe(CN)6]4-
= Cu2[Fe(CN)6]
Однако, в отличие от “простых” ионов, комплексные ионы сами способны к диссоциации, которая называется вторичной диссоциацией. Она характеризует диссоциацию самого комплексного иона и протекает ступенчато, как у слабых электролитов, подчиняясь закону действия масс. Количественно каждая ступень характеризуется константой диссоциации.
I ступень: [Ag(NH3)2]+ = [AgNH3]+ +NH3
Кд(I)
 =
=
[Ag(NH3)2]+
II ступень: [AgNH3]+ = Ag+ + NH3
Кд(II)
= [Ag+]
[NH3]
[Ag+]
[NH3]
[AgNH3]+
В целом устойчивость комплексного иона в растворе характеризуется величиной константы нестойкости Кн , которая равна произведению констант диссоциации отдельных ступеней.
Кн = Кд(I) Кд(II)
Общая константа нестойкости Княвляется константой равновесия полной диссоциации комплекса:
[Ag(NH3)2]+ = Ag+ + 2NH3
[Ag+]
[NH3]2
К
[Ag(NH3)2]+ н=
н=
Чем меньше константа нестойкости, тем прочнее комплексный ион.
Комплексные соединения, в частности соли, очень сходны с двойными солями. Подобно комплексным, двойные соли также образуются путем соединения простых солей
MgCl2+KCl=KCl∙MgCl2
Отличаются комплексные соли от двойных прежде всего величиной константы нестойкости: у типичных двойных солей константа нестойкости очень велика , у типичных комплексных солей она, наоборот, очень мала. Резкой границы между двойными и комплексными солями не существует.
Двойные соли диссоциируют на те ионы, которые находились в растворах простых солей, послуживших для их образования, например,
K Cl∙MgCl2K++Mg2++3Cl-
Cl∙MgCl2K++Mg2++3Cl-
Двойные соли можно рассматривать как комплексные соли с малоустойчивой, легко диссоциирующей на ионы внутренней координационной сферой.
